Впч что это вирус эпштейна-барр

В Ростовской области (РО) в 2012 г. заболеваемость РОПР составила 4,11 (на 100000 нас.), что превышает заболеваемостьв 2008 г. (3,72), и приравнивает её к средним показателям (4,58) по РФ [3].
Рост заболеваемости связывают с такими факторами как: вредное производство, неблагоприятная окружающая среда, вредные привычки, неполноценное питание, не соблюдение гигиены полости рта, депрессивное состояние, инфицированность вирусной инфекцией и др.
Выявление причин возникновения РОПР,возможностираннего его распознавания, закономерностей развития опухоли, продолженного ее рост после лечения,возникновение рецидивов являются актуальными проблемами, требующимисвоего решения.
Исходя из этого, выбор методов лечения и их результаты тесно связаны с изучением факторов прогнозатечениязаболевания.
Результатом исследования Мардалейшвили К. М.по прогнозированию появления регионарных метастазов и эффективности лечения при РОПР, и как следствие выбораоптимального метода лечения, явилась разработка критериев прогноза заболевания: размер опухоли и форма ее роста, распространенность на другие анатомические части органа, инфильтрация окружающих тканей, распространенность опухоли за среднюю линию и длительность существования опухоли. Так размер опухоли >4 см, эндофитный рост, ее распространение более чем на 2 отдела, болевой синдром и хотя бы один метастаз не дает прогноза прожить более 2-х лет. Местно-распространенные формы рака органов полости рта характеризуются малой чувствительностью или резистентностью опухоли к лучевой терапии[4].
Развитие регионарных метастазов после комбинированного лечения наблюдается у 40-75% больных, а отдаленные метастазы выявляется в 15% случаев по даннымЛюбаева В.И.
Лечение регионарных метастазов, в большинстве случаев, осуществляется хирургически, но ряд авторов, таких какЛюбаевВ.И. и др. утверждают, что необходимо проводить комбинированное лечение, где первым этапом является лучевая терапия, химиотерапия.
Эти авторы отмечают, что после комбинированного и даже комплексного лечения местные рецидивы у больных раком органов полости рта возникают в 25-40% случаев всех наблюдений.
Цель исследования.Оценить инфицированность вирусами герпеса человека и папилломы человека у больных раком органов полости рта в Ростовской области.
Задачи.Определитьпрогностическую значимость вируса Эпштейна-Барр и вируса папилломы человека длятечения рака органов полости рта.
Мужчин было 24 (80%), женщин – 6 (20%). Возраст больных составлял 33 - 66 лет.По распространенности процесса (рис. 1) со II стадией (T2N0M0) было 8(26,7%) человек, III– 10 (33,3%)(T2N1M0, T3N0M0, T3N1M0), IV– 12 (40%)(T3N2M0, T4N0M0, T4N1M0, T4N2M0).
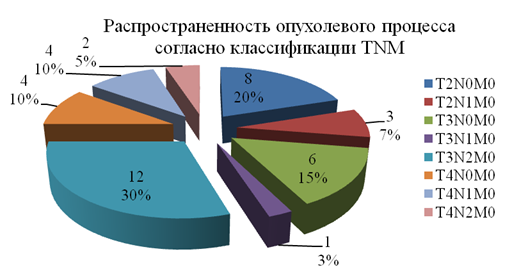
У 25 (83,3%) больных опухолевый процесс располагался на языке, из них у 15 (60%) – на боковой поверхности языка, у 6 (24%) – в средней трети тела языка и у 4 (16%) – на кончике языка; у 5 (16,7%) - на слизистой дна полости рта.
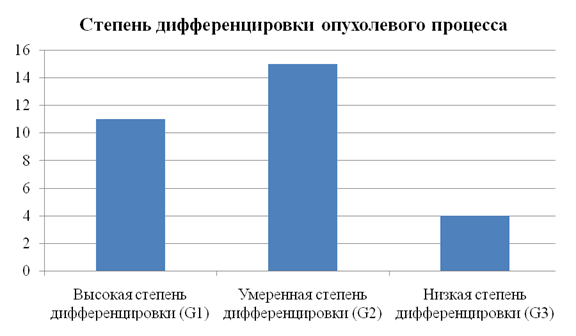
У всех больных был выявлен плоскоклеточный рак. Степень дифференцировкипервичной опухоли представлена нарис. 2.
Метастазы (IB-III уровней) были выявлены у 10 (33,3%) больных при первом обращении.
Материалом для молекулярно-биологических исследований служили образцы ткани опухоли РОПР, взятые у больных в ходе операции.
Из гомогената ткани опухоливыделяли ДНК вирусов, с использованием коммерческого набора реагентов MagNaPureCompactNucleicAcidIsolationKit I-LargeVolume на приборе MagNaPureCompact (Roche, Швейцария).Амплификацию с последующей детекцией ДНК осуществляли методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени на термоциклереRotorGene 6000 (QIAGEN, Германия).
ОпределялиДНК вируса папилломычеловека высокого канцерогенного риска (ВПЧ ВКР) 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов и ВПЧнизкого канцерогенного риска (ВПЧ НКР) 6 и11 типов,вируса простогогерпеса 1,2 типов (ВПГ 1,2 типа), цитомегаловируса (ЦМВ), вируса Эпштейна-Барр (ВЭБ) и вируса герпеса человека 6 типа (ВГЧ 6 типа).
Статистическая обработка полученных данных проводилась с применением программы STATISTICA.
Результаты и обсуждения.Данные лабораторных исследований 30 обследованных больных представлены в табл. №1.
Вирус папилломы человека
Вирус папилломы человека (ВПЧ) чаще всего передается половым путем. Возможны также перинатальный и оральный пути передачи инфекций. Инфицирование наиболее вероятно на участках поврежденного эпителиального покрова. Процент носительства ВПЧ наиболее высок среди сексуально активных молодых людей. Частота инфицированности одинаково высока среди обоих полов. Заражение ВПЧ в подавляющем большинстве случаев не приводит к заболеванию и не дает никаких симптомов. Однако у определенного процента инфицированных возникают кондиломы и папилломы дыхательных и половых органов и других слизистых оболочек, а также папилломы и бородавки на коже. И только у очень небольшого процента ВПЧ-инфицированных развивается предрак и рак шейки матки.
ВПЧ, скорее всего, является этиологическим фактором и других форм злокачественных опухолей, в частности, рака вульвы, полового члена и анального рака. Однако, учитывая высокую частоту инфицированности HPV населения и крайнюю редкость этих форм рака, ВПЧ, скорее всего, не является достаточным фактором, и для развития злокачественной опухоли необходимы другие дополнительные факторы или кофакторы.
В ряде исследований показана связь между инфицированностью ВПЧ и раком полости рта и гортани, злокачественных опухолей, основной причиной которых является курение. В связи с этим возникает необходимость дальнейшего изучения роли ВПЧ в этиологии рака этих органов. На основании анализа существующих научных данных рабочая группа МАИР пришла к заключению, что ВПЧ 16-го и 18-го типов являются канцерогенными для человека.
Получена и yспешно апробирована профилактическая вакцина против ВПЧ 16-го типа. Разрабатывается мультивалентная вакцина против наиболее часто встречающихся типов ВПЧ, применение которой может стать наиболее эффективным методом профилактики рака шейки матки. Первостепенное значение для профилактики ВПЧ инфекции имеет половая гигиена, исключение случайных половых контактов и использование кондомов.
Helicobacter pylori (HP)
Инфицированность HP тесно коррелирует с возрастом и выше среди бедных слоев населения. Инфицированность этой бактерией выше среди населения, живущего в неадекватных коммунальных условиях, скученно. Частота HP-положительных людей значительно ниже среди населения развитых стран и продолжает снижаться. Однако у трети взрослого населения развитых стран выявляются антитела к HP. У большинства носителей HP не вызывает никаких клинических проявлений, однако инфицированность может приводить к развитию хронического гастрита и язвы желудка. Кроме того, у очень небольшой части HP-инфицированных развивается аденокарцинома или В-клеточная лимфома желудка.
Механизм канцерогенного действия HP не установлен. HP вызывает воспаление слизистой оболочки желудка, что влечет за собой увеличение синтеза простагландинов, гиперпролиферацию клеток и ингибирование апоптоза. Наиболее сильное повреждающее действие на слизистую оболочку желудка оказывают цитокинсодержащие линии HP (CaA +). Инфицированность этим типом HP, по-видимому, и играет ключевую роль в развитии рака желудка.
Таким образом, роль HP в этиологии рака желудка можно считать доказанной. Инфицированность HP также, скорее всего, является причиной лимфомы желудка, которая развивается из лимфоидной ткани слизистой оболочки (mucosa associated lymphoid tissue – MALT). Эта, достаточно редкая опухоль, которая составляет не более 5% всех злокачественных опухолей желудка. Исследования показали, что более 90% больных лимфомой желудка HP позитивны и что инфицированность HP в 3 и более раз повышает риск развития MALT. Опубликованы результаты успешной антибиотикотерапии лимфом желудка.
Рабочая группа МАИР пришла к заключению, что инфицированность HP является канцерогенной для человека.
Работа над вакциной против HP пока не принесла успеха. Лечение инфекции с использованием антибиотиков и других антибактериальных препаратов не всегда эффективно ввиду резистентное к антибиотикам и частоты рецидивов инфекции. Для профилактики инфекции HP необходимо создание нормальных коммунальных условий и соблюдение элементарных гигиенических норм, использование индивидуальной посуды мытье рук перед приемом пищи и т.д.
Вирус Т-клеточного лейкоза взрослых
Распространенность среди населения вируса Т-клеточного лейкоза взрослых (HTLV-I) значительно ниже, чем других онкогенных вирусов, и варьирует от 0,2-2% в регионах с низкой инфицированностью до 2-15% в эндемических регионах. К эндемическим регионам относятся Япония, Карибские острова, Южная Америка, Ближний Восток и Центральная Африка. Более одного миллиона носителей HTLV-I выявлено в Японии, на островах Окинава, Киуши и Шикоку. В других районах Японии инфицированность HTLV-I значительно ниже. Наиболее крупным резервуаром HTLV-I инфекции является Африка, где количество зараженных достигает 5-10 млн. В Европе и Америке инфицированность HTLV-I крайне редка и встречается в основном у эмигрантов из стран с высокой инфицированностью. В целом в мире HTLV-I инфицированы 15-20 млн. человек.
Чаще всего HTLV-I передается от матери к ребенку при грудном вскармливании, однако даже в эндемических регионах носительство HTLV-I среди детей встречается чрезвычайно редко. Известны также два других пути передачи инфекции: половой и гематогенный. Частота носительства растет с возрастом и достигает максимума в возрасте 50 лет и более и выше у женщин, чем у мужчин. В эндемических по инфицированности HTLV-1 регионах отмечается высокая заболеваемость Т-клеточным лейкозом взрослых (adult T-cell leukemia/lymphoma – ATLL). Дескриптивные эпидемиологические исследования выявили кластеры с высокой заболеваемостью ATLL в Японии, Экваториальной Африке и Центральной Америке, которые совпадали с районами, эндемическими по HTLV-I. Сероэпидемиологические исследования показали, что 90% больных ATLL серопозитивны к HTLV-1.
В Японии ATLL заболевают 0,6-1,5 на 1 тыс. HTLV-I инфицированных в возрасте 40-59 лет. Кумулятивный риск заболеть ATLL в течение жизни у HTLV-I носителей обоих полов равен 1-5%. Эпидемиологические исследования, проведенные в Японии, показали, что смертность от ATLL среди HTLV-I положительных мужчин равна 68,1, а среди женщин – 35,8 на 100 тыс. населения, в то время как ожидаемая смертность среди HTLV-I отрицательных крайне низка. В эндемических районах до 100% всех больных ATLL, HTLV-I серопозитивны. Процент серопозитивных больных ATLL также очень высок (> 90%) в неэндемических регионах. Процент HTLV-I положительных больных значительно ниже при других формах Т-клеточных лимфом (3-52%) и других лимфом (3-25%).
Инфицированность HTLV-I в младенческом и детском возрасте, при которой вирус, скорее всего, передается с молоком матери, по-видимому, играет важную роль в патогенезе ATLL. Серологическое обследование матерей, больных ATLL и другими формами лимфом, показало, что все без исключения матери больных ATLL HTLV-I положительны, в то время как среди матерей, больных другими формами лимфом HTLV-I, инфицированность не превышала 30%.
В результате анализа научных данных рабочая группа МАИР пришла к заключению, что данных, указывающих на канцерогенность HTLV-I для человека, достаточно, и отнесла HTLV-I к группе 1 доказанных канцерогенов.
Вирус Эпштейна – Барр
Вирусом Эпштейна – Барр (ВЭБ) инфицированы более 90% взрослого населения. Заражение ВЭБ обычно происходит в раннем детском возрасте и не сопровождается никакими клиническими проявлениями. Если же человек заражается ВЭБ во взрослом возрасте, то у него развивается инфекционный мононуклеоз. Перенос ВЭБ от человека к человеку происходит через слюну, и носительство вируса приобретает хронический характер.
Первой злокачественной опухолью, для которой была доказана этиологическая роль ВЭБ, является лимфома Беркитта. Большинство случаев (до 100%) лимфомы Беркитта в эндемических регионах Африки ассоциированы с ВЭБ, в то же время в неэндемических регионах частота ВЭБ ассоциированных случаев колеблется от 20 до 87%.
Этиологическая роль ВЭБ показана также для других типов неходжкинских лимфом. У больных различными формами иммунодефицита, в т.ч. и у реципиентов трансплантатов и больных врожденным и приобретенным иммунодефицитом, заболевание лимфомой практически всегда ассоциировано с ВЭБ.
Показано, что титры антител к КА ВЭБ, которые являются маркером предшествующей инфекции, достоверно выше у больных лимфогранулематозом, чем в контрольной группе. Титры антител к комплексу РА ВЭБ, присутствие которых указывает на активную репликацию вируса, также выше у больных лимфогранулематозом, чем у контрольных лиц. Исследование антител к комплексу ядерных антигенов выявили аналогичную зависимость.
Моноклональность ВЭБ в опухолевых клетках и экспрессия белка LMP-1 является подтверждением этиологической связи между ВЭБ и лимфогранулематозом.
В эпидемиологических исследованиях, проведенных в Юго-Восточной Азии и США, была показана этиологическая связь между ВЭБ и раком носоглотки. Подтверждения этиологической роли ВЭБ для рака носоглотки были получены в результате массового скрининга на носительство ВЭБ в нескольких провинциях Китая и на Тайване. Наличие антител к ВЭБ КА повышает риск развития назофарингиального рака.
Результаты молекулярных исследований, в которых показано, что практически все случаи недифференцированного рака носоглотки являются ВЭБ – положительными и то, что ВЭБ -положительные опухолевые клетки моноклональны и содержат ВЭБ ДНК и белки, подтверждают роль ВЭБ в этиологии назофарингиального рака.
ВЭБ с различной частотой обнаруживается в лимфоэпителиальных опухолях различной локализации и в первую очередь – лимфомах желудка. ВЭБ также обнаружен при аденокарциноме желудка. Во всех случаях ВЭБ в опухолевых клетках моноклонален, что говорит о том, что ВЭБ присутствовал в эпителиальных клетках слизистой оболочки желудка до экспансии, размножения опухолевого клона.
Рабочая группа МАИР по оценке канцерогенного риска пришла к заключению, что имеется достаточно данных для подтверждения роли ВЭБ в этиологии лимфомы Беркитта, синоназальной ангиоцентрической Т-клеточной лимфомы, лимфомы у больных с иммунодефицитом, лимфогранулематоза и рака носоглотки. Рабочая группа отнесла ВЭБ к группе 1, к которой относятся факторы доказанной канцерогенности для человека.
Вирус гепатита В (HBV)
Частота хронической инфицированности HBV колеблется от высокой в странах Юго-Восточной Азии и Центральной Африки, где носителями хронической инфекции являются более 8% населения, до низкой в Европе и Северной Америке, где частота инфицированности не превышает 2%.
В эндемических регионах HBV чаще всего передается перинатально от матери к ребенку, а также в раннем детском возрасте от ребенка к ребенку. В 70-90% этих случаев инфицированность не проявляется клинически и приобретает хронический характер.
В развитых странах инфекция HBV в основном распространяется среди взрослых парентерально и половым путем, что приводит к развитию гепатита и только в 5-10% случаях инфицированность приобретает хронический характер. Основным серологическим маркером инфицированности HBV является HBsAg, поверхностный антиген. Если HbsAg определяется в сыворотке более 6 месяцев, то это указывает на то, что инфицированность приобрела хронический характер. Имеется выраженная корреляция между инфицированностью населения HBV и заболеваемостью гепатоцеллюлярным раком.
Результаты более десятка проспективных когортных исследований показали, что хроническая инфицированность HBV в 100 и более раз повышает риск развития гепатоцеллюлярного рака. Исследования методом "случай-контроль" также выявили связь между серологическими показателями инфицированности HBV и относительным риском гепатоцеллюлярного рака. ОР в этих работах колебался в пределах 5-30.
Хроническая инфицированностъ HBV является канцерогенной для человека. HBV отнесен к группе 1 доказанных канцерогенных факторов.
Вирус гепатита С (HCV)
Частота носительства HCV в различных регионах колеблется от менее чем 1% в Европе и до 1-3% в странах Ближнего Востока и Азии. HCV чаще всего передается парентеральным путем. К группе риска, в первую очередь, относятся наркоманы, больные, которым проводится гемодиализ и частые переливания крови, а также медицинские работники. Передача HCV половым путем или перинатально происходит реже. Инфекция HCV обычно приобретает хронический характер и вызывает тяжелый хронический гепатит, а в дальнейшем цирроз печени. Тестом инфицированности HCV является выявление в сыворотке крови антител к HCV или непосредственно РНК вируса.
Результаты эпидемиологических исследований показали, что наличие антител к HCV, т.е. инфицированность HCV, является маркером повышенного риска печеночно-клеточного рака. На основании анализа существующих эпидемиологических данных рабочая группа МАИР по оценке канцерогенного риска пришла к выводу, что хроническое носительство вируса гепатита С является канцерогенным для человека, a HCV отнесен к группе 1 доказанных канцерогенов.
Вирус иммунодефицита человека (ВИЧ)
Вирус иммунодефицита человека, как известно, является возбудителем синдрома приобретенного иммунодефицита человека (СПИД). ВИЧ-инфицированность повышает риск саркомы Капоши (СК). Более того, СК является одним из патологических состояний, на основании которых ставится диагноз СПИД (disease defining condition).
На основании сравнения и анализа записей регистров злокачественных опухолей и СПИДа (linkage study) был подсчитан показатель стандартизованного соотношения заболеваемости СК среди больных СПИДом, который оказался равен 97% по результатам исследования в Иллинойсе и 71% в Калифорнии.
В когортных исследованиях было показано, что среди ВИЧ инфицированных и больных СПИДом заболеваемость СК значительно выше, чем среди здорового населения. При этом если СК заболевают 10-20% всех ВИЧ положительных, то среди мужчин гомо- и бисексуальной ориентации частота СК достигает 35-50%. СК встречается чаще у больных, заразившихся ВИЧ половым путем, и реже – у имевших другие пути передачи инфекции. Среди ВИЧ инфицированных чаще болеют молодые мужчины гомо- и бисексуальной ориентации. В ряде работ, в которых была сделана попытка объяснить высокий риск СК среди ВИЧ инфицированных гомо- и гетеросексуальных мужчин, обнаружено, что риск СК выше у наиболее сексуально активных больных, имеющих большее число сексуальных партнеров (в т.ч. больных различными формами венерических заболеваний). Все это позволяет предположить, что в этиологии СК играет роль другой, независимый от ВИЧ инфекционный кофактор, передающийся половым путем. Среди известных инфекционных агентов в настоящее время рассматривается герпесвирус 8 типа (HHV8).
ВИЧ отнесен к группе 1, т.е. факторам, канцерогенность которых для человека доказана.
Злокачественные опухоли, которые вызваны инфекционными агентами
| Канцерогенные вирусы | |
|---|---|
| Вирусы | Ассоциированные новообразования |
| Вирус гепатита В (HBV) | Гепатоцеллюлярный рак |
| Вирус гепатита С (HCV) | Гепатоцеллюлярный рак |
| Вирус Т-клеточного лейкоза взрослых (HTLV-I) | Т-клеточный лейкоз взрослых |
| Вирус папилломы человека (ВПЧ) 16, 18 типов | Рак шейки матки |
| Вирус Эпштейна-Барр (ВЭБ) | Лимфома Беркитта Рак носоглотки Лимфогранулематоз Рак желудка |
| Вирус иммунодефицита человека (ВИЧ) 1 типа | Саркома Капоши Лимфомы |
| Канцерогенные бактерии и паразиты | |
|---|---|
| Helicobacter pylori | Рак желудка |
| Schisto'soma haemotobium | Рак мочевого пузыря |
| Opistorchis vivеrrini | Холангиоцеллюлярный рак |
При копировании материалов
ссылка на сайт обязательна.
Вирус папилломы человека (ВПЧ), вирус из семейства Papovaviridea, обладающий способностью инфицировать и трансформировать эпителиальные клетки. Идентифицировано более 100 видов ВПЧ, из которых 35 инфицируют урогенитальный тракт человека, вызывая поражение покровного эпителия кожи и слизистых оболочек половых органов. На сегодняшний день ВПЧ-инфекция является одной из наиболее распространенных и важных инфекций, передаваемых половым путем, которой инфицирована большая часть сексуально активного населения планеты. Папилломавирусы одна из групп вирусов, для которых доказана индукция опухолей у человека. Эпидемиологические и вирусологические исследования подтверждают, что, по крайней мере, 95% всех плоскоклеточных раков шейки матки содержат ДНК ВПЧ [1]. Но не только папиломавирусы обладают трансформирующей способностью в отношении эпителиальных клеток [3].
Герпес-вирусы связывают с рядом онкологических заболеваний и рассматривают их в качестве кофактора канцерогенеза, индуцирующего развитие дисплазии и рака шейки матки. Из многочисленного семейства Herpesviridae, объединяющего больше 100 идентичных или сходных по морфологии вирусов, лишь 8 инфицируют человека: ВПГ-1 и ВПГ-2 типа, вирус Зостер (вирус герпеса 3 типа), вирус Эпштейн-Барр (вирус герпеса 4 типа), цитомегаловирус (вирус герпеса 5 типа), вирус герпеса 6 типа- возбудитель внезапной экзантемы, вирус герпеса 7 типа – выявляется у пациентов с синдромом хронической усталости, ВПГ-8 причастен к возникновению саркомы Капоши. Вирусы герпеса обладают пантропизмом, т.е. поражают практически все органы и ткани [3]. ВПГ -2, ВЭБ и ЦМВ чаще других герпесов можно обнаружить в урогенитальном тракте человека. Именно поэтому, эти вирусы наиболее интересны как синергисты течения ВПЧ-инфекции. Герпесы способны достигать латентного состояния, и таким образом, обеспечивают пожизненное носительство. Это происходит за счет встраивания нуклеиновой кислоты вируса в ДНК клетки-хозяина (так называемая интеграция) или путем формирования эписомы – внехромосомной молекулы ДНК вируса, лежащей обособленно в кареоплазме или цитоплазме зараженной клетки. В таком состоянии герпесвирусы способны длительно персистировать в организме человека, но при снижении иммунной защиты происходит реактивация и активная репликация вируса [3]. Встраиваясь в структуру человеческой ДНК, герпес-вирусы могут выступать в роли мутагенов, в т.ч. канцерогенов. Изменение активности некоторых человеческих генов, контролирующих рост и пролиферацию клеток, является чрезвычайно важной для герпес-вирусов свойством, т.к. бесконтрольная интенсивная пролиферация зараженных клеток обеспечивает более выраженную и эффективную репродукцию вирусных частиц [4]. В тоже время, известно, что ВПЧ отличается высокой тропностью именно к пролиферирующим клеточным популяциям, наиболее активно инфицирует клетки эпителия в этой фазе [2].
Таким образом, активация герпес-вирусов на слизистой оболочке урогенитального тракта, приводит к созданию идеальных условий для проникновения ВПЧ в эпителиальные клетки. Из вышеизложенного можно заключить, что пациенты с выраженными иммунодефицитными состояниями составляют группу риска инфицирования ВПЧ, и следовательно, риск развития дисплазии и рака шейки матки у таких пациенток существенно выше. В первую очередь в такую группу попадают женщины с диагнозом ВИЧ-инфекция. Это заболевание сопровождается тяжелым поражением системы иммунитета и поэтому реактивация герпетических инфекций не редкость для этих пациенток.
Целью нашего исследования было изучение распространенности герпес-вирусов - ВПГ 2 типа, ВЭБ и ЦМВ в урогенитальном тракте ВИЧ-инфицированных пациенток Липецкого центра СПИД, частота встречаемости сочетанной герпетической инфекции с ВПЧ.
Результаты. Анализ распространенности герпесвирусов и ВПЧ в урогенитальном тракте у ВИЧ-инфицированных пациенток показал, что ДНК ВЭБ была обнаружена в 15,3% обследованных женщин, ДНК ЦМВ – в 13,7 %, ДНК ВПГ-2 – в 1,3 %. Вирус папилломы человека был обнаружен в 18,3 % образцов.
Мы детально проанализировали 90 образцов положительных на ДНК ВПЧ. Нас интересовало, в первую очередь, наличие сочетанной инфекции с герпесвирусами – ВЭБ, ЦМВ и ВПГ-2. Как показало исследование, в 20 (22,5%) случаях ВПЧ встречался вместе с ВЭБ, в 22 (24,7%) образцах ВПЧ был обнаружен вместе с ЦМВ, сочетание ВПГ-2 и ВПЧ было выявлено только в 4 случаях и составило чуть больше 4%. Следует отметить, что в 8 образцах были выявлены ДНК трех вирусов - ВПЧ, ВЭБ и ЦМВ. В 54 образцах, что составило (60%) выявлялся только ВПЧ.
Таким образом, можно отметить, что выявляемость герпесвирусов (ВЭБ, ЦМВ, ВПГ-2) с сочетанной ВПЧ-инфекцей значительно выше выявляемости тех же моноинфекций у ВИЧ- инфицированных женщин в урогенитальном тракте. Доказано, что тяжесть ВПЧ – инфекции зависит от одновременного наличия различных генотипов ВПЧ и пораженности клеток эпителия вирусом (количества вирусной ДНК) [1].
Вирусная нагрузка (ВН) ВПЧ в анализированных образцах была следующей: В 13 образцах ВН была менее или равна 3 lg копий ДНК ВПЧ на 10 5 клеток эпителия, причем в 12 образцах это была моноинфекция ВПЧ и только в 2 случаях сочеталась с ЦМВ-инфекцией. ВН ВПЧ менее 3 lg копий ДНК ВПЧ в клинической практике расценивается как малозначимая, транзиторная ВПЧ-инфекция. В 29 образцах ВН ВПЧ колебалась в пределах 3 lg- 5 lg копий ДНК ВПЧ на 10 5 клеток эпителия. Из них 12 образцов содержали только ДНК ВПЧ, а в 5 выявлялась ДНК ВПЧ вместе с нуклеиновой кислотой герпесов. Концентрация ВПЧ в пределах 3 lg- 5 lg копий расценивается как клинически значимая – риск развития дисплазии. В 48 образцах ВН ВПЧ была очень высокой - более 5 lg копий ДНК ВПЧ на 10 5 клеток эпителия. 29 образцов из этой группы имели сочетанную ВПЧ-инфекцию с герпесвирусами, а в 19 пробах была обнаружена только ДНК ВПЧ. Концентрация ВПЧ в более 5 lg копий считается высоким риском наличия дисплазии у пациентки.
Распространенность различных генотипов среди ВПЧ положительных пациенток Центра СПИД оказалось следующей: 16 тип- 25%, 18 тип- 10%, 31 тип- 22%, 33 тип- 10%, 35 тип -17%, 39- 7%, 45 тип -8%, 51 тип -1%, 52 тип- 20%, 56 тип – 5%, 58 тип – 7%, 59 тип -2%. Кроме того, в 44% было выявлялся более чем 1 генотип.
Выводы. Полученные результаты свидетельствуют о широкой распространенности сочетанной ВПЧ-инфекции и герпес-вирусов (ВЭБ,ЦМВ, ВПГ-2) в урогенитальном тракте ВИЧ-инфицированных женщин. Проведенные исследования подтверждают более активную репликацию ВПЧ при наличии сочетанной инфекции с герпесвирусами. На фоне ВИЧ-инфекции, герпесвирусы способны усиливать иммуносупрессию, блокировать клеточный апоптоз и вызывать пролиферативную активность зараженных клеток, таким образом, значительно облегчают процесс инфицирования ВПЧ-инфекцией, что существенно повышает риск развития дисплазии и рака шейки матки у пациенток с ВИЧ-инфекцией. Проведение комплексного исследования урогенитального тракта на ВПЧ и герпесвирусы у женщин с иммуносупрессивными состояниями является целесообразным, т.к. несет высокое профилактическое значение.
Литература
- Киселев В.И., Киселев О.И. Вирусы папиломы человека в развитии рака шейки матки-С.-Пб.-М., 2008.
- Мазуренко Н.Н. Роль вирусов папилломы в канцерогенезе шейки матки //Современая онкология-2009.1.-С.7-10.
- Гурцевич В. Э., Афанасьева Т. А. Гены латентной инфекции Эпштейна-Барр (ВЭБ) и их роль в возникновении неоплазий // Русский журнал . 1998; Т. 2, № 1: 68-75.
- Lekstron-Himes J. A., Dale J. K., Kingma D. W. Periodic illness assotiated with Epstein-Barr virus infection // Clin. Infect.2009. Dis. Jan. 22(1): 22-27.
СПИСОК авторов:
Human gammaherpesvirus 4
Информация об исследовании
Вирус Эпштейна-Барра
Полимеразная цепная реакция (ПЦР) позволяет увеличить число копий ДНК бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Для диагностики достаточно одной молекулы ДНК. Синтезированное количество ДНК идентифицируют методами иммуноферментного анализа или электрофореза. ПЦР-диагностика позволяет обнаружить возбудителя на самых ранних этапах инфекционного процесса, в любой биологической среде организма, с возможностью количественного определения вирусов или бактерий.
Вирус Эпштейна-Барра вызывает инфекционный мононуклеоз. Инфекционный мононуклеоз (железистая лихорадка Филатова-Пфейффера, моноцитарная ангина, доброкачественный острый лимфобластоз) – острое вирусное заболевание, вызываемое 4 типом вируса простого герпеса вирусом Эпштейна-Барра. Заболевание характеризуется интоксикацией, поражением небных и глоточных миндалин, увеличением лимфатических узлов, печени и селезенки, а также изменениями в крови (наличием атипичных мононуклеаров). Источник инфекции – больной и вирусоносители. Пути передачи: контактный (через посуду, предметы личной гигиены) и воздушно-капельный. Инкубационный период составляет от нескольких дней до 2 месяцев, первые симптомы – умеренные признаки интоксикации и лихорадка. Вирус способствует развитию опухолей, например, лимфомы Беркитта, карциномы носоглотки. Учитывая неспецифичность признаков инфекционного заболевания нужно проводить дифференциальную диагностику с такими заболеваниями, как лакунарная ангина, аденовирусная инфекция, дифтерия. Материалом для исследования методом ПЦР могут служить мазок из зева и миндалин.
Обращаем Ваше внимание, что взятие урогенитального мазка, мазка из зева, носа, полости рта - платное.
Вирус Эпштейна-Барр (ВЭБ) - представитель ДНК-содержащих вирусов из семейства Herpesviridae, являющийся вирусом герпеса человека 4-го типа. В настоящее время доказано, что ВЭБ вызывает инфекционный мононуклеоз, а также способствует развитию опухолей, таких как назофарингеальная карцинома, лимфома Беркитта, Т-клеточная лимфома, болезнь Ходжкина. Около 90% людей старше 40 лет инфицированы ВЭБ. Учитывая неспецифичность признаков инфекционного заболевания нужно проводить дифференциальную диагностику с такими заболеваниями, как лакунарная ангина, аденовирусная инфекция, дифтерия. Вирус выделяется со слюной в остром периоде заболевания и в течение 6-ти месяцев после выздоровления.
Инфекционный мононуклеоз - это острая вирусная патология, которая характеризуется лихорадкой, поражением ротоглотки, увеличением лимфатических узлов, печени и селезенки. У 10-18% больных появляется пятнисто-папулёзная сыпь, возникновению которой предшествует приём препаратов ампициллина или амоксициллина. Инкубационный период - от 4-х до 7-ми недель. Острые симптомы могут сохраняться в течение 3-4-х недель. Реже возможно развитие затяжного (3-6 месяцев) или хронического (более 6-ти месяцев) инфекционного процесса.
Вирус определяется с помощью полимеразной цепной реакции (ПЦР), которая позволяет увеличить число копий ДНК бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Для диагностики достаточно одной молекулы ДНК. Синтезированное количество ДНК идентифицируют методами иммуноферментного анализа или электрофореза. ПЦР-диагностика позволяет обнаружить возбудителя на самых ранних этапах инфекционного процесса, в любой биологической среде организма, с возможностью количественного определения вирусов или бактерий.
Показания к назначению исследования
- Для диагностики инфекционного мононуклеоза.
- Для дифференциальной диагностики герпетических инфекций.
- Для дифференциальной диагностики при ангинах и тонзиллитах.
- Для выявления реактивации вируса Эпштейна – Барр при трансплантации органов и тканей.
Подготовка к исследованию
За 2 недели исключить прием противовирусной терапии
Исключить прием антисептических препаратов за 5-7 дней до исследования.
Не принимать пищу в течение 4 часов перед сдачей анализа, можно пить чистую негазированную воду.
Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования, обязательных требований нет.
Читайте также:


