Вирусы синтезируют свою днк и белки из нуклеотидов
Биология, 10 класс
Перечень вопросов, рассматриваемых в теме;
Урок позволит выявить особенности строения макромолекул, определяющие многообразие белковых молекул, а также обеспечивающие возможность хранения и реализации генетической информации нуклеиновыми кислотами.
Глоссарий по теме (перечень терминов и понятий, введенных на данном уроке);
Белки; аминокислоты; пептидная связь; полипептид; незаменимые аминокислоты; структура белковой молекулы; глобулярные и фибриллярные белки; денатурация белка; ферменты; гормоны; антитела; рецепторы; нуклеиновые кислоты; нуклеотид; ДНК; РНК; АТФ; копмлементарность.
Белки – азотсодержащие высокомолекулярные органические соединения, нерегулярные полимеры, мономерами которых являются аминокислоты.
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильная группа (- СООН) и аминогруппа (- NН2).
Пептидная связь – это прочная ковалентная связь, возникающая при образовании белков (пептидов) в результате взаимодействия аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты.
Полипептид – соединение, состоящее из более 20 аминокислотных остатков.
Незаменимые аминокислоты – необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Незаменимыми для взрослого здорового человека являются 8 аминокислот.
Структура белковой молекулы – сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации. Для того чтобы осуществлять свои биологические функции, белки сворачиваются в одну или несколько особых пространственных конфигураций, обусловленных рядом нековалентных взаимодействий, таких, как водородные связи, ионные связи, гидрофобные взаимодействия и др.
Глобулярные белки – белки, в молекулах которых полипептидные цепи плотно свёрнуты в глобулы (компактные шарообразные третичные структуры). Глобулярную структуру имеют ферменты, иммуноглобулины, некоторые гормоны.
Фибриллярные белки – белки, в молекулах которых расположенные параллельно друг другу вытянутые полипептидные цепи образуют длинные нити или слои (коллаген, кератин, фиброин).
Денатурация – это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. В результате денатурации белок теряет способность выполнять свою функцию.
Ферменты – органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям.
Гормоны – биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах. По химической природе могут быть белками, производными аминокислот, липидами.
Антитела (иммуноглобулины) – белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека или теплокровных животных бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества.
Клеточный рецептор – молекула (обычно белок или гликопротеид) на поверхности клетки, клеточных органелл или растворенная в цитоплазме. Специфично реагирует изменением своей пространственной конфигурации на присоединение к ней молекулы определённого химического вещества, передающего внешний регуляторный сигнал и, в свою очередь, передает этот сигнал внутрь клетки или клеточной органеллы.
Нуклеиновые кислоты – природные биополимеры, образованные остатками нуклеотидов, обеспечивающие хранение, передачу и реализацию наследственной (генетической) информации в живых организмах.
Нуклеотид – низкомолекулярные вещества, которые выполняют функции биорегуляторов (НАД, НАДФ, АТФ и др.) либо входят в состав полимерных молекул ДНК и РНК. В состав нуклеотида входит азотистое основание, углевод пентоза и остаток фосфорной кислоты.
Дезоксирибонуклеиновая кислота (ДНК) – макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Молекула ДНК хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов. ДНК содержит информацию о структуре различных видов РНК и белков.
Рибонуклеиновые кислоты (РНК) – макромолекулы, биологическая функция которых связана с реализацией наследственной информации в клетке.
Аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ) – нуклеотид с тремя остатками фосфорной кислоты, имеющий большое значение в обмене энергии и веществ в организмах. АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Комплементарность – способность нуклеотидов к избирательному соединению друг с другом. Комплементарность обеспечивается взаимодополнением пространственных конфигураций молекул азотистых оснований, а также количеством водородных связей, возникающих между азотистыми основаниями.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц);
1. Беляев Д.К., Дымшиц Г.М. Биология. 10 класс: учебник для общеобразовательных организаций: базовый уровень. – М.: Просвещение, 2014. – стр. 20-37;
2. Тейлор Д., Грин Н., Стаут У. Биология: в 3т. Том 1. – М.: Лаборатория знаний, 2016. – стр. 124-167
6. Открытые электронные ресурсы по теме урока (при наличии);
Теоретический материал для самостоятельного изучения;
Белки — наиболее специфичны и важны для организма. Они относятся к непериодическим полимерам. В отличие от других полимеров их молекулы состоят из сходных, но нетождественных мономеров — 20 различных аминокислот.
Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде
Молекула аминокислоты состоит из специфической части (радикала R) и части, одинаковой для всех аминокислот, включающей аминогруппу (— NH2) с основными свойствами, и карбоксильную группу (СООН) с кислотными свойствами. Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность. Через эти группы происходит соединение аминокислот при образовании полимера — белка. При этом из аминогруппы одной аминокислоты и карбоксила другой выделяется молекула воды, а освободившиеся электроны соединяются, образуя пептидную связь. Поэтому белки называют полипептидами.
Молекула белка представляет собой цепь из нескольких десятков или сотен аминокислот.
Молекулы белков имеют огромные размеры, поэтому их называют макромолекулами. Белки, как и аминокислоты, обладают высокой реактивностью и способны реагировать с кислотами и щелочами. Они различаются по составу, количеству и последовательности расположения аминокислот (число таких сочетаний из 20 аминокислот практически бесконечно). Этим объясняется многообразие белков.
В строении молекул белков различают четыре уровня организации (59)
- Первичная структура — полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными (прочными) пептидными связями.
- Вторичная структура — полипептидная цепь, закрученная в тугую спираль. В ней между пептидными связями соседних витков (и другими атомами) возникают малопрочные водородные связи. В комплексе они обеспечивают довольно прочную структуру.
- Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию — глобулу. Она удерживается малопрочными гидрофобными связями или силами сцепления между неполярными радикалами, которые встречаются у многих аминокислот. Благодаря их многочисленности они обеспечивают достаточную устойчивость белковой макромолекулы и ее подвижность. Третичная структура белков поддерживается также за счет ковалентных S — S (эс — эс) связей, возникающих между удаленными друг от друга радикалами серосодержащей аминокислоты — цистеина.
- Четвертичная структура типична не для всех белков. Она возникает при соединении нескольких белковых макромолекул, образующих комплексы. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул этого белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам. Однако строение белковых молекул зависит от свойств окружающей среды.
Нарушение природной структуры белка называют денатурацией. Она может возникать под воздействием высокой температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде первичной структуры — полипептидной цепи, Этот процесс частично обратим, и денатурированный белок способен восстанавливать свою структуру.
Роль белка в жизни клетки огромна.
Белки — это строительный материал организма. Они участвуют в построении оболочки, органоидов и мембран клетки и отдельных тканей (волос, сосудов и др.). Многие белки выполняют в клетке роль катализаторов — ферментов, ускоряющих клеточные реакции в десятки, сотни миллионов раз. Известно около тысячи ферментов. В их состав, кроме белка, входят металлы Mg, Fe, Мn, витамины и т. д.
Каждая реакция катализируется своим особым ферментом. При этом действует не весь фермент, а определенный участок — активный центр. Он подходит к субстрату, как ключ к замку. Действуют ферменты при определенной температуре и рН среды. Особые сократительные белки обеспечивают двигательные функции клеток (движение жгутиковых, инфузорий, сокращение мышц и т. д.). Отдельные белки (гемоглобин крови) выполняют транспортную функцию, доставляя кислород ко всем органам и тканям тела. Специфические белки — антитела — выполняют защитную функцию, обезвреживая чужеродные вещества. Некоторые белки выполняют энергетическую функцию. Распадаясь до аминокислот, а затем до еще более простых веществ, 1 г белка освобождает 17,6 кДж энергии.
Молекула ДНК имеет сложное строение. Она состоит из двух спирально закрученных цепей. Ширина двойной спирали 2 нм 1 , длина несколько десятков и даже сотен микромикрон (в сотни или тысячи раз больше самой крупной белковой молекулы). ДНК — полимер, мономерами которой являются нуклеотиды — соединения, состоящие из молекулы фосфорной кислоты, углевода — дезоксирибозы и азотистого основания. Их общая формула имеет следующий вид:
Фосфорная кислота и углевод одинаковы у всех нуклеотидов, а азотистые основания бывают четырех типов: аденин, гуанин, цитозин и тимин. Они и определяют название соответствующих нуклеотидов:
- адениловый (А),
- гуаниловый (Г),
- цитозиловый (Ц),
- тимидиловый (Т).
Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов. В ней соседние нуклеотиды соединены прочной ковалентной связью между фосфорной кислотой и дезоксирибозой.
При огромных размерах молекул ДНК сочетание в них из четырех нуклеотидов может быть бесконечно большим.
Между А и Т возникают две связи, между Г и Ц — три.
Удвоение молекулы ДНК — ее уникальная особенность, обеспечивающая передачу наследственной информации от материнской клетки дочерним. Процесс удвоения ДНК называется редупликацией ДНК. Он осуществляется следующим образом. Незадолго перед делением клетки молекула ДНК раскручивается и ее двойная цепочка под действием фермента с одного конца расщепляется на две самостоятельные цепи. На каждой половине из свободных нуклеотидов клетки, по принципу комплементарности, выстраивается вторая цепь. В результате вместо одной молекулы ДНК возникают две совершенно одинаковые молекулы.
РНК — полимер, по структуре сходный с одной цепочкой ДНК, но значительно меньших размеров. Мономерами РНК являются нуклеотиды, состоящие из фосфорной кислоты, углевода (рибозы) и азотистого основания. Три азотистых основания РНК — аденин, гуанин и цитозин — соответствуют таковым ДНК, а четвертое — иное. Вместо тимина в РНК присутствует урацил. Образование полимера РНК происходит через ковалентные связи между рибозой и фосфорной кислотой соседних нуклеотидов. Известны три вида РНК: информационная РНК (и-РНК) передает информацию о структуре белка с молекулы ДНК; транспортная РНК (т-РНК) транспортирует аминокислоты к месту синтеза белка; рибосомная РНК (р-РНК) содержится в рибосомах, участвует в синтезе белка.
Эта реакция сопровождается выделением 40 кДж энергии, поэтому фосфорнокислородную связь называют макроэнергетической связью и обозначают знаком [бесконечность]. В АТФ имеются две такие связи. Если отщепляются две молекулы фосфорной кислоты, то АТФ переходит в АМФ (аденозинмонофосфорную кислоту).
АТФ играет центральную роль в превращении энергии в клетке.
Примеры и разбор решения заданий тренировочного модуля (не менее 2 заданий).
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
Тип вариантов ответов: (Текстовые, Графические, Комбинированные)
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца
Подсказка: вспомните, какую роль выполняют ферменты.
Соберите из элементов изображение молекулы вещества, являющегося универсальным источником энергии для многих биохимических процессов, протекающих в живых системах.

Изображение необходимо разрезать на тайлы таким образом, чтобы была возможность выбора варианта соединения между разными компонентами молекулы.
Тип вариантов ответов: (Текстовые, Графические, Комбинированные)
Подсказка: универсальным источником энергии для многих биохимических процессов, протекающих в живых системах, является АТФ (аденозинтрифосфат). АТФ – адениловый нуклеотид, к которому присоединены ещё два остатка фосфорной кислоты.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
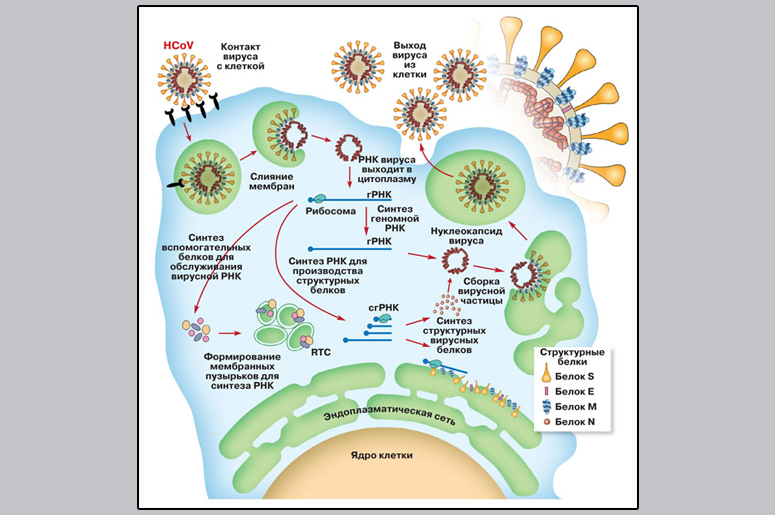
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.
Кирилл Стасевич, биолог
Какие слабые места антибиотики находят у бактерий?
Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.)
Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией
Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей.
Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном.
Почему же антибиотики не действуют на вирусы?
Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию.
До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии).
Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает.
Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль.
Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой.
Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки.
Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики.
Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен.
Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента.
Читайте также:


