Вирусный эндокардит что это такое

Инфекционный эндокардит (ИЭ) – грозное заболевание, характеризующееся крайне неблагоприятным прогнозом при естественном его течении. Анализируя литературные данные, можно отметить, что частота ИЭ в Российской Федерации имеет сравнительно высокие показатели распространенности по отношению к другим странам; так, в расчете на 1 млн населения заболеваемость ИЭ составляет: в США 38-92,9 человека, в Канаде – 20-25, в Швеции – 59, Англии – 23-25, Франции – 18-23, Германии и Италии – 16. В России заболеваемость ИЭ достигает 46,3 человека на 1 млн населения [1]. Особую активность проблема данного заболевания приобретает в связи с неуклонным ростом ИЭ интактных клапанов в течение последних десятилетий на фоне общего роста заболеваемости инфекционным эндокардитом в 3-4 раза 2.
Диагностика ИЭ представляет значительные затруднения в связи с ярко выраженным полиморфизмом клиники, широким спектром возбудителей и ростом доли полимикробной инфекции в генезе ИЭ [5]. На ранних этапах заболевание не имеет специфических диагностических признаков. Так, клиническая картина подострого ИЭ характеризуется преобладанием и нарастанием общей астеновегетативной симптоматики на фоне лихорадки и в некоторых случаях миалгии, а острая форма инфекционного эндокардита может манифестировать уже с осложнений в виде отрыва вегетаций и эмболии органов. Результаты лабораторной диагностики также не позволяют врачу-клиницисту заподозрить данное заболевание, так как у пациента будут отмечаться анемия, лейкоцитоз и ускорение скорости оседания эритроцитов (СОЭ), в общем анализе мочи может быть микрогематурия и протеинурия [6; 7]. Доказана чувствительность С-реактивного белка (СРБ) при диагностике ИЭ, но данный воспалительный маркер специфичен для целого ряда воспалительных заболеваний [8].
Даже несмотря на технические достижения современной медицины, постановка диагноза ИЭ во многих случаях значительно растягивается во времени, что, вероятно, связано с небольшим числом работ, описывающих клинико-эпидемиологические характеристики инфекционного эндокардита на современном этапе [9].
Целью нашей работы явилось изучение структуры заболеваемости, основных особенностей клинической и лабораторно-инструментальной картины, вариантов поражения клапанного аппарата, а также осложнений ИЭ.
Результаты и их обсуждение. За исследуемый период времени наблюдается увеличение числа пациентов с ИЭ (рис. 1), что хорошо согласуется с данными общемировой статистики [1].
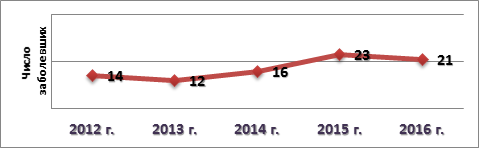
Рис. 1. Случаи выявления ИЭ в период за 2012-2016 гг.
Анализ половой структуры заболеваемости показывает, что мужчины болеют в 3 раза чаще, чем женщины (Z=2,137880, p-level=0,032527), составляя при этом 64% от общего числа.
Результаты анализа возрастной структуры ИЭ позволяют утверждать, что большинство страдающих инфекционным эндокардитом пациентов - это больные молодого и среднего возраста, при этом отмечается отчетливая тенденция к увеличению абсолютного числа пациентов молодого и среднего возраста среди всех пациентов с ИЭ (рис. 2, 3).
Далее нами были проанализированы особенности течения ИЭ по клиническим вариантам: острая форма наблюдалась лишь в 7 клинических случаях (8,14%), подострая – у 91,86% пациентов с ИЭ.
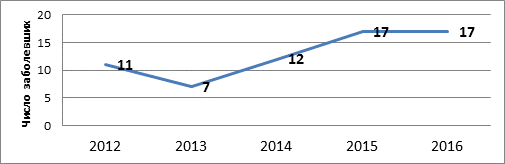
Рис. 2. Динамика заболеваемости ИЭ пациентов молодого и среднего возраста
в период с 2012 по 2016 г.
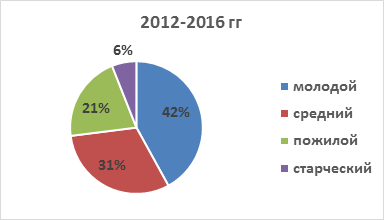
Рис. 3. Возрастная структура пациентов с ИЭ
Анализ поражений клапанного аппарата выявил следующие морфологические варианты инфекционного эндокардита: первичный ИЭ естественных клапанов – 66,27%, вторичный ИЭ естественных клапанов – 15,12%, ранний ИЭ протеза клапанов – 11,63% и поздний ИЭ протеза клапанов в 6,98% случаев.
Среди случаев ИЭ естественных клапанов преобладает эндокардит левых отделов – 65,11%. Сочетанное поражение трикуспидального клапана (ТК) и митрального клапана (МК) наблюдалось в 4,65% случаев в результате сообщения правой и левой полостей сердца вследствие образования абсцессов. Эндокардит правых отделов сердца был выявлен у 33,24% пациентов.
Анализируя случаи эндокардита правых отделов сердца, можно отметить неуклонный рост числа больных с данным видом поражения клапанного аппарата в период с 2013 по 2016 год (рис. 4).
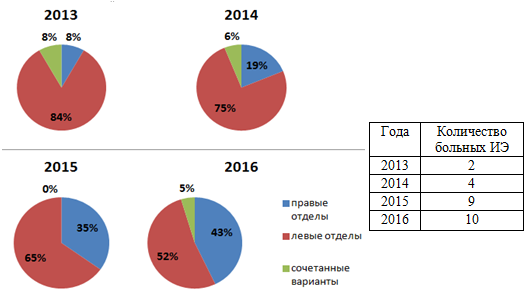
Рис. 4. Рост абсолютного числа больных с эндокардитом правых отделов сердца
Среди наиболее распространенных осложнений ИЭ у пациентов с эндокардитом правых отделов сердца можно отметить: пневмонию, экссудативный перикардит, абсцесс легкого, асцит, гидроторакс, нефритический синдром с явлениями почечной недостаточности.
При этом тяжелая почечная недостаточность с максимальным повышением креатинина до 671 мкмоль/л отмечалась лишь у пациентов с поражением митрального и аортального клапанов.
Среди эндокардита левых отделов характерны осложнения в виде левожелудочковой сердечной недостаточности, нефритического синдрома с развитием почечной недостаточности, экссудативного перикардита, гидроторакса.
Анемия была типичным осложнением как при поражении правых, так и левых отделов, встречаясь в 16,3% случаев.
Эмболические осложнения наблюдались у 8 пациентов, что составило 9% от общего числа. При ИЭ левых отделов сердца у больных развился эмболический инфаркт селезенки в одном случае, а в другом – эмболизация сосудов головного мозга, почек и сердца. При поражении трикуспидального и легочного клапанов в 6 случаях (7% от общего количества больных ИЭ) закономерно развилась тромбоэмболия мелких ветвей легочной артерии.
Проанализировав клиническую симптоматику, можно выявить следующие ведущие симптомы инфекционного эндокардита: одышка в 73% случаев, лихорадка – 72%, астения – 64%, отеки нижних конечностей – 31%, кардиалгия – 30%, миалгия – 10%.
Изучив результаты диагностических методов выявления ИЭ, можно отметить низкую выявляемость положительной гемокультуры среди всех пациентов вне зависимости от формы, сроков возникновения, половозрастной группы (таблица). Положительная гемокультура встречалась только у 23% больных от общего числа, что, вероятно, свидетельствует как о необходимости совершенствования лабораторной диагностики сепсиса, так и о высокой распространенности назначения антибактериальной терапии до проведения бактериологического посева крови.
Структура бактериологически подтвержденных возбудителей ИЭ
*Enterococcus faecium, Klebsiella pneumoniae, Stenotrophomonas maltophilia
Варианты положительной гемокультуры
Анализируя данные лабораторной диагностики, отмечаем повышение СОЭ свыше 20 мм/ч у 57 больных – 67% от общего количества больных, и свыше 40 мм/ч в 27% случаев. Вместе с тем 21% больных имели уровень СОЭ в пределах нормальных значений. В работе [5] Тюрина В.П. и Гогина Е.Е. в качестве одного из патогномоничных симптомов отмечено ускорение СОЭ в 97% случаев у пациентов с ИЭ, что противоречит полученным нами данным. Таким образом, ИЭ не всегда сопровождается увеличением СОЭ (рис. 5).
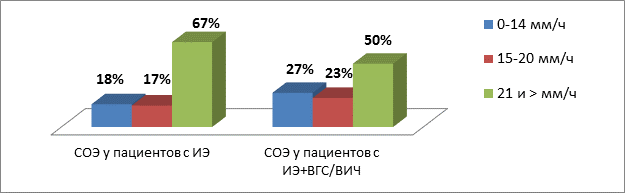
Рис. 5. Показатели СОЭ у пациентов с ИЭ
Примечание к рисунку: СОЭ – скорость оседания эритроцитов, ИЭ – инфекционный эндокардит, ВГС – вирус гепатита С, ВИЧ – вирус иммунодефицита человека
Среднее значение СРБ среди всех пациентов составило 47,99 ±10,49 мг/л. СРБ оставался в пределах нормальных значений (за норму принимали диапазон от 0 до 5 мг/л) у 17,65% пациентов, для большинства пациентов характерно повышение СРБ свыше 10 и более мг/л (76,47%). Подавляющее большинство больных имели значение СРБ свыше 30 мг/л.
Наличие нормальных значений СРБ при ИЭ, очевидно, свидетельствует о крайне низкой реактивности организма. Среди всех пациентов с нормальными значениями СРБ нам встретился лишь 1 пациент в возрасте 46 лет с ИЭ левых отделов сердца. При этом нормальные значения СРБ наблюдались у двух пациентов старческого возраста и 3 больных с ИЭ правых отделов сердца. В первом случае низкая реактивность обусловлена снижением иммунного ответа, связанным с возрастом. Во втором случае – нормальные значения СРБ обусловлены угнетением иммунитета, вероятнее всего, вследствие внутривенной наркомании, определенный вклад в снижение реактивности иммунитета, несомненно, вносит вирусный гепатит С (ВГС). Два из трех пациентов с эндокардитом правых отделов сердца, имевших нормальный уровень СРБ, страдали вирусным гепатитом С.
В целом проанализировать вклад вирусного гепатита С и ВИЧ в ареактивность пациентов с ИЭ практически невозможно, так как значения СРБ у таких больных варьируют в крайне широком диапазоне: от нормальных до крайне экстремальных значений (166, 177 и даже 298 мг/л). Однако при анализе значения СОЭ у пациентов с ИЭ выявляется отчетливая тенденция к более низким значениям СОЭ (рис. 5) у пациентов, страдающих ВГС/ВИЧ, приближающаяся к статистической достоверности (Z=1,676; P=0,09). Вышеописанные изменения СОЭ, вероятно, подтверждают мысль о роли ВГС и ВИЧ в снижении иммунной реактивности организма пациентов с ИЭ.
Необходимо отметить, что в исследовании ряда авторов под руководством Hogevik H., Olaison L. было также установлено, что СОЭ является менее чувствительным показателем по отношению к СРБ, так как нормальные значения СОЭ наблюдались в 28% случаев, в то время когда уровень СРБ был в норме лишь у 4%. В работе также отмечено, что ИЭ стафилококкового происхождения с коротким периодом клинической симптоматики коррелируют с более высокими уровнями СРБ [8].
Таким образом, полученные результаты позволяют отметить, что наблюдающийся рост заболеваемости ИЭ в период за 2012-2016 годы связан с увеличением поражения числа лиц молодого и среднего возраста.
Значительная доля и увеличение числа больных с поражением правых отделов сердца свидетельствуют о том, что вышеуказанные изменения заболеваемости связаны с вероятным распространением внутривенной наркомании.
Таким образом, к 2015-2016 году сформировалось характерное клиническое лицо пациента с ИЭ: молодой больной, чаще мужского пола, с длительным лихорадочным синдромом, проявлениями общей интоксикации, симптомами правожелудочковой сердечной недостаточности в сочетании с инфаркт-пневмонией легкого или деструктивными поражениями легочной ткани.
Согласно анамнестическим данным, проведение посевов крови в большинстве случаев предшествовало проведению антибиотикотерапии, что закономерно привело к значительному снижению лиц с положительной гемокультурой. Выявлен крайне низкий процент высевания микроорганизмов возбудителей ИЭ. Полученные данные убедительно свидетельствуют о первостепенности клинической и инструментальной диагностики (ЭхоКГ, ЧПЭхоКГ). Методы бактериальной диагностики в большинстве случаев имеют вторичное значение в подтверждении диагноза, но играют определяющую роль при выборе антибиотикотерапии в случае выявления положительной гемокультуры у пациента. Отсутствие воспалительной активности в анализах крови при яркой клинической картине ИЭ и положительного результата посева гемокультуры не должно вводить в заблуждение лечащего врача.
Сервис предоставляет возможность записи на прием через интернет,
только платный прием!
только для взрослых!
Запись на прием - ежедневно!
Прием врачей по субботним дням уточняйте в регистратуре.
Инфекционный эндокардит. Что это такое? Меры профилактики.

Инфекционный эндокардит (ИЭ) – воспалительное заболевание инфекционной природы, характеризующееся преимущественным поражением клапанов сердца, пристеночного эндокарда и эндотелия крупных сосудов, протекающее по типу сепсиса с токсическим поражением органов, развитием иммунопатологических реакций, эмболических и других осложнений.
В последние годы регистрируется рост заболеваемости ИЭ в различных странах мира. В среднем ИЭ встречается в 3,1-11,6 случаев на 100000 населения. Распространенность ИЭ в разных странах неодинакова: в США – 3,8-9,3; в Канаде- 2,0-2,5; в Швеции – 5,9; в Англии – 2,3-2,5; во Франции – 1,8-2,3; в Германии и Италии – 1,6; в России- 4,6; в РБ – 3,9 случаев на 100000 населения.
Инфекционный эндокардит является полиэтиологичным заболеванием. В настоящее время в качестве возбудителей болезни известны более 120 микроорганизмов. Основное значение среди возбудителей ИЭ имеют грамположительные кокки (представители родов Staphylococcus, Streptococcus, Enterococcus), грамотрицательные бактерии (бактерии группы НАСЕК (Haemophilus, Actinobacillus actinomycetecomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella Kingae) и другие грамотрицательные бактерии: Escherichia, Salmonella, Shigella, Proteus, Klebsiella), грибы (Candida, Aspergillus). В последние десятилетия основными возбудителями инфекционного эндокардита стали эпидермальный и золотистый стафилококк, которые выделяют у 75-80% лиц с положительной гемокультурой.
Существует несколько классификаций ИЭ.
1. Клинико-морфологическая форма:
первичный ИЭ – возникающий на неповрежденных клапанах сердца;
вторичный ИЭ – возникающий на фоне существующей патологии клапанов сердца в результате предшествующего ревматического, атеросклеротического поражения, либо перенесенного ранее ИЭ.
2. По этиологическому фактору:
энтерококковый и т.д.
3. По течению заболевания:
острое (длительностью менее 2 месяцев),
подострое (длительностью более 2 месяцев),
затяжной ИЭ (употребляется крайне редко, в значении маломанифестного подострого течения ИЭ).
В особые формы ИЭ выделяют:
ИЭ протезированного клапана;
ИЭ у лиц с имплантированными внутрисердечными устройствами - электрокардиостимулятором и кардиовертером-дефибриллятором;
ИЭ у лиц с трансплантированными органами;
ИЭ у наркоманов;
ИЭ у лиц пожилого и старческого возраста (марантический).
Факторы риска развития инфекционного эндокардита.
Выделяют три категории риска, связанные с внутрисердечными причинами.
Категория высокого риска:
1. протезированные клапаны сердца;
2. предшествующий ИЭ;
4. хирургически установленный пульмональный шунт;
5. приобретенные пороки сердца (в том числе ревматические).
Категория умеренного (промежуточного) риска:
1. другие врожденные пороки сердца;
2. гипертрофическая кардиомиопатия;
3. пролапс митрального клапана с регургитацией и (или) утолщением его створок (миксоматозная дегенерация створок митрального клапана).
Категория минимального риска:
1. изолированный дефект межпредсердной перегородки;
2. хирургически корригированный дефект межпредсердной перегородки, дефект межжелудочковой перегородки;
3. предшествующее аортокоронарное шунтирование;
4. пролапс митрального клапана без регургитации;
5. предшествующая ревматическая лихорадка без клапанной дисфункции;
6. имплантированный ЭКС и/или КД.
В случае бактериемии, повреждении эндокарда и имеющихся нарушений в иммунной защите организма ИЭ также может развиваться при следующих состояниях: интоксикация, пожилой и старческий возраст, наркомания, алкоголизм, прием иммунодепрессантов (глюкокортикостероиды, цитостатики), длительно стоящие катетеры центральных вен, сахарный диабет, ВИЧ-инфекция, солидные опухоли, синдром диссеминированного внутрисосудистого свертывания (ДВС), трансплантация органов, инфицированные кожные заболевания, программный гемодиализ, медицинские манипуляции на мочевыводящих путях и толстом кишечнике.
Диагностика включает в себя внимательный осмотр пациента, аускультацию сердца, анализы крови, ЭКГ, ультразвуковое исследование сердца (эхокардиография). В общем анализе крови выявляются типичные признаки воспаления (увеличение СОЭ, лейкоцитоз). Необходимо также дважды провести посев венозной крови с целью выявления конкретного возбудителя (для этого необходимо две пробы крови). Отрицательный результат посева крови, тем не менее, не исключает диагноз ИЭ. Решающую роль в диагностике играет эхокардиография (через переднюю грудную стенку или чреспищеводная), с помощью которой можно достоверно установить наличие микробных вегетаций, степень поражения клапанов и нарушения насосной функции сердца.
Лечение инфекционного эндокардита. Медикаментозная терапия должна быть этиотропной, патогенетической, симптоматической. В каждом конкретном случае лечение проводится индивидуально, учитываются тяжесть состояния больного, возбудитель, фаза развития, вариант течения болезни, объем лечебных мероприятий на предыдущих этапах.
Антибиотикотерапия является основой медикаментозного лечения ИЭ и проводится с учетом вида возбудителя, его чувствительности к антибиотикам (каждый микроорганизм подавляется только определенными видами антибиотиков), состояния сердечно-сосудистой системы, наличия осложнений инфекционного эндокардита и общего состояния организма. Длительность антибиотикотерапии составляет не менее 4-8 недель в зависимости от вида возбудителя.
Хирургическое лечение используется примерно у половины больных инфекционным эндокардитом при развитии серьезных осложнений (разрушение клапанов сердца, наличие абсцессов, фистул, ложных аневризм, стойкая лихорадка более 10 дней и др.).
Профилактика инфекционного эндокардита направлена на устранение факторов риска этого заболевания. Например, соблюдение гигиены полости рта (чистка зубов несколько раз ежедневно, регулярное использование зубной нити, применение антисептиков для полоскания рта и регулярное наблюдение у стоматолога) значительно уменьшит количество бактерий в ротовой полости и уменьшит риск эндокардита. Необходимо также избегать переохлаждения, вирусных и бактериальных инфекций ( гриппа , ангины ). Проводить санацию очагов хронической инфекции не реже 1 раза в 3 - 6 месяцев.
Пациентам с высоким риском эндокардита может быть показан профилактический прием антибиотика, который назначают перед любой инвазивной процедурой - стоматологические манипуляции на деснах или перфорации слизистой оболочки рта (например, депульпирование зуба) или при любом состоянии (например , инфекции желудочно-кишечного тракта или мочевыводящей системы ), которые могут способствовать попаданию микробов в кровоток.
Антибиотикопрофилактика показана только пациентам с высоким риском при инвазивных процедурах или состояниях, повышающих вероятность попадания микробов в кровоток. Однако, решение о профилактическом использовании антибиотиков лучше всего принимать вместе с врачом.
Врач-кардиолог второй квалификационной категории
, MD, North Shore Hospital, Auckland
Last full review/revision September 2017 by Guy P. Armstrong, MD







Эндокардит обычно означает инфекцию эндокарда (то есть инфекционный эндокардит). Термин эндокардит также может включать неинфекционный эндокардит, при котором стерильные тромбоциты и фибриновые тромбы фиксируются на клапанах сердца и прилегающем эндокарде. Неинфекционный эндокардит иногда может приводить к инфекционному эндокардиту. Оба могут привести к эмболизации и нарушению функции сердца.
Диагноз инфекционного эндокардита обычно устанавливается с учетом совокупности всех клинических данных, а не результата одного исследования.
Инфекционный эндокардит может возникнуть в любом возрасте. Мужчины заболевают в два раза чаще, чем женщины. Лица, употребляющие внутривенные наркотики, пациенты с ослабленным иммунитетом и пациенты с искусственными клапанами сердца и другими внутрисердечными устройствами имеют наибольший риск.
Этиология
Здоровое сердце относительно устойчиво к инфекции. Бактерии и грибы не легко адгезируются к поверхности эндокарда, и постоянный ток крови помогает предотвратить их оседание на эндокард. Таким образом, для развития эндокардита требуются, как правило, 2 условия:
Предшествующая аномалия эндокарда
Присутствие микроорганизмов в кровотоке (бактериемия)
Реже, массивная бактериемия или особо вирулентные микроорганизмы поражают нормальные клапаны.
Эндокардит часто поражает клапаны сердца. Основными предрасполагающими факторами ИЭ являются врожденные пороки сердца, ревматическое поражение клапанов, бикуспидальный или кальцинированный аортальный клапан, пролапс митрального клапана, гипертрофическая кардиомиопатия и предшествующий эндокардит. Протезирование клапанов и других внутрисердечных устройств представляет особый риск. Иногда пристеночные тромбы, дефекты межжелудочковой перегородки и область открытого аортального протока подвергаются инфицированию. Ядром инфекции является стерильная фибринозно-тромбоцитарная вегетация, формирующаяся при высвобождении поврежденными эндотелиальными клетками тканевых факторов.
Инфекционный эндокардит чаще всего поражает левые отделы сердца (например, митральный или аортальный клапаны). Примерно в 10–20% случаев поражаются правые отделы (трикуспидальный или пульмональный клапаны). Внутривенные наркоманы имеют более высокий риск развития правостороннего эндокардита (около 30–70%).
Микроорганизмы, поражающие эндокард, могут попадать из отдаленных очагов инфекции (например, кожный абсцесс, воспаленные или инфицированные десны, инфекция мочевыводящих путей) или через очевидные входные ворота, такие как центральный венозный катетер или места инъекций препаратов. Практически любой чужеродный имплантированный материал (например, желудочковый или перитонеальный шунт, протез) подвергается риску бактериальной колонизации, тем самым становясь источником бактериемии и, следовательно, эндокардита. Эндокардит может быть результатом асимптомной бактериемии, которая, как правило, возникает во время инвазивных стоматологических, медицинских или хирургических вмешательств. Даже чистка зубов и жевание могут приводить к бактериемии (обычно зеленящим стрептококком) у пациентов с гингивитом.
Возбудители различаются в зависимости от места инфекции, источника бактериемии и факторов риска пациента (например, внутривенные наркоманы), но в 80–90% случаев стрептококки и Staphylococcus aureus являются причиной ИЭ. Энтерококки, грам-отрицательные бациллы, микроорганизмы группы HACEK (Haemophilus, гемофильные бактерии, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens и Kingella kingae) и грибки являются причиной большинства других случаев.
Болезнь протекает в трех стадиях:
Бактериемия: микроорганизмы присутствуют в крови
Адгезия: микроорганизм присоединяется к аномальному или поврежденному эндотелию с помощью поверхностных адгезинов
Колонизация: пролиферация организма вместе с развитием воспаления, что приводит к образованию зрелых вегетаций
Многие из возбудителей образовывают полисахаридные биопленки, которые защищают их от иммунной защиты хозяина и препятствуют проникновению антибиотиков
Патофизиология
Эндокардит имеет локальные и системные осложнения.
Местные последствия инфекционного эндокардита включают:
Абсцессы миокарда с деструкцией тканей, а иногда и с нарушением проводимости (чаще при нижне-перегородочных абсцессах).
Внезапная, тяжелая клапанная регургитация может привести к сердечной недостаточности и смерти (чаще из-за поражения митрального или аортального клапана).
Аортит в связи с распространением инфекции из прилегающих структур.
Для больных с протезированными клапанами характерно развитие абсцессов клапанного кольца, обструктивных вегетаций, абсцессов миокарда и грибковых аневризм, что проявляется клапанной обструкцией, дисфункцией клапана и нарушением проводимости.
Системные осложнения в первую очередь обусловлены
Эмболизация инфицированным материалом из сердечного клапана
Иммуно-опосредованные явления (в основном при хронической инфекции)
Поражение правых камер сердца характеризуется развитием септических эмболий легочной артерии, которые могут привести к инфаркту легкого, пневмонии или эмпиеме. Поражение левых камер сердца может приводить к эмболиям любых органов, особенно часто почек, селезенки и центральной нервной системы. Микотические аневризмы могут формироваться в любых крупных сосудах. Часто развиваются эмболии кожи и сетчатки. Вследствие отложения иммунных комплексов развивается диффузный гломерулонефрит.
Классификация
Инфекционный эндокардит может иметь вялотекущее, подострое течение или более острое, молниеносное течение с высокой опасностью развития быстрой декомпенсации.
Подострый бактериальный эндокардит (ПБЭ), несмотря на агрессивность, обычно развивается незаметно и прогрессирует медленно (т.е от нескольких недель до месяцев). Источник инфекции или входные ворота часто не выявляются. Возбудителями ПСЭ чаще всего являются стрептококки (особенно зеленящий, микроаэрофильный, анаэробный, стрептококки группы D и энтерококки), реже причиной могут быть золотистый и эпидермальный стафилококки - S. aureus, Staphylococcus epidermidis, стрептококки Gemella morbillorum, Abiotrophia defectiva (ранее, Streptococcus defectivus), Granulicatella и требовательный к питательным средам Haemophilus. Стрептококковый подострый эндокардит часто развивается на пораженных клапанах после асимптомной бактериемии, вследствие инфекций периодонта, гастроинтестинальных и урогенитальных инфекций.
Острый бактериальный эндокардит (ОБЭ) обычно развивается внезапно и прогрессирует быстро (т.е. в течение дней). Источник инфекции или входные ворота часто легко выявляются. Когда инфекция высоко вирулентна или бактериальное воздействие массивно, острый бактериальных эндокардит может поражать нормальные клапаны сердца. Он обычно вызван золотистым стрептококком S. aureus, гемолитическим стрептококком группы А, пневмококком или гонококком.
Эндокардит протезированного клапана (ЭПК) развивается у 2–3% пациентов в течение первого года после протезирования клапана и в 0,5% в последующие годы. Чаще развивается после замены аортального клапана, нежели митрального и в одинаковой степени поражает как механические, так и биологические протезы. Раннее начало инфекции ( 2 мес. после хирургического лечения) вызвано главным образом инфицированием в ходе операции бактериями, резистентными к противомикробным препаратам (S. epidermidis, дифтероиды, колиформные бациллы, Candida, Aspergillus). Позднее начало инфекции происходит в основном в результате контаминации низко-вирулентными организмами во время оперативного вмешательства или при транзиторных бессимптомных бактериемиях, чаще всего благодаря попаданию стрептококка; S. epidermidis; дифтероидов; и требовательной к средам грамотрицательной палочки Haemophilus, Actinobacillus actinomycetemcomitans, и Cardiobacterium hominis.
Клинические проявления
Клиническая картина зависит от классификации, но она неспецифична.
Первоначально симптомы подострого бактериального эндокардита смазанные: субфебрильная лихорадка ( 39 ° С), ночные поты, утомляемость, недомогание и потеря веса. Возможны озноб и артралгии. Симптомы клапанной недостаточности могут быть первым признаком, ведущим к постановке диагноза. Первоначально менее чем ( ≤ ) у 15% пациентов наблюдается лихорадка или шумы в сердце, но со временем оба эти симптома развиваются практически у всех больных. Объективное исследование может выявлять бледность, лихорадку, изменение ранее существовавшего шума или появление шума новой регугитации и тахикардию.

Этот пациент с инфекционным эндокардитом имеет множественные узелки Ослера (болезненные, эритематозные узелки на пальцах ног).
У данного пациента с инфекционным эндокардитом на ладонях видны множественные язвочки Джейнвея (безболезненные эритематозные папулы). На пальцах пациента также наблюдаются своеобразные узлы Ослера (болезненные, эритематозные узелки на пальцах).
На изображении слева показан узелок Ослера (мягкий эритематозный узелок) на большом пальце. На изображении справа показаны язвочки Джейнвея (безболезненные эритематозные пятна на ладони).
Точечные кровоизлияния представляют собой небольшие линейные кровоизлияния под ногтевыми пластинами.

На данной фотографии показаны конъюнктивальные петехии у пациента с инфекционным перикардитом.
На данной фотографии показано конъюктивальное кровоизлияние у пациента с инфекционным перикардитом.
На изображении слева показаны множественные пятна Рота или ретинальные кровоизлияния. Изображение справа – увеличенный снимок пятен Рота с бледной зоной в центре.
Клиническая картина острого бактериального эндокардита и эндокардита искусственного клапана подобна картине подострого бактериального эндокардита, но течение более быстрое. Лихорадка почти всегда выявляется в начале заболевания, у пациентов имеются симптомы интоксикации; иногда развивается септический шок. Сердечные шумы выявляются первоначально примерно у 50–80% пациентов и со временем у > 90%. Редко развивается гнойный менингит.
Септическая эмболия легочной артерии может вызывать кашель, плевральные боли в грудной клетке и иногда кровохарканье. Характерно наличие шума трикуспидальной регургитации.
Диагностика
Эхокардиография, иногда – другие методы получения изображения
Так как клиническая картина неспецифична, вариабельна и может развиться незаметно, диагностика требует высокой настороженности. Эндокардит следует подозревать у пациентов с лихорадкой без явных причин инфекции, особенно если есть шум в сердце. Настороженность в плане ИЭ должна быть очень велика в том случае, если имеются положительные результаты посева крови у пациентов с патологией клапанов сердца, у пациентов, которым недавно выполнялись инвазивные процедуры или у внутривенных наркоманов. Пациенты с доказанной бактериемией должны быть тщательно и многократно обследованы на предмет новых клапанных шумов и признаков эмболии.
Кроме позитивных посевов крови, других специфических лабораторных изменений нет. Установленные инфекционные поражения эндокарда часто приводят к нормохромной нормоцитарной анемии, лейкоцитозу, повышению СОЭ, увеличению уровня иммуноглобулинов, появлению циркулирующих иммунных комплексов и положительному ревматоидному фактору, но эти изменения не помогают в постановке диагноза. В общем анализе мочи часто выявляется микрогематурия, иногда эритроцитарные цилиндры, пиурия или бактериурия.
Идентификация возбудителя и определение его чувствительности к антибиотикам жизненно необходимы для определения тактики лечения.
Если заподозрен эндокардит, должно быть выполнено 3 забора крови на посев (20 мл каждый) в течение 24 ч (если клиническая картина представлена острым бактериальным эндокардитом, то 2 забора крови с интервалом между 1-м и 2-м в 1 час). Каждый новый забор крови должен быть произведен путем отдельной венепункции (т.е. не из ранее установленных внутрисосудистых катетеров). Забор крови не должен производиться во время наличия у пациента лихорадки или озноба, поскольку у большинства пациентов бактериемия носит постоянный характер. При эндокардите и в отсутствие предшествовавшей антибиотикотерапии все 3 посева образцов крови положительны, поскольку бактериемия продолжается; по крайней мере, 1 посев крови положительный в 99% случаев. Необходимо избегать преждевременного использования эмпирической антибактериальной терапии у пациентов с приобретенными или врожденными пороками во избежание эндокардитов с негативными посевами крови. Если ранее проводили антибактериальную терапию, следует также получить результаты гемокультуры, однако они могут быть отрицательными.
Посевы крови требуют 3–4-недельной инкубации для определенных микроорганизмов; однако некоторые запатентованные автоматически мониторирующие культуральные системы могут идентифицировать позитивные культуры в течение недели. Другие микроорганизмы (например, Aspergillus sp) могут не выявляться при посевах крови. Некоторые микроорганизмы (например, Coxiella burnetii, Bartonella sp, Chlamydia psittaci, Brucella sp) требуют серологической диагностики; другие микроорганизмы (например, Legionella pneumophila) требуют специальную культуральную среду или ПЦР (например, Tropheryma whippelii). Негативные результаты посевов крови могут быть следствием первичной антибактериальной терапии, инфицированности микроорганизмами, которые не растут на стандартных питательных средах, или указывать на другой диагноз (например, неинфекционный эндокардит, миксома предсердия с эмболиями, васкулит).
На начальном этапе необходимо выполнение эхокардиаграфии, обычно трансторакальной (ТТЭ), а не трансэзофагеальной (ТЭЭ). ТЭЭ является более чувствительной (т.е. способна выявлять вегетации маленького размера, невидимые при ТТЭ),
Чреспищеводную эхокардиографию следует проводить при таких случаях:
Пациенты имеют искусственный клапан
Трансторакальная эхокардиография не является диагностической
Диагноз инфекционного эндокардита был установлен клинически (проводится для выявления перфораций, абсцессов и свищей)
Иногда используется КТ, если при ЧПЭ не возможно точно определить околоклапанные абсцессы, а также для обнаружения микотических аневризм. ПЭТ является новым инструментом для диагностики эндокардита, который возникает в простетических и внутрисердечных устройствах. В настоящее время патологии, выявленные при КТ и ПЭТ включены в Европейские рекомендации в качестве основных критериев.
Инфекционный эндокардит достоверно диагностируется, когда микроорганизмы выявляются гистологически (или культурально) в эндокардиальных вегетациях, полученных в ходе операции на сердце, эмболэктомии или аутопсии. Так как вегетации обычно недоступны для исследования, существуют разнообразные клинические критерии для установления диагноза. К ним относятся пересмотренные критерии Дюка (с чувствительностью и специфичностью > 90%— Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка а также Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита) и модифицированные критерии Европейского общества кардиологии (ESC) 2015 года (1).
Критерии ESC аналогичны модифицированным критериям Дюка, но в качестве основных критериев включают результаты расширенной визуализации как указано далее:
Вегетации, абсцесс, псевдоаневризма, внутрисердечная фистула, клапанная перфорация или аневризма или новое частичное раскрывание створок искуссвенного клапана, которые выявлены при эхокардиографии
Аномальная активность вокруг искусственного клапана (имплантированного > 3 мес раньше), обнаруженная при ПЭТ/КТ или ОФЭКТ/КТ с лейкоцитами, меченными радиоактивными изотопами
Околоклапанные поражения, выявленные при КТ сердца
Критерии ESC также отличаются от малых модифицированных критериев Дюка, детализируя, что только лишь выявление бессимптомных сосудистых явлений при визуализации является достаточным.
Читайте также:


