Вирусные белки синтезируются из нуклеотидов вируса
В 1901 американский военный хирург У.Рид и его коллеги установили, что возбудитель желтой лихорадки также является фильтрующимся вирусом. Желтая лихорадка была первым заболеванием человека, опознанным как вирусное, однако потребовалось еще 26 лет, чтобы ее вирусное происхождение было окончательно доказано.
Свойства и происхождение вирусов. Наиболее просто устроенные вирусы состоят из нуклеиновой кислоты, являющейся генетическим материалом (геномом) вируса, и покрывающего нуклеиновую кислоту белкового чехла. В состав некоторых вирусов входят также углеводы и жиры (липиды). Таким образом, вирусы можно рассматривать просто как мобильные наборы генетической информации. Вирусы лишены некоторых ферментов, необходимых для репродукции, и могут размножаться только внутри живой клетки, метаболизм которой после заражения перестраивается на воспроизводство вирусных, а не клеточных компонентов. Это свойство вирусов позволяет отнести их к облигатным (обязательным) клеточным паразитам. После синтеза отдельных компонентов формируются новые вирусные частицы. Симптомы вирусного заболевания развиваются как следствие повреждения вирусами отдельных клеток.
Принято считать, что вирусы произошли в результате обособления (автономизации) отдельных генетических элементов клетки, получивших, кроме того, способность передаваться от организма к организму. В нормальной клетке происходят перемещения нескольких типов генетических структур, например матричной, или информационной, РНК (мРНК), транспозонов, интронов, плазмид. Такие мобильные элементы, возможно, были предшественниками, или прародителями, вирусов.
Являются ли вирусы живыми организмами? В 1935 американский биохимик У.Стэнли выделил в кристаллической форме вирус табачной мозаики, доказав тем самым его молекулярную природу. Полученные результаты вызвали бурные дискуссии о природе вирусов: являются ли они живыми организмами или просто активированными молекулами? Действительно, внутри зараженной клетки вирусы проявляют себя как интегральные компоненты более сложных живых систем, но вне клетки представляют собой метаболически инертные нуклеопротеины. Вирусы содержат генетическую информацию, но не могут самостоятельно реализовать ее, не обладая собственным механизмом синтеза белка. Когда особенности строения и репродукции вирусов оказались выясненными, вопрос о том, являются ли они живыми, постепенно утратил свое значение.
Размеры вирусов. Величина вирусов варьирует от 20 до 300 нм (1 нм = 10 - 9 м). Практически все вирусы по своим размерам мельче, чем бактерии ( см. БАКТЕРИИ) . Однако наиболее крупные вирусы, например вирус коровьей оспы, имеют такие же размеры, как и наиболее мелкие бактерии (хламидии и риккетсии), которые тоже являются облигатными паразитами и размножаются только в живых клетках. Поэтому отличительными чертами вирусов по сравнению с другими микроскопическими возбудителями инфекций служат не размеры или обязательный паразитизм, а особенности строения и уникальные механизмы репликации (воспроизведения самих себя).
Вирионы со спиральным типом симметрии, как у вируса табачной мозаики, имеют форму удлиненного цилиндра; внутри белкового чехла, состоящего из отдельных субъединиц капсомеров, находится свернутая спираль нуклеиновой кислоты (РНК). Вирионы с икосаэдрическим типом симметрии (от греч. eikosi двадцать, hedra поверхность), как у полиовируса, имеют сферическую, а точнее, многогранную форму; их капсиды построены из 20 правильных треугольных фасеток (поверхностей) и похожи на геодезический купол.
Встречаются вирусы с еще более сложным строением. Вирионы поксвирусов (вирусы группы оспы) не имеют правильного, типичного капсида: между сердцевиной и наружной оболочкой у них располагаются трубчатые и мембранные структуры.
ДНК обычно существует в виде двухцепочечных структур: две полинуклеотидные цепочки соединены водородными связями и закручены таким образом, что образуется двойная спираль. РНК, напротив, обычно существует в виде одноцепочечных структур. Однако геном отдельных вирусов представляет собой одноцепочечную ДНК или двухцепочечную РНК. Нити (цепочки) вирусной нуклеиновой кислоты, двойные или одинарные, могут иметь линейную форму или замыкаться в кольцо.
У некоторых ДНК-содержащих вирусов сам цикл репродукции в клетке не связан с немедленной репликацией вирусной ДНК; вместо этого вирусная ДНК встраивается (интегрируется) в ДНК клетки-хозяина. На этой стадии вирус как единое структурное образование исчезает: его геном становится частью генетического аппарата клетки и даже реплицируется в составе клеточной ДНК во время деления клетки. Однако впоследствии, иногда через много лет, вирус может появиться вновь запускается механизм синтеза вирусных белков, которые, объединяясь с вирусной ДНК, формируют новые вирионы.
Так называемые ретровирусы содержат в качестве генома РНК и имеют необычный способ транскрипции генетического материала: вместо транскрипции ДНК в РНК, как это происходит в клетке и характерно для ДНК-содержащих вирусов, их РНК транскрибируется в ДНК. Двухцепочечная ДНК вируса затем встраивается в хромосомную ДНК клетки. На матрице такой вирусной ДНК синтезируется новая вирусная РНК, которая, как и другие, определяет синтез вирусных белков. См. также РЕТРОВИРУСЫ.
Тем не менее система классификации вирусов необходима в практической работе, и попытки ее создания предпринимались неоднократно. Наиболее продуктивным оказался подход, основанный на структурно-функциональной характеристике вирусов: чтобы отличить разные группы вирусов друг от друга, описывают тип их нуклеиновой кислоты (ДНК или РНК, каждая из которых может быть одноцепочечной или двухцепочечной), ее размеры (число нуклеотидов в цепочке нуклеиновой кислоты), число молекул нуклеиновой кислоты в одном вирионе, геометрию вириона и особенности строения капсида и наружной оболочки вириона, тип хозяина (растения, бактерии, насекомые, млекопитающие и т.д.), особенности вызываемой вирусами патологии (симптомы и характер заболевания), антигенные свойства вирусных белков и особенности реакции иммунной системы организма на внедрение вируса.
В систему классификации вирусов не вполне укладывается группа микроскопических возбудителей болезней, называемая вироидами (т.е. вирусоподобными частицами). Вироиды вызывают многие распространенные среди растений болезни. Это мельчайшие инфекционные агенты, лишенные даже простейшего белкового чехла (имеющегося у всех вирусов); они состоят только из замкнутой в кольцо одноцепочечной РНК.
Эволюция вирусов и вирусных инфекций. Хотя вирусы не являются полноценными живыми организмами, их эволюционное развитие имеет много общего с эволюцией других патогенных организмов. Для того чтобы сохраниться как вид, ни один паразит не может быть слишком опасным для своего основного хозяина, в котором размножается. В противном случае это привело бы к полному исчезновению хозяина как биологического вида, а вместе с ним и самого возбудителя. В то же время любой патогенный организм не сможет существовать как биологический вид, если у его основного хозяина слишком быстро и эффективно развивается иммунитет, позволяющий подавлять репродукцию возбудителя. Поэтому вирус, вызывающий острое и тяжелое заболевание у какого-либо вида животных, обычно имеет еще и другого хозяина. Размножаясь в последнем, вирус не наносит ему (как виду) существенного вреда, однако такое относительно безвредное сосуществование поддерживает циркуляцию вируса в природе. Так, например, вирус бешенства в природе сохраняется среди грызунов, для которых заражение этим вирусом не является смертельным. Природным резервуаром для вирусов лошадиных энцефалитов, особо опасных для лошадей и в несколько меньшей степени для человека, являются птицы. Эти вирусы переносятся кровососущими комарами, в которых вирус размножается без существенного вреда для комара. Иногда вирусы могут передаваться насекомыми пассивно (без размножения в них), однако чаще всего они репродуцируются в переносчиках.
Для многих вирусов, например кори, герпеса и отчасти гриппа, основным природным резервуаром является человек. Передача этих вирусов происходит воздушно-капельным или контактным путем.
Распространение некоторых вирусных заболеваний, как и других инфекций, полно неожиданностей. Например, в группах людей, проживающих в антисанитарных условиях, практически все дети в раннем возрасте переносят полиомиелит, обычно протекающий в легкой форме, и приобретают иммунитет. Если же условия жизни в этих группах улучшаются, дети младшего возраста обычно полиомиелитом не болеют, но заболевание может возникнуть в более старшем возрасте, и тогда оно часто протекает в тяжелой форме.
Возбудители некоторых болезней, в том числе очень тяжелых, не укладываются ни в одну из вышеперечисленных категорий. К особой группе медленных вирусных инфекций еще недавно относили, например, болезнь Крейтцфельда Якоба и куру дегенеративные заболевания головного мозга, имеющие очень продолжительный инкубационный период. Однако оказалось, что они вызываются не вирусами, а мельчайшими инфекционными агентами белковой природы прионами ( см . ПРИОН) .
Лечение и профилактика. Репродукция вирусов тесно переплетается с механизмами синтеза белка и нуклеиновых кислот клетки в зараженном организме. Поэтому создать лекарства, избирательно подавляющие вирус, но не наносящие вреда организму, задача чрезвычайно трудная. Все же оказалось, что у наиболее крупных вирусов герпеса и оспы геномные ДНК кодируют большое число ферментов, отличающихся по свойствам от сходных клеточных ферментов, и это послужило основой для разработки противовирусных препаратов. Действительно, создано несколько препаратов, механизм действия которых основан на подавлении синтеза вирусных ДНК. Некоторые соединения, слишком токсичные для общего применения (внутривенно или через рот), годятся для местного использования, например при поражении глаз вирусом герпеса.
Известно, что в организме человека вырабатываются особые белки интерфероны. Они подавляют трансляцию вирусных нуклеиновых кислот и таким образом угнетают размножение вируса. Благодаря генной инженерии стали доступны и проходят проверку в медицинской практике интерфероны, производимые бактериями ( см. ГЕННАЯ ИНЖЕНЕРИЯ) .
К самым действенным элементам естественной защиты организма относятся специфические антитела (специальные белки, вырабатываемые иммунной системой), которые взаимодействуют с соответствующим вирусом и тем самым эффективно препятствуют развитию болезни; однако они не могут нейтрализовать вирус, уже проникший в клетку. Примером может служить герпетическая инфекция: вирус герпеса сохраняется в клетках нервных узлов (ганглиев), где антитела не могут его достичь. Время от времени вирус активируется и вызывает рецидивы заболевания.
Обычно специфические антитела образуются в организме в результате проникновения в него возбудителя инфекции. Организму можно помочь, усиливая выработку антител искусственно, в том числе создавая иммунитет заранее, с помощью вакцинации. Именно таким способом, путем массовой вакцинации, заболевание натуральной оспой было практически ликвидировано во всем мире. См. также ВАКЦИНАЦИЯ И ИММУНИЗАЦИЯ.
Накопление вирусов. Для приготовления вакцинных препаратов необходимо накопить вирус. С этой целью часто используют развивающиеся куриные эмбрионы, которых заражают данным вирусом. После инкубирования зараженных эмбрионов в течение определенного времени накопившийся в них вследствие размножения вирус собирают, очищают (центрифугированием или другим способом) и, если нужно, инактивируют. Очень важно удалить из препаратов вируса все балластные примеси, которые могут вызывать серьезные осложнения при вакцинации. Конечно, не менее важно убедиться, что в препаратах не осталось неинактивированного патогенного вируса. В последние годы для накопления вирусов широко используют различные типы клеточных культур.
Работы с бактериофагами способствовали расширению методического арсенала в изучении вирусов животных. До этого исследования вирусов позвоночных выполнялись в основном на лабораторных животных; такие опыты были очень трудоемки, дороги и не очень информативны. Впоследствие появились новые методы, основанные на применении тканевых культур; бактериальные клетки, использовавшиеся в экспериментах с фагами, были заменены на клетки позвоночных. Однако для изучения механизмов развития вирусных заболеваний эксперименты на лабораторных животных очень важны и продолжают проводиться в настоящее время.
Вирусология . Под редакцией Филдса Б., Найта Д., тт. 13, М., 1989
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
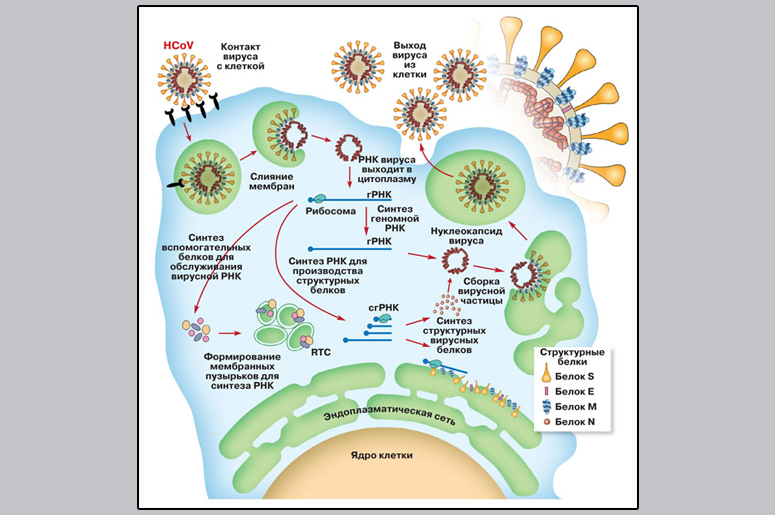
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.


Вполне вероятно, что в обозримом будущем значение этого слова применительно к компьютерным данным получит свое оригинальное значение. Дело в том, что этим летом исследователям из Microsoft и Университета Вашингтона удалось сделать то, что не удавалось сделать до них никому, — записать 200 Мбайт данных в виде последовательности нуклеотидов, входящих в состав искусственно созданной ДНК.
Какое отношение к этому имеют вирусы? Да самое прямое! Вирусы внедряют свой генетический код в ДНК клеток пораженных организмов, заставляя их воспроизводить себя, а не полезные для организма белки (напомню, что жизнь, как учили нас классики, — это форма существования белковых тел).
Особенно агрессивные вирусы настолько мешают нормальной работе пораженного ими организма, что в итоге приводят к его смерти. Точно так же особенно неприятный вредоносный код может привести к невозможности использовать пораженную информационную систему.
Все признаки организма, начиная от цвета волос и глаз и заканчивая предрасположенностью к наследственным заболеваниям, записаны в ДНК. Записаны они в виде последовательности нуклеотидов — молекулярных блоков, содержащих в себе всего лишь четыре разновидности азотистых оснований: аденин, гуанин, тимин, цитозин. Это такие биологические биты.
Как видите, в отличие от человека, матушка-природа использовала не двоичную систему счисления, а четверичную. Кстати, природа хорошо позаботилась о защите от сбоев — у большинства живых существ ДНК представляет собой не одну, а две цепочки нуклеотидов, закрученные друг вокруг друга как витая пара в двойную спираль.
Держатся эти две цепочки друг за друга водородными связями, которые образуются только в том случае, если с каждой из сторон расположен строго определенный нуклеотид, — таким образом автоматически гарантируется взаимное соответствие информации в каждой из двух спиралей. На этом и основан первый механизм защиты от сбоев: при расшифровке или репликации ДНК используется одна из двух спиралей, а вторая играет роль контрольной — на тот случай, если вдруг какая-то последовательность нуклеотидов, кодирующих тот или иной генетический признак, оказалась в одной из спиралей повреждена.
Кроме взаимного соответствия двух цепочек нуклеотидов кодирование наследственных признаков дополнительно производится с применением избыточного алгоритма — можно сказать, что каждый наследственный признак, записанный в виде последовательности биологических битов — оснований, дополнительно снабжен контрольной суммой.
За те полвека, что прошли с момента открытия ДНК, эти последовательности довольно неплохо изучены, что позволяет любому желающему заказать расшифровку основных генетических признаков собственной ДНК онлайн, причем не только в ближайшей лаборатории, но и в Интернете — с помощью сервиса 23andme и аналогичных ему.
Теперь о том, как информацию ДНК считывают. Изначально в распоряжении ученых были такие методы, как рентгеновский структурный анализ, семейство спектроскопических методов и масс-спектрометрия. Все эти методы неплохо работают для небольших молекул, состоящих из двух, трех, четырех атомов, но все становится сильно сложнее, когда количество атомов действительно велико.
Однако ДНК не зря считают самой большой молекулой в нашем организме — в человеческой ДНК из гаплоидной клетки содержится порядка 3 млрд пар оснований. Ее молекулярная масса на несколько порядков больше молекулярной массы самого крупного из известных науке белков.
В общем, это неимоверно огромная куча атомов, поэтому на расшифровку данных при использовании классических методов считывания даже сегодня, с применением суперкомпьютеров, легко уходят месяцы, а то и годы.
Но ученым удалось придумать метод секвенирования, который сильно ускоряет процедуру. Основная его идея — разбиение одной длинной последовательности атомов на много коротких фрагментов, которые можно анализировать параллельно, тем самым кратно увеличивая скорость расшифровки.
Но поскольку нам нужна не просто полная копия ДНК, а нарезка на короткие фрагменты, то дополнительно используют так называемые праймеры и маркеры — соединения, сообщающие полимеразе, где начать клонировать, а где закончить.
Если говорить в компьютерных терминах, то происходит это следующим образом. Допустим, у нас есть комбинация бит 1101100001010111010010111. Предположим, что нашим праймером является комбинация 0000, а маркером — комбинация 11. В результате секвенирования мы получим следующий набор фрагментов, в порядке убывания их вероятности: 0000101011, 00001010111, 0000101011101001011, 00001010111010010111.
Варьируя праймер и маркер, мы в конечном итоге переберем все возможные комбинации бит, считаем их, а после считывания восстановим из отдельных фрагментов всю последовательность.
Выглядит немного сложно и неочевидно, но это действительно работает и обеспечивает неплохую скорость, поскольку в итоге все необходимые действия можно делать параллельно. Неплохая скорость по меркам биологов — это несколько часов. Существенно лучше вышеупомянутых месяцев или даже лет, но по меркам ИТ, скажем так, многовато.
Научившись за полвека неплохо считывать информацию из ДНК, оставалось научиться синтезировать цепочки нуклеотидов. Тут надо уточнить, что исследователи Microsoft были не первыми, кто записал информацию в виде двойной спирали ДНК. Первыми были ученые из европейского института биоинформатики (EMBL-EBI), несколько лет назад записавшие 739 Кбайт.
В чем же новизна достижений Microsoft? Во-первых, в существенном увеличении объема записи — до 200 Мбайт. Уже довольно близко к тем 750 Мбайт, которые содержатся в ДНК человека. Впрочем, главная инновация состоит в том, что исследователи предложили способ, позволяющий считывать не всю ДНК целиком, а ее отдельный участок — порядка 100 битов-оснований за одну операцию.
Пока ученые считают, что основной нишей подобного использования ДНК могут стать модули памяти высокой плотности, предназначенные для длительного хранения информации. В этом есть смысл — плотность записи данных в лучших современных образцах флеш-памяти достигает десятков квадриллионов (
10 16 ) бит на кубический сантиметр, в то время как плотность хранения данных в ДНК на три порядка выше: десятки квинтиллионов (
Дополнительное преимущество состоит в том, что молекулы ДНК достаточно стабильны и, с учетом алгоритмов коррекции ошибок, позволяют хранить информацию годами, а то и веками.
Что это означает с точки зрения информационной безопасности? А означает это, что целостности записанной в таком видео информации угрожают организмы, которые специализируются на порче данных уже миллиарды лет, — вирусы.
А вот надо ли будет думать о защите от обычных вирусов, работая с таким запоминающим устройством, — вопрос открытый. Ведь если в раствор с ДНК попадет, например, вирус насморка, полимераза, скорее всего, будет реплицировать и его тоже.
Поэтому как бы не пришлось, прочитав ДНК-чип лет через десять после его записи, вспоминать, не чихала ли лаборантка во время записи важного архивного документа.
Читайте также:


