Вирус ньюкасла против рака отзывы онкобольных
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
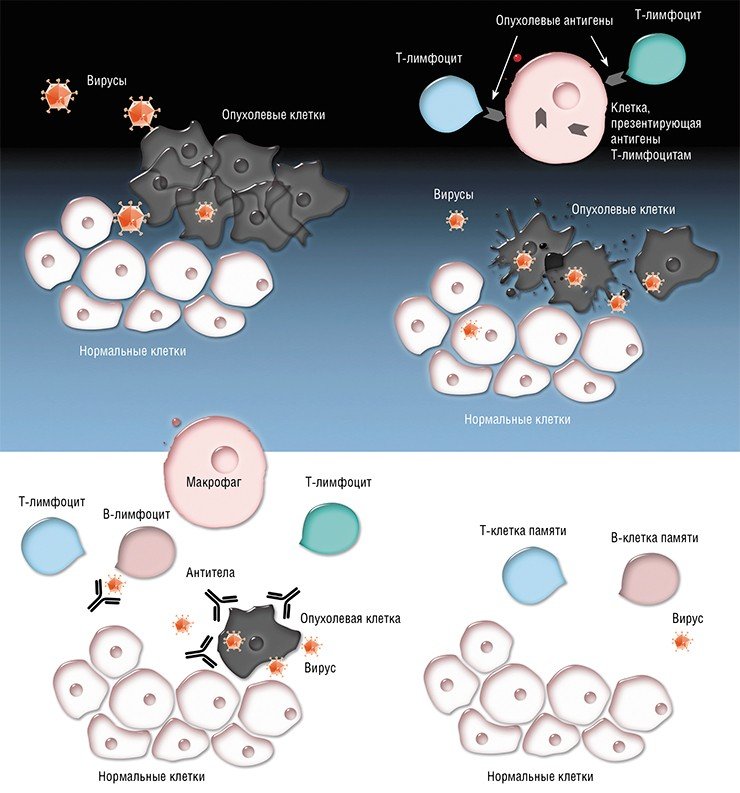
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
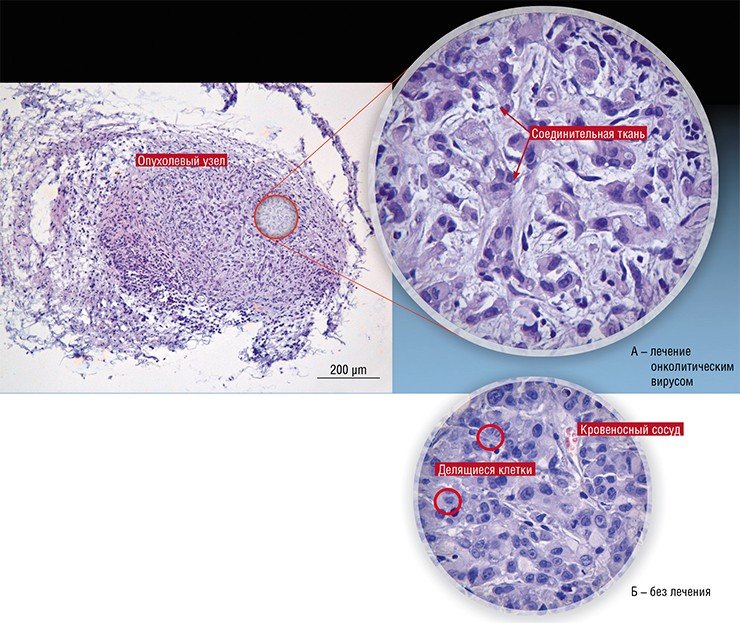
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
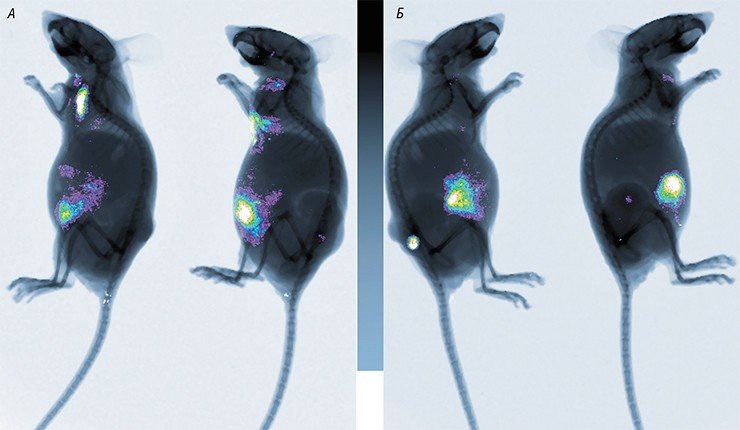
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
Во время эпидемий пациенты онкологических клиник всегда находятся в зоне повышенного риска. Ситуация с COVID-19 — не исключение.
COVID-19 не спешит покидать Россию, и каждый день сообщается о сотнях новых зараженных. В группе риска — пожилые люди и пациенты с патологиями.
Вместе с врачами разбираемся, насколько сильно угрожает коронавирус онкобольным.
Почему онкобольные находятся в повышенной группе риска?
Онкологические больные в принципе находятся в группе повышенного риска, когда дело касается инфекционных заболеваний. На фоне химиотерапии и других видов лечения иммунитет пациентов сильно подавлен, и организму гораздо труднее справляется с угрозами.
Он напомнил, что некоторые новообразования связаны с хроническим воздействием канцерогенов, в частности при курении. Это, по словам онколога, приводит к серьезным болезням легких и сердечно-сосудистой системы, что создает дополнительную угрозу при заражении COVID-19.
Есть ли статистика, какова доля онкобольных среди пациентов с COVID-19?
Группа китайских исследователей собрали анамнез по 1,5 тыс. пациентов с коронавирусом. Восемнадцать из них болели той или иной формой рака. В частности, у пятерых диагностировали опухоль в легких, четверо получали химиотерапию либо подвергались хирургическим вмешательствам за последний месяц.
Ученых смутило, что в общей выборке оказалось сравнительно много онкобольных, что статистически выше раковой статистики по Китаю. Поэтому исследователи пришли к выводу, что эти цифры могут лишний раз свидетельствовать о том, что из-за угнетенного иммунитета онкобольные особенно восприимчивы к коронавирусу нового типа.
Больным с какими видами рака стоит быть особенно осторожными?
В национальной службе здравоохранения Англии подготовили рекомендации для врачей-онкологов. Авторы документа составили список пациентов, которые наиболее уязвимы перед COVID-19.
Так, упоминаются больные, проходящие химиотерапию или радикальную лучевую терапию при раке легких. Далее следуют пациенты с раком крови или костного мозга. Подвержены риску люди, проходящие иммунотерапию или которым в последние полгода произвели трансплантацию костного мозга, стволовых клеток.
Рекомендации английских властей, разумеется, универсальны. Такие же группы больных перечисляет и химиотерапевт Федор Моисеенко.
Как себя защитить?
По возможности соблюдать режим самоизоляции. Недавно власти разъяснили, пациентам с какими диагнозами лучше оставаться дома. В том числе упоминают больных с острым лейкозом, высокозлокачественной лимфомой и другими опухолями. Ознакомиться подробнее с перечнем можно здесь.
Что делать, если повысилась температура тела?
Напомним, COVID-19 часто протекает с типичными для простуды и гриппа симптомами. Врачи НМИЦ онкологии им. Петрова разъяснили, как себя вести при появлении первых признаков ОРВИ. По словам экспертов, стоит остаться дома, надеть маску и вызвать врача. Специалист уточнит сроки противоопухолевой терапии и хирургических вмешательств.
Что будет, если онкобольной заболеет коронавирусом?
Противоопухолевую терапию отменят, пока анализы не покажут отрицательный результат на COVID-19, рассказали сотрудники НМИЦ онкологии имени Н.Н. Петрова.
Если признаков ОРВИ нет, то лечение должно продолжаться. Однако ведь сейчас довольно сложно попасть к врачу…
Действительно, в Петербурге и других населенных пунктах вводят запрет на прием в поликлиниках и госпитализацию. Койки освобождают, больницы перепрофилируют, все силы брошены на борьбу с коронавирусом.
Значит, записаться на прием к онкологу можно. Но ведь на улице теперь небезопасно. Как быть?
Да, угроза COVID-19 до сих пор актуальна. Почитайте наши рекомендации, как защитить себя во время пандемии. Соблюдать меры предосторожности сейчас особенно важно.
Полный текст:
В настоящее время рак остается одной из ведущих причин смертности в развитых странах мира. Использование онколитических вирусов (ОВ) является перспективным возможным методом ингибирования опухолевого роста. Несмотря на то, что открытие онколитической функции ряда вирусов произошло еще в прошлом веке, использование ОВ до сих пор не нашло должного признания. Одни из наиболее многообещающих - вирусы семейства Paramyxoviridae, в частности вирус болезни Ньюкасла (ВБН), не являющийся патогенным для человека и обладающий некоторыми эффективными механизмами воздействия на опухолевые клетки и индукции иммунного ответа. Для ВБН характерны селективное инфицирование и распространение вируса в опухолевых клетках, прямой цитопатический эффект, а также косвенная индукция врожденного и адаптивного иммунного ответа хозяина. Однако внутриопухолевое введение ОВ не всегда является возможным и приводит лишь к локальному действию. Существует предположение, что клетки иммунной системы могут использоваться в качестве возможных носителей ОВ для обеспечения временной защиты от факторов иммунной системы организма опухоленосителя. В исследованиях действия ОВ самыми эффективными клеточными носителями среди многочисленных оцениваемых типов иммунных клеток являлись дендритные клетки (ДК). Таким образом, совместное действие ОВ и ДКВ является важным для взаимного потенцирования противоопухолевого эффекта обоих компонентов (вирусного и клеточного); получение таких продуктов представляется целесообразным с целью их дальнейшего клинического применения.
Ситковская Анастасия Олеговна - младший научный сотрудник лаборатории иммунофенотипирования опухолей.
Ростов-на-Дону, 344037, ул. 14-я линия, 63
SPIN-код: 1659-6976, ResearcherlD (WOS): E-7496-2018, Author ID (Scopus): 56381527400
Златник Елена Юрьевна - доктор медицинских наук, профессор, главный научный сотрудник лаборатории иммунофенотипирования опухолей.
Ростов-на-Дону, 344037, ул. 14-я линия, 63
SPIN-код: 4137-7410, Author ID (Scopus): 6603160432
Новикова Инна Арнольдовна - кандидат медицинских наук, ведущий научный сотрудник лаборатории иммунофенотипиро-вания опухолей.
Ростов-на-Дону, 344037, ул. 14-я линия, 63
SPIN-код: 4810-2424, ResearcherID (WOS): E-7710-2018, Author ID (Scopus): 7005153343
Кит Олег Иванович - доктор медицинских наук, профессор, член-корреспондент РАН, генеральный директор.
Ростов-на-Дону, 344037, ул. 14-я линия, 63
SPIN-код: 1728-0329, ResearcherID (WOS): U-2241-2017, Author ID (Scopus): 55994103100
1. De Pace N. Sulla scomparsa di un enorme cancro vegetante del collo dell’utero senza cura chirurgica. Ginecologia. 1912; 9: 82-89.
2. Ottolino-Perry K., Diallo J.S., Lichty B.D., Bell J.C., McCart JA. Intelligent design: combination therapy with oncolytic viruses. Mol Ther. 2010; 18 (2): 251-263. doi: 10.1038/mt.2009.283.
3. Fournier P., Schirrmacher V. Oncolytic Newcastle Disease Virus as Cutting Edge between Tumor and Host. Biology (Basel). 2013 Jul 2; 2 (3): 936-75. doi: 10.3390/biology2030936.
4. Alexander D.J. Historical aspects. Newcastle disease. Boston: Kluwer Academic Publishers. 1988: 1-10.
5. Dimitrov K.M., Ramey AM., Qiu X., Bahl J., Afonso C.L. Temporal, geographic, and host distribution of avian paramyxovirus 1 (Newcastle disease virus). Infect Genet Evol. 2016 Apr; 39: 22-34. doi: 10.1016/j.meegid.2016.01.008.
6. Dimitrov K.M., Afonso C.L., Yu Q., Miller PJ. Newcastle disease vaccines A solved problem or a continuous challenge? Vet Microbiol. 2017 Jul; 206: 126-136. doi: 10.1016/j.vetmic.2016.12.019.
7. Schirrmacher V. Immunobiology of Newcastle Disease Virus and Its Use for Prophylactic Vaccination in Poultry and as Adjuvant for Therapeutic Vaccination in Cancer Patients. Int J Mol Sci. 2017 May 20; 18 (5). pii: E1103. doi: 10.3390/ijms18051103.
8. Cassel W.A., Garrett R.E. Newcastle disease virus as an antineoplastic agent. Cancer. 1965; 18: 863-868.
9. Sinkovics J.G., Horvath J.C. Newcastle disease virus (NDV): brief history of its oncolytic strains. J Clin Virol. 2000; 16: 1-15.
10. Csatary L.K. Viruses in the treatment of cancer. Lancet. 1971; 2 (7728): 825.
11. Miller P.J., Koch G. Newcastle disease. Diseases of Poultry. 13th ed. NJ, USA: Wiley-Blackwell; Hoboken. 2013. 89-138.
12. Юрченко К.С., Губанова Н.В., Шестопалова Л.В., Щелка-новМ.Ю., ШестопаловА.М. Онколитические свойства вируса болезни Ньюкасла. Тихоокеанский медицинский журнал. 2015; 3: 14—18.
13. Шестопалова Л.В., Максимова ДА., Красильникова АА., Корчагина К.В., Силко Н.Ю., Шестопалов А.М. Вирусы болезни Ньюкасла как перспективный агент для создания онколитических препаратов. Вестник НГУ. Серия: Биология, клиническая медицина. 2012; 10 (2): 232-242.
14. Tayeb S., Zakay-Rones Z., Panet A. Therapeutic potential of oncolytic Newcastle disease virus: a critical review. Oncolytic Virother. 2015 Mar 27; 4: 49-62. doi: 10.2147/OV.S78600.
15. Zhang S., Sun Y., Chen H., Dai Y., Zhan Y., Yu S., Qiu X., Tan L., Song C., Ding C. Activation of the PKR/eIF2a signaling cascade inhibits replication of Newcastle disease virus. Virol J. 2014 Mar 31; 11: 62. doi: 10.1186/1743-422X-11-62.
16. Каверин Н.В., Львов Д.К., Щелканов М.Ю. Парамиксовирусы (Paramyxoviridae). Руководство по вирусологии. М., 2013. 192-197.
17. Sanchez-FelipeL., VillarE., Munoz-Barroso I. a2-3- and a2-6- N-linked sialic acids allow efficient interaction of Newcastle Disease Virus with target cells. Glycoconj J. 2012 Oct; 29 (7): 539-49. doi: 10.1007/s10719-012-9431-0.
18. Schirrmacher V. Fifty Years of Clinical Application of Newcastle Disease Virus: Time to Celebrate! Biomedicines. 2016 Jul 20; 4 (3). pii: E16. doi: 10.3390/biomedicines4030016.
19. Porotto M., Salah Z., DeVito I., Talekar A., Palmer S.G., Xu R., Wilson I.A., Moscona A. The second receptor binding site of the globular head of the Newcastle disease virus (NDV) hemagglutinin-neuraminidase activates the stalk of multiple paramyxovirus receptor binding proteins to trigger fusion. J Virol. 2012 May; 86 (10): 5730^1. doi: 10.1128/JVI.06793-11.
20. Molouki A., Peeters B. Rescue of recombinant Newcastle disease virus: Current cloning strategies and RNA polymerase provision systems. Arch Virol. 2017 Jan; 162 (1): 1-12. doi: 10.1007/s00705-016-3065-7.
21. Lundstrom K. New frontiers in oncolytic viruses: optimizing and selecting for virus strains with improved efficacy. Biologics. 2018 Feb 9; 12: 43-60. doi: 10.2147/BTT.S140114.
22. Kroemer G., Galuzzi I., Kepp O., Zitvogel I. Immunogenic cell death in cancer therapy. Annu Rev Immunol. 2013; 31: 51-72. doi: 10.1146/annurev-immunol-032712-100008.
23. KomminothP., Roth J., Saremaslani P, Matias-Guiu X., Wolfe H. J., Heitz P. U. Polysialic acid of the neural cell adhesion molecule in the human thyroid: a marker for medullary thyroid carcinoma and primary C-cell hyperplasia. An immunohistochemical study on 79 thyroid lesions. Am J Surg Pathol. 1994 Apr; 18 (4): 399-411.
24. Lu D.Y., Lu T.R., Wu H.Y. Development of Antimetastatic Drugs by Targeting Tumor Sialic Acids. Sci Pharm. 2012 Jul-Sep; 80 (3): 497-508. doi: 10.3797/scipharm.1205-01.
25. Матвеева О.В., Кочиева Г.В., Нетесов С.В., Оникиенко С.Б., Чумаков П.М. Механизмы онколитического действия парамиксовируса сендай. Acta Naturae. 2015; 7 (2(25)): 6-16.
26. CohenM., Elkabets M., PerlmutterM., Porgador A., Voronov E., ApteR.N., LichtensteinR.G. Sialylation of 3-methylcholanthrene-induced fibrosarcoma determines antitumor immune responses during immu-noediting. J Immunol. 2010 Nov 15; 185 (10): 5869-78. doi: 10.4049/jimmunol.1001635.
27. Santry L.A., McAusland T.M., Susta L., Wood G.A., Major Petrik J.J., Bridle B.W., Wootton S.K. Production and Purification of High-Titer Newcastle Disease Virus for Use in Preclinical Mouse Models of Cancer. Mol Ther Methods Clin Dev. 2017 Oct 16; 9: 181-191. doi: 10.1016/j.omtm.2017.10.004.
28. Elankumaran S., Rockemann D., Samal S.K. Newcastle Disease Virus Exerts Oncolysis by both Intrinsic and Extrinsic Caspase-Dependent Pathways of Cell Death. J Virol. 2006 Aug; 80: 7522-7534. doi: 10.1128/JVI.00241-06.
29. Kumar R., Tiwari A.K., Chaturvedi U., Kumar G.R., SahooA.P., Rajmani R.S., Saxena L., Saxena S., Tiwari S., Kumar S. Velogenic Newcastle disease virus as an oncolytic virotherapeutics: In vitro characterization. Appl Biochem Biotechnol. 2012 Aug; 167 (7): 2005-22. doi: 10.1007/s12010-012-9700-1.
30. Elmore S. Apoptosis:A Review of Programmed Cell Death. Toxicologic pathology. 2007; 35 (4): 495-516. doi:10.1080/01926230701320337.
31. ZamarinD., Palese P. Oncolytic Newcastle disease virus for cancer therapy: old challenges and new directions. Future Microbiol. 2012 Mar; 7 (3): 347-67. doi: 10.2217/fmb.12.4.
32. Ch’ng W.C., StanbridgeE.J., Yusoff K., Shafee N. The Oncolytic Activity of Newcastle Disease Virus in Clear Cell Renal Carcinoma Cells in Normoxic and Hypoxic Conditions: The Interplay Between von Hippel-Lindau and Interferon-p Signaling. J Interferon Cytokine Res. 2013 Jul; 33 (7): 346-54. doi: 10.1089/jir.2012.0095.
33. Abdullah J.M., Mustafa Z., IderisA. Newcastle Disease Virus Interaction in Targeted Therapy against Proliferation and Invasion Pathways of Glioblastoma Multiforme. Biomed Res Int. 2014; 2014: 386470. doi: 10.1155/2014/386470.
34. Schirrmacher V., Fournier P. Harnessing oncolytic virus-mediated antitumor immunity. Front Oncol. 2014 Nov 24; 4: 337. doi: 10.3389/fonc.2014.00337.
35. Schirrmacher V. Oncolytic Newcastle disease virus as a prospective anti-cancer therapy. A biologic agent with potential to break therapy resistance. Expert Opin Biol Ther. 2015; 15 (12): 1757-71. doi: 10.1517/14712598.2015.1088000.
36. Guo Z.S., Liu Z., Bartlett D.L. Oncolytic immunotherapy: Dying the right way is a key to eliciting potent antitumor immunity. Front Oncol. 2014 Apr 10; 4: 74. doi: 10.3389/fonc.2014.00074.
37. Schirrmacher V., Haas C., Bonifer R., Ertel C. Virus potentiation of tumor vaccine T-cell stimulatory capacity requires cell surface binding but not infection. Clin Cancer Res. 1997 Jul; 3 (7): 1135-1148.
38. Schirrmacher V., Haas C., Bonifer R., Ahlert T., Gerhards R., Ertel C. Human tumor cell modification by virus infection: an efficient and safe way to produce cancer vaccine with pleiotropic immune stimulatory properties when using Newcastle disease virus. Gene Ther. 1999 Jan; 6: 63-73. doi: 10.1038/sj.gt.3300787.
39. Washburn B., Schirrmacher V. Human tumor cell infection by Newcastle Disease Virus leads to upregulation of HLA and cell adhesion molecules and to induction of interferons, chemokines and finally apoptosis. Int. J. Oncol. 2002 Jul; 21: 85-93.
40. JarahianM., Watzl C., FournierP., A , DjandjiD., Zahedi S., Cerwenka A., Paschen A., Schirrmacher V., Momburg F. Activation of natural killer cells by newcastle disease virus hemagglutinin-neuraminidase. J Virol. 2009 Aug; 83: 8108-21. doi: 10.1128/JVI.00211-09.
41. Fujita M., Scheurer M.E., Decker S.A., McDonald HA., Kohan-bash G., Kastenhuber E.R., Kato H., Bondy M.L., Ohlfest J.R., Okada H. Role of type 1 IFNs in antiglioma immunosurveillance - Using mouse studies to guide examination of novel prognostic markers in humans. Clin Cancer Res. 2010 Jul 1; 16 (13): 3409-19. doi: 10.1158/1078-0432.CCR-10-0644.
42. Termeer C.C., Schirrmacher V, Brocker E.B., Becker J.C. Newcastle disease virus infection induces B7-1/B7-2-independent T-cell costimulatory activity in human melanoma cells. Cancer Gene Ther. 2000 Feb; 7: 316-323. doi: 10.1038/sj.cgt.7700109.
43. Koks C.A., Garg A.D., Ehrhardt M., Riva M., Vandenberk L., Boon L., de Vleeschouwer S., Agostinis P, Graf N., van Gool S.W. Newcastle disease virotherapy induces long-term survival and tumor-specific immune memory in ortheotopic glioma through the induction of immunogenic cell death. Int J Cancer. 2015 Mar 1; 136 (5): E313-25. doi: 10.1002/ijc.29202.
44. Schirrmacher V, Bai L., Umansky V, Yu L., Xing Y., Qian Z. Newcastle disease virus activates macrophages for anti-tumor activity. Int J Oncol. 2000 Feb; 16 (2): 363-373.
45. Zamarin D., Holmgaard R.B., Subudhi S.K., Park J.S., Man-sour M., Palese P, Merghoub T, Wolchok J.D., Allison J.P. Localized oncolytic virotherapy overcomes systemic tumor resistance to immune checkpoint blockade immunotherapy. Sci Transl Med. 2014 Mar 5; 6 (226): 226ra32. doi: 10.1126/scitranslmed.3008095.
46. Steiner H.H., Bonsanto MM., Beckhove P, Brysch M., Gelet-neky K., Ahmadi R., Schuele-Freyer R., Kremer P, Ranaie G., Matejic D., Bauer H., Kiessling M., Kunze S., Schirrmacher V, Herold-Mende C. Antitumor vaccination of patients with glioblastoma multiforme: a pilot study to assess feasibility, safety, and clinical benefit. J Clin Oncol. 2004; 22: 4272-4281. doi: 10.1200/JCO.2004.09.038.
47. Herold-Mende C., Karcher J., Dyckhoff G., Schirrmacher V. Antitumor immunization of head and neck squamous cell carcinoma patients with a virus-modified autologous tumor cell vaccine. Adv Otorhinolaryn-gol. 2005; 62: 173-183. doi: 10.1159/000082507.
48. Cassel W.A., Murray D.R. A ten-year follow-up on stage II malignant melanoma patients treated postsurgically with Newcastle disease virus oncolysate. Med Oncol Tumor Pharmacother. 1992; 9: 169-171.
49. Niu Z., Bai F., Sun T., Tian H., Yu D., Yin J., Li S., Li T., Cao H., Yu Q., Wu Y., Ren G., Li D. Recombinant Newcastle disease virus expressing IL15 demonstrates promising antitumor efficiency in melanoma model. Technol Cancer Res Treat. 2015 Oct; 14 (5): 607-15. doi: 10.7785/tcrt.2012.500414.
50. Pecora A.L., Rizvi N., Cohen G.I., Meropol N.J., Sterman D., Marshall J.L., Goldberg S., Gross P., O’Neil J.D., Groene W.S., Roberts M.S., Rabin H., Bamat M.K., Lorence RM. Phase I trial of intravenous administration of PV701, an oncolytic virus, in patients with advanced solid cancers. J Clin Oncol. 2002; 20: 2251-2266. doi: 10.1200/JCO.2002.08.042.
51. Wu Y., He J., An Y., Wang X., Liu Y, Yan S., Ye X., Qi J., Zhu S., Yu Q., Yin J., Li D., Wang W. Recombinant Newcastle disease virus (NDV/ ANH-IL-2) expressing human IL-2 as a potential candidate suppresses growth of hepatoma therapy. J Pharmacol Sci. 2016 Sep; 132 (1): 24-30. doi: 10.1016/j.jphs.2016.03.012.
52. Wu Y., He J., Geng J., An Y., YeX., Yan S., Yu Q., Yin J., Zhang Z., Li D. Recombinant Newcastle disease virus expressing human TRAIL as a potential candidate for hepatoma therapy. Eur J Pharmacol. 2017 May 5; 802: 85-92. doi: 10.1016/j.ejphar.2017.02.042.
53. Fournier P, Arnold A., Wilden H., Schirrmacher V. Newcastle disease virus induces pro-inflammatory conditions and type I interferon for counter-acting Treg activity. Int J Oncol. 2012 Mar; 40 (3): 840-50. doi: 10.3892/ijo.2011.1265.
54. Roy D.G., Bell J.C. Cell carriers for oncolytic viruses: current challenges and future directions. Oncolytic Virother. 2013 Oct 9; 2: 47-56. doi: 10.2147/OV.S36623.
55. Ricca JM., Oseledchyk A., Walther T., Liu C., MangarinL., Merghoub T., Wolchok J.D., Zamarin D. Pre-existing Immunity to Oncolytic Virus Potentiates Its Immunotherapeutic Efficacy. Mol Ther. 2018 Apr 4; 26(4): 10081019. doi: 10.1016/j.ymthe.2018.01.019.
56. Kim Y., Clements D.R., Sterea AM., Jang H. W., Gujar ShA., LeeP. WK. Dendritic Cells in Oncolytic Virus-Based Anti-Cancer Therapy. Viruses. 2015 Dec 9; 7 (12): 6506-25. doi: 10.3390/v7122953.
57. Jennings V, Ilett E., Scott K., West E.J., Vile R., Pandha H., Harrington K., Young A., Hall G.D., Coffey M., Selby P., Errington-Mais F, Melcher A.A. Lymphokine-activated killer and dendritic cell carriage enhances oncolytic reovirus therapy for ovarian cancer by overcoming antibody neutralization in ascites. Int J Cancer. 2014; 134 (5): 1091-101. doi:10.1002/ijc.28450.
58. Iankov I.D., Msaouel P., Allen C., Federspiel MJ., Bulur P.A., Dietz A.B., Gastineau D., Ikeda Y., Ingle J.N., Russell S.J., Galanis E. Demonstration of anti-tumor activity of oncolytic measles virus strains in a malignant pleural effusion breast cancer model. Breast Cancer Res Treat. 2010 Aug; 122 (3): 745-54. doi: 10.1007/s10549-009-0602-z.
59. Ilett E.J., Prestwich R.J., Kottke T., Errington F., Thompson JM., HarringtonK.J.,PandhaH.S., CoffeyM., SelbyPJ., VileRG.,MelcherAA. Dendritic cells and T cells deliver oncolytic reovirus for tumour killing despite pre-existing anti-viral immunity. Gene Ther. 2009 May; 16 (5): 689-99. doi: 10.1038/gt.2009.29.
60. БалдуеваИА., НовикА.В., МоисеенкоВ.М., Нехаева Т.Л., Данилова А.Б., ДаниловА.О., Проценко С.А., Петрова Т.Ю., УлейскаяГ.И., Щёкина Л.А., Семёнова А.И., Михайличенко Т.Д., Телетаева ГМ., ЖабинаА.С., Волков Н.В., Комаров Ю.И. Клиническое исследование (II фаза) вакцины на основе аутологичных дендритных клеток с иммунологическим адъювантом у больных с меланомой кожи. Вопросы онкологии. 2012; 58 (2): 212-221.
61. Леплина О.Ю., Насонова Г.В., ТихоноваМ.А., Крючкова И.В., Лисуков И.А., Останин А.А., Черных Е.Р. IFNa-индуцированные дендритные клетки у больных множественной миеломой. Сибирский онкологический журнал. 2009; 6: 37-43.
62. Семилетова Ю.В., Анисимов В.В., Вагнер Р.И. Лечение больных первичной меланомой кожи. Современное состояние проблемы. Сибирский онкологический журнал. 2010; 4: 71-77.
63. Нехаева Т.Л. Оптимизация аутологичных дендритно-клеточных вакцин для лечения больных злокачественными новообразованиями. Сибирский онкологический журнал. 2013; 3: 52-56.
64. IlettE.J., PrestwichR.J., Kottke T., ErringtonF, Thompson J.M., HarringtonK.J., PandhaH.S., Coffey M, SelbyP.J., VileR.G.,Melcher A.A. Long-term remission of prostate cancer with extensive bone metastases upon immuno- and virotherapy: A case report. Gene Ther. 2009 May; 16 (5): 689-99. doi: 10.1038/gt.2009.29.
65. Ahlert T., Sauerbrei W., Bastert G., RuhlandS., BartikB., Simian-tonaki N., Schumacher J., Hacker B., Schumacher M., Schirrmacher VJ. Tumor-cell number and viability as quality and efficacy parameters of autologous virus-modified cancer vaccine in patients with breast or ovarian cancer. Clin. Oncol. 1997; 15: 1354-1366.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


