Вирус инфекционной анемии цыплят
Историческая справка, распространение, степень опасности и ущерб. Впервые возбудитель был выделен в 1979 г. в Японии, а затем в 1983 г. в Европе в птицеводческих хозяйствах при выращивании бройлеров. Эпизоотологическая и экономическая опасность болезни заключается в том, что она регистрируется во всех бройлерных птицехозяйствах, сопровождается повышенной смертностью (5. 10 %, а в отдельных хозяйствах до 60 %).
Возбудитель болезни. Возбудитель инфекционной анемии цыплят представляет собой мелкий (23. 25 нм) однонитчатый ДНК-содержащий вирус. По последним данным, его относят к семейству Circoviridae. Вирус хорошо культивируется в развивающихся куриных эмбрионах, СПФ-цыплятах и культуре клеток.
Вирус устойчив к ацетону, хлороформу, спирту и кислой среде (рН 3,0), погибает при 80 °С в течение 30 мин, 100 °С — за 10 мин. Дезинфицирующие препараты в общепринятой концентрации быстро инакти-вируют его.
Эпизоотология. К инфекции более всего чувствительна птица мясного направления, особенно бройлеры, что, вероятно, связано с интенсивным ростом. Болезнь чаще наблюдается у цыплят в возрасте 14. 21 день, причем цыплята младшего возраста, как правило, не болеют, так как у них развитие инфекции предупреждают материнские антитела.
Инфекция у бройлеров обычно носит субклинический характер. Тем не менее и клиническая, и субклиническая формы оказывают иммуносуп-рессивное влияние на организм (подавляют иммунитет), что может стать причиной больших потерь.
579При этом у цыплят в неблагополучных хозяйствах четко выражена чувствительность к заражению вирусом — после 3-недельного возраста они уже устойчивы. Птица, не имевшая контакта с вирусом, чувствительна к нему в любом возрасте. Вертикальный путь передачи отмечается, как правило, в тех хозяйствах, в которые завозят инкубационное яйцо из неблагополучных пунктов.
В естественных условиях инфекция распространяется контактным способом у цыплят раннего возраста либо посредством вакцинации их против болезни Марека в суточном возрасте. При этом вирус может быть как интегрирован в геном цыпленка, так и находиться непосредственно в вакцине. Последний путь распространения инфекции представляет для промышленного птицеводства наибольшую опасность, если для производства вакцин используют куриные эмбрионы, полученные из коммерческих хозяйств.
Патогенез. Патогенез заболевания связан с инфицированием интра- и экстрасинусоидальных гемоцитобластов и ретикулярных клеток в костном мозге и корковом слое тимуса. После заражения быстро развивается анемический синдром; цыплята отстают в росте, возникают апластическая анемия и атрофия лимфоидных органов. Красный костный мозг замещается жировой тканью, атрофируются зобная железа, фабрициева сумка.
Патологоанатомические признаки. При патологоанатомическом вскрытии павшей или больной птицы макроскопически отмечают атрофию тимуса и бурсы, увеличение и обесцвечивание печени, застойные явления в сосудах крыльев.
Кожа, особенно на крыльях, вследствие геморрагии синеет (отсюда одно из названий болезни), теряет эластичность, через нее на поверхность выделяется экссудат. Такая кожа легко повреждается и становится своеобразными воротами для вторичной микробной инфекции, приводящей к гангренозному дерматиту.
Иногда в особо тяжелых случаях на вскрытии находят гидроперикар-дит, асцит. Транссудат выходит в сердечную сумку (до 5 мл), и это основной признак у погибшего молодняка. В полости сердечной сорочки можно обнаружить фибринозные наложения. Наиболее тяжелая форма сопровождается подкожной отечностью. Сердце увеличено в объеме и расширено.
При гистологических исследованиях в печени находят экстенсивные некрозы с фибринозными наложениями, жировой дегенерацией и отложением капелек жира в клетках, лимфоидно-клеточную инфильтрацию перипортального поля, гиперплазию желчных ходов, пролиферацию и выраженный цирроз. В сердечной мышце обнаруживают кровоизлияния.
580Диагностика и дифференциальная диагностика. Диагностику заболевания проводят по данным эпизоотологического анализа, результатам определения антител к вирусу анемии цыплят в основном в непрямой РИФ, ИФА, а также путем выделения вируса на чувствительных к нему СПФ-эмбрионах и цыплятах.
Возможна диагностика болезни на основании исследования крови больных цыплят на 12. 16-й день после начала заболевания — при этом гематокрит снижен до 11. 20 % при норме 30. 40 %. Это простой, но специфичный способ лабораторной диагностики анемии цыплят, так как другие вирусные агенты не вызывают подобных изменений крови.
При дифференциальной диагностике на инфекционную анемию цыплят в первую очередь надо исключить инфекционную бурсальную болезнь, стафилококкоз, гиповитаминоз К, отравление мико-токсинами.
Профилактика. Профилактика инфекционной анемии цыплят основывается на строгом соблюдении технологии по выращиванию бройлеров изолированно от взрослого ПОГОЛОВЬЯ.
Бройлеров необходимо выращивать с соблюдением плотности посадки (не больше 14 голов на 1 м2 площади пола), при выращивании в клетках плотность посадки регулируется паспортными данными на клеточное оборудование. Необходимо обеспечить высокий уровень неспецифических антител у цыплят в первые недели выращивания; исключить из рациона корма, пораженные микотоксинами.
При проектировании хозяйств важно не допустить размещения на одной территории инкубатория цыплят раннего возраста и взрослой птицы, которая инфицирована вирусом анемии. Особо тщательно нужно дезинфицировать инкубационные яйца, на поверхности которых может находиться вирус. Применяют общепринятые меры по подготовке, очистке и дезинфекции помещений, в которых содержится птица.
Меры борьбы. Меры борьбы с заболеванием состоят из организационно-хозяйственных, ветеринарно-санитарных мероприятий и специфической профилактики болезни.
Контрольные вопросы и задания. 1. Дайте общее определение болезни, характеристику возбудителя. 2. Назовите способы заражения цыплят, особенности возрастной восприимчивости. 3. Каковы наиболее характерные патологоанатомические изменения, обнаруживаемые при вскрытии трупа? 4. Перечислите ограничительные мероприятия в неблагополучных хозяйствах. 5. Каковы специфическая иммунопрофилактика, сроки вакцинации?
[Infectious chicken anaemia]
Впервые это заболевание зарегистрировано и описано в Японии в 1979 г. Позднее оно также диагностировано в США, Швеции, Германии, Великобритании. От цыплят, вакцинированных ВГИ, выявлено заболевание, характеризующееся высокой смертностью, некротическими поражениями и сильно выраженной атрофией тимуса и бурсы, а также поражениями, сходными с таковыми при БМ. Из почек больных цыплят изолирован вирус анемии цыплят (АЦ), названный ЦАА82—2 и вирулентный ВБМ, названный ВБМ82—2. При заражении цыплят обоими агентами (двойная инфекция) отмечалась ранняя гибель цыплят, связанная с сильным некрозом и уменьшением количества лимфоцитов в лимфоидных органах и аплазией костного мозга.
Клинические признаки и патологоанатомические изменения. К заболеванию наиболее чувствительны к вирусу АЦ цыплята 1—8-дневного возраста. При возникновении заболевания вирусом может поражаться до 60 % птиц. Отход в среднем составляет 10%. При сочетании вируса анемии цыплят с реовирусами наблюдается более тяжелое течение болезни. Аналогичные явления наблюдаются при ассоциации инфекционной анемии цыплят с БМ и ИББ. В естественных условиях возбудитель передается вертикальным путем — через яйцо. Появление первых вспышек инфекционной анемии цыплят в Японии и Германии связывают с иммунизацией птицы против БМ вакциной, контаминированной вирусом анемии цыплят. Последний поражает цыплят и реже кур, заболевание сопровождается инфицированием гемопоэтических клеток <включая костный мозг), внутрикожными и внутримышечными геморрагиями, а также вовлечением в процесс лимфоидной ткани.
У заболевших цыплят отмечают сильную депрессию, отсутствие аппетита, замедление роста, истощение. Слизистые оболочки, кожа бледные, костный мозг развит недостаточно с изменением цвета до желтого и белого. Часто наблюдается гангренозный дерматит. Очаговые поражения кожи локализуются в области головы, крыльев, грудной клетки, брюшка, бедра и голени. Из трещин кожи вытекает кровянисто-серозный эксудат. По-видимому, причиной дерматитов является секундарная микрофлора. Болезнь может протекать со слабо выраженными признаками или бессимптомно, что зависит от состояния иммунитета. В естественных условиях заболевают обычно цыплята в возрасте 5 недель, если родители не имели соответствующих AT.
Патологоанатомические изменения проявляются септическим некротическим дерматитом, гепатитом, целлюлитом, миозитом, фибринозно-гнойным некротическим бурситом. У цыплят, которым в суточном возрасте инокулировали внутримышечно шт. BI-TK 5803 вируса анемии цыплят отмечали снижение гематокрита и подавление прироста массы тела особенно на 12—20 день. У большинства цыплят на пике инфекции макроскопически обнаруживают желтоватый костный мозг, атрофию тимуса и бурсы, увеличение и обесцвечивание печени. Гистологические поражения выявлялись у зараженных вирусом анемии цыплят, сначала в костном мозге и тимусе (на 6-й днень), затем в бурсе, селезенке и печени. На ранней стадии заболевания в гемопоэтических клетках наблюдали нарушение плазменных мембран, вакуолизацию, наличие внутриядерных включений, состоящих из тонких гранул гомогенного материала. В дегенеративных клетках обнаруживались конгломераты вирусподобных частиц. Незрелые клетки изредка находили на 12-й днень после заражения. Активный эритропоэз возобновлялся на 20-й день или позже. У выживших цыплят большинство тканей восстанавливались через 32 дня.
Характеристика возбудителя. Вирионы диаметром 18—25 нм. Геном вируса представлен циркулярной однонитчатой ДНК. Вирус состоит из 32 пустотелых морфологических единиц (капсомеров), представляющих правильный Т-3 икосаэдр. По данным венгерских исследователей, диаметр вирионов — менее 50 нм. Клонирован полный геном ВАЦ, который использован для гибридизации с ДНК полевых изолятов вируса. Разработан метод точечной гибридизации с использованием нерадиоактивно-меченных зондов. Все полевые изоляты обнаруживали высокую степень идентичности с клонированной прототипной ДНК.
Вирус устойчив к эфиру, хлороформу, рН 3, выдерживает прогревание при 56 °С в течение 60 мин. Вирус, выделенный в Венгрии Bia-штамм устойчив к хлороформу, проявил АГ родство с референс-штаммом CUX-1. Полевой изолят EF-88/78/276 оказался устойчив к воздействию хлороформа и нагреванию до 70 °С в течение 5 мин (16). Раствор йода и 1 %-ный гипохлорит натрия полностью инактивируют вирус в культуре клеток. Он устойчив к действию таких жирорастворителей как этиловый и метиловый спирты, ацетону, хлороформу.
Культивирование. Вирус репродуцируется в КЭ, но не вызывает у них патологических изменений и гибели. Вирус анемии цыплят (CAV-BIA) был выделен в культуре клеток MDC-MSB1 от однодневных цыплят-бройлеров различных птицеферм Венгрии.
Экспериментальная инфекция. Легко воспроизводится гомогенатом печени от погибших птиц. Она проявляется существенным отставанием птиц в росте, апластической анемией и общей атрофией лимфоидных органов. При экспериментальном заражении общие потери составляют 7—8 %, кроме того 25 % цыплят не набирают необходимой массы к 7 недельному возрасту. У СПФ-цыплят породы леггорн при внутримышечном заражении полевым материалом развивался анемический синдром и возбудитель выделялся в культуре клеток MDCC-MSB1 из костного мозга и лимфоидной ткани инфицированных цыплят. У цыплят, находившихся в контакте с зараженными суточного возраста, симптомов болезни не отмечали, однако у всех цыплят на 30-й день опыта в сыворотках крови обнаруживали AT к ВАЦ. Ни в одном случае смертельных случаев не отмечали, но на 14-й день опыта при вскрытии обнаруживали выраженную атрофию зобной железы и бурсы, желтизну костного мозга, а у некоторых птиц — подкожные и внутримышечные кровоизлияния. При введении ВАЦ однодневным цыплятам в течение 10 дней у них развивалась апластическая анемия, причем снижалось число как эритроцитов, так и лейкоциитов и тромбоцитов. В период с 12-го по 24-й день около 50 % цыплят погибало. С возрастом чувствительность их уменьшалась. Материнские AT защищают цыплят от инфекции.
По данным Otary et al., основные клинические признаки у 9 обследованных экспериментально зараженных изолятами ЦАА82—2 и БМ82—2 цыплят отмечалось угнетенное состояние и слабость или параличи ног. При вскрытии у всех птиц находили утолщение плечевого, сидалищного и блуждающего нервов, а также сильно выраженную атрофию тимуса и бурсы. Микроскопические исследования выявляли от незначительной до обширной лимфоидную инфильтрацию периферических нервов всех птиц.
Вирус удавалось выделить из разных органов инфицированных птиц. О наличии инфекции у зараженных суточных цыплят судят по пониженному числу эритроцитов, наличию апластического процесса клеток MDCC-MSB1 из индуцированной ВБМ лимфомы.
Эпизоотологические особенности. Заболевание чаше возникает у бройлеров в возрасте 14—21 дня. При ассоциации вируса АЦ и реовирусов наблюдают более тяжелое течение болезни. Аналогичное явление наблюдается при ассоциации ИАЦ с болезнями Гамборо и Марека. Заражение японскими и немецкими изолятами вируса суточных цыплят вызывало анемию, атрофию лимфоидных органов и костного мозга и в некоторых случаях гибель до 30 % Цыплят. В естественных условиях возбудитель передавался потомству вертикальным путем — через яйцо. Горизонтальное распространение вируса связано с субклинической инфекцией. Вертикальная передача встречалась в результате первичной инфекции несушек. Как клиническая, так и субклиническая формы инфекции наносят хозяйству большой экономический ущерб. Появление первых вспышек ИАЦ в Японии и Германии связывают с иммунизацией птицы против БМ вакциной, контаминированной вирусом АЦ. Японские исследователи отмечают, что проводить дезобработку среды в присутствии птицы крайне трудно.
Специфическая профилактика. Для профилактики инфекционной анемии цыплят некоторые исследователи рекомендуют создавать иммунитет у родительского поголовья с целью обеспечения передачи материнских AT потомству. Такая устойчивость цыплят может сохраняться до 3 недель. В Германии создана экспериментальная эмбриональная вакцина.
Изобретение относится к ветеринарной вирусологии и биотехнологии и может быть использовано при производстве вакцины против инфекционной анемии цыплят.
Вирус инфекционной анемии цыплят (ИАЦ), единственный представитель рода Gyrovirus семейства Circoviridae [1], который широко распространен во всем мире. В организме больной птицы возбудитель активно реплицируется в гемоцитобластах костного мозга и предшественниках Т-лимфоцитов и, как следствие, проявляется атрофия тимуса [2, 3]. Развитие инфекционного процесса характеризуется снижением количества лимфоцитов, особенно CD8 + Т-клеток, нарушением продукции цитокинов, иммуносупрессией и повышенной чувствительностью к различным инфекциям вирусной и бактериальной этиологии [4, 5, 6].
Клиническое проявление болезни установлено у молодняка (2-3 недель) птицы без материнских антител с признаками депрессии, анемией, задержкой роста и увеличением смертности [7]. У птицы более старшего возраста с формированием иммунной системы развивается возрастная устойчивость к вирусу ИАЦ, хотя они могут быть инфицированы и стать источником горизонтальной передачи вируса [8, 9]. Единственным и надежным способом зашиты цыплят от вируса ИАЦ является применение вакцины за месяц до начала яйцекладки.
Сведения о выделении и характеристике изолятов вируса ИАЦ в России фрагментарны. По этой причине отечественные средства диагностики и профилактики болезни до настоящего времени не разработаны.
В задачу создания настоящего изобретения входило получение нового штамма вируса ИАЦ, обладающего высокой биологической и антигенной активностью и безвредного для ремонтного молодняка птицы.
Технический результат от использования предлагаемого изобретения заключается в повышении биологической и специфической антигенной активности для производства ареактогенных средств специфической профилактики болезни.
Штамм "ИК-4" получен и поддерживается путем серийных последовательных пассажей исходного изолята вируса ИАЦ в клеточной культуре MDCC MSBI.
Штамм "ИК-4" относится к семейству Circoviridae, роду Gyrovirus, обладает морфологическими признаками, характерными для возбудителя ИАЦ: форма вириона икосаэдрическая, размер - 22-25 нм, относится к ДНК-содержащим вирусам, устойчив к воздействию температуры до +56°С в течение 30 мин, эфира и хлороформа. Капсид вирионов состоит из 32 капсомеров, оболочка отсутствует и имеет один главный структурный белок VP1. Штамм "ИК-4" активно репродуцируется в клеточной культуре МДСС - MSB1, вызывая ЦПД, стабилен в течение 20 последовательных пассажей. Штамм "ИК-4" депонирован в государственной коллекции вирусов НИИ вирусологии им. Д.И. Ивановского 26 апреля 2017 г., регистрационный номер 2844.
Для пояснения сущности предлагаемого изобретения приведены примеры его исполнения, которые не ограничивают объем изобретения.
Пример 1. Культивирование штамма "ИК-4" вируса ИАЦ в суспензионной линии клеток MDCC MSBI.
Пример 2. Определение инфекционной активности "ИК-4" вируса ИАЦ.
Предварительно готовили серию 10-кратных разведений штамма "ИК-4" вируса ИАЦ на питательной среде RPM1 - 1640 от 10 -1 до 10 -7 , которыми заражали культуру клеток МДСС - MSB1. Каждое разведение супернатанта в объеме 100 мкл вносили в 4 лунки 24-луночноого планшета, затем - 900 мкл клеточной культуры в питательной среде с плотностью 5×10 4 кл/см 3 и инкубировали в СО2 инкубаторе при 39,5°С. Контролем служили флаконы с незараженной культурой МДСС - MSB1. Пересевы вирусных суспензий проводили через каждые 48 ч из расчета 200 мкл зараженной культуры в 800 мкл свежей подогретой питательной среды. Процедуру повторяли не менее 8 раз до проявления ЦПД в конечных разведениях и изменения цвета среды (красный) в связи с прекращением роста клеток. За титр вируса принимали максимальное (предельное) его разведение, вызывающее цитопатогенное действие в 50% лунок и выражали в lg ТЦД50/см 3 . Расчет активности вируса проводят по методу Рида и Менча. Титр вируса составил 5,5-6,0 lg ТЦД50/см 3 .
Пример 3. Оценка стабильности биологической и антигенной активности штамма "ИК-4" на уровне разных пассажей.
Предварительно пробы вируса 5-; 10-; 15- и 20-го пассажа титровали в клеточной культуре МДСС MSB1 так, как описано в примере 2. Антигенную активность вируса на разных уровнях пассажей определяли на птице путем его введения внутримышечно по 0,2 см 3 каждой птице. Результаты опыта представлены в таблице 1.
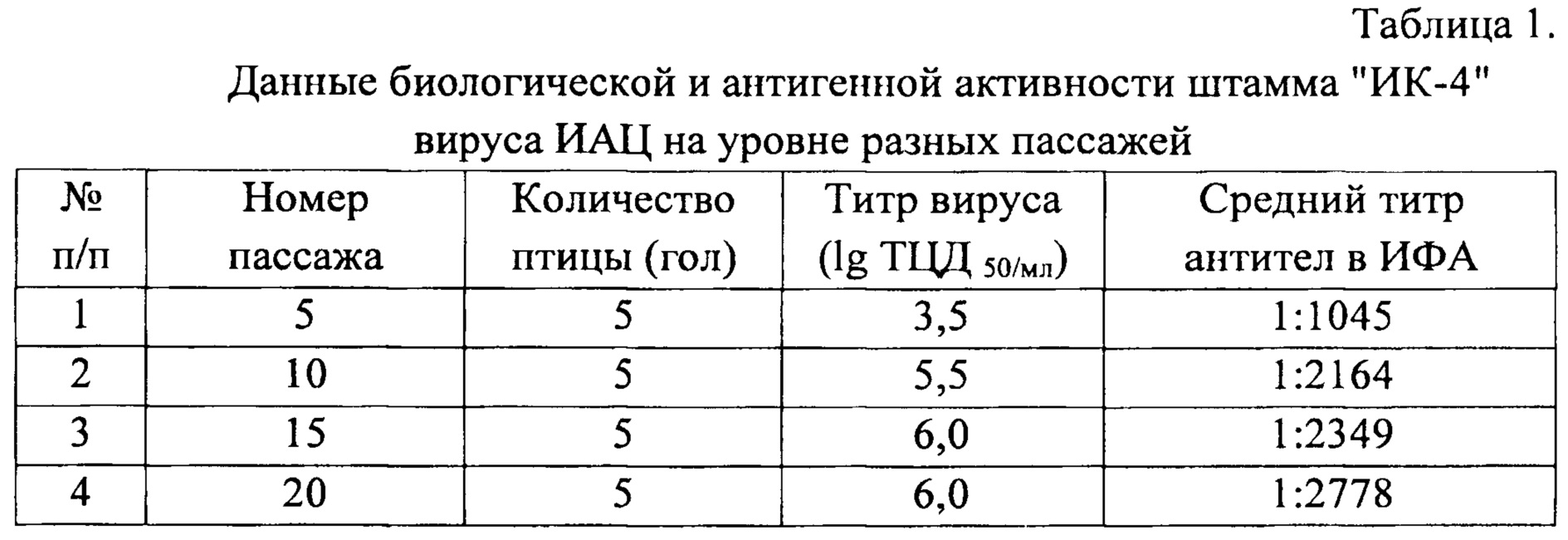
Из данных таблицы 1 следует, что штамм "ИК-4", выращенный в клеточной культуре МДСС MSB1 в течение 20 пассажей, сохраняет биологические и антигенные свойства, что свидетельствует о его стабильности по указанным признакам.
Пример 4. Определение безвредности штамма "ИК-4".
Вирус в дозе 5,0 lg ТЦД50/см 3 вводили внутримышечно ремонтному молодняку 8-9-недельного возраста в количестве 15 голов, свободному от антител к вирусу ИАЦ. Контролем служили 15 голов птицы аналогичного возраста, которым вводили физиологический раствор без вакцины. На 14, 21 и 28-е сутки опыта по 5 голов в каждой группе птицы подвергали диагностическому убою и соответственно отбирали трубчатую кость и тимус для выявления морфологических изменений. За период проведения опыта клинических признаков болезни у птицы не наблюдали. Патматериал фиксировали в 10% растворе нейтрального формалина и исследовали по общепринятой методике проведения гистологических исследований. Результаты патологоморфологических исследований костного мозга и тимуса цыплят в разные сроки после введения вируса показали сохранность морфологической структуры на всех этапах опыта. Таким образом, результаты испытаний показали, что штамм "ИК-4" вируса ИАЦ является безвредным в отношении ремонтного молодняка птицы.
1. Pringle С.R. Virus Taxonomy at the XIth International Congress of Virology, Sydney, Australia. Archives of Virology, 1999, 144, 2065-2070.
2. Gorio M., T. Suwa, T. Umemura, C. Utakura S. Yamashiro, 1989. Histopathology of chicks inoculated with chicken anaemia agent (MSB1-TK5803 strain). Avian Pathology, 18, 73-89.
3. Smyth J., D. Moffett, M. McNulty, D. Todd D. Mackie, Aequential histopathologic and immunocytochemical study of chicken anemia virus infection at one day of age. 1993. Avian Diseases, 37, 324-338.
4. Adair В.M. Immunopathogenesis of chicken anemia virus infection. Developmental and Comparative Immunology, 2000. 24, 247-255.
5. Todd D. Circoviruses: Immunosuppressive threat to avian species; a review. Avian Pathology, 2000. 29, 373-394.
6. Ragland W.L., R. Novak, J. El-Attrache, 
Ester, Chicken anemia virus and infectious bursal disease virus interfere with transcription of chicken IFN-alpha and IFN-gamma mRNA. 2002. Journalof Interferon and Cytokine Research, 22, 437-341.
7. Schat K.A. Chicken infectious anemia.In: Diseases of Poultry. 11th edn, eds Saif, Y.M., H.J. Barnes, J.R. Glisson, A.M. Fadly, L.R. McDougald & D.E. Swayne, Iowa State University, Ames, 2003, pp 182-202.
8. Rosenberger J.K. & S.S. Cloud, The effects of age, route of exposure, and coinfection with infectious bursal disease virus on the pathogenicity and transmissibility of chicken anemia agent (CAA). Avian Diseases, 1989, 33, 753-759.
9. Toro H., A.M. Ramirez, J. Larenas. Pathogenicity of chicken anaemia virus (isolate 10343) for young and older chickens. Avian Pathology, 1997. 26, 485-499.
10. Vielitz E., Bulow V. von, Landgraf H., Conrad C. Anemia in broilers: development of a vaccine for parent stock. - Journal of Veterinary Medicine, 1987, Vol. 34, P. 553-557.
11. Пат. США 5686077, 453-454.11.1997.
12. Пат. РФ №2489487, C12N 7/00; 10.08.2013.
Таймасуков А.А. ОАО "Компания Кубаньптицепром"
Аденовирусный гидроперикардит бройлеров - остропротекающее и высоко контагиозное вирусное заболевание преимущественно бройлеров 3-5-тинедельного возраста, характеризующееся накоплением в перикарде транссудата, гепатитом, асцитом и нефрозо-нефритом. Степень тяжести болезни в естественных условиях зависит от влияния некоторых иммунодепрессивных инфекций, таких как инфекционная бурсальная болезнь (болезнь Гамборо), болезнь Марека и инфекционная анемия цыплят.
В настоящее время, во многих хозяйствах аденовирусный гидроперикардит начинает проявляться у 24-28 - дневных, а иногда у более молодых бройлеров, в свою очередь, провоцируя болезнь Гамборо или ухудшая формирование поствакцинального иммунитета против данного заболевания, а также Ньюкаслской болезни, инфекционного бронхита кур и других болезней. Источником инфекции является больная и переболевшая птица. Вирус передается аэрогенно, алиментарно и трансовариально. Возбудитель распространяется с воздухом, водой, кормом, предметами ухода, контактно, "с помощью" обслуживающего персонала. Переносчиками возбудителя инфекции могут быть дикие и синантропные птицы, насекомые и иксодовые клещи, а также простейшие микроорганизмы, в том числе кокцидии. Птицы родительского стада могут быть инфицированы аденовирусом перед началом или в процессе яйцекладки, что обуславливает интенсивную трансовариальную передачу возбудителя.
Аденовирусы птиц, по данным профессора В.А.Бакулина, условно дифференцированы на 3 группы. В первую группу входят 12 серотипов аденовирусов кур и других птиц, которые имеют общий группоспецифический преципитирующий антиген, например возбудители "CELO - инфекции", бронхита перепелов, панкреатита цесарок гепатита с включениями - гидроперикардита кур. Ко второй группе относятся аденовирусы, обладающие гемаглютинирующим антигеном и имеющие общий с первой группой преципитирующий антиген, в том числе аденовирус "Синдрома снижения яйценоскости-76 (ССЯ-76)". В третью группу включены аденовирусы с группоспецифическим преципитирующим антигеном, отличающимся от таковых первых двух групп - аденовирусы геморрагического энтерита индеек и болезни "мраморной селезенки" фазанов. В промышленных птицеводческих хозяйствах аденовирусы распространены повсеместно. Любые из имеющихся 13 серотипов аденовирусов в различных сочетаниях могут циркулировать в одном хозяйстве, а также в организме одной внешне здоровой птицы [3].
Инкубационный период при заражении аденовирусом составляет 24-72 часа. Наиболее часто аденовирусный гидроперикардит бройлеров связан с застойными явлениями в сердце и с гидремией, приводящих к анемии. При экспериментальном заражении цыплята угнетены, взъерошены, "не держат крылья", возможна анемия, диарея с выделением фекалий с примесью уратов, отсутствие реакции на внешние раздражители. Максимальная смертность птиц на 2-4 день после заражения. Общая смертность цыплят-бройлеров может достигать до 75-85%. При хроническом или субклиническом течении клинические признаки незначительные или отсутствуют. Смертность составляет 1-7%.
При вскрытии трупов павших бройлеров обнаруживают желтоватое окрашивание подкожной клетчатки и внутреннего жира, очаговые кровоизлияния в мышцах, скопления в сердечной сорочке от 5 до 20 мл. серозного транссудата соломенно-желтого цвета водянистой или желеподобной консистенции. У экспериментально зараженных цыплят иногда наблюдается появление небольшого количества асцитной жидкости.
Сердце деформированное и дряблое, с точечными кровоизлияниями в миокарде, особенно на верхушке сердца и в ушках предсердий. Легкие уплотнены и отечны, в некоторых случаях с наличием серозной жидкости. Печень увеличена, с очагами некроза. Почки увеличены, с точечными кровоизлияниями, мозаичные, иногда с канальцами и мочеточниками заполненными уратами. Селезенка может быть увеличена, мраморная, отмечается атрофия фабрициевой бурсы.
Диагноз на аденовирусный гидроперикардит бройлеров ставят на основании эпизоотологических, клинических и патологоанатоми-ческих данных, результатов выделения вируса (из печени) на развивающихся эмбрионах кур, в культуре клеток печени, почек, фиброблас-тов эмбрионов кур, а также результатов заражения восприимчивых цыплят 10 дневного возраста [1]. Завершающим этапом в постановке диагноза является идентификация выделенного вируса в реакции нейтрализации, диффузиозной преципитации в агаровом геле (РДП), ПЦР. Ретроспективная диагностика проводится на основании выявления антител к возбудителю в РДП, РН и ИФА.
В настоящее время РНГА считается более предпочтительной, чем тест диффузной преципитации в агаровом геле, так как дает меньше неспецифических реакций.
Аденовирусный гидроперикардит бройлеров необходимо прежде всего дифференцировать от гидроперикардитов другой этиологии. Так, при пастереллезе, стафиллококкозе и стрептококкозе иногда возникает серозный перикардит. Решающим фактором при постановке диагноза служит выделение чистой культуры бактерий, вызывающих эти заболевания, путем посева материала из внутренних органов больных птиц на искусственные питательные среды. Аденовирусный гидроперикардит бройлеров от гидроперикардита, возникшего при острой форме болезни Марека, дифференцируют по наличию при болезни Марека в начальной стадии единичных, а позднее множественных опухолей в мышцах и во внутренних органах. Необходимо исключить инфекционную бурсальную болезнь (болезнь Гамборо), так как она часто сопутствует аденовирусной инфекции. При инфекционном бурсите поражения фабрициевой сумки постоянны и сопровождаются некрозом и псевдоэозинофильной инфильтрацией лимфоидных фолликулов. Для аденовирусной инфекции изменения фабрициевой сумки не характерны. Точечные кровоизлияния размером со спичечную головку по тонкому отделу кишечника, а особенно в двенадцатиперстной кишке необходимо дифференцировать от Ньюкаслской болезни [4].
Парвовирусную анемию цыплят и геморрагический синдром, обусловленные микотоксинами и применением сульфаниламидов также необходимо дифференцировать от аденовирусного гидроперикардита бройлеров. При парвовирусной анемии цыплят внутриядерные тельца-включения в гепатоцитах отсутствуют. При исключении геморрагического синдрома и апластической анемии принимают во внимание анамнестические сведения и результаты анализа кормов и гистологических исследований печени [2].
Для предотвращения возникновения эпизоотии по аденовирусному гидроперикардиту бройлеров необходимо использовать все доступные методы профилактики, в том числе и организационно-хозяйственного и социально-экономического характера. Они включают в себя раздельное кормление и содержание разновозрастных групп птиц, привлечение к работе не контактирующего с птицей в личных подсобных хозяйствах обслуживающего персонала и многие другие вопросы, направленные на охрану птицеводческих хозяйств от заноса инфекции. Защита птицеводческих предприятий должна осуществляться посредством использования програмных мер безопасности, с обязательным соблюдением принципа "все пусто - все занято".
Распространение инфекции может произойти при диагностических исследованиях птицы, поэтому участники проведения вакцинации и диагностических исследований, особенно при работе с вирусвакцинами, должны строго соблюдать все меры санитарной профилактики.
Аденовирус весьма устойчив к условиям внешней среды и может длительное время сохраняться в помете и подстилке. В качестве более эффективных дезинфектантов рекомендуются йодсодержащие препараты и гипохлорид натрия.
В регионах, неблагополучных по аденовирусному гидроперикардиту, применение только санитарных мер было малоэффективным и в связи с этим возникла необходимость разработки специфических мер профилактики.
В настоящее время в неблагополучных хозяйствах для специфической профилактики аденовирусного гидроперикардита цыплят используются инактивированные гидроокисьалюминиевые или эмульсионные вакцины. Цыплят-бройлеров вакцинируют однократно в 10-17 дневном возрасте, внутримышечно или подкожно. Ремонтный молодняк и кур яйценоских пород вакцинируют дважды: в 10-17 дней и затем при переводе, в удвоенной дозе, не позднее чем за 30 дней до начала яйцекладки. В некоторых хозяйствах, ремонтный молодняк предназначенный для формирования родительских стад, в раннем возрасте вакцинируют дважды с 2-недельным интервалом, а затем третий раз в удвоенной дозе при переводе. Иногда вакцину применяют в суточном возрасте, одновременно с вакциной против болезни Марека. Иммунитет, регистрируемый в РДП, наступает через 14-21 день.
Эффективного специфического лечения и профилактики лекарственными препаратами при аденовирусном гидроперикардите не разработано [1].
Конкретную схему специфической профилактики для каждого птицеводческого хозяйства необходимо выбирать индивидуально, в зависимости от его эпизоотической ситуации.
- Алиев А.С., Сираждинов Р.С., Джавадов Э.Д., Алиев Г.С. Гидроперикардит (ГИП) птиц || Сборник Трудов ученых Академии менеджмента и агробизнеса нечерноземной зоны Российской Федерации "Пути совершенствования переподготовки руководящих кадров и повышения эффективности аграрного производства". - Санкт-Петербург. - 1996. - С.146-151.
- Алиев А.С., Никитина Н.В. Диагностика и специфическая профилактика инфекционного гидроперикардита птиц || Мат. научно-производственной конференции, посвященной 190-летию высшего ветеринарного образования в России и 100-летию вет. науки. С-Петербург. - 1998. - Ч.1 - С. 14-15.
- Бакулин В.А. Патоморфология экспериментального проявления аденовирусного гепатита с тельцами-включениями || Передовой научно-производственный опыт в птицеводстве, рекомендуемый для внедрения. - Загорск. - 1991. - С.33-37.
- Бакулин В.А., Аксенова Е.Г., Горецкая Т.И. Ассоциированное течение инфекционных болезней респираторного комплекса, аденовирусной инфекции и болезни Гамборо || Мат. Всероссийской научно-производственной конф. "Ветеринарная биологическая наука сельскохозяйственному производству". - Н-Новгород. - 1997. - С.301-303.
В статье изложены распространения аденовирусной инфекции, клинические признаки и патологические изменения у цыплят-бройлеров. Предложены различные методы специфической профилактики аденовирусного гидроперикардита бройлеров.
Ключевые слова : аденовирусная инфекция птиц, аденовирусный гидроперикардит, дифференциальная диагностика болезни Гамборо и Марека, вакцинация бройлеров и ремонтного молодняка.
Сведения об авторe
Ответственный за переписку с редакцией: Таймасуков Адам Азмето-вич, кандидат ветеринарных наук, генеральный директор ОАО "Компания Кубаньптицепром", 350000 г. Краснодар, ул. Северная 324, литер А, тел. 8 918 442 77 84, электронный адрес: kubpticeprom@yandex.ru.
ADENOVIRAL HYDROPERICARDITIS OF BROILER CHICKENS
Article describes distribution of adenoviral infection, its clinical signs and pathological changes in broiler chickens. Various methods of specific prevention of adenoviral hydropericarditis of broilers are offered.
Key words: adenoviral infection of birds, adenoviral hydropericarditis, differential diagnostics of Gumboro and Marek diseases, vaccination of broilers and young growth.
- Aliev A.S., Sirazhdinov R.S., Dzhavadov Eh.D., Aliev G.S. Gidroperikardit ptits [Hydropericarditis of birds]. St. Petersburg (1996): pp.146 - 151. Print (in Russ.).
- Aliev A.S., Nikitina N.V. Diagnostika i spetsificheskaya profilaktika infektsionnogo gidroperikardita ptits [Diagnostics and specific prophylaxis of infectious hydropericarditis of birds]. St. Petersburg (1998): pp. 14 - 15. Print (in Russ.).
- Bakulin V.A. Patomorfologiya eksperimentalnogo proyavleniya adenovirusnogo gepatita s teltsami-vklyucheniyami [Pathomorphology of experimental display of adenoviral hepatitis with corpuscules-inclusions]. (1991): pp.33 - 37. Print (in Russ.).
- Bakulin V.A., Aksenova E.G., Goretskaja T.I. Assotsiirovannoe techenie infektsionnykh bolezney respiratornogo kompleksa, adenovirusnoy infektsii i bolezni Gamboro [Associated course of infectious diseases of respiratory complex, adenoviral infection and Gumboro disease]. N.Novgorod (1997): pp. 301 - 303. Print (in Russ.).
Responsible for correspondence with the editorial board:
Читайте также:


