Вирус иммунодефицита функционирует в клетках
14 октября 2013
- 19783
- 15,7
- 2
- 4
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
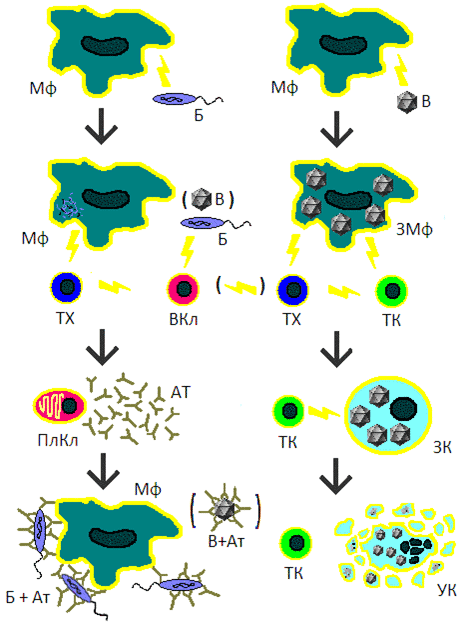
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
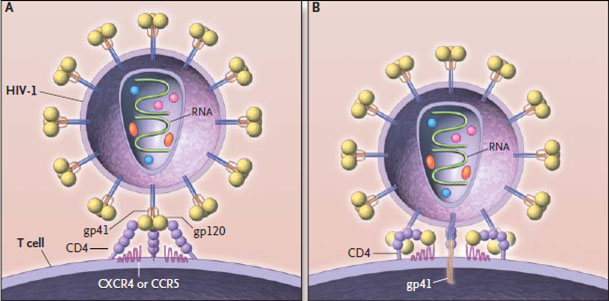
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
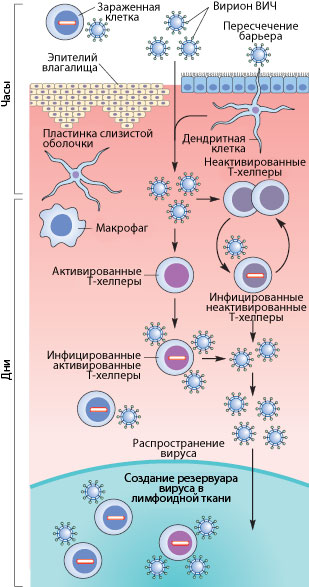
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
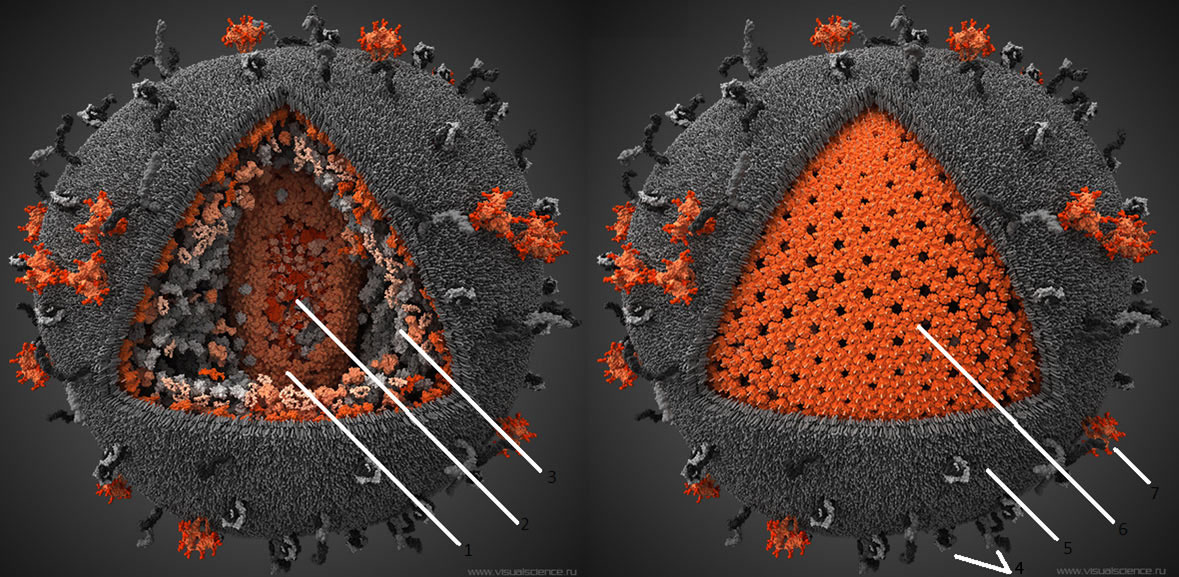
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Вирусолог Грег Тауэрс об открытии ВИЧ в Сан-Франциско, симптомах болезни и исследованиях антивирусной терапии
Вирусолог Грег Тауэрс об открытии ВИЧ в Сан-Франциско, симптомах болезни и исследованиях антивирусной терапии
Professor of Molecular Virology, University College London; Head of Research Group, UCL Division of Infection and Immunity
Вместе с Британским Советом в России мы подготовили проект "Британские ученые", посвященный истории британской науки. В этой лекции профессор молекулярной вирусологии Университетского колледжа Лондона Грег Тауэрс рассказывает о репликации ВИЧ и поисках противовирусной вакцины.
ВИЧ - это первый ретровирус человека. Ретровирус - это особый тип вируса. Про него было известно, что он существует у других видов, а ВИЧ - это первый пример такого вируса у людей. ВИЧ впервые был обнаружен в начале 1980-х годов, когда было зарегистрировано несколько случаев обращения геев в отделения неотложной помощи в больницах с новой болезнью, которая, по-видимому, была как-то связана с иммунодефицитом. Их иммунная система переставала работать, и было непонятно почему. Какое-то время ушло на то, чтобы понять, что дело было в новой вирусной инфекции, которая раньше у людей не наблюдалась. Впервые она была описана в начале 1980-х годов в Сан-Франциско, а затем ученые поняли, что она распространена гораздо шире. Люди, которые ее идентифицировали, работали в Институте Пастера: Франсуаза Барре-Синусси и Люк Монтанье работали в лаборатории над другими ретровирусами и обнаружили под электронным микроскопом ретровирус в клетках пациентов, страдающих от этой инфекции.
За эту работу они получили Нобелевскую премию, и большой вклад в нее также внесли исследователи из США, например Роберт Галло. Для диагностики этого вируса был разработан тест, мы научились диагностировать наличие этого вируса, и оказалось, что им было заражено большое количество людей, но лечения тогда еще не было. И оказалось, что вирус распространяется через сексуальный контакт, то есть это заболевание, передающееся половым путем, а также через препараты крови, и в то время люди, которым вводились препараты крови, например люди с гемофилией, могли быть заражены этим вирусом. Также можно заразиться, например, через контакт с кровью - таким образом, потребители инъекционных наркотиков оказываются в группе риска: среди них часто бывает, что несколько человек используют одну иглу, и если один из них был заражен, то заражены будут и все остальные, кто использовал ту же иглу. Так что в те дни все это очень пугало: появился совершенно новый вирус, люди умирали, и никто не знал, что делать. Но, к счастью, мы довольно много знали о ретровирусах, потому что проводили исследования ретровирусов у других видов, в частности у мышей, так что довольно быстро был разработан новый тип препаратов для лечения ВИЧ, и они применяются и сейчас.
К 2016 году уже можно лечить ВИЧ коктейлем из антивирусных препаратов, которые в теории должны предотвратить заражение новых клеток тела. А это значит, что вирус в большинстве случаев становится невозможно обнаружить, и мы думаем, что пациент может прожить достаточно долгую жизнь, если будет принимать антиретровирусные препараты. Так что если вы можете себе их позволить, то все в порядке, и на Западе все хорошо, но в бедных ресурсами регионах, таких как Тропическая Африка, где меньше денег и сложнее купить довольно дорогие антиретровирусные препараты, это проблематично. Но они доступны, и сейчас существуют широкие программы по распространению антиретровирусной терапии, чтобы каждый больной мог получить доступ к необходимым препаратам.
ВИЧ - это ретровирус человека, он расшифровывается как "вирус иммунодефицита человека". Есть несколько его видов, самый часто встречающийся называется ВИЧ-1. СПИД же - синдром приобретенного иммунодефицита - это болезнь, вызываемая ВИЧ. Насколько мы можем судить, почти все, кто заражен вирусом, в итоге заболевают СПИДом - очень редки случаи, когда люди так и не заболевают, и очень сложно сказать, заболеет ли зараженный человек: он может умереть раньше по какой-то другой причине. Однако большая часть зараженных страдает от этой болезни, но она развивается не раньше чем через 8-10 лет после заражения. Так что есть большой промежуток времени, когда зараженные не страдают от значительных симптомов, хотя некоторые симптомы все-таки есть.
Когда вы впервые подхватываете ВИЧ, вы получаете инфекционный синдром, очень похожий на другие вирусные инфекции, например грипп. Тогда вирус реплицируется в вашем теле до очень высоких титров, то есть очень большого количества вируса в теле, и вы чувствуете себя очень больным. У вас может появиться сыпь и температура, и вы, возможно, проведете несколько дней в постели и будете чувствовать себя так, как будто подхватили какую-то вирусную инфекцию. А затем все проходит, ваша иммунная система подавляет репликацию вируса и может даже подавить ее до очень низкого уровня, такого, что спустя несколько недель после заражения вирус в вашем теле обнаружить невозможно.
Что происходит затем - не вполне ясно, но точно известно, что ваша иммунная система постоянно сражается с вирусом. В течение этого периода времени вы не чувствуете особых симптомов, так что возникает ощущение, что вам стало лучше, вы выздоровели, но в случае с ВИЧ это не так. Он по-прежнему реплицируется в вашем теле, а это значит, что со временем по причинам, которые мы до конца не понимаем, ваша иммунная система оказывается истощенной и перестает работать. В этот момент вирус берет верх и уничтожает вашу иммунную систему, и вся эта долгая битва между вирусом и иммунной системой заканчивается полным поражением последней. Из-за этого вы заболеваете, и болезни, вызванные ВИЧ, - это в основном оппортунистические инфекции.
Так что все это - болезни, от которых вы обычно не страдаете, например грибковые инфекции. Мы постоянно подвергаемся атакам грибов, которые пытаются нас разрушить, но у них ничего не выходит, потому что наша иммунная система нас защищает. Но без нее эти грибковые инфекции начинают вызывать очень тяжелые заболевания рта, легких и дыхательных путей. И к моменту обнаружения СПИДа все эти болезни у людей ранее не наблюдались, потому что наша иммунная система с ними очень хорошо справляется, так что лечить их было очень сложно. Теперь для этих болезней разработаны разные способы лечения. Но до тех пор должен пройти долгий промежуток времени, около 8-10 лет, в течение которого ваше тело борется с вирусом и держит его под контролем.
Сейчас считается, что если вы заражены ВИЧ, то вам нужно начать медикаментозное лечение как можно скорее, хотя раньше, если мы видели, что вы не страдаете от каких-то симптомов, мы думали, что нет нужды принимать препараты, пока симптомы не проявятся. Сейчас мы можем измерять количество клеток CD4, являющихся целью вируса, и мы можем мониторить, как себя чувствует ваша иммунная система. Раньше мы начинали лечить людей, только когда они достигали определенной точки, после которой их иммунная система выходила из строя. Сейчас мы считаем, что чем раньше начать лечение, тем лучше, так как оно помогает защитить вашу иммунную систему от урона, который она возьмет на себя, даже пока вы сами не страдаете от каких-либо серьезных симптомов. Так что цель современной терапии состоит в том, чтобы помешать вирусу размножиться. Но это, к сожалению, не приводит к излечению, и мы не вполне понимаем почему. Так что если вы принимаете антиретровирусные препараты, то вы можете подавить репликацию вируса до такого состояния, что он будет незаметен: его будет невозможно обнаружить в вашем теле. Но все же, если вы прекратите принимать препарат, за короткий промежуток времени - около нескольких месяцев - вирус вернется. Так что мы знаем, что препараты не позволяют полностью избавиться от вируса и иммунная система тоже не может избавиться от вируса, но мы не понимаем почему.
Я думаю, есть два объяснения, и в настоящее время проводится много исследований в попытках выяснить, какое из них верно (а может быть, верны оба). Объяснение первое - что вирус по-прежнему находится в вашем теле где-то в органах (возможно, в лимфоидной ткани пищеварительной системы) и тихо там себе размножается. Объяснение второе - что он действительно перестает реплицироваться, а препараты позволяют избавиться от всех клеток, которые производят вирус. В этом случае в теле остаются только те клетки, которые содержат вирус, но активно его не производят, так что, пока они не начнут производить вирус, избавиться от них не получится. Поэтому если вы перестанете принимать препараты, то рано или поздно эти клетки начнут производить вирус, и все начнется заново. Так что мы не до конца понимаем, нужно ли нам улучшать препараты, чтобы уничтожить вирус, включая его остатки в организме, или нам нужна стратегия для пробуждения клеток, которые содержат вирус, но не производят его, чтобы уничтожить и их тоже. И это задает повестку исследований, цель которых - найти лучший способ до конца вылечивать людей.
Есть две большие области исследований ВИЧ. В США, как мне кажется, сейчас пытаются сосредоточить все исследования на поиске лечения. Есть ощущение, что нам надо не валять дурака, а просто сосредоточиться на лечении больных, и это единственный способ искоренить болезнь. Конечно же, есть попытки также и изобрести вакцину, но мы не понимаем, как ее сделать, и мы недостаточно много знаем о вакцинах, чтобы понять, почему у нас не получается сделать вакцину от ВИЧ. Мы пробовали классические способы получения вакцины, и все они с ВИЧ просто не работают. Есть множество возможных причин, почему это так, но до конца мы их не понимаем. И я не думаю, что кто-то верит, что в ближайшее время вакцина появится, так что, мне кажется, произошел сдвиг в сторону идеи, что нужно искать новые способы лечения, возможно, с новыми стратегиями терапии. Это одна область исследований.
Вторая глобальная область исследований ВИЧ - использование ВИЧ как инструмента. ВИЧ очень маленький вирус, он состоит из девяти генов - это девять белков. Часть из этих белков довольно сложны и могут быть разбиты еще на несколько, но все-таки это простой вирус. Для сравнения: вирус герпеса состоит из более чем двухсот генов, тогда как у ВИЧ их всего девять. И из-за этого ВИЧ становится очень легко управляемым генетическим инструментом.
Мы можем использовать этот вирус, чтобы изучать клеточную биологию, и это оказался очень мощный инструмент для понимания, что происходит в клетках нашего тела, как они работают, как они делятся, как движется вещество, как они организованы, и ВИЧ - потрясающий инструмент в этой области. Например, мы многое узнали об экспорте РНК из клеточного ядра, как регулируется экспорт РНК из ядра, как регулируется сплайсинг. ВИЧ должен управлять этими процессами, и, изучая, как он это делает, мы узнали об этом очень многое. Мы многое поняли о контроле за транскрипцией: ВИЧ обладает своим активатором транскрипции, но он работает не так, как другие активаторы, и изучение этого процесса позволило нам понять многое о том, как транскрипция работает в целом. Так что это потрясающий инструмент для решения разных научных вопросов, и в моей лаборатории мы используем ВИЧ именно как инструмент для исследования иммунной системы.
Нас часто спрашивают: действительно ли изучение ВИЧ и того, как он работает, помогает лечить его или другие болезни? И я думаю, что ответ - да. Очень важно понимать: когда в начале 1980-х годов ВИЧ только появился, единственное, как мы могли разработать лечение, - это основываясь на понимании биологии ретровирусов, которое мы получили, изучая ретровирусы мышей. Все лечение ВИЧ основано на твердом понимании того, как он работает. И если мы расширим наше понимание, мне кажется, оно поможет нам разработать и новые препараты. Вопрос в том, нужны ли нам новые препараты: те, которые мы используем сейчас, уже достаточно эффективны. Устойчивость к препаратам - вот это проблема. Если вы лечите кого-то одним препаратом, вирус может мутировать, измениться и перестать быть чувствительным к нему. Но если вы используете несколько препаратов, то эта проблема уменьшается, так что люди обычно принимают по три препарата. Но все же устойчивость к препаратам растет, становится более распространенной, и вполне возможно, что все закончится так же, как в ситуации с устойчивостью к антибиотикам, что наши препараты станут менее эффективны в борьбе с ВИЧ. И в таком случае знание, как работает ВИЧ и как создать новый препарат, будет очень полезным. Также возможно, что, действительно хорошо поняв, как работает ВИЧ, мы сможем найти уязвимые места у всех вирусов, так что некоторые считают, что мы сможем разработать антивирусные препараты более широкого спектра действия.
Изучение вирусных инфекций в целом очень важно, так как есть вероятность, что если мы больше узнаем о том, как вирусы реплицируются, как клетки обычно защищают себя от инфекции и как вирусы преодолевают эти защитные стратегии, то мы сможем понять, какими приемами должны пользоваться разные вирусы, чтобы заразить клетки человека. И если мы начнем разрабатывать препараты, влияющие на эти процессы, есть очень высокие шансы, что мы сможем разработать антивирусные препараты широкого спектра действия. Например, можно будет разработать один препарат, который будет противодействовать большому количеству вирусов. Думаю, это только сейчас становится реалистичной перспективой, и все мы из-за этого полны энтузиазма.
Онлайновые вопросы и ответы
Ноябрь 2017 г.
Вирус иммунодефицита человека (ВИЧ) инфицирует клетки иммунной системы, разрушая или нарушая ее функции. Инфицирование вирусом приводит к прогрессирующей деградации иммунной системы и, в результате, к "иммунодефициту". Иммунная система считается дефектной тогда, когда она больше не может выполнять свою роль в борьбе с инфекциями и болезнями. Инфекции, связанные с тяжелым иммунодефицитом, известны как "оппортунистические инфекции", так как они "пользуются возможностями" ослабленной иммунной системы.
Синдром приобретенного иммунодефицита (СПИД) — это термин, применяемый к самым последним стадиям ВИЧ-инфекции. Для него характерно появление каких-либо из более чем 20 оппортунистических инфекций или связанных с ВИЧ видов рака.
ВИЧ может передаваться при незащищенном сексуальном контакте (вагинальном или анальном) и оральном сексе с инфицированным человеком; при переливании зараженной крови; и при совместном использовании зараженных игл, шприцев или других острых инструментов. Он может также передаваться от матери ребенку во время беременности, родов и грудного вскармливания.
По оценкам ВОЗ и ЮНЭЙДС, в конце 2016 года в мире насчитывалось 36,7 миллионов человек с ВИЧ. В этом же году около 1,8 миллиона человек приобрели инфекцию, а 1 миллион человек умерли от причин, связанных с ВИЧ.
В 2016 году почти 400 000 людей с ВИЧ умерли от туберкулеза. Это основная причина смерти среди ВИЧ-инфицированных людей в Африке и одна из основных причин смерти среди этой группы населения во всем мире. Существует целый ряд основных стратегий в области здравоохранения, имеющих решающее значение для профилактики и ведения инфекции туберкулеза у людей, живущих с ВИЧ:
- рутинное обследование на симптомы туберкулеза при каждом посещении врача;
- ведение скрытой туберкулезной инфекции (например, профилактическое лечение изониазидом);
- борьба с туберкулезной инфекцией;
- раннее начало антиретровирусной терапии.
- при каждом сексуальном контакте правильно использовать мужские или женские презервативы;
- принимать антиретровирусные препараты для доконтактной профилактики ВИЧ (ДКП)
- заниматься только непроникающим сексом;
- сохранять верность в отношениях с неинфицированным и равным образом верным партнером и избегать каких-либо других форм рискованного поведения.
Мужское обрезание способствует снижению риска приобретения ВИЧ во время сексуальных контактов между мужчиной и женщиной примерно на 60%.
Одноразовая процедура медицинского мужского обрезания обеспечивает пожизненную частичную защиту от ВИЧ, а также от других инфекций, передаваемых половым путем. Мужское обрезание следует всегда рассматривать в качестве составной части общего пакета мер профилактики ВИЧ, которая ни в коей мере не заменяет другие известные способы профилактики, такие как мужские и женские презервативы.
При правильном использовании во время каждого сексуального контакта презервативы являются надежным способом профилактики ВИЧ-инфекции у женщин и мужчин. Тем не менее, ни один способ защиты, кроме воздержания, не эффективен на 100%.
Женский презерватив является единственным контролируемым женщиной контрацептивным барьерным методом, доступным в настоящее время на рынке. Женский презерватив представляет собой прочный, мягкий, прозрачный колпачок из полиуретана, вставляемый во влагалище перед сексуальным контактом. При его правильном использовании при каждом сексуальном контакте он полностью облегает влагалище и обеспечивает защиту как от беременности, так и от инфекций, передаваемых половым путем, включая ВИЧ.
Знание своего ВИЧ-статуса дает два важных преимущества:
- Узнав о том, что вы ВИЧ-позитивны, вы можете принять необходимые меры для того, чтобы получить доступ к лечению, уходу и поддержке до того, как появятся симптомы, и, тем самым, потенциально продлить свою жизнь и предотвратить развитие осложнений на протяжении многих лет.
- Узнав о том, что вы инфицированы, вы можете принять меры предосторожности, чтобы не допустить передачи ВИЧ другим людям.
Антиретровирусные препараты используются при лечении и профилактике ВИЧ-инфекции. Они борются с ВИЧ, останавливая или сдерживая репродукцию вируса и уменьшая его количество в организме.
По состоянию на середину 2017 г. 20,9 миллиона человек проходили антиретровирусную терапию (АРТ) во всем мире. Несмотря на то, что эта цифра свидетельствует о внушительных успехах, достигнутых за последнее десятилетие в области расширения охвата лечением против ВИЧ, она представляет собой лишь 53% пациентов, которым требуется АРТ. Таким образом, более половины человек, нуждающихся в доступе к лечению, по-прежнему не имеют его.
Нет, лекарства от ВИЧ не существует. Но при надлежащем и непрерывном соблюдении предписаний в отношении антиретровирусной терапии прогрессирование ВИЧ в организме можно замедлить почти до полной остановки. Все больше и больше людей с ВИЧ, даже в странах с низким уровнем дохода, могут сохранять хорошее самочувствие и продуктивность на протяжении длительного времени. ВОЗ рекомендует лечение для всех людей, инфицированных ВИЧ, а также для тех, кто подвергается значительному риску.
Помимо антиретровирусной терапии людям с ВИЧ часто необходимо консультирование и психологическая поддержка. Доступ ВИЧ-инфицированных людей к надлежащему питанию, безопасной воде и основным гигиеническим средствам может также способствовать поддержанию высокого качества жизни.

Ретровирусы отличаются рядом особенностей жизненного цикла, которыми являются: наличие стадии обратной транскрипции (и, таким образом, чередование форм вирусного генома РНК – ДНК – РНК) и стадии интеграции вирусного ДНК-генома в геном зараженной клетки. Проникновение ретровируса в клетку начинается с взаимодействия белка оболочки с клеточным рецептором. После взаимодействия вируса с клеточным рецептором происходит проникновение нуклеокапсида в цитоплазму (путем слияния мембран вируса и клетки). В цитоплазме происходит обратная транскрипция, продуктом которой является двухцепочечная ДНК-копия РНК-генома вируса (провирус). Провирус интегрируется в геном зараженной клетки, этот процесс обеспечивается вирусной интегразой и рядом клеточных белков [6].
После интеграции провирус ведет себя как обычный клеточный ген – транскрибируется клеточной РНК-полимеразой II с участием клеточных факторов транскрипции, однако уровень его транскрипции зависит от вирусных регуляторных последовательностей, локализованных в длинных концевых повторах (LTR) провируса. После синтеза вирусных белков происходит сборка вириона и отпочковывание его от цитоплазматической мембраны клетки, после чего инфекционный цикл повторяется [6].
Было показано, что в осуществление первичного связывания многих простых и сложных ретровирусов с клеткой вовлечены расположенные на внешней стороне клеточной мембраны гепарансульфаты и протеогликаны, находящиеся на поверхности вирусных частиц. Контакт ретровируса с первичными рецепторами необходим для последующего прочного взаимодействия с рецептором/корецептором, специфичным для разных ретровирусов. Таким образом, поиск эффективных ингибиторов, подавляющих взаимодействие ретровирусов с гепарансульфатами, расположенными на клеточной мембране, является актуальной задачей, решение которой может привести к созданию препарата широкого спектра действия, эффективного в отношении различных групп патогенных ретровирусов, а также ряда других патогенных вирусов, использующих гепарансульфаты в качестве первичных неспецифических рецепторов.
Гепарансульфаты – компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. По своей структуре гепарансульфаты, как и гепарин, относятся к группе гликозоаминогликанов, которые представляют собой длинные неразветвленные цепи гетерополисахаридов, построенные из повторяющихся дисахаридных единиц. Основные составляющие этих полимеров – гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая) и N-ацетилглюкозамин. Основное отличие гепарина от гепарансульфата состоит в меньшей степени сульфирования. Наличие сульфатных, а также карбоксильных групп определяет существенный отрицательный заряд этих биополимеров в нейтральных условиях. Известно, что сульфированные полисахариды проявляют высокую антивирусную активность, препятствуя проникновению в клетку ДНК- и РНК-содержащих вирусов (вирус простого герпеса, цитомегаловирус человека, вирус Синдбис, ВИЧ, вирус лейкоза мышей) [2; 3; 7; 8].
За последние 20 лет было показано, что сульфированные полисахариды обладают широким спектром противовирусной активности in vitro. Огромное структурное многообразие этих макромолекул, тем не менее, создает серьезные препятствия для установления взаимосвязи их структуры и активности. Однако, на основе накопленных данных, выявлено несколько структурных элементов, которые предположительно очень важны для противовирусной активности.
Степень сульфирования имеет большое влияние на противовирусную активность полисахаридов. Для отдельных классов полусинтетических полисахаридов (например, декстран сульфат) известно, что чем больше степень сульфирования, тем выше противовирусная активность [10]. Предполагается, что чем длиннее полисахаридная цепь, тем более вероятно узнавание и взаимодействие с несколькими вирусными белками, которые отвечают за взаимодействие вируса с клеткой-мишенью [5].
Для определения адекватности системы для исследования и тестирования потенциальных противовирусных препаратов, был использован описанный в литературе препарат – декстран сульфат [5].
В работе использовали клетки почки эмбриона человека линии HEK293, растущие на стандартной среде DMEM, содержащей 10% эмбриональной сыворотки крупного рогатого скота (СЭ КРС), 4мM L-глутамина, 1мM пирувата натрия, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл, соответственно, и клетки Т-лифобластного лейкоза человека линии Jurkat, которые культивировали на среде RPMI-1640, содержащей 20% СЭ КРС, 4мM L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина. Клетки растили при температуре 37 °С в атмосфере 5% СО2.
Получение псевдолентивирусных частиц
В качестве упаковывающих клеток, в которых осуществляется сборка рекомбинантных лентивирусных частиц и их секреция в культуральную среду, использовали клетки HEK293, которые за 12-14 часов до начала трансфекции высевали на чашки Петри диаметром 100 мм в количестве 3.0–3.5×106 клеток на чашку.
ДНК лентивирусного вектора, содержащего маркерный ген зеленого флуоресцирующего белка, вместе с плазмидами, направляющими синтез белков, необходимых для формирования псевдовирусных частиц, вводили в клетки HEK293 методом Ca-фосфатной трансфекции. Инфекционные псевдовирусные частицы начинали собирать через 24 часа после трансфекции с интервалами 10-12 часов [1].
Титрование вируса проводили на клетках Jurkat, за 14–16 часов до заражения высеянных в лунки 24-луночных планшетов (3×105 клеток на лунку). Измерение уровня флуоресценции клеток проводили на проточном цитофлуориметре Epics 4XL Beckman Coulter (США) через 48 часов после заражения. Титр вируса рассчитывали по формуле T = N×P/V, где N – количество высеянных клеток, P – доля инфицированных клеток в популяции, V – количество добавленного супернатанта, содержащего псевдо-ВИЧ-1 частицы, T – титр вируса. В работе использовали сборы с титрами вируса в пределах 5.4×106мл-1.
Определение цитотоксичности исследуемых соединений
Цитотоксичность препаратов для неинфицированных клеток Jurkat определяли по изменению морфологии и количеству жизнеспособных клеток методом окрашивания раствором трипанового синего (Invitrogen Corporation, США). Для этого в культуральную среду вносили препарат полисахарида до концентрации 10 и 100 мкг/мл. Через 48 ч клетки ресуспендировали в среде и окрашивали 0,4%-ным раствором трипанового синего в течение 5 мин. Затем подсчитывали число жизнеспособных (неокрашенных) и нежизнеспособных (окрашенных) клеток в камере Ньюбауэра. Количество живых клеток в популяции оценивали по количеству неокрашенных клеток в процентах от общего числа клеток.
Определение противовирусной активности исследуемых соединений
Активность препаратов против псевдолентивирусных частиц определяли на клетках линии Jurkat, к которым добавляли различные количества испытуемых препаратов в объеме 20 мкл на лунку перед добавлением препарата псевдолентивирусных частиц. Измерения количества флуоресцирующих клеток проводились через 48 ч после заражения на проточном цитофлуориметре. Полученные данные обрабатывали по методу Фишера-Стьюдента. Различия считали достоверными при p 100
Сульфат хитозана, МW 100 кДа, СЗ 1.5
Сульфосукцинилхитозан, МW 16.9 кДа, СЗ 0.64
Читайте также:


