Вирус герпеса это аутоиммунное заболевание
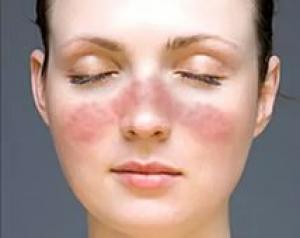
Пожалуй, аутоиммунные заболевания, одни из самых трудных в лечении. Поскольку не ясна этиология заболевания, лечение, как правило, ограничивается приёмом иммуномодуляторов и иммуносупрессоров. То есть лекарственных средств, направленных на стимулирование или на угнетение работы иммунной системы. При аутоиммунном заболевании наблюдается глубокое нарушение работы иммунной системы, при которой она не может распознать разницу между белками чужеродных агентов и клетками здоровых тканей своего организма. При таком нарушении защитной реакции организма, клетки иммунной системы атакуют здоровые клетки органов и тканей, так как это они делают в отношении вирусов, бактерий, паразитов, грибков, губят их, разрушают, что приводит к повреждению тканей и развитию аутоиммунных заболеваний, таких как:
- системная красная волчанка
- некоторые заболевания щитовидной железы и т.д.
Аутоиммунный процесс развивается при активном поражении организма антигенами, т.е. агрессивными чужеродными агентами (вирусами, бактериями, паразитами и грибками). При такой нагрузке клетки иммунной системы выходят из-под контроля и воспринимают белки собственного организма как чужеродные, стремясь их разрушить.
Прежде всего, необходимо помнить, что вирусы очень сильно угнетают иммунную систему. И не только ВИЧ. Цитомегаловирус и вирус Эпштейн-Барра – это более распространённые вирусные инфекции, о которых люди часто и не подозревают. Нередко у людей выявляют сразу оба этих вируса. Заразиться ими можно даже через слюну, посредством поцелуя в губы, обмена конфетами и жевательной резинкой изо рта в рот, как это часто делают дети, если пить из одного стакана или бутылки, при половом контакте и т.д. Основное действие этих вирусов – сильное угнетение иммунитета, развитие многих хронических заболеваний, провокация опухолевых процессов, развитие неврологических заболевания и многих других. К вирусам, влияющим на развитие аутоиммунного заболевания так же можно отнести вирус герпеса зостера, вирус клещевого энцефалита, простой герпес 1 и 2 типа, вирусы гепатита, вирусы краснухи, кори, гриппа – словом, это большое количество распространённых в нашей стране вирусов, которые подавляют иммунитет.
Аутоиммунная реакция может развиться и после перенесённых бактериальных инфекций, возбудителями которых являются хламидии, стрептококки, стафилококки, гонококк и другие. Паразиты и грибки ничуть не меньше являются причиной аутоиммунных заболеваний, ведь на борьбу с ними у нашего организма уходит очень много энергии. Различные гельминты, простейшие, паразитические и условно-патогенные грибки – всё это подрывает работу нашего иммунитета.
Несмотря на то, что лечение аутоиммунных заболеваний часто является длительным процессом из-за накопления большого количества вирусов, паразитов, грибков и болезнетворных бактерий, которые и повлекли за собой это заболевание, именно выведение патогенных факторов из организма является наиболее здравым решением. И не только для скорейшего улучшения самочувствия, но и в плане долговременных перспектив оздоровления, ведь в итоге восстанавливается организм в целом, и он будет лучше вас защищать от вторжения новых инфекционных агентов.
Рада предложить вашему вниманию комплекс от ЛОР- и лёгочных заболеваний, который охватывает широкий спектр патогенных факторов, помогает справиться с большинством возбудителей отитов, синуситов, ринитов, трахеитов, бронхитов и может иметь высокую эффективность в лечении пневмонии БЕЗ антибиотиков и противовирусных средств. Многократно успешно опробирован на пациентах г.Владивостока.
Сегодня я записала в свою базу Юпраны специально заказанный из США нозод Короновируса. Всем желающим пациентам он будет вставляться в курс превентивно.
P.S. Полный список новых нозодов в мою базу Юпраны предоставляется всем моим пациентам по личному запросу.
Буду лично вести приём в Москве 24, 25, 26 июля и в Санкт-Петербурге 27,28 июля

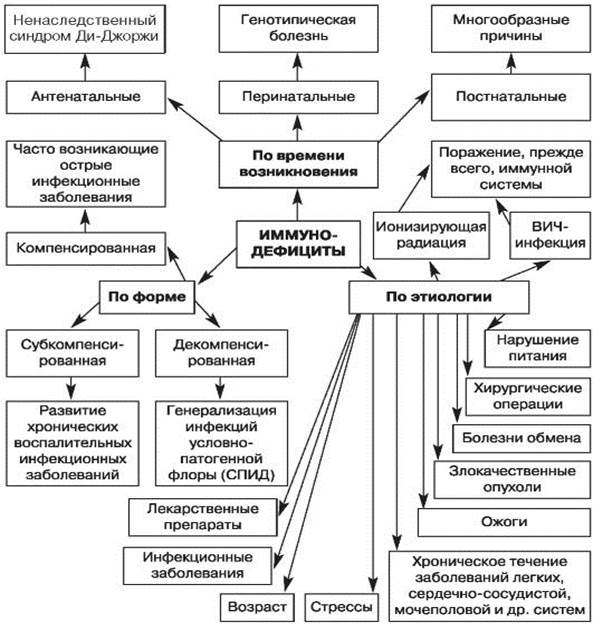
Рис. 1. Классификация вторичных иммунодефицитов по времени возникновения, этиологии, форме (по Белозерову Е.С. и др., 1992) [3]
Подводя итог в теоретической составляющей статьи – актуальности, необходимо обобщить следующее.
В педиатрии (17 лет 11 месяцев и 29 дней) в доминирующем большинстве речь идет об антенатальных и перинатальных иммунодефицитных болезнях, вторичных по отношению к анатомо-морфологическому субстрату иммунной системы – функциональных.
Таким образом, заключение врача-иммунолога должно быть сформулировано следующим образом. Антенатальная (или функциональная) иммунодефицитная болезнь, смешанного типа (или, при возможности, по отдельным звеньям, что мало вероятно), комбинированная индукция (инфекционная, гипоксическая и т.д.) с клиническими проявлениями основных синдромов – инфекционного, аллергического, аутоиммунного, неопластического и/или лимфопролиферативного.
Данные теоретические изыскания легли в основу целого цикла научно-исследовательских работ. Одно из таких исследований представлено в данной статье и посвящено исследованию иммуноиндуцирующей роли герпеса 4 типа - вируса Эпштейна-Барр у детей.
Цель: изучение особенностей клинических проявлений у детей с герпес-индуцированными формами иммунодефицитов (на примере 4 типа герпеса).
Все дети (100%) относились к часто и длительно болеющим, при этом 72 ребенка были неорганизованными (22,5%). У 78 (24,4%) детей были зарегистрированы признаки рецидивирующей герпетической инфекции с локализацией на губах, крыльях носа, слизистой оболочке полости рта. Ежегодно 92 ребенка (28,4%) переносили бактериальные инфекции в виде тонзиллитов, пневмоний, пиелонефритов, фурункулезов, гнойных конъюнктивитов, отитов, рино-синуситов. Признаки лимфоаденопатии (микролимфоаденопатии) регистрировались у 270 детей (84,4%). У 2 детей были диагностированы неопластические процессы (один ребенок умер в 2009 году). Одна девочка с лейкемоидной реакцией наблюдается у гематоонколога в течение 2 лет. Субфебрильные реакции более 12 месяцев были зарегистрированы у 39 детей (12,2%). Грубые неврологические нарушения (преимущественно двигательные) были зафиксированы у 43 детей (13,4%) (рис. 2).
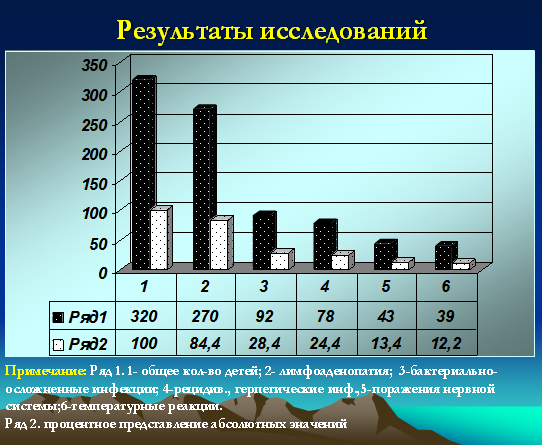
Рис. 2. Частота распределения клинических проявлений у детей с герпесиндуцированными иммунодефицитами
Иммунологические данные (в т.ч. данные лейкограммы), кроме количества лейкоцитов и лимфоцитов (абсолютное и относительное количество), носили неоднозначный характер. Классический супрессорный тип (в т.ч. и со снижением клеток цитолитической направленности) выявлялся у 108 детей (33,7%). Активация в системе клеток естественной цитотоксичности (CD16+) зафиксирована у 52 детей (16,2%). Увеличение В-клеточного пула было зарегистрировано у 38 детей (11,8%). Интересными, на наш взгляд, были полученные данные по CD95 маркеру, у 92 (28,7%) детей данный показатель был резко повышен и достигал значений 20-25%, у 30 (9,3%) детей указанный показатель не превышал 3% (рис. 3).
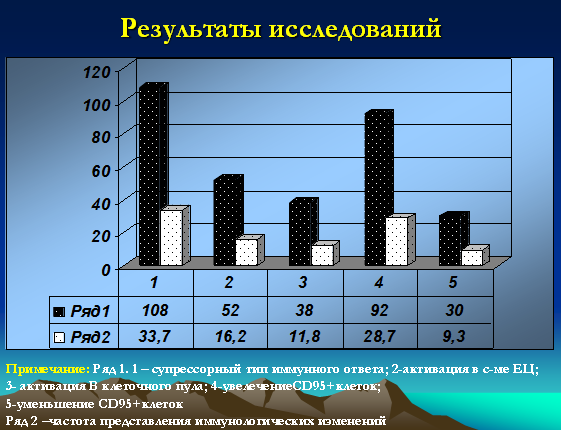
Рис. 3. Иммунологические особенности (типы распределения) у детей с герпесиндуцированными иммунодефицитами
ИФА, проведенный у детей, выявил 100% контаминацию вирусом ЭБ. Определялась следующая совокупность специфических антител:
- IgM к VCA (к капсидному антигену) – выявляются в крови в первые дни и недели болезни, максимально сохраняются до 3-4 недель;
- IgG к VCA (к капсидному антигену) – появляются в крови спустя 1-2 месяца от начала болезни, затем постепенно снижаются и сохраняются на пороговом (низком уровне) пожизненно. Повышение их титра характерно для обострения хронической ЭБВИ;
- IgM к EA (к раннему антигену) – появляются в крови в первую неделю заболевания, сохраняются в течение 2-3 месяцев и исчезают. Могут сохраняться в высоких титрах длительное время (более 3-4 месяцев), тревожно в плане формирования хронической формы ЭБВИ. Появление их при хронической инфекции служит индикатором реактивации;
- IgG к ЕA (к раннему антигену) – появляются к 3-4-й неделе заболевания, становятся максимальными на 4-6-й неделе болезни, исчезают через 3-6 месяцев. Появление высоких титров повторно указывает на активацию хронической инфекции;
- IgG к NA-1 или EBNA (к нуклеарному или ядерному антигену) – являются поздними, поскольку появляются в крови через 1-3 месяца после начала заболевания. При этом острофазные антитела выявлялись (IgM к VCA и IgM к EA) у 42 детей (13,1%), у 268 (83,7%) детей титры антител (IgG VCA + IgG к NA-1 или EBNA) значительно превышали нормативные и достигали значений более 160, у 10 (3,1%) детей диагностически значимых титров выявлено не было [9; 13] (рис. 4).
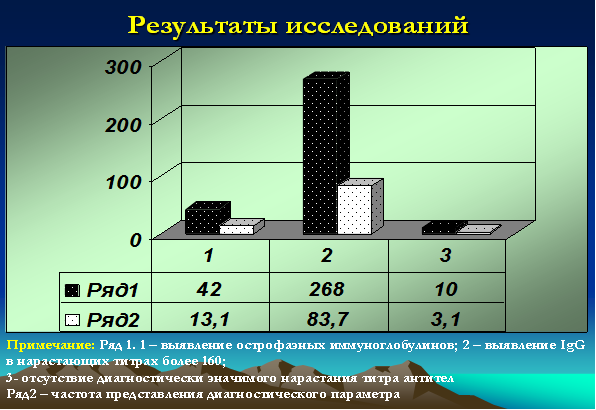
Рис. 4. Серологические исследования у детей с герпесиндуцированными иммунодефицитными болезнями
Клинические, иммунологические и этиологические сопоставления выявили следующие закономерности.
Отдельно хочется остановиться на методах ПЦР-диагностики. В литературе активно обсуждается вопрос об использовании ПЦР для исследований на инфекции семейства герпес в различных биологических субстратах. Здесь необходимо понимать, что данный метод, особенно при использовании его для исследования плазмы, имеет свои особенности – он всегда количественный! Определение качественное не имеет смысла, так как инфекция пожизненно персистирует в организме человека. Как у больных ЭБВИ, так и у носителей может быть положительная ПЦР. Поэтому для их дифференцировки проводится ПЦР-анализ с заданной чувствительностью: для носителей до 10 копий в пробе, а для активной инфекции – 100 копий в пробе. Специфичность данного метода хоть и достигает 100%, при этом не исключает ложноположительные результаты, т.к. ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов с отсутствием репликации в момент исследования [5; 9].
В результате проведенного нами исследования, ПЦР крови всегда имела отрицательный результат, даже у детей с неопластическими процессами. Распределение ПЦР-положительных результатов у детей со слизистых оболочек (ротоглотка, нос) и мочи имело следующее цифровое распределение.
Положительные реакции с 3 биологических объектов имели 36 детей (11,25%), у 62 положительные ПЦР реакции были с зева и носа – 19,38%, у 43 детей диагностировали положительный результат только с зева (13.44%), и 71 ребенок имели положительные значения ПЦР со слизистой оболочки носа (22,19%). Положительные значения только в моче имели 51 ребенок (15,94%). Остальные дети (в количестве 57) имели отрицательный результат ПЦР-исследований с биологических сред.
Дети с неопластическими процессами, длительным субфебрилитетом, лейкемоидной реакцией, лимфоаденопатией имели признаки активации хронической инфекции, резкое увеличение CD95+ клеток, положительные маркеры наличия и обострения ВЭБ в ИФА и ПЦР-исследованиях.
Таким образом, все дети имели индуцированные формы функциональной иммунодефицитной болезни, доминирующей причиной которой являлся вирус ЭБ. Проведенные предварительные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Выявление основных причин трактуется необходимостью применения комплексных методов лечения, в т.ч. и с применением противовирусных препаратов.
Аутоиммунные болезни — это группа заболеваний, в основе которых лежит развитие иммунных реакций на собственные ткани организма (аутоаллергия). Причины возникновения. Наиболее частой причиной аутоиммунных болезней являются инфекции (бактериальные, вирусные) и прием лекарственных препаратов. Так, установлено, что инсулинзависимый I тип сахарного диабета у детей может развиться после инфекций, возбудителями которых являются вирусы Коксаки B, паротита, гепатита A; ревматизм вызывается стрептококковой инфекцией; аутоиммунные болезни могут развиться после кори или герпеса.
Описаны лекарственные аутоиммунные болезни, например, лекарственная аутоиммунная гемолитическая анемия и др. Однако это не означает, что аутоиммунные болезни обязательно развиваются после указанных инфекций или после приема лекарств. Для их возникновения необходимы определенные условия, в частности, генетические нарушения иммунных механизмов. Так, ряд аутоиммунных болезней сочетается с наличием или отсутствием того или иного антигена гистосовместимости . Например, при ревматоидном артрите часто выявляется DR4-антиген, при системной красной волчанке — DR2- и DR3-антигены.
Классификация. Общепринятой классификации аутоиммунных болезней нет. Наиболее распространенной является классификация, основанная на характере аутоантигенов, к которым образуются антитела:
1. Органоспецифические аутоиммунные расстройства — группа болезней, при которых поражается один орган или какая-либо ткань. К ним относятся:
тиреоидит Хасимото;
болезнь Аддиссона;
пернициозная анемия;
аутоиммунная тромбоцитопения;
гипертиреоз;
язвенный колит;
гемолитическая анемия, обусловленная выработкой тепловых аутоантител;
аутоиммунный хронический активный гепатит;
тяжелая миастения.
Роль аутоаллергена при этих заболеваниях выполняют органоспецифические аутоантигены.
2. Системные аутоиммунные болезни — группа болезней, при которых в патологический процесс вовлекаются разные органы и ткани с участием аутоантигенов, общих для этих органов и тканей:
системная красная волчанка;
ревматоидный артрит;
иммунные коагулопатии;
Некоторые исследователи выделяют еще группу промежуточных аутоиммунных болезней. В нее включают болезни, которые трудно с уверенностью отнести к органоспецифическим или системным аутоиммунным болезням, например, синдром Шегрена. В связи с несовершенством этой классификации делаются попытки построить ее с учетом особенностей иммунных механизмов:
1. Аутоиммунные болезни со сниженной супрессорной функцией T-лимфоцитов:
системная красная волчанка;
T-тип сахарного диабета;
диффузный токсический зоб;
рассеянный склероз.
2. Аутоиммунные болезни с усиленной хелперной функцией T-лимфоцитов:
склеродермия;
системная лекарственная волчанка.
Диагностика. Диагноз ставится на основе клинической картины и данных лабораторных показателей. Снижается количество T-лимфоцитов, соотношение хелперы-супрессоры сдвигается в сторону уменьшения супрессорной активности, ослабляется реакция на митогены в культуре.
Более информативны такие серологические показатели, как выявление циркулирующих антител, иммуноглобулинов, иммунных комплексов, криоглобулинов и комплемента. Небольшое увеличение циркулирующих аутоантител и иммунных комплексов при отсутствии клинических симптомов расценивается как фактор риска. При аутоиммунных болезнях их содержание и продолжительность циркуляции значительно увеличены, и эти показатели вместе с показателями криоглобулинов могут использоваться для оценки активности воспаления и прогноза заболевания. Показатели комплемента снижены.
Лечение. Главным образом патогенетическое (лечение, направленное на устранение причины) и симптоматическое (лечение проявлений заболевания), в значительной степени определяется видом и стадией заболевания. В иммунологической стадии используются гормоны вилочковой железы, иммуномодуляторы. Применяются препараты, угнетающие протеолиз (контрикал, гордокс). Широко используются кортикостероиды и особенно нестероидные противовоспалительные препараты. Полезны мероприятия, направленные на уменьшение образования аутоантигенов (ликвидация очагов хронических воспалений, стимуляция регенераторных процессов).
Когда иммунная система бунтует против собственного организма и вместо патогенов иммунный ответ вызывают его клетки — это называют аутоиммунной болезнью.
Общее лечение системных аутоиммунных заболеваний включает в себя иммуносупрессоры и противовоспалительные препараты, которые могут и сами нанести вред организму. Для некоторых болезней терапия направлена не на устранение причины, а на облегчение ее симптомов. Например, это так в случае с диабетом: пациенту назначают инъекции инсулина. Cитуацию пытаются преодолеть генной терапией. Другой многообещающий подход — это использование моноклональных антител.
Всего таких расстройств больше 80 типов, среди них — инсулинзависимый сахарный диабет, ревматоидный артрит, базедова болезнь, рассеянный склероз и системная красная волчанка. Многие были известны давно, но их аутоиммунная природа была раскрыта недавно.
Страдают от этих болезней гораздо чаще, чем кажется: как минимум 5% жителей Европы и Северной Америки, причем две трети их них — женщины. Оценить суммарно, насколько остра социальная значимость аутоиммунных болезней по сравнению с другими — к примеру, возрастными неврологическими заболеваниями — трудно. Некоторые болезни крайне тяжелые, другие, — напротив, легко переносятся. Однако по финансовым затратам для общества они занимают явно не последнее место. Только бремя лечения от артрита оценивается в $65 млрд. Вдобавок пациент может иметь несколько аутоиммунных болезней одновременно, а лечение всегда продолжительное. Кроме того, эти заболевания часто сопутствуют первичным иммунодефицитам и осложняют болезни с неиммунологической этиологией, например, мышечную дистрофию Дюшена и атеросклероз.
Кроме того, как показало недавнее исследование Американской ассоциации по аутоиммунным заболеваниям и связанным с ними болезням (American Autoimmune Disease Related Diseases Association — AARDA), жизнь пациентов осложнена и тяжелой формой утомляемости. В онлайн-опросе участвовало 7838 человек. Как оказалось, утомляемость влияет почти на все стороны жизни: ее общее качество, карьеру, трудоспособность, романтические, семейные и профессиональные отношения, психическое и эмоциональное благополучие. Несмотря на то, что большинство больных обсуждает эти проблемы с врачами, многим не назначают дополнительного лечения.
Аутоиммунное заболевание считается локальным, если повреждение сосредоточено в отдельных органах. Это случай рассеянного склероза, где затрагиваются клетки центральной нервной системы, и диабета первого типа — разрушается поджелудочная железа. Другие же болезни системные и поражают весь организм. Это, например, системная склеродермия и красная волчанка с изменениями соединительной ткани.
В диагностику аутоиммунных болезней входят специфические методы по обнаружению аутоантител в крови. К примеру, это тест на антинуклеарные антитела (ANA test) — большую группу антител, направленных на ДНК, гистоны и другие компоненты ядра клетки.
Помимо этого, поскольку в организме развиваются воспалительные реакции, в клинической практике используют полный анализ крови, определение уровня С-реактивного белка, скорости оседания эритроцитов (СОЭ) и другие общие методы обнаружения воспаления.
К 1957 году Фрэнк Макфарлейн Бернет (Frank McFarlane Burnet) сформулировал клонально-селективную теорию, в которой показал, как некоторые лимфоциты с мутациями могут избежать уничтожения и вызвать аутоиммунное расстройство.
Воспроизводимые эксперименты и модели изучения на животных появились в 1960-х. Например, в это время были описаны аутоантитела, появляющиеся при синдроме Шегрена, при котором в основном повреждаются слюнные и слезные железы. Тогда же была впервые выдвинута гипотеза о связи аутоиммунных болезней с вирусными инфекциями. В начале 1970-х начали появляться молекулярные детали. К 1980-м обсуждали схожесть симптомов аутоиммунной болезни и побочных эффектов пересадки костного мозга. Десятилетием позже возникла идея применить принципы аутоиммунного заболевания в качестве контрацепции — как иммунизацию против сперматозоидов.
Сейчас научные исследования позволили идентифицировать множество аутоантигенов для конкретных заболеваний. Эксперименты на животных и семейный анализ позволили изучить мутации ДНК, приводящие к нарушению функций клеток иммунной системы. Кроме того, генетические исследования помогают выявить гомологии между белками патогенов и внутренних молекул организма. К примеру, у одного из аутоантигенов — натрий-йодного симпортера NIS — присутствует гомология с тремя другими антигенами щитовидной железы: тироглобулином, тиреопероксидазой и рецептором тиреотропина. Исследователи показали, что NIS обладает значительной локальной гомологией с по меньшей мере 11 белками бактерий и вирусов, например, со стрептококком и герпесом. Таким образом, если организм человека борется с герпесом, то заодно он может уничтожить и клетки щитовидной железы.
Наконец, появились и новые виды терапии, опирающиеся на молекулярные исследования. Прошлогоднее открытие исследователей из бристольского университета (University of Bristol) может помочь в лечении многих аутоиммунных расстройств, например, рассеянного склероза, сахарного диабета первого типа, болезни Грейвса и системной красной волчанки. Ученые выяснили, как влияет антиген-специфическая иммунотерапия на экспрессию генов, в результате чего клетки переходят от нападения на ткани организма — к их защите.
В следующих статьях цикла мы расскажем о молекулярных механизмах развития аутоиммунных заболеваний.
Несколько представителей семейства герпесвирусов заразили до 95% населения Земли. Почему одни больные находятся из-за них на грани жизни и смерти, а другие не замечают, что инфицированы, какие методы лечения одобрены ВОЗ, как вирусы могут дремать годами и даже вызывать рак, рассказывает Indicator.Ru.
Чем больше геномов читают и сопоставляют биологи, тем сложнее и ветвистее становятся родословные древа живых организмов. Даже у вирусов, которые и живыми язык мало у кого из биологов повернется назвать, есть целый Международный комитет по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV).
Вирус сложный, герпес простой
Thomas Splettstoesser/Wikimedia Commons
Вообще у вирусов бывает два типа размножения. Они могут либо встраиваться в хозяйский геном и мирно дремать, позволяя размножающейся клетке-хозяину многократно копировать себя и передавать по наследству вместе с родными генами, либо сразу разрывать оболочку клетки, убивая ее, и отправляться на поиск новых жертв. Первый вариант называют лизогеническим циклом, второй — литическим.
Литический и лизогенический циклы
Семейство Herpesviridae подразделяется на три подсемейства, которые для простоты назвали альфа–, бета– и гаммагерпесвирусами. Мы выбрали четыре из них — по сочетанию распространенности и коварства. Зараженные этими вирусами часто не знают о своей болезни и о способах борьбы с ней. Поэтому, даже если у них самих симптомы не проявляются, носители могут быть опасны для окружающих, не должны становиться донорами и рискуют заразить людей с подавленным иммунитетом.
Всемогущество с точки зрения вируса
Вирус простого герпеса второго типа (Herpes simplex virus type 2, HSV-2) отстает от собрата, но все же и здесь масштабы впечатляют: им заражено 11% мировой популяции. Эти вирусы избрали своим объектом людей, которых, конечно, немало, но и не бесконечно много. А теперь представьте, как многочисленны могут быть вирусы, заразившие насекомых. А бактериофаги? Но мы отвлеклись.
Устройство белкового капсида вируса простого герпеса первого типа
Простой человеческий герпес второго типа чаще всего передается половым путем, но может распространяться и через контакты участков кожи. Он гораздо чаще вызывает язвочки на половых органах. Инфекция может сопровождаться набуханием лимфоузлов, лихорадкой и болями в теле, но часто вирус долгое время существует в организме бессимптомно.
Схема репликации (размножения) простого герпесвируса человека. Видно, что этот вирус не только заставляет клетку тиражировать себя, но и, уходя, прихватывает с собой кусок ее оболочки
Двое из ларца
Хотя по своим проявлениям герпесвирусы человека первого и второго типа различны, общего у них гораздо больше. Оба они сперва поражают клетки слизистых оболочек и лишь затем распространяются по организму. Оба хранят все знания о себе в менее чем сотне генов. Оба только и ждут, пока наш иммунитет утомится от борьбы с другими болезнями, а потом проявляются во всей красе. И оба могут, спрятавшись в телах нейронов от иммунитета, дремать годами, оставляя своего носителя заразным (правда, HSV-1 предпочитает гассеров узел тройничного нерва, а HSV-2 — крестцовые ганглии, но бывают и другие варианты), а потом резко переходить к литическому циклу и проникать по аксонам в клетки эпителия, чтобы продолжить свою работу.
Больше всего неприятностей HSV доставят новорожденным и людям с ослабленной иммунной системой: живущим с ВИЧ или тем, чей иммунитет временно подавлен, например, для трансплантации какого-либо органа. У них вирусы простого герпеса чаще переходят в литический цикл, уже не боясь иммунной обороны, что вызывает множество воспалительных осложнений. Если это произошло в нервных клетках, может начаться менингит (воспаление мозговых оболочек) или энцефалит (воспаление головного мозга).
Коварство обоих типов HSV в том, что заболевание протекает скрытно. Люди могут долгое время даже не догадываться, что они больны, и распространять инфекцию. Причем, что печально, лечения от обоих типов вируса простого герпеса в данный момент не существует. Вы можете прислушаться к рекомендациям Всемирной организации здравоохранения (ВОЗ) и использовать ацикловир, фамцикловир или валацикловир, которые останавливают цикл репликации (воспроизводства) вируса и не дают ему бесконтрольно плодиться. Их, согласно руководству той же ВОЗ, нужно принимать внутрь курсами по десять дней.
Авторы кохрейновского обзора 2016 года про первое проявление генитального герпеса и противовирусные препараты приходят к выводу, что прием ацикловира и валацикловира ослабляет симптомы заболевания. Этот вывод, однако, основывается на небольшом числе данных. А вот польза местных препаратов (различных мазей и антисептической обработки) пока не доказана.
В обзоре научных статей, выпущенном клиникой Мэйо в Рочестере, говорится, что в особенно тяжелых случаях и при частых рецидивах, возможно, понадобится вводить ацикловир внутривенно. Правда, тут нужно соблюдать осторожность во избежание нарушения работы почек.
Вирус Эпштейна — Барр: от поцелуя к спящему вулкану
Первой мишенью этого вируса обычно становятся эпителиальные клетки, чаще всего на тех же слизистых оболочках. Там вирус Эпштейна — Барр активно размножается по литическому циклу. Хотя в слизистых оболочках, на границе с жестоким внешним миром, не дремлет и иммунитет. B-лимфоциты только и ждут, чтобы отправить антитела на борьбу с врагом, но человеческий герпесвирус 4-го типа не боится встреч с ними. Он берет их на абордаж, присоединяясь к специфическим белкам на их поверхности. Связывается он и с белками MHC-II, которые в норме показывают другим иммунным клеткам, Т-лимфоцитам, кусочки внутриклеточных белков для проверки, нет ли в В-лимфоците чего-то чужеродного.
Схема репликационного цикла вируса Эпштейна — Барр у здоровых людей
Graham Beards/Wikimedia Commons
Белки играют в прятки
В ответ на такие наглые посягательства на уже порабощенную территорию вирус Эпштейна — Барр переходит в литический цикл. При этом он задействует много вирусных белков. Часть из них отвечают за конспирацию, мешая зараженным клеткам показывать куски вирусных белков Т-лимфоцитам, постоянно ищущим признаки поломок и инфекции. И вот, словно пробудившийся вулкан, B-лимфоциты извергают вирусные частицы, которые поражают лейкоциты и вызывают инфекционный мононуклеоз.
Симптомы инфекционного мононуклеоза
Чтобы улучшить состояние пациента, ему нужно больше отдыхать (хотя лежать в постели вовсе необязательно), снизить физическую активность, при болях и лихорадке принимать обезболивающие: ибупрофен, парацетамол или напроксен. Аспирина же советуют избегать, поскольку он повышает у зараженных герпесвирусом 4-го типа риск заполучить синдром Рейе — острую печеночную недостаточность вместе с поражением головного мозга. Антибиотики (как и против любых вирусов) будут бесполезны, если нет осложнения в виде бактериальной инфекции. Такие рекомендации по лечению дает сайт JAMA (Журнал Американской медицинской ассоциации, The Journal of the American Medical Association).
А как насчет противовирусных препаратов? Их в руководства по лечению инфекционного мононуклеоза не включают. Согласно уже упомянутому выше обзору клиники Мэйо в Рочестере, ни одно противовирусное лекарство не было одобрено для лечения инфекционного мононуклеоза, а к ацикловиру вирус Эпштейна — Барр чувствителен намного меньше, чем большинство герпесвирусов человека (кроме герпесвирусов 6-го, 7-го и 8-го типов, на которые он не влияет вовсе).
Эффективность ацикловира (а также валомацикловира и валацикловира), по данным кохрейновского обзора 2016 года, не доказана. То же самое о стероидных обезболивающих и жаропонижающих препаратах сообщают авторы еще одного обзора.
После первой вспышки, которая длится обычно пару недель или месяц, вирус остается в теле больного на всю жизнь, но перестает быть таким заразным для окружающих. Чувство слабости, тошноты и постоянной усталости может продлиться до трех месяцев. Однако потом, подавленный иммунитетом, вирус вынужден прятаться и дремать под его надзором, и во второй раз он уже может не активироваться никогда.
Как и в случае поражения герпесвирусами 1-го и 2-го типов, у больных изредка возможны серьезные осложнения. Их риск возрастает у людей с сильно ослабленным иммунитетом или зараженных ВИЧ. В таких случаях вирус может вызывать злокачественные перерождения клеток крови и эпителия. Оно и понятно: вирус Эпштейна — Барр любит воспроизводиться за счет хозяйской клетки, а не по литическому циклу, поэтому ему выгодно подарить клетке-носителю и ее потомкам бессмертие.
Но бессмертие отдельной клетки в сочетании с пренебрежением интересами организма на выходе чаще всего дает рак. Так происходит и с клеткой, зараженной вирусом Эпштейна — Барр, который даже открыт был при изучении лимфомы Беркитта. Назофарингеальная карцинома — еще одно онкологическое заболевание носоглотки, к которому приводят запущенные случаи, когда зараженный пациент долго не обращает внимание на боли и незаживающие язвы в носоглотке, а также затрудненное дыхание, вызванные усиленным распространением вируса.
Герпес номер пять с совиным глазом
Герпесвирус человека 5-го типа, который часто называют цитомегаловирусом, может вызвать заболевание, симптомы которого очень напоминают мононуклеоз. Но лимфоузлы и селезенка у таких пациентов обычно не увеличиваются, а следов вирусов гепатита или Эпштейна — Барр найти не удается.
Как и вирус Эпштейна — Барр, цитомегаловирус передается через жидкости тела, больше всего его в слюне и моче. Поэтому заражение очень часто происходит в детском саду, особенно когда дети не очень тщательно соблюдают правила личной гигиены.
Противовирусные препараты могут подавлять синтез новых частиц цитомегаловируса на разных стадиях. В списке важнейших лекарств по версии Всемирной организации здравоохранения можно увидеть валганцикловир, который, как и ганцикловир, обычно назначается в первую очередь. Ганцикловир рекомендуют вводить внутривенно в более тяжелых случаях, валганцикловир применяется в таблетках и лучше подойдет для борьбы с заболеванием средней и легкой тяжести. Также обзор противовирусных препаратов клиники Мэйо называет эффективными препараты фоскарнет и цидофовир, но они очень токсичны для почек, поэтому назначаются только в том случае, если препараты первого выбора не помогли.
Однако наука продвинулась в борьбе с цитомегаловирусом дальше, чем с его родственником под номером 4. Сейчас появились профилактические вакцины, которые даже получили одобрение Всемирной организацией здравоохранения. Поэтому людям с серьезным иммунодефицитом можно защитить себя при помощи пассивного иммунитета — готовых антител. Кстати, иногда можно услышать советы поддержать ослабленный каким-нибудь герпесвирусом иммунитет с помощью этих самых антител, иммуноглобулинов, интерферонов. Давайте вкратце обсудим, что это такое и может ли оно помочь от болезней, упомянутых в этой статье.
Интерфероны, иммуноглобулины, антитела
Тем более что тот же цитомегаловирус может грозить вам аутоиммунным заболеванием и без дополнительной стимуляции. Публикация в одном из самых цитируемых медицинских журналов, The Lancet, указывает на то, что цитомегаловирус связан с диабетом 1-го типа. Есть и сообщения о том, что герпесвирусы могут способствовать развитию синдрома Гийена — Барре, при котором из-за аутоиммунных воспалительных процессов у пациентов наступает мышечная слабость. И это еще не полный список.
К тому же, согласно обзору в журнале Annual Review of Microbiology, многие герпесвирусы человека благополучно подавляют работу наших интерферонов против самих себя, поэтому вы вряд ли сможете как-то на них повлиять.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Читайте также:


