Вирус эпштейн барр кондиломы

В Ростовской области (РО) в 2012 г. заболеваемость РОПР составила 4,11 (на 100000 нас.), что превышает заболеваемостьв 2008 г. (3,72), и приравнивает её к средним показателям (4,58) по РФ [3].
Рост заболеваемости связывают с такими факторами как: вредное производство, неблагоприятная окружающая среда, вредные привычки, неполноценное питание, не соблюдение гигиены полости рта, депрессивное состояние, инфицированность вирусной инфекцией и др.
Выявление причин возникновения РОПР,возможностираннего его распознавания, закономерностей развития опухоли, продолженного ее рост после лечения,возникновение рецидивов являются актуальными проблемами, требующимисвоего решения.
Исходя из этого, выбор методов лечения и их результаты тесно связаны с изучением факторов прогнозатечениязаболевания.
Результатом исследования Мардалейшвили К. М.по прогнозированию появления регионарных метастазов и эффективности лечения при РОПР, и как следствие выбораоптимального метода лечения, явилась разработка критериев прогноза заболевания: размер опухоли и форма ее роста, распространенность на другие анатомические части органа, инфильтрация окружающих тканей, распространенность опухоли за среднюю линию и длительность существования опухоли. Так размер опухоли >4 см, эндофитный рост, ее распространение более чем на 2 отдела, болевой синдром и хотя бы один метастаз не дает прогноза прожить более 2-х лет. Местно-распространенные формы рака органов полости рта характеризуются малой чувствительностью или резистентностью опухоли к лучевой терапии[4].
Развитие регионарных метастазов после комбинированного лечения наблюдается у 40-75% больных, а отдаленные метастазы выявляется в 15% случаев по даннымЛюбаева В.И.
Лечение регионарных метастазов, в большинстве случаев, осуществляется хирургически, но ряд авторов, таких какЛюбаевВ.И. и др. утверждают, что необходимо проводить комбинированное лечение, где первым этапом является лучевая терапия, химиотерапия.
Эти авторы отмечают, что после комбинированного и даже комплексного лечения местные рецидивы у больных раком органов полости рта возникают в 25-40% случаев всех наблюдений.
Цель исследования.Оценить инфицированность вирусами герпеса человека и папилломы человека у больных раком органов полости рта в Ростовской области.
Задачи.Определитьпрогностическую значимость вируса Эпштейна-Барр и вируса папилломы человека длятечения рака органов полости рта.
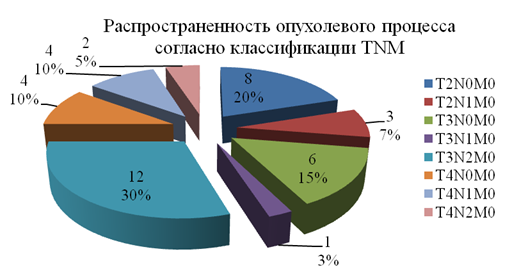
Мужчин было 24 (80%), женщин – 6 (20%). Возраст больных составлял 33 - 66 лет.По распространенности процесса (рис. 1) со II стадией (T2N0M0) было 8(26,7%) человек, III– 10 (33,3%)(T2N1M0, T3N0M0, T3N1M0), IV– 12 (40%)(T3N2M0, T4N0M0, T4N1M0, T4N2M0).
У 25 (83,3%) больных опухолевый процесс располагался на языке, из них у 15 (60%) – на боковой поверхности языка, у 6 (24%) – в средней трети тела языка и у 4 (16%) – на кончике языка; у 5 (16,7%) - на слизистой дна полости рта.
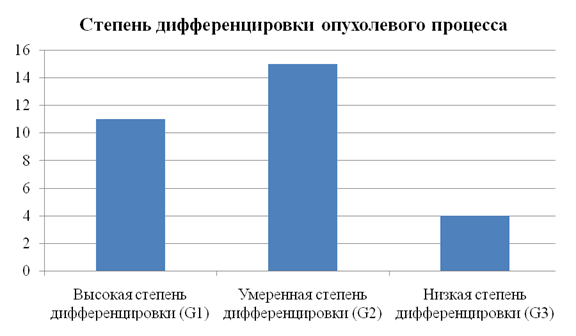
У всех больных был выявлен плоскоклеточный рак. Степень дифференцировкипервичной опухоли представлена нарис. 2.
Метастазы (IB-III уровней) были выявлены у 10 (33,3%) больных при первом обращении.
Материалом для молекулярно-биологических исследований служили образцы ткани опухоли РОПР, взятые у больных в ходе операции.
Из гомогената ткани опухоливыделяли ДНК вирусов, с использованием коммерческого набора реагентов MagNaPureCompactNucleicAcidIsolationKit I-LargeVolume на приборе MagNaPureCompact (Roche, Швейцария).Амплификацию с последующей детекцией ДНК осуществляли методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени на термоциклереRotorGene 6000 (QIAGEN, Германия).
ОпределялиДНК вируса папилломычеловека высокого канцерогенного риска (ВПЧ ВКР) 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов и ВПЧнизкого канцерогенного риска (ВПЧ НКР) 6 и11 типов,вируса простогогерпеса 1,2 типов (ВПГ 1,2 типа), цитомегаловируса (ЦМВ), вируса Эпштейна-Барр (ВЭБ) и вируса герпеса человека 6 типа (ВГЧ 6 типа).
Статистическая обработка полученных данных проводилась с применением программы STATISTICA.
Результаты и обсуждения.Данные лабораторных исследований 30 обследованных больных представлены в табл. №1.
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалисты
проконсультируют Вас.
Описание заболевания
Открыли вирус в середине прошлого века, и за истекшее время патологическая роль возбудителя доказана при множестве инфекций. Передается от больного человека к здоровому через биологические жидкости: кровь, пот, слюну, мочу, слезы, патологические выделения. К подростковому возрасту носителями становятся около половины подростков, а среди взрослых насчитывается не более 5% людей , организм которых свободен от вируса. Поселяется вирус в нервной ткани и не покидает ее до конца жизни, находясь в дремлющем состоянии.
При любом ослаблении иммунитета или воздействии вредных факторов вирус становится причиной таких заболеваний:
- болезнь Филатова, или инфекционный мононуклеоз;
- синдром хронической усталости;
- лимфома Беркитта;
- лимфогранулематоз;
- носоглоточный рак (карцинома);
- гепатит;
- стоматит;
- герпетические поражения кожи и слизистых;
- нарушение схемы тела, синдром Алисы в стране чудес;
- рассеянный склероз;
- гипотиреоз;
- поражения слизистой оболочки языка в виде волосатой лейкоплакии у больных СПИДом.
Симптомы
Классическое проявление поражения вирусом Эпштейна-Барра — инфекционный мононуклеоз. У маленьких детей заболевание никак не проявляется, а вот у детей старшего возраста и взрослых развивается характерная клиническая картина.
Период от заражения до клинических проявлений или инкубация длится месяц-полтора. Далее появляется триада симптомов: лихорадка, воспаление горла и увеличение лимфатических узлов. Температура тела высоко поднимается вечером, а днем нормальная, и такая ситуация продолжается около 3-х недель. Воспаление горла (фарингит) протекает тяжело, с сильной болью. Поражаются шейные лимфатические узлы, как правило, симметрично, но может быть увеличение лимфоузлов по всему телу.
С течением времени присоединяется увеличение печени и селезенки, изменяется состав крови.
В течение месяца или немногим более клиническая картина угасает, заболевание заканчивается полным клиническим выздоровлением, однако вирус остается в организме навсегда.
Редко бывают осложнения: неврологические симптомы в виде энцефалита или менингита, разрыв селезенки, сужение дыхательных путей.
Другие проявления инфицирования в виде опухолей, рассеянного склероза или синдрома хронической усталости протекают по своим законам. Связь заболевания с вирусом обнаруживается только при углубленном целенаправленном обследовании.
Наши специалисты подходят к решению проблем максимально деликатно. Поэтому вы можете без стеснения рассказать обо всех сопутствующих симптомах на приёме у специалиста. Полная картина позволит врачу подобрать наиболее эффективную терапию. Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи +7 (495) 292-39-72
Причины
Любой вирус — это внутриклеточный паразит, который не может существовать вне человеческого тела. Проникает вирус через слизистые оболочки ротоглотки и верхних дыхательных путей. Момент заражения установить невозможно, поскольку никаких клинических проявлений нет. Недомогание бывает только у крайне ослабленных больных. Вирус попадает в кровь и лимфу, постоянно находится в нервной ткани.
Паразитирование вируса провоцирует ускоренное деление клеток, которые становятся источником опухолей различной локализации. Азиаты, зараженные вирусом, болеют раком носоглотки, жители Африки — опухолями яичников и почек, европейцы переносят вторжение вируса преимущественно как тяжелую ОРВИ.
При других заболеваниях, перечисленных выше, вирус обнаруживается почти всегда, но продолжаются дискуссии о его роли в формировании данных болезней.
Диагностика
Лабораторная диагностика включает несколько тестов:
- анализ крови на ранние антитела класса G (IgG) — определяются в течение месяца после заражения, затем исчезают, считаются маркером острого периода;
- анализ крови на капсидный белок или иммуноглобулины класса М (IgM) — появляются одновременно с первыми клиническим и проявлениями, сохраняются в течение нескольких месяцев, но обнаруживаются не у всех болеющих;
- анализ крови на ядерный антиген EBNA IgG — определяется группа из 6 антигенов, считается маркером хронического носительства или перенесенной ранее инфекции;
- полимеразная цепная реакция (ПЦР) — обнаружение ДНК вируса в биологической жидкости, чаще всего в крови, показатель активирования дремлющей инфекции;
- лейкоцитарная формула в составе общего анализа крови — используется для разграничения с другими инфекциями.
Сопоставляя клинические и лабораторные данные, а также особенности динамического наблюдения за пациентом, можно установить, связано ли с вирусом Эпштейна-Барр текущее заболевание или нет.
Лечение
Лечение полностью зависит от формы заболевания, ассоциированного с вирусом Эпштейна-Барр. При инфекционном мононуклеозе требуется в основном покой и поддерживающее лечение в виде охранительного режима и легкого сбалансированного питания. При возникновении осложнений применяются кортикостероиды, которые облегчают течение болезни. При разрыве селезенки орган удаляют хирургическим путем.
Опухоли лечатся традиционно: хирургическое удаление, химио- или лучевая терапия, поддерживающие препараты.
Рассеянный склероз лечится глюкокортикоидными препаратами в высоких изменяющихся дозах (пульс-терапия), препаратами на основе моноклональных антител.
Лечение всех заболеваний, ассоциированных с вирусом Эпшейна-Барра, в основном симптоматическое.
Меры профилактики заражения до настоящего времени не разработаны.
Помимо ярко выраженного антибактериального эффекта витамин D также оказывает противовирусное действие. Увеличивая экспрессию интерферона альфа, кателицидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного иммунитета. Результаты фундаментальных и клинических исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусных гепатитов, респираторной и папилломавирусной инфекций. Противовирусные эффекты витамина D также важны для повышения эффективности профилактики и терапии опухолевых заболеваний шейки матки.
Помимо ярко выраженного антибактериального эффекта витамин D также оказывает противовирусное действие. Увеличивая экспрессию интерферона альфа, кателицидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного иммунитета. Результаты фундаментальных и клинических исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусных гепатитов, респираторной и папилломавирусной инфекций. Противовирусные эффекты витамина D также важны для повышения эффективности профилактики и терапии опухолевых заболеваний шейки матки.
Витамин D – комплексный регулятор врожденного и приобретенного иммунитета, поэтому недостаточность этого витамина снижает антибактериальный и противовирусный иммунитет, стимулирует развитие патологий, ассоциированных с хроническим системным воспалением (атопического дерматита, ревматоидного артрита, воспалительных заболеваний кишечника, аутоиммунных заболеваний щитовидной железы и сепсиса). Результаты фундаментальных и клинических исследований показали, что возникающие на фоне недостаточности витамина D хроническое воспаление и нарушения врожденного иммунитета значительно снижают резистентность организма к туберкулезу, хроническому бронхиту, вирусным заболеваниям (вирусному гепатиту, острому респираторному заболеванию, папилломавирусной инфекции) [1, 2]. Таким образом, обеспеченность витамином D может существенно влиять на иммунитет, в том числе на противовирусную защиту организма.
В настоящей статье последовательно рассмотрены молекулярные основы противовирусного действия витамина D, результаты фундаментальных и клинических исследований, указывающие на действие витамина D против вирусов гепатита, Эпштейна – Барр, папилломы человека (ВПЧ), респираторно-синцитиального вируса и др. Показана целесообразность применения витамина D в профилактике и терапии опухолевых заболеваний шейки матки.
О молекулярных механизмах противовирусного действия витамина D
Витамин-D-индуцированные механизмы, связанные с противовирусной активностью, включают корректировку врожденного иммунного ответа (интерфероны), повышение уровней кателицидина (LL-37) и дефенсина, а также активацию специфических противовирусных микроРНК. Витамин D усиливает эффект интерферона, уменьшая синтез вирусных белков в зараженных вирусами клетках. Например, при инфицировании гепатоцитов в культуре вирусом гепатита С воздействие витамина D в форме 1,25(OH)2D активирует гены, связанные с аутофагией вирусных частиц (рецептор 37 G-белков (GPR37), фактор, индуцируемый гипоксией 1-альфа (HIF-1-альфа), хемокиновый лиганд 20 (CCL20)), и подавляет интенсивность репликации вируса (рис. 1) [5].
Одна из основ противовирусного действия витамина D – повышение экспрессии антимикробных пептидов кателицидина и бета-дефенсина 2 [6], которые проявляют не только микробицидную, но и противогрибковую и противовирусную активность [7].
Антимикробный пептид кателицидин – неотъемлемый компонент витамин-D-зависимого врожденного антимикробного иммунитета. Антимикробные пептиды встраиваются в цитоплазматическую мембрану бактерий и белковые оболочки вирусов и, приводя к образованию пор, нарушают целостность бактерий и вирусов. Кроме того, проникая внутрь бактерий и вирусов, положительно заряженные антимикробные пептиды связываются с отрицательно заряженными ДНК и РНК, что также стимулирует гибель бактерий и вирусов.
Обработка моноцитов в культуре посредством биологически активной формы витамина D (1,25(OH)2D) дозозависимо повышала экспрессию мРНК антимикробного пептида кателицидина в 48–140 раз, причем увеличение экспрессии гена кателицидина коррелировало с повышенной экспрессией белка кателицидина [8]. В клиническом исследовании установлена корреляция между уровнями 25(OH)D и кателицидина в плазме крови (фактор корреляции 0,45, р = 0,05) [9]. Более высокая концентрация кателицидина в плазме существенно (в 3,7 раза) снижала риск смерти от инфекции у пациентов с диализом [10].
Витамин D повышает экспрессию определенных микроРНК, которые проявляют противовирусные и онкопротективные свойства. Напомним, что микроРНК представляют собой короткие специфические фрагменты РНК, которые ассоциируются с матричной РНК для синтеза того или иного белка и осуществляют тонкую настройку экспрессии этого белка. Иначе говоря, посредством микроРНК синтезируется столько молекул белка, сколько нужно для потребностей клетки. Как недостаточный, так и избыточный синтез белков может приводить к развитию опухолей.
Витамин D и активированные им микроРНК (в частности, miR-155 и miR-146) тормозят экспрессию целевых специфических белков, ассоциированных с формированием избыточного воспаления: толл-подобных рецепторов 2 и 4, фактора некроза опухоли альфа, интерлейкинов 1-бета и 6, транскрипционного фактора NF-kB, киназного комплекса IkB (IKK), супрессора сигналинга цитокинов 1 (SOCS1) [11]. Активная форма витамина 1,25(OH)2D потенцирует ингибирующее действие miR-130а при репликации вируса гепатита C [5], повышающего риск опухолевых процессов в печени в десятки раз. Фундаментальные исследования показали, что воздействие витамина D на иммунитет также осуществляется посредством регуляции деления Т-хелперных лимфоцитов, дифференцирования В-клеток, секреции интерферона и других цитокинов, что способствует снижению избыточного воспаления [1].
Витамин D против вирусного гепатита
25(OH)D подавляет продукцию вируса гепатита С. Клетки HuH-7 в культуре были инфицированы вирусом гепатита С в присутствии или в отсутствие витамина D. 25(OH)D дозозависимо уменьшал вне- и внутриклеточный уровни основного антигена вируса гепатита С. Ингибирующее действие 25(OH)D осуществлялось на стадии сборки инфицирующего вирусного комплекса [12].
25(OH)D подавляет репликацию вируса гепатита С и способствует более быстрому вирусологическому ответу организма. Выживаемость клеток и нагрузка вирусом наблюдались в линиях клеток Con1-1b и J6/JFH-2a в культуре, обработанных различными дозами 25(OH)D. Вирусная нагрузка клеток Con1-1b дозозависимо снижалась на 69, 80 и 86% после обработки 1, 5 и 10 мкМ 25(OH)D соответственно (р 3+ - и CD 4+ -T-лимфоцитов и отношение CD 4+ /CD 8+ значительно увеличивались (p 30 нг/мл (ОР 1,57, 95% ДИ 1,12–2,2), особенно у пациентов, получавших витамин D (ОР 4,59, 95% ДИ 1,67–12,63). Важно отметить, что противовирусный эффект витамина D не зависел от генотипа вируса гепатита С [16].
Витамин D против других вирусов
Респираторно-синцитиальная вирусная инфекция ослабляет противовирусную и противоопухолевую защиту организма путем негативного воздействия на метаболизм витамина D. При заражении клеток респираторно-синцитиальные вирусы уменьшают экспрессию рецептора витамина D (Vitamin D Receptor – VDR) и увеличивают экспрессию фермента 1-бета-гидроксилазы, которая инактивирует витамин D [19].
Витамин D способствует усилению противовирусной защиты бронхиальных эпителиальных клеток при участии противовирусного и антибактериального пептида кателицидина и активации сигнальных путей интерферона [20]. Поддерживая противовирусный иммунитет, витамин D также снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительного фактора NF-kB и соответствующих цитокинов в эпителии дыхательных путей. Витамин D индуцирует белок IkBa, ингибитор фактора NF-kB, и снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительных генов, управляемых NF-kB (интерферон бета, CXCL10 и др.). Ингибирование NF-kB посредством аденовирусных частиц, содержащих IkBa, имитировало эффекты витамина D. Таким образом, витамин D уменьшал воспалительную реакцию в ответ на вирусные инфекции, не снижая при этом противовирусного действия [21].
Метаанализ 25 рандомизированных исследований (n = 10 933), проведенный с использованием данных об индивидуальных пациентах, показал, что дотации витамина D способствовали снижению риска инфицирования острым респираторным заболеванием в среднем на 12% (ОР 0,88, 95% ДИ 0,81–0,96, p 30 нг/мл) [28]. В среднем риск инфицирования ВПЧ увеличивался на 14% при снижении уровня в сыворотке 25(ОН)D на каждые 10 нг/мл (ОР 1,14, 95% ДИ 1,02–1,27) (рис. 2).
Был опубликован клинический случай, который продемонстрировал эффективность местного применения витамина D у пациентки с папилломой на правом указательном пальце [29]. Так, пациентка А., 41 год, с врожденным заболеванием почек перенесла трансплантацию почки от умершего донора и находилась на терапии иммунодепрессантами (такролимус, микофенолата мофетил). Через 19 месяцев после трансплантации у пациентки образовалась папиллома на правом указательном пальце, которая вырастала вновь и вновь, несмотря на многократную криотерапию и электрокоагуляцию. Местное лечение папилломы с использованием раствора 1,25(OH)2D (0,5 мкг/сут) привело к полному излечению через три месяца.
Витамин D как нутриентная основа профилактики и терапии опухолевых заболеваний шейки матки
1,25(OH)2D ингибирует пролиферацию опухолевых клеток шейки матки путем подавления экспрессии онкогена рака шейки матки (HCCR-1) и увеличения экспрессии проапоптотического белка р21. Опухолевые клетки шейки матки (линия HeLaS3) культивировали в средах с различными концентрациями 1,25(OH)2D, которые индуцировали остановку клеточного цикла на фазе G1. 1,25(OH)2D дозозависимо уменьшал экспрессию белка HCCR-1 посредством транскрипционной регуляции экспрессии гена HCCR-1 и повышенной экспрессии белка p21 и промоторной активности [30].
1,25(OH)2D увеличивает экспрессию онкопротективных микроРНК в клетках рака шейки матки (линия SiHa). МикроРНК влияют на экспрессию многочисленных белков деления клетки, поэтому поддержание функции микроРНК играет важную роль в торможении возникновения и развития опухолей. Показано, что 1,25(OH)2D регулирует экспрессию онкозащитных микроРНК miR-22, miR-296-3p и miR-498 [31].
Иммуногистохимический анализ показал, что уровни экспрессии VDR при цервикальной карциноме повышены по сравнению с нормальной тканью шейки матки. Окрашивание на VDR было однородным, без визуальных различий между отдельными опухолевыми клетками. Умеренно-сильное окрашивание на VDR было обнаружено в 16 из 21 биопсии рака шейки матки независимо от того, экспрессировали эти опухоли цитокератин 10 или трансглутаминазу К. Повышенная экспрессия VDR – один из аспектов иммунного ответа организма на ВПЧ [32].
Делеция рецептора витамина D в эксперименте сенсибилизирует эпителий к химически индуцированному опухолегенезу. Данный эффект вполне понятен, так как 1,25(OH)2D – мощный регулятор клеточной пролиферации, дифференцировки и апоптоза в различных типах клеток, включая кератиноциты. У мышей, гомозиготных по делеции рецептора витамина D (VDR(-/-)), пероральное введение канцерогена 7,12-диметилбензатрацена (ДМБА) вызывало развитие папиллом на всех участках тела со средней опухолевой нагрузкой в 5,3 папиллом/мышь. Никаких папиллом или каких-либо других поражений кожи не наблюдалось у мышей соответствующего возраста и пола без делеции рецептора витамина D (VDR (+/+)) [33].
У мышей линии VDR(-/-) начиная с семинедельного возраста отмечалась гиперпролиферация клеток кожи, которая резко усиливалась после воздействия ДМБА. Без воздействия канцерогена у мышей VDR(-/-) образования опухолей не наблюдалось, но имел место прогрессирующий фенотип кожи, характеризующийся утолщенной морщинистой кожей, дермоидными кистами и длинными вьющимися когтями. Усиленная чувствительность мышей VDR(-/-) к химически индуцированному канцерогенезу кожи убедительно доказывает, что нарушение сигнализации VDR предрасполагает к неоплазиям, вызываемым ВПЧ [33].
Согласно гистопатологическому анализу поражений кожи, у мышей VDR(-/-) обнаружены 94 опухоли на коже, которые были классифицированы по гистологическим подтипам (рис. 3). Большинство всех опухолей (40%) были сальными папилломами (рис. 3А) – доброкачественными поражениями, которые связаны с волосяными фолликулами, сальными железами и межфолликулярной дермой. Кроме того, встречались плоскоклеточные папилломы (25% поражений, рис. 3Б) и фолликулярные папилломы (15% поражений, рис. 3В). Такие виды поражений, как базально-клеточная карцинома (рис. 3Г) и гемангиома (рис. 3Д), выявлялись гораздо реже. Пигментированные поражения, классифицированные как меланотические очаги, которые обычно отсутствуют в мышиной коже, наблюдались у мышей с делецией VDR(-/-) (11% поражений). Меланотические очаги (рис. 3Е) состояли из агрегатов сильно пигментированных клеток с плохо выраженными цитоплазматическими признаками [33].
Витамин D оказывает антипролиферативное и продифференцирующее действие на кератиноциты, поэтому были исследованы биопсии кожи мышей VDR(-/-) посредством количественного определения пролиферативного маркера BrdU. Во всех опухолях мышей VDR(-/-) уровни BrdU были выше, чем рядом в здоровой коже (рис. 4 и 5). В большинстве опухолей пролиферация клеток ограничивалась одним слоем. В других случаях (особенно при плоских папилломах) BrdU-положительные клетки были сгруппированы в несколько слоев. Данные показывают, что расширение опухоли связано с дальнейшим усилением пролиферации эпидермальных клеток у мышей с делецией гена рецептора витамина D [33].
В клинико-эпидемиологическом исследовании более высокое потребление кальция и витамина D ассоциировалось с уменьшением риска развития неоплазии шейки матки (n = 2430, в том числе 405 случаев цервикальной неоплазии). По сравнению с самым низким квартилем потребления кальция риск заболевания дозозависимо понижался в двух верхних квартилях на 14% (ОШ 0,86, 95% ДИ 0,63–1,17) и 50% (ОШ 0,50, 95% ДИ 0,34–0,73) соответственно (p = 0,004). Более высокое потребление витамина D независимо снижало риск заболевания на 20% в третьем (ОР 0,80, 95% ДИ 0,56–1,15) и 36% в четвертом квартиле (ОР 0,64, 95% ДИ 0,43–0,94, p = 0,013) [34].
Таким образом, противовирусное и противоопухолевое действие витамина D позволяет предположить, что повышение обеспеченности этим витамином улучшит результаты терапии опухолевых заболеваний шейки матки. Действительно, в рандомизированном плацебоконтролируемом исследовании долгосрочное применение витамина D индуцировало регрессию цервикальной интраэпителиальной неоплазии [35].
Женщины с диагнозом интраэпителиальной неоплазии первой степени (n = 58) были рандомизированы на прием 50 000 МЕ витамина D3 (n = 29) или плацебо (n = 29) каждые две недели в течение шести месяцев. Через шесть месяцев регресс заболевания был выше среди женщин, принимавших витамин D – 85% (в группе плацебо только 54%, p = 0,01). Дотации витамина D повышали его концентрацию в сыворотке – +12,3 ± 11,4 (в группе плацебо -0,1 ± 3,7 нг/мл, p
Читайте также:


