Вакцины вирусные и бактериальные
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы — возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
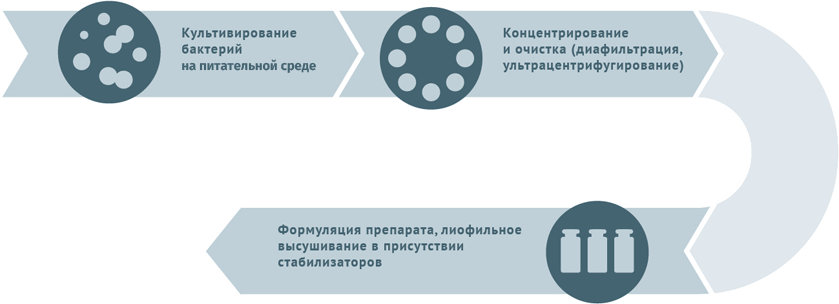
Схема подходит для вакцины БЦЖ, БЦЖ-М.
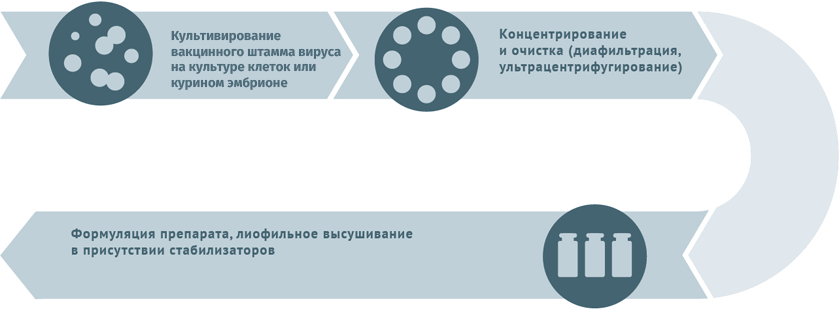
Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
- куриные эмбрионы;
- перепелиные эмбриональные фибробласты;
- первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков);
- перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293).
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
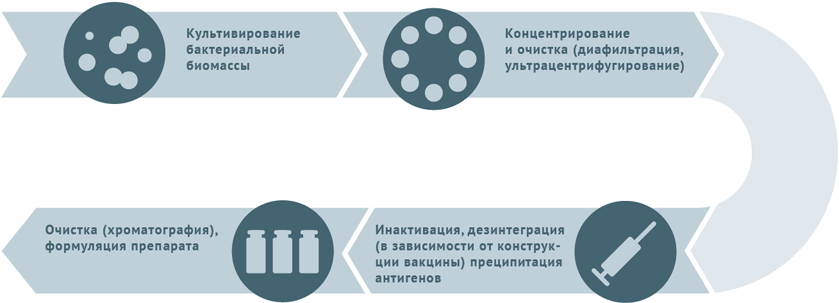
- Культивация и очистка штаммов бактерий.
- Инактивация биомассы.
- Для расщепленных вакцин клетки микробов дезинтегрируют и осаждают антигены с последующим их хроматографическим выделением.
- Для конъюгированных вакцин полученные при предыдущей обработке антигены (как правило, полисахаридные) сближают с белком-носителем (конъюгация).
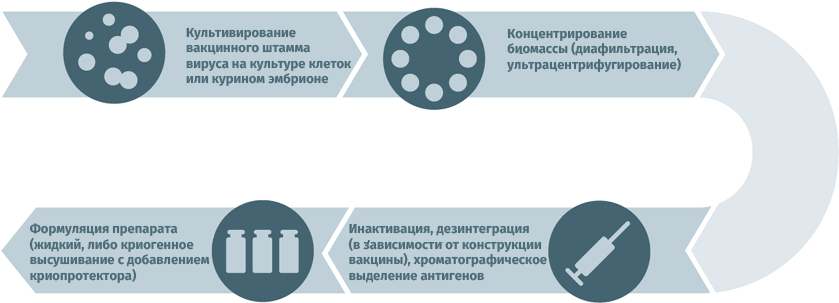
- Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться куриные эмбрионы, перепелиные эмбриональные фибробласты, первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков), перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293). Первичная очистка для удаления клеточного дебриса проводится методами ультрацентрифугирования и диафильтрации.
- Для инактивации используются ультрафиолет, формалин, бета-пропиолактон.
- В случае приготовления расщепленных или субъединичных вакцин полупродукт подвергают действию детергента с целью разрушить вирусные частицы, а затем выделяют специфические антигены тонкой хроматографией.
- Человеческий сывороточный альбумин применяется для стабилизации полученного вещества.
- Криопротекторы (в лиофилизатах): сахароза, поливинилпирролидон, желатин.
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
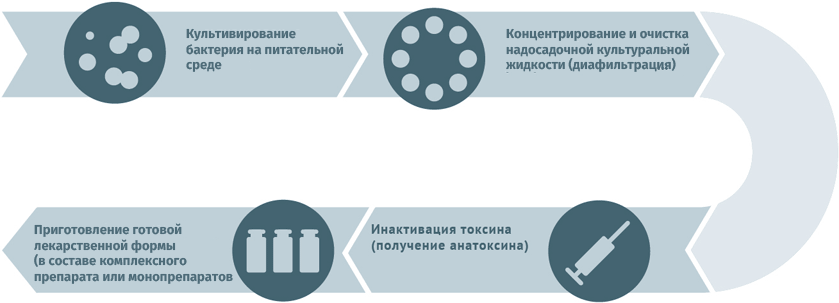
Для дезактивации вредного воздействия токсинов используют методы:
- химический (обработка спиртом, ацетоном или формальдегидом);
- физический (подогрев).
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вакцина "Менюгейт" зарегистрирована в России? С какого возраста разрешена к применению?
Отвечает Харит Сусанна Михайловна
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Вы абсолютно правы, если в контейнере был лед. Но если там была смесь воды и льда- вакцина не должна замерзать. Однако живые вакцины, к которым относится ротавирусная, не увеличивают реактогенность при температуре менее 0, в отличие от неживых, а, например, для живой полиомиелитной допускается замораживание до -20 град С.
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
В нашей стране уже очень долгая история использования многих вакцин – ведутся ли долгосрочные исследования их безопасности и можно ли ознакомиться с результатами воздействия вакцин на поколения людей?
Отвечает Шамшева Ольга Васильевна
За прошлый век продолжительность жизни людей возросла на 30 лет, из них 25 дополнительных лет жизни люди получили за счет вакцинации. Больше людей выживают, они живут дольше и качественнее за счет того, что снизилось инвалидность из-за инфекционных заболеваний. Это общий ответ на то, как влияют вакцины на поколения людей.
На сайте Всемирной Организации Здравоохранения (ВОЗ) есть обширный фактический материал о благотворном влиянии вакцинации на здоровье отдельных людей и человечества в целом. Отмечу, что вакцинация –это не система верований, это - область деятельности, опирающаяся на систему научных фактов и данных.
На основании чего мы можем судить о безопасности вакцинации? Во-первых, ведется учет и регистрация побочных действий и нежелательных явлений и выяснение их причинно-следственной связи с применением вакцин (фармаконадзор). Во-вторых, важную роль в отслеживании нежелательных реакций играют постмаркетинговые исследования (возможного отсроченного неблагоприятного действия вакцин на организм), которые проводят компании — владельцы регистрационных свидетельств. И, наконец, проводится оценка эпидемиологической, клинической и социально-экономической эффективности вакцинации в ходе эпидемиологических исследований.
Отвечает кандидат медицинских наук, медицинский директор по вакцинам кластера Северо-Восточной Европы и России (Евразия) фармацевтической компании Pfizer, Мария Сырочкина.
— Существует несколько видов возбудителей болезней: вирусы, бактерии, грибы и паразиты. Сегодня в арсенале врачей есть вакцины против трех разновидностей – противовирусные, противобактериальные, а сейчас появились еще и противопаразитарные.
Бактериальных инфекций, к которым относится и пневмококковая (или streptococcus pneumoniae), на самом деле достаточно много. Чем они отличаются от вирусных инфекций? Препаратов для лечения вирусных инфекций очень мало, и чаще всего единственное средство их предупреждения — вакцинация. Для бактериальных инфекций ситуация иная – есть антибиотики.
Вирус – это примитивный организм, одна из самых древних форм жизни на Земле. По сути, это кусок генетического кода – ДНК или РНК, и его самая главная задача – воспроизводиться. Бактерии – это более сложные организмы, уже вооруженные разными факторами защиты, однако биологическая или эволюционная задача бактерий – тоже самовоспроизводство.
Тем не менее, есть разные виды пневмококка, серотипы, которые, попадая к человеку, ведут себя иначе. Так возникают инвазивные пневмококковые инфекции, они протекают очень тяжело и с высокой угрозой для жизни хозяина.
Инвазия – это проникновение пневмококка за пределы носоглотки, попадание бактерии в исходно стерильные среды организма (кровь, ликвор, плевральную жидкость и т. д.), что может привести к таким тяжелым состояниям, как сепсис, бактериемия, плеврит; или в мозговые оболочки, вызывая пневмококковые менингиты.
Чаще пневмококк вызывает пневмонию (воспаление легких), пневмококковые отиты (воспаление среднего уха), наблюдаются также синуситы, гаймориты, пневмококковые конъюнктивиты (воспаление слизистой оболочки глаз).
Вакциноуправляемых инфекций сегодня становится все больше, поскольку развиваются молекулярная биология и биохимия, появляются новые вакцины. Мы лучше понимаем, как бактерии или вирусы действуют, и можем выбрать механизм противодействия им через обучение организма.
В начале XX века вакцины появлялись относительно быстро. Сегодня же этот процесс претерпел значительные изменения, в том числе, в связи с тем, что сейчас требования к безопасности вакцин – самые строгие в сфере фармацевтики. Фазы доклинических и клинических исследований для вакцин очень длительные и обширные по объему – в исследования вакцин включается большее количество людей, чем в испытания других препаратов.
В исследованиях второй фазы участвуют сотни людей, идет более четкая отработка дозировок и оценки того, как дальше вакцину регистрировать и лицензировать. Необходимо спрогнозировать, как будет вести себя вакцина, какой иммунный ответ она будет вызывать и достаточно ли этого ответа для защиты от инфекций без нарушения нормального процесса жизнедеятельности.
Именно тогда изучают поствакцинные реакции, разделяя их на группы: легкие, среднетяжелые и тяжелые. Этот этап занимает в среднем два-три года. Третья фаза уже подразумевает участие тысяч, а иногда – десятков тысяч людей, она длится минимум пять лет.
Таким образом, современный процесс разработки вакцин, от возникновения идеи, что взять в качестве вакцины, до момента регистрации занимает в среднем 10–15 лет. Это обусловлено, в том числе, тем, что, если, например, у онкологических препаратов есть то, что считается терпимым или допустимым побочным эффектом или нежелательным явлением, то вакцину в случае появления такого эффекта дальше просто не пропустят.
Вакцины в принципе предназначены для здоровых людей и должны быть максимально безопасны.
Помимо оценки эффективности и иммуногенности вакцины обязательно параллельно идет процесс отработки производства. Вакцины выпускаются десятками и сотнями тысяч доз, и нужно быть уверенными, что в каждой дозе содержится строго определенное количество антигенного (активного) материала, и каждая доза будет вызывать предсказуемый и ожидаемый иммунный ответ.
Лицензируется не только сама вакцина как таковая, но обязательно и процесс производства, и, если происходят какие-то изменения в этом процессе, приходится возвращаться на этап доклинических исследований или на первую фазу клинических.
Бывает такое, что третья фаза уже проведена, исследования идут восемь или девять лет, но было обнаружено, что что-то в процессе производства не позволяет выйти на стабильный процесс – тогда нужна реформуляция, и приходится возвращаться на исходную точку.
О популярных мифах, связанных с вакцинами, а также о том, почему вакцинация нужна не только детям, но и взрослым, читайте в следующем материале.

Все вакцины подразделяются на живые и инактивированные. Инактивированные вакцины, в свою очередь, делят на:
- представляют собой бактерии или вирусы, инактивированные химическим (формалин, спирт, фенол) или физическим (тепло, ультрафиолетовое облучение) воздействием. Примерами корпускулярных вакцин являются: коклюшная (как компонент АКДС и Тетракок), антирабическая, лептоспирозная, гриппозные цельновирионные, вакцины против энцефалита, против гепатита А (Аваксим), инактивированная полиовакцина (Имовакс Полио, или как компонент вакцины Тетракок).
- создаются из антигенных компонентов, извлеченных из микробной клетки. Выделяют те антигены, которые определяют иммуногенные характеристики микроорганизма. К таким вакцинам относятся: полисахаридные вакцины (Менинго А+С, Акт-ХИБ, Пневмо 23, Тифим Ви), ацеллюлярные коклюшные вакцины.
- для производства этих вакцин применяют рекомбинантную технологию, встраивая генетический материал микроорганизма в дрожжевые клетки, продуцирующие антиген. После культивирования дрожжей из них выделяют нужный антиген, очищают и готовят вакцину. Примером таких вакцин может служить вакцина против гепатита В (Эувакс В).
вакцины выпускают как в сухом (лиофилизированном), так и в жидком виде.
Живые вакцины изготовляют на основе ослабленных штаммов микроорганизма со стойко закрепленной авирулентностью (безвредностью). Вакцинный штамм, после введения, размножается в организме привитого и вызывает вакцинальный инфекционный процесс. У большинства привитых вакцинальная инфекция протекает без выраженных клинических симптомов и приводит к формированию, как правило, стойкого иммунитета. Примером живых вакцин могут служить вакцины для профилактики краснухи (Рудивакс), кори (Рувакс), полиомиелита (Полио Сэбин Веро), туберкулеза, паротита (Имовакс Орейон).
Живые вакцины выпускаются в лиофилизированном (порошкообразном) виде (кроме полиомиелитной).
Эти препараты представляют собой бактериальные токсины, обезвреженные воздействием формалина при повышенной температуре с последующей очисткой и концентрацией. Анатоксины сорбируют на различных минеральных адсорбентах, например на гидроокиси алюминия. Адсорбция значительно повышает иммуногенную активность анатоксинов. Это связано как с созданием "депо" препарата в месте введения, так и с адъювантным действием сорбента, вызывающего местное воспаление, усиление плазмоцитарной реакции в регионарных лимфатических узлах. Анатоксины обеспечивают развитие стойкой иммунологической памяти, этим объясняется возможность применения анатоксинов для экстренной активной профилактики дифтерии и столбняка.
- живые вакцины (грипп, корь, эпидемический паротит, полиомиелит, сибирская язва, туберкулез, лихорадка Ку, туляремия, чума, бруцеллез);
- убитые (инактивированные) вакцины (бешенство, брюшной тиф, грипп, клещевой энцефалит, коклюш, холера, лептоспироз, сыпной тиф, герпес);
- химические вакцины (менингококковая инфекция, холера, брюшной тиф);
- анатоксины (дифтерия, столбняк, ботулизм);
- рекомбинантные вакцины (гепатит В).
Кроме основного действующего начала в состав вакцин могут входить и другие компоненты - сорбент, консервант, наполнитель, стабилизатор и неспецифические примеси. К последним могут быть отнесены белки субстрата культивирования вирусных вакцин, следовое количество антибиотика и белка сыворотки животных, используемых в ряде случаев при культивировании клеточных культур.
Консерванты входят в состав вакцин, производимых во всем мире. Их назначение состоит в обеспечении стерильности препаратов в тех случаях, когда возникают условия для бактериальной контаминации (появление микротрещин при транспортировке, хранение вскрытой первичной многодозной упаковки). Указание о необходимости наличия консервантов содержится в рекомендациях ВОЗ.
Что касается веществ, используемых в качестве стабилизаторов и наполнителей, то в производстве вакцин используются те из них, которые допущены для введения в организм человека.
Ампулы и другие емкости с неиспользованными остатками инактивированных бактериальных и вирусных вакцин, а также живой коревой, паротитной и краснушной вакцин, анатоксинов, иммуноглобулинов человека, гетерологичных сывороток, аллергенов, бактериофагов, эубиотиков, а также одноразовый инструментарий, который был использован для их введения не подлежит какой-либо специальной обработке.
Емкости, содержащие неиспользованные остатки других живых бактериальных и вирусных вакцин, а также инструментарий, использованный для их введения, подлежат кипячению в течение 60 минут (сибиреязвенная вакцина 2 ч), или обработке 3-5% раствором хлорамина в течение 1 ч, или 6% раствором перекиси водорода (срок хранения не более 7 сут) в течение 1 ч, или автоклавируются.
Все неиспользованные серии препаратов с истекшим сроком годности, а также не подлежащие применению по другим причинам следует направлять на уничтожение в районный (городской) центр санэпиднадзора.
Клещевой энцефалит (энцефалит весенне-летнего типа, таежный энцефалит) -вирусная природно-очаговая инфекция, передающаяся клещами, протекающая с лихорадкой, интоксикацией, поражением нервной системы, принимающая иногда хроническое течение.
В природе основным переносчиком вируса клещевого энцефалита являются иксодовые клещи, ареал обитания которых находится по всей лесной и лесостепной умеренной климатической зоне Евразийского континента. Для клещевого энцефалита характерна строгая весенне-летняя сезонность, связанная с сезонной активностью переносчиков. Инфицирование человека вирусом клещевого энцефалита происходит во время присасывания энцефалитных клещей. Передача вируса клещевого энцефалита возможна и через желудочно-кишечный тракт при приёме сырого молока коз, зараженных клещевым энцефалитом.
Вы можете сделать прививку отечественной вакциной и вакциной ФСМЕ-ИММУН Инжект (пр-во Австрия).
Иммунизация отечественной вакциной состоит из 2х курсов внутримышечных инъекций по 1 дозе (0,5 мл) с интервалом в 7 месяцев. Курс вакцинации (2 прививки) можно проводить в течение всего года, в том числе и в летний период (эпидсезон), но не позднее, чем за 2 недели до посещения очага клещевого энцефалита. Наиболее оптимальным является интервал между 1-й и 2-й прививками 5-7 мес.(осень-весна). Ревакцинацию проводят 1 кратно в дозе 0,5 мл через 1 год после завершения курса вакцинации. Последующие отдаленные ревакцинации проводят каждые 3 года однократно.
- 1я прививка- 0,5мл в 1й день
- 2я прививка-0,5мл через 1-3 мес.
- 3я прививка-0,5мл через 9-12 мес. после 2й прививки. Обычно, вакцинацию назначают детям с 12-ти месяцев и старше. В течение первого года жизни вакцинацию следует проводить в исключительных случаях риска заражения вирусом клещевого энцефалита.
Ревакцинация - 1 инъекция вакцины необходима через каждые 3 года после последней прививки.
После введения вакцин, как отечественной, так и австрийской, в отдельных случаях могут развиваться местные и общие реакции. Местные реакции выражаются в покраснении, припухлости, болезненности в месте введения, развитии инфильтрата. Возможно небольшое увеличение регионарных лимфоузлов. Продолжительность местных реакций не превышает 3 суток. Общие реакции могут развиваться в первые 2 суток после вакцинации и выражаются в подъёме температуры, головной боли, недомогании, их продолжительность не превышает 48 часов. После второй вакцинации лихорадка наблюдается очень редко, может появляться кратковременная сыпь, сопровождаемая зудом (крайне редко).
Дачники, охотники, рыбаки, и все, все, все - болезнь проще предупредить (сделать прививку от клещевого энцефалита), чем лечить её.
которая характеризуется острым началом, выраженной токсической реакцией (озноб, повышение температуры тела до 39,00 и выше, скудными катаральными явлениями - насморк, боль в горле), суставными и мышечными болями, кашлем.
При тяжелом течении гриппа могут возникнуть необратимые поражения сердечно - сосудистой, дыхательной и центральной нервной систем.
Тяжесть болезни зависит от общего состояния организма, возраста (наиболее уязвимы дети, беременные женщины, люди пожилого возраста), бытовых условий (в плохо проветриваемых, пыльных помещениях создаются идеальные условия для размножения вируса гриппа). Вирус гриппа очень легко передается.
Самый распространенный путь передачи инфекции - воздушно-капельный. Также возможен и бытовой путь передачи, например, через предметы обихода. При кашле, чихании, разговоре из носоглотки больного или вирусоносителя выбрасываются частицы слюны, слизи, мокроты с болезнетворной микрофлорой. Вокруг больного образуется зараженная зона с максимальной концентрацией аэрозольных частиц. Дальность их рассеивания обычно не превышает 2-3 м.
Основным методом профилактики гриппа является активная иммунизация-вакцинация. Вирус, содержащийся в вакцине, стимулирует организм к выработке антител, которые предотвращают размножение вирусов и инфицирование клетки. Благодаря этому заболевание предупреждается еще до его начала. Конечно, вакцинация не дает 100%- ной гарантии, что вы не заболеете, однако если такое произойдет, то вы должны легче перенести болезнь, и такие грозные осложнения гриппа, как пневмония, менингоэнцефалит, миокардит - вам не страшны.
Вакцинацию лучше проводить осенью, поскольку эпидемии гриппа в классическом их варианте бывают между ноябрем и мартом. Высокий титр антител, вызванный прививкой, держится несколько месяцев и начинает снижаться спустя 6 месяцев после вакцинации.
Принципиального отличия между этими вакцинами нет. Опыт применения вакцин у беременных женщин ограничен. Тем не менее, имеющийся опыт показывает, что данные вакцины не оказывают тератогенного или токсического действия на плод.
Вакцинацию можно проводить беременным женщинам, начиная со 2-го триместра беременности. Перед вакцинацией обязательно нужно посетить терапевта, который после осмотра, исключающего у вас наличие противопоказаний для вакцинации, порекомендует ту или иную вакцину.
Да (в случае микоплазмы)
Источник: презентация Пирет Калмус. XII Международный молочный конгресс, 5−6 марта, 2019
Вакцинация против респираторно-синцитиального вируса
Если респираторно-синцитиальный вирус вызывает заболевание у маленьких телят (нашли вирус или увидели изменения в сыворотке крови), то прежде всего ограничьте передачу вируса в стаде и уменьшите инфекционное давление. Источником инфекции могут быть коровы, поэтому телят следует отделить от них сразу после отела. В случае заболевания ежедневно измеряйте температуру тела всех телят, хотя это и требует много времени. Как правило, быстро наслаивается вторичная бактериальная инфекция, и практически всегда на респираторно-синцитиальный вирус. Поэтому нужно немедленно лечить больных телят антибиотиками и начать программу вакцинации после того, как все возможные условия содержания улучшены. Очень важное время вакцинации. Телят необходимо иммунизировать как можно раньше — на четвертый-пятый день жизни. Обязательно читайте инструкцию к вакцине. Важно знать, как быстро происходит иммунный ответ, как долго длится иммунная защита.
Материнский иммунитет тормозит развитие активного иммунитета при системной вакцинации. Цель состоит в том, чтобы повысить концентрацию уровня IgA слизистой оболочки. В Эстонии в этот период используют интраназальные живые вакцины, ведь путем распространения является носовая полость, где и нужно выстроить защиту.
Когда вакцинируем внутримышечно или подкожно, надо учитывать риск остаточного колострального иммунитета. Остаточные колостральные антитела уменьшают эффект вакцины, так уменьшают количество антигенов. Теоретически можем рассчитать, до какого времени продлится колостральный иммунитет (посчитать антитела), но практически это нереально.
Признаки респираторно-синцитиальной инфекции заметны рано из-за того, что защиты колостральных антител недостаточно. И, конечно, действие вакцины зависит от инфекционного давления на телят. Вакцинация будет эффективной, если она является частью общей программы здоровья стада. Телят нужно защитить на ранних стадиях жизни.
Вакцинация против инфекцийного ринотрахеита (ИРТ)
ИРТ вызывает респираторные заболевания телят в возрасте 2−6 месяцев. Если он является основной причиной заболевания телят в стаде, наблюдаются клинические признаки у животных, которым более двух месяцев, в Эстонии, как правило, используют программу эрадикации ринотрахеита. Она предусматривает использование маркированной живой вакцины и анализ животных после убоя. Эстония хочет быть свободной от ринотрахеита страной, поэтому дважды в год вакцинируем всех животных, которым более трех месяцев. Разрабатываем программу вакцинации для конкретного хозяйства. После этого делаем серологический анализ и 10% серопозитивных животных выбраковываем. Вакцинация не полностью исключает циркуляцию вируса, но значительно уменьшает ее. Другие меры управления и контроля нужно применять первыми.
В Эстонии доступна только маркированная вакцина. Используя ее, можем потом дифференцировать антитела — против возбудителя или вакцинного штамма. Мы используем программу вакцинации в неблагополучном стаде. Когда оно становится благополучным, прекращаем ее. Как правило, она длится 4−7 лет в зависимости от распространенности болезни.
Вирусная диарея КРС
Вирус связан с плохой резистентностью, плохим состоянием иммунной системы телят. Он опасен, потому что приводит к бактериальным, паразитарным и другим инфекциям. Этот вирус является иммуносупрессором. Чтобы избавиться от заболевания, в Эстонии домашних животных не вакцинируют, а используют программу эрадикации.
Если в стаде есть вирусная диарея, исследуем всех телят, которым более двух недель, методом полимеразной цепной реакции (ПЦР). Цель исследований — выявить и выбраковать персистентно инфицированных животных. Как правило, их в стаде немного, но это те животные, которые сохраняют и распространяют живой вирус в стаде. Когда вы можете найти и удалить этих животных, это дает возможность очистить стадо. После выбраковки последнего больного животного проверяйте телят менее года. Программа ликвидации длится 2−3 года. Она недешевая, но жить с вирусом в стаде гораздо дороже.
Мы можем использовать программу вакцинации тогда, когда слишком высокое давление инфекции в стаде. Ее цель — предотвратить рождение персистентно инфицированных телят. То есть предотвратить инфицирование во внутриутробный период. Вакцинировать животных следует перед осеменением. Но даже в таком случае нужно проявлять и выбраковывать персистентно инфицированных животных. В Эстонии очень редко применяют вакцинацию против вирусной диареи.
Итак, возвращаемся к главному:
— качественно управляйте молозивом, потому что это важнейший источник хорошего иммунного статуса телят;
— улучшайте условия содержания;
— уменьшайте риск инфекций в группах: быстро отделяйте зараженных телят от здоровых;
— вовремя лечите больных телят (антибиотики, нестероидные противовоспалительные препараты);
— начинайте программу вакцинации, когда уверены, что болезнь вызывает вирус респираторно-синцитиальной инфекции или вирусная диарея.
Пример 2. Диарея телят
Для нее характерны тяжелые клинические признаки, в частности водянистый понос в очень ранние периоды — первые два дня жизни. Часто диарея регистрируется между десятым и четырнадцатым днем и даже через месяц после рождения (см. фото 3−5).
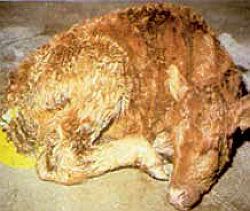 |  | 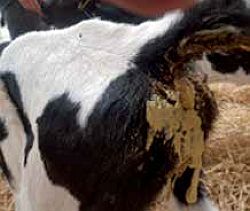 |
| Фото 3. | Фото 4. | Фото 5. |
Опять возвращаемся к определению проблемы: если в стаде диарея, вопрос — в какой возрастной группе? Диарею вызывают практически все возбудители (см. Таблицу 2).
Таблица 2. Типичный возраст телят, когда их могут поразить перечисленные патогены*
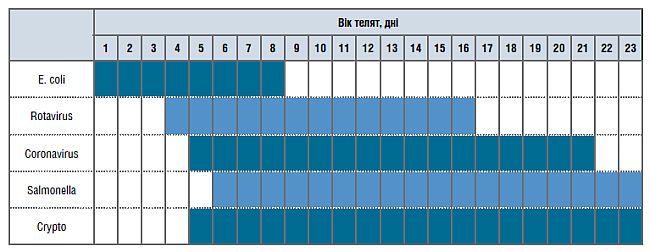
*Другие возбудители инфекций, такие как Coccidia, BVDV, Clostridium perfringens, также могут поражать телят в возрасте 3−4 недели.
Источник: презентация Пирет Калмус. XII Международный молочный конгресс, 5−6 марта, 2019
Первоочередной причиной ранней диареи является E. coli. Она вызывает колисептицимию. В более позднем возрасте (например, через две недели) животных поражает Rotavirus, Coronavirus, Cryptosporidium. Основной причиной диареи у эстонских телят является Cryptosporidium. Ее трудно удалить, потому что она очень устойчива к дезинфектантам. Единственный способ борьбы — применить все меры контроля и профилактики: улучшить управление молозивом и условия содержания, отделить больных телят, провести дезинфекцию и быстрее лечить.
Правильно лечить диарею означает использовать не антибиотики, а регидратационную терапию и нестероидные противовоспалительные препараты. Но и здесь надо знать диагноз, чтобы разработать правильные меры. Важный отбор образцов. На ранней стадии инфицирования можно сделать быстрый анализ, чтобы определить Rotavirus, Coronavirus или E. coli. В случае септицемии можем отправить патматериал в лабораторию на определение чувствительности к антибиотикам.
Диагноз помогает решить, какие вакцины использовать. Вакцинировать следует коров позднего сухостоя и нетелей. Обычно в молозиве первого и второго доения есть достаточное количество антител. Уровень антител резко падает ниже защитного уровня через 24−48 ч. после отела. В моей практике была одна ферма, которая вакцинировала против рота и коронавируса, но неправильно выпаивали молозиво.
Соответственно, результата не было. Поэтому рекомендуем кормить телят сборным молозивом от привитых коров с молоком в течение 3−4 недель жизни в соотношении 1:10. Скармливайте молозиво, собранное за 6−8 доений. Вакцинация повышает уровень антител, и они дольше хранятся в молозиве. В Эстонии используют только инактивированные рта-, коронавирус, E. coli F5 (K99) вакцины. Прививают коров и нетелей за 12−3 недели до отела, ревакцинируют в ближайшие годы — за 4 недели до отела. Вместе с тем следует уделять внимание окружающей среде.
Исследование результатов вакцинации показали уменьшение смертности телят. Но животных следует вакцинировать, если вы уверены, что причиной болезни является рота, корона-вирус или E. coli, и нет других путей избежать поражения этими патогенами. Преимущественно все проблемы, связанные с диареей, исчезают, когда телят содержат в надлежащих условиях и дают хорошее молозиво.
К сожалению, остается криптоспоридиоз, против которого все-таки не можем прививать телят. Это огромная проблема в Эстонии.
Инфекционный статус стада
Сначала сделайте анализ сборного молока на антитела к инфекционному ринотрахеиту и вирусной диареи, только при условии, что вы не вакцинируете животных. Если результат положительный, выберите телок для тестирования — старше 12-месячного возраста, иначе могут оставаться колостральные антитела. Количество образцов зависит от распространенности ИРТ в стаде, но обычно в больших стадах берут 20−60 образцов. На их основе считайте, какая распространенность болезни.
Что касается вирусной диареи, достаточно взять 10 образцов сыворотки крови. Если 7 из 10 положительные, в стаде есть персистентно инфицированные животные, которые распространяют вирус. В таком случае мы должны отбирать больше образцов, чтобы определить, в какой группе есть персистентно инфицированное животное, и начать программу эрадикации. Для определения состояния стада можно использовать исследования сборного молока. Эта методика и дает ценную информацию.
В Эстонии используют интраназально живую вакцину против инфекционного ринотрахеита и парагриппа. В случаях инфекционного ринотрахеита используем только маркированную живую вакцину, потому что нет других доступных. Иногда вакцинируем от рота, коронавируса, эширихии коли.
В некоторых стадах используем вакцинацию против трихофитии. Нужно поставить правильный диагноз, потому что вакцина защищает только от Trichophyton verrucosum, а не Microsporum spp.
Почему вакцины не дают желаемого результата
Причин много. Неизвестно, способны ли животные одинаково хорошо реагировать на комбинированные антигены, которые вводятся одновременно. Или определенные антигены мешают или отрицательно влияют на реакцию на другие введенные антигены.
Эффективность вакцины также зависит от индивидуальных факторов животных — болезнь и стресс. Животное под влиянием стресса имеет повышенную восприимчивость ко всем патогенам (облигатные и условно-патогенные). На результат будут влиять также уровень инфекционного давления окружающей среды, условия хранения вакцин, дозировка, введение, время вакцинации и ревакцинации.
А главное — действительно ли в стаде есть инфекция, против которой прививаем. В Эстонии немало ферм, где вакцинируют, не зная причины заболевания. Трудно определить причину болезни, когда вакцинация уже начата. Помните: плохой менеджмент и плохое здоровье животных вакцинацией не исправишь никогда.
Выводы
Вакцинация — это лишь один из компонентов хорошо структурированной программы здоровья стада. Если отсутствует надлежащая биобезопасность (между стадами) и биозащита (в стаде), надлежащее кормление, а также управление экологическими условиями и другими факторами, которые вызывают стресс, любая хорошо спланированная программа вакцинации может быть неэффективной. Вакцины эффективны и поддерживают здоровье стада и производительность там, где есть надлежащее управление.
Читайте также:


