В чем проявляются действие вирусов на клетку
Вопрос 1. Как устроены вирусы?
Вирусы — это неклеточная форма жизни. Они имеют очень простое строение. Каждый вирус состоит из нуклеиновой кислоты (РНК или ДНК) и белка. Нуклеиновая кислота представляет собой генетический материал вируса; она окружена защитной оболочкой — капсидом. Капсид состоит из белковых молекул и обладает высокой степенью симметрии, имея, как правило, спиральную или многогранную форму. Кроме нуклеиновой кислоты внутри капсида могут находиться собственные ферменты вируса. Примером может служить вирус табачной мозаики
(рис. 3).
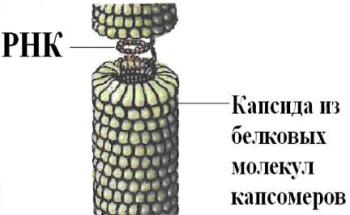
Рис.3. Вирус табачной мозаики
Его оболочка содержит всего один вид белка с небольшой молекулярной массой.
Сложно организованные вирусы имеют дополнительную оболочку, белковую или липопротеиновую. Иногда в наружных оболочках сложных вирусов помимо белков содержатся углеводы. Примером сложно организованных вирусов служат возбудители гриппа (рис. 4) и герпеса (рис. 5).
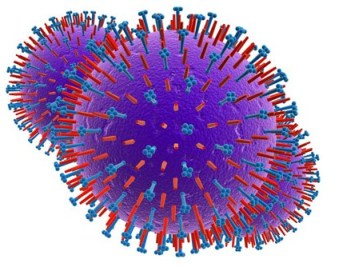
Рис.4. Вирус гриппа и вирус герпеса
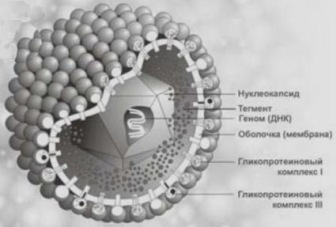
Рис.5. Вирус герпеса
Их наружная оболочка является фрагментом ядерной или цитоплазмптической мембраны клетки-хозяина, из которой вирус выходит во внеклеточную среду. К сложноорганизованным вирусам относятся вирусы гриппа и ВИЧ, они также имеют дополнительную оболочку, образованную из клеточной мембраны хозяина.
Вопрос 2. Каков принцип взаимодействия вируса и клетки?
Вирус функционирует как внутриклеточный паразит. Он внедряется в клетку, блокирует в ней обмен веществ и использует ее ресурсы (ферменты, запасные вещества) для собственного размножения. Некоторые вирусы способны встраиваться в ДНК хозяина и переходить в скрытое состояние, в течение длительного времени никак не выдавая своего присутствия. В такой форме вирусы даже способны передаваться потомству хозяина.
Вопрос 5. Используя знания о путях распространения вирусных и бактериальных инфекций, предложите пути предотвращения инфекционных заболеваний.
Если заболевание широко распространено на данной территории, целесообразно провести вакцинацию населения. Необходим постоянный медицинский контроль, чтобы быстро обнаружить вспышку заболевания и предотвратить его распространение. Многие инфекции передаются воздушно-капельным путем (например, вирус гриппа). Во время вспышек таких заболеваний имеет смысл использовать ватномарлевые повязки или респираторы.
Есть возбудители заболеваний, которые передаются через предметы обихода, пищу и воду. К ним относятся вирус гепатита А, холерный вибрион, чумная палочка и многие другие. Чтобы избежать заражения, необходимо соблюдать правила личной гигиены: мыть руки перед едой, не пользоваться чужими личными вещами (полотенцем, зубной щеткой), мыть фрукты и овощи, избегать контакта с больными. Необходим постоянный санитарный контроль состояния источников воды и пищевых продуктов, а также дезинфекция помещений, стерилизация инструментов и перевязочного материала.
Существуют заболевания, передающиеся через кровь и другие жидкости тела, в частности ВИЧ и вирус гепатита С. В группы риска по таким заболеваниям попадают наркоманы (часто шприцы используются больше одного раза) и лица, практикующие беспорядочные незащищенные половые контакты. Пока не существует эффективных методов лечения таких заболеваний, поэтому лучшим способом защиты является соблюдение следующих мер предосторожности:
• следует избегать случайных половых связей, а при контактах изолировать себя при помощи презерватива;
• в медицине и косметологии необходимо использовать одноразовые шприцы и тщательно стерилизовать инструменты многоразового использования;
• донорскую кровь следует обязательно проверять на наличие вирусов.
Подробное решение страница стр.189 по биологии углубленный уровень для учащихся 10 класса, авторов Захаров В.Б., Мамонтов С.Г. Углубленный уровень 2015
ВОПРОСЫ И ЗАДАНИЯ ДЛЯ ПОВТОРЕНИЯ
Вопрос 1. Как устроены вирусы?
Вирусы — это неклеточная форма жизни. Они имеют очень простое строение. Каждый вирус состоит из нуклеиновой кислоты (РНК или ДНК) и белка. Нуклеиновая кислота представляет собой генетический материал вируса; она окружена защитной оболочкой — капсидом. Капсид состоит из белковых молекул и обладает высокой степенью симметрии, имея, как правило, спиральную или многогранную форму. Кроме нуклеиновой кислоты внутри капсида могут находиться собственные ферменты вируса. Некоторые вирусы (например, вирус гриппа и ВИЧ) имеют дополнительную оболочку, образованную из клеточной мембраны хозяина.
Вопрос 2. Чем простые вирусы отличаются от сложных?
Простые вирусы представляют собой нуклеопротеиды, т. е. состоят из одной нуклеиновой кислоты ДНК или РНК и нескольких белков, образующих оболочку вокруг нуклеиновой кислоты. Белковая оболочка вируса называется капсидом. Примером такого вируса может служить вирус табачной мозаики. Его капсид содержит один белок с низкой молекулярной массой.
Сложноорганизованные вирусы имеют дополнительную оболочку - белковую или липопротеиновую. Иногда в наружных оболочках сложных вирусов помимо белка содержатся углеводы, например у вирусов герпеса и гриппа. Их наружная оболочка является фрагментом цитоплазматической мембраны клетки хозяина.
Вопрос 3. Каков принцип взаимодействия вируса и клетки?
Вирусы являются внутриклеточными паразитами. Проникновение вирусов в клетку основано на рецепторных механизмах взаимодействия.
Участок поверхности клеточной мембраны, к которому прикрепляется вирус, погружается а цитоплазму и превращается в вакуоль, которая может сливаться с ядерной мембраной.
Инфекционный процесс начинается, когда проникшие в клетку вирусы начинают размножаться, т. е. происходит редупликация вирусного генома и самосборка капсида. После синтеза новой молекулы нуклеиновой кислоты вируса она одевается синтезированными в цитоплазме клетки хозяина вирусными белками - образуется капсид.
Выход вирусных частиц в окружающую среду может сопровождаться разрушением клетки.
Вопрос 4. Как вирус проникает в клетку?
Вопрос 5. Укажите особенности взаимодействия бактериофага с бактериальной клеткой.
Проникновение бактериофагов в бактериальную клетку имеет некоторые особенности, так как бактериальные клетки имеют толстую клеточную стенку, вирус не может проникнуть в цитоплазму путем впячивания мембраны. Поэтому бактериофаг вводит полый стержень в клетку и через него выталкивает нуклеиновую кислоту в цитоплазму. Геном бактериофага попадает в клетку.
Вопрос 6. В чём проявляется действие вирусов на клетку?
Генетический материал вируса взаимодействует с ДНК хозяина таким образом, что клетка сама начинает синтезировать необходимые вирусу белки. Одновременно происходит копирование нуклеиновых кислот паразита. Через некоторое время в цитоплазме хозяина начинается самосборка новых вирусных частиц. Эти частицы покидают клетку постепенно, не вызывая ее гибели, но изменяя работоспособность, либо выходят одновременно в большом количестве, что приводит к разрушению клетки.
ВОПРОСЫ И ЗАДАНИЯ ДЛЯ ОБСУЖДЕНИЯ
Вопрос 1. Чем горизонтальный путь передачи вирусной инфекции отличается от вертикального? Приведите примеры.
Различают механизм передачи возбудителя инфекции горизонтальный и вертикальный. Горизонтальный– это механизм передачи, связанный с выходом возбудителя во внешнюю среду. Он свойственен большинству инфекционных болезней. Горизонтальный путь передачи инфекций может быть осуществлен во время хирургической операции, проведении противоэпизоотических мероприятий через инструменты и предметы, контаминированные микробами (так называемые ятрогенные инфекции).
Вертикальный – это механизм передачи возбудителя от родителей потомству через плаценту, с молоком, через яйцеклетку. Этот механизм свойственен чаще вирусным инфекциям, например, лейкоз, инфекционный ринит свиней, встречается и при бактериозах – сальмонеллезе, пуллорозе, колибактериозе, микоплазмозе.
Вопрос 2. Как происходит синтез вирусных белков и упаковка новых вирусных частиц?
Полиомиелит и оспа, синдром приобретенного иммунодефицита человека и герпес – всем известные заболевания, вызванные специфическими возбудителями. Это вирусы – иждивенцы клеток, стоящие на границе живого и неживого. В чем проявляется действие вирусов на клетку, как они были открыты и каковы способы борьбы и профилактики данной группы заболеваний – тема данной статьи.
Рождение вирусологии
В 1892 году в лаборатории Никитского ботанического сада при Академии наук России молодой ученый Дмитрий Иосифович Ивановский (1864-1920) установил, что мозаичная болезнь табака вызвана возбудителем, который проходит через бактериальные фильтры, не растет, как бактерии, на искусственных средах и не дает картины заболевания через фильтраты.
Именно эту дату принято считать рождением науки о вирусах, хотя их первооткрыватель так и не смог их увидеть на протяжении своей жизни. Мы увидели их лишь в 30-х годах прошлого столетия, когда появились электронные микроскопы.

Отдельное царство
Вирусы настолько удивительны, что выделены в отдельное царство Vira (от лат. virus, яд). Как устроены вирусы, что они так отличаются от всех живых организмов на нашей планете? Во-первых, они содержат только один тип нуклеиновых кислот – либо ДНК, либо РНК. Все остальные организмы в своих клетках имеют оба типа.
Во-вторых, у вирусов отсутствует клеточное строение и белоксинтезирующие системы. В-третьих, вирусы распространены убиквитарно (повсеместно) и имеют очень малые размеры. И самое главное – это внутриклеточные паразиты на генетическом (молекулярном) уровне.
Вирион и вирус
Классификация и структура вирусов разнообразна в различных источниках. Сегодня изучено и описано порядка тысячи вирусов человека, но это далеко не полный их перечень. Ведь мы начинаем их изучение исключительно в контексте заболевания. Внеклеточная форма существования этих паразитов – вирион. Когда таковой попадает в клетку, механизм проникновения вируса превращает его в совершенно другую форму. И именно тогда мы говорим о вирусной инфекции.

Размер и форма имеют значение
Размеры вирионов измеряются в нанометрах (10 -9 метра). Одни из самых мелких – вирусы полиомиелита – имеют размер вириона 17 нанометров. Вирусы гриппа – средних размеров, от 80 до 120 нанометров. Но есть и гиганты – вирус оспы имеет размер порядка 400 нанометров.
Живые или нет?
На этот вопрос однозначного ответа нет даже у вирусологов. Если живой считать систему, способную воспроизводить себе подобных, то вирусы - живые организмы. Если же к этому добавить хоть какие-то процессы жизнедеятельности – то они не живые. Кроме того, следует помнить, что они не воспроизводят себя вне клетки-хозяина.
Действие вируса на клетку
Вирусы взаимодействуют с клетками по двум типам сценария, принципиальные отличия которых - в степени зависимости паразита от хозяина. Он полностью зависит от энергетического и белоксинтезирующего хозяйства клетки, но ведет себя самостоятельно.
В чем проявляется действие вирусов на клетку? В репликации вирусных нуклеиновых кислот по собственному расписанию. Такой сценарий называют продуктивным, конечно, с точки зрения паразита. И он может закончиться гибелью клетки-хозяина.
Второй сценарий – соглашательный. В этом случае геном вируса включается в геном хозяина и ковалентно реплицируется с клеточными нуклеиновыми кислотами. Развитие того, в чем проявляется действие вирусов на клетку, дальше может пойти двумя путями. Либо вирус ведет себя тихо, и только при определенных условиях его гены начинают работать, и из погибающей клетки выходят молодые вирионы в поиске новых жертв. Либо гены вируса постоянно работают и производят молодое поколение, но клетка не погибает.
Во внешнюю среду молодые вирусы попадают либо в результате разрушения клетки-хозяина, либо с выталкиванием фрагментов цитоплазмы, либо путем экзоцитоза небольших групп вирионов.

Везде и всюду
Как уже говорилось, вирусы встречаются повсеместно. Но есть и нюансы. Так, вирионы с хвостом паразитируют преимущественно в клетках бактерий. Вирионы в виде нитки или спирали встречаются чаще в клетках растений, ведь именно они имеют плотные целлюлозные оболочки, которые как шприцом протыкают хвостом вирионы. К слову, появление полосок на цветках тюльпанов часто связано с заражением растений вирусами. А ведь нам продают их как особый сорт!

Как они попадают в организм хозяина
Самый распространенный способ – воздушно-капельный путь заражения. Миллиарды мельчайших капелек жидкости выбрасываются в окружающее пространство при кашле, чихании и просто при дыхании. При высокой вирулентности (заразности) возбудителя предотвратить распространение инфекции очень сложно.
Другой путь заражения – контагиозный, при непосредственном физическом контакте. Это небольшая группа вирусных заболеваний, а именно герпес, СПИД и венерические инфекции.
Довольно опасный способ заражения – через переносчиков. Им может стать любой живой организм, получивший инфекцию от резервуара или носителя. В таком случае переносчик становится промежуточным хозяином, в клетках которого патогенный агент может размножаться или даже проходить определенные стадии жизненного цикла. К таким возбудителям относится, например, вирус бешенства.
Некоторые вирусы способны к переносу на покровах насекомых, а вирус оспы может долгое время сохранять свою вирулентность даже в пыли.
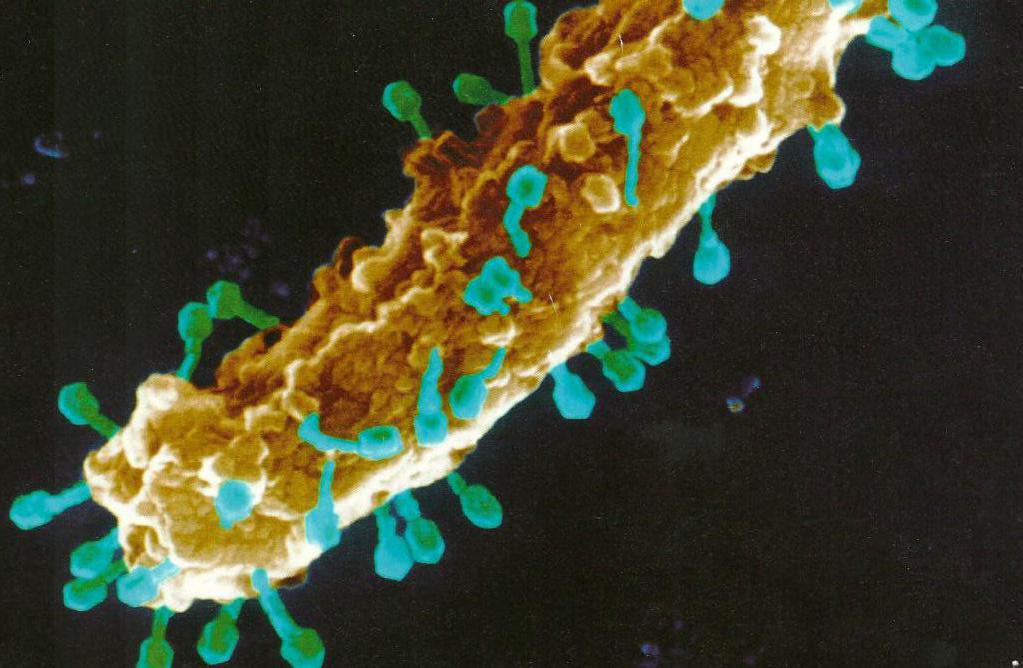
Множество болезней
Учитывая многообразие вирусов, не стоит удивляться разнообразию вирусных инфекций на клеточном уровне, хотя учеными и не установлено наличие корреляции между формой вируса и характером заболевания. Например, воспаление печени у человека могут вызвать вирусы гепатита А, С и Е. При этом все они различны по генетической структуре и внешней форме и даже классифицированы в три разных семейства.
А семейство пикорнавирусов, виды которого внешне похожи, как близнецы, вызывают такие заболевания. как ящур, диабет, миокардит, конъюнктивит и различные простудные болезни.

Мечта микробиолога
Вирусы, а особенно бактериофаги - сегодня излюбленный объект исследований молекулярных биологов. Цитотехнологии активно используют уникальную способность вирусов встраивать свою наследственную информацию в геном клетки-хозяина. Вирусы получили название векторов переноса генетического материала.
Современная наука представляет множество примеров успешных трансгенных организмов, например, сорт картофеля в геном которого введен ген хитиназы – фермента, который разлагает хитин. Хитиназа накапливается в стеблях и листьях картофеля и делает его непригодным для питания насекомыми и паразитическими грибами.

Вне зависимости от того, в чем проявляется действие вирусов на клетку, их формы и содержания, а также стратегий размножения, панацеи в борьбе с ними как возбудителями болезней нет. В инфекционной патологии порядка 75% заболеваний имеют вирусную природу. Этиология 25% всех инфекций желудочно-кишечного тракта также объясняется вирусами.
Определение усложняется еще и возможностью пребывания инфекции в латентном периоде. Именно поэтому приходится углубленно изучать каждого возбудителя при проявлении его патогенности и искать совершенно особенные способы борьбы с ними, что далеко не всегда получается.
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
- Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. - СПб, 2003.
- Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. - СПб, 2003.
- Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. СПб, 2007. - 254 с.
- Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. - М., 2006. - С.226-247.
- Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. - М., 2005. - С.159-175.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М., 2005. - С.287-292.
- Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. - М., 2002.
- Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. - М., 2004. - С.5-9.
- Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
- Романцов М.Г., Ершов Ф.И.Часто болеющие дети: Современная фармакотерапия. - М., 2006. - 192 с.
- Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. - Санкт-Петербург. - 2004. - С.82-95.
- Лекарственные средства в фармакотерапии патологии клетки / под ред. Т.Г.Кожока. - М., 2007.
Читайте также:


