Токсический гепатит научная статья

Вирусы гепатитов В, С, D являются основными причинами формирования цирроза печени. Следствием развития цирроза печени является ее неспособность выполнять свои основные функции, что приводит к нарушению деятельности всего организма и, нередко, к летальному исходу. Цирроз печени имеет необратимый характер, что является важным прогностическим показателем с необходимостью своевременного назначения лечения и профилактических мер. Вирусные гепатиты В и С приводят к развитию цирроза в 15–26 % от всех случаев случаев хронической инфекции. По данным динамического клинического наблюдения, цирроз печени у хронических носителей HBsAg наблюдается в 10 % случаев, по данным же морфологического контроля – в 20–60 % [1]. А в государствах Центральной Азии частота цирроза печени, из числа носителей HBsAg, достигает примерно 2 % в год.
Согласно нашим наблюдением, при хроническом гепатите С, цирроз печени развивается преимущественно у лиц старше 50 лет, где он обнаруживается примерно, в 50 % случаев от общего числа лиц этого контингента. При этом наиболее высока частота формирования цирроза в случае HCV – генотипом 1b [2]. По другим источникам, частота формирования цирроза печени различными генотипами HCV почти одинакова [3]. Следовательно, этиологический диагноз требует неотъемлемой индикации специфических маркеров HCV (HCV-РНК, анти-HCV).
При хроническом ГD заболевание протекает с высокой степенью циррозогенности. При этом в сравнении с хроническими сывороточными гепатитами иной этиологии, цирроз печени развивается гораздо чаще и в гораздо ранние сроки. Так, уже в ранние сроки выявляются отечно-асцитический синдром. При хронических гепатитах наблюдается ряд и других осложнений, таких как портальная гипертензия, спленомегалия и кровотечения из варикозных вен пищевода [4, 5].
В данное время в мире частота цирроза печени составляет около 20–40 случаев на 100 тыс. населения. Однако этот показатель все же неуклонно возрастает. Ежегодно от цирроза печени умирает около 2 млн человек. Совместно цирроз и рак печени оказываются причиной 90–95 % от всех случаев летальных исходов при хронических заболеваниях печени. Цирроз печени входит в список основных причин смерти. Смертность населения от цирроза печени в возрасте от 35 до 60 лет доходит до 14–30 случаев на 100 тыс. населения. Частота развития цирроза печени у мужчин выше, чем у женщин, примерно в 1,5–3 раза [6]. Однако у 10–20 % больных истинную причину цирроза печени установить все же не удается.
Большое количество больных циррозом печени, наблюдавшихся в Кыргызской Республике (38,8 на 100 тыс. нас. 2017 г.), обусловило и высокую летальность. Показатели смертности от цирроза печени в Республике колеблются в пределах 37,7–25,5 на 100 тыс. нас. на протяжении 10 лет наблюдения. Остаются, однако, на высоком уровне высокие показатели смертности среди трудоспособного населения. В связи с этим данная проблема показывает особую актуальность в Кыргызской Республике, и для ее решения требуется этиологическая верификация хронических вирусных гепатитов, особенно в цирротической стадии. Это необходимо в целях уточнения диагноза и организации адекватных лечебно-профилактических мероприятий.
Цель исследования: изучение этиологической верификации цирроза печени.
Материалы и методы исследования
В целях этиологической верификации возбудителя цирроза печени нами были отобраны 260 пациентов амбулаторно-поликлинической сети и стационарных учреждений, имевших диагноз цирроз печени. У них производились биохимические анализы крови, включающие определение активности ферментов АСТ и АЛТ, тимоловой пробы, уровней билирубина, содержание общего белка и его фракций, выявление специфических маркеров вирусов гепатитов.
Этиологически документированный диагноз хронических вирусных гепатитов устанавливали на основании выявления в крови маркеров инфицирования вирусами ВГВ (HbsAg, HBc-IgM IgG, HBeAg), ВГD (HDV-IgG), ВГС (HCVIg(total). Тесты на наличие ДНК – ВГВ и РНК – ВГС проводили с помощью полимеразно-цепной реакции (ПЦР). При неверифицированных случаях нами проводились АNА, AМА исследования в целях исключения аутоиммунного цирроза.
Для диагностики цирроза печени дополнительно использовали следующие инструментальные методы: ультразвуковое исследование, компьютерная томография и фиброскан исследования.
Результаты исследования и их обсуждение
Группа обследованных больных состояла из лиц мужского пола – (58 %) и женщин (42 %). Среди больных с циррозом печени преобладали взрослые люди (рис. 1).
Приведенные на рис. 1 данные показывают, что заболеванию циррозом печени в наибольшей степени подвержены люди 55–59-летнего возраста. Среди детей отмечен лишь один случай.
Рис. 2 показывает, что основной причиной цирроза печени является инфицирование вирусами гепатитов. У обследуемых пациентов был диагностирован хронический гепатит дельта (ХГD) – 48 %, хронический гепатит С – 24 %, хронический вирусный гепатит В – 18 %, алкогольный гепатит – 2,6 %, а аутоиммунный гепатит – 1,6 % пациентов, 0,8 % – составил токсический гепатит. В 5 % случаев причину цирроза печени выявить не удалось.
Существенную роль в развитии прогрессирующего цирроза печени, на наш взгляд, сыграло превалирование репликативной фазы хронических вирусных гепатитов В и С (35/74 %, и 54/87 %) соответственно. Маркеры гепатитов В и С определялиcь методом ПЦР, констатирующим виремию (таблица).
Результаты исследования, представленные в табл. 1, показали, что у 125 больных с хроническим вирусным гепатитом D осложнившимся циррозом печени, на момент исследования методом ПЦР была выявлена повышенная репликация вируса HDV-инфекции (91/73 %). Эти данные свидетельствует о том, что HDV приводит к подавлению вируса гепатита В, что согласуется с мнением других авторов. У 18 % пациентов отмечена одновременная репликация ДНК HBV и РНК HDV – инфекций.
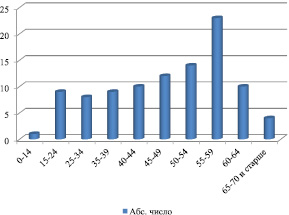
Рис. 1. Возрастная структура больных с циррозом печени (n = 260)
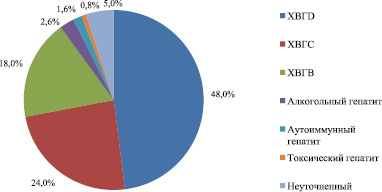
Рис. 2. Этиологическая структура циррозов печени (n = 260)
Наибольшее число хронических вирусных гепатитов представлено вариантом РНК-НСV. Учитывая клиническую диагностику генотипов HCV, было проведено изучение определяющих этих генотипов тяжесть заболевания и исход, во взаимосвязи с циррозом печени. Нами была обследована группа больных из 54 человек, которые имели в сыворотках крови РНК-HCV согласно сведениям ПЦР (рис. 3).
Впоследствии определения типа генотипов HCV получены следующие итоги: тип 1а выявлен у 5 человек (9 %), 1b – у 36 человек (67 %), 2 – у 4 (7 %) человек. 3а выявлен у 7 пациентов (13 %), у 2 человек (4 %) генотип РНК HCV не типировался (рис. 3).
Таким образом, из всех форм генотипов хронического вирусного гепатита С, наибольшее количество приходится на HCV генотипа 1b. У всех больных клинически был ярко выражен астеновегетативный синдром, проявлявшийся слабостью и повышенной утомляемостью. Диспепсический синдром (тошнота, рвота) наблюдался у 92 % больных. У 8 больных в клинической картине болезни имела место желтуха. Более чем у половины больных течение заболевания осложнялось геморрагическим синдромом, проявлениями которого были носовое кровотечение, кровоточивость из десен, кровотечение из варикозных вен пищевода, петехиальная сыпь. У всех пациентов наблюдался также синдром портальной гипертензии. Большинство пациентов 67 % имели клинически выраженные асцит и отеки нижних конечностей. У 87 % больных отмечены спленомегалия и внепеченочные знаки (телеангиэктезия и пальмарная эритема).
Далее приведено описание клинической картины и вирусологические, биохимические сведения пациента хроническим гепатитом С, у которого был отмечен цирроз печени.
Результаты детекции ДНК HBV, РНК HDV и РНК HCV, в сыворотке крови больных с циррозом печени (n = 234)

Введение
Вирусный гепатит Е (ГЕ) является распространенным заболеванием среди острых вирусных гепатитов в развивающихся странах с тропическим и субтропическим климатом. Однако за последнее десятилетие отмечаетсярост числа случаев автохтонного (местного) ГЕ в промышленно развитых странах3.Представлены данные о заболеваемости острым ГЕ в мире: за год регистрируется около 3,4 млн случаев острого ГЕ, в результате которого умирают 70 тыс. больных и происходит 3 тыс. мертворождений [4]. В подавляющем большинстве работ дано описание ГЕ легкой и среднетяжелой формы, заканчивающейся выздоровлением пациентов. Установлено, что молниеносный ГЕ встречается от1% до 4% [5]. Однако описанные случаи фульминантного гепатита, ассоциированного с ВГЕ на территории России, носят единичный характер [6].
Цель исследования - дать клинико-эпидемиологическое описание случаев фульминантного гепатита с летальным исходом, ассоциированный с острым автохтонным ГЕ, на территории Российской Федерации (РФ) с анализом причин и факторов, влияющих на характер течения этой инфекции.
Материал и методы исследования
Проведен ретроспективный анализ 3 случаев автохтонного ГЕфульминантного течения. Все пациенты находились на стационарном лечении в многопрофильных больницах Владимира, Москвы и Белгорода.
Этиологическую принадлежность к ГЕ доказывали обнаружением серологических маркеров в сыворотке крови больных - анти-ВГЕ IgG и IgM. Выявление РНК ВГЕ проводили в ОТ-ПЦР [7] с последующимсеквенированием этого образца.
Результаты
Клиническое наблюдение №1. Больной Л., 72 лет, госпитализирован в инфекционное отделение больницы № 6 г. Владимира с жалобами на выраженную слабость, желтуху, тошноту, боли в правом подреберье. Заболел остро, когда отметил появление слабости, тошноты и болей в животе. Температуру тела не измерял. На третий день появилась темная моча, замечена желтушность кожи и склер, что послужило поводом для госпитализации.
Эпидемиологический анамнез: в течение последних 40 лет проживал во Владимирской области в частном доме без централизованного водопровода и канализации. Отмечены эпизоды употребления некипяченой воды (из колонки). За последние 5 лет контакты с животными отсутствовали. В пищу употреблял мясные продукты (в том числе свинину); контакт с лихорадящими и/или желтушными больными отрицал. Наличие гепатита (желтухи) в анамнезе отрицал.
В анамнезе: язвенная болезнь желудка, осложнившаяся перфорацией с последующей резекцией желудка (1999 г.); хроническая обструктивная болезнь легких (ХОБЛ); хронический бронхит курильщика; перелом шейки бедра слева (2006 г.); перелом шейки бедра справа (февраль 2009 г.).
Состояние при поступлении среднетяжелое. Выраженная желтушность кожных покровов и склер. Печень выступала из-под правого края реберной дуги на 3-4 см, уплотнена, поверхность гладкая. Селезенка пальпировалась в глубине левого подреберья. Асцит, отеки отсутствовали.
Клинико-биохимические исследования. Выявлен умеренный лейкоцитоз (до 15,4 х 10 9 /л) со сдвигом лейкоцитарной формулы влево, выраженная тромбоцитопения (до 55 х 10 9 /л), протеинурия (до 0,5 г/л), гипостенурия.Отмечены значительные изменения функциональных проб печени: увеличение активности ферментов цитолиза - аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз(в 46 раз выше нормативных значений) и содержания билирубина (в 30 раз выше нормативных значений), а также двукратное повышение активности ферментов холестаза (щелочной фосфатазы (ЩФ), γ-глутамил-транспептидазы (ГГТП)).
При УЗИ выявлена незначительная гепатомегалия. Портальной и билиарной гипертензии не обнаружено. Поджелудочная железа нормальных размеров, эхогенность повышена, эхоструктура неоднородная, вирсунгов проток не расширен.
Лабораторное подтверждение диагноза ГЕ. Отсутствие анти-ВГА IgM, HBsAg, НВeAg, анти-ВГС, ДНК ВГВ, РНК ВГС и РНК ВГD позволило исключить острые гепатиты А (ГА), В (ГВ), С (ГС) и D (ГD). Обнаружение анти-ВГАIgG, анти-НВс, анти-HBs и анти-HBе свидетельствовали о том, что пациент ранее имел встречу с ВГА и ВГВ. Выявлены анти-ВГЕ IgМ и IgG. РНК ВГЕ в сыворотке крови регистрировали дважды - при поступлении в стационар и за 4 дня до летального исхода. Филогенетический анализ последовательности изолята ВГЕ показал его принадлежность к ВГЕ генотипа 3е.
Течение и исход заболевания.Несмотря на интенсивную терапию, отмечено прогрессирующее ухудшение состояния больного: нарастание слабости, снижение массы тела, усиление болейивздутие живота, накопление свободной жидкости в брюшной полости, появление пятнисто-геморрагической сыпи на коже лица, конечностей и туловища. Сохранялась значительная гипербилирубинемия (599-430 мкмоль/л), наблюдалось снижение общего белка (48 г/л). Тяжесть состояния пациента усугублялась вследствие формирования портальной гипертензии (асцит), выраженности энцефалопатии и печеночно-клеточной недостаточности, а также присоединения сердечно-сосудистой недостаточности (гипотония). Не исключено наличие внутрисосудистого гемолиза (неконъюгированный билирубин - 357,0 мкмоль/л, снижение гемоглобина - с 161 г/л до 131 г/л) и, как следствие, поражение почечных канальцев и углубление печеночной энцефалопатии с последующим формированием гепаторенального синдрома (олигоурия - 300 мл). При нарастающих явлениях полиорганной недостаточности отмечено развитие сопорозного состояния (кома I по Глазго)и, как следствие, летальный исход.
При аутопсии в печени обнаружены множественные некрозы, выраженныйхолестаз. Какие-либо признаки, свидетельствующие о хронической патологии печени, не обнаружены. Смерть больного, страдавшего ГЕ, наступила в результате развития печеночно-почечной недостаточности.
Посмертный диагноз: гепатит Е (РНК ВГЕ +), фульминантное течение. Причина смерти - печеночно-почечная недостаточность.
Клиническое наблюдение №2. Пациент Р., 86 лет, художник по профессии, был госпитализирован в многопрофильную больницу г. Москвы с жалобами на желтушность кожных покровов и слизистых, общую слабость, потемнение мочи, обесцвеченный кал.
Эпидемиологический анамнез: городской житель и последние годы за пределы города не выезжал. Употреблял только кипяченую воду, периодически - термически обработанную свинину. Из лекарственных препаратов систематически принимал церукал, винпоцетин, циннаризин, биологически активные добавки - БАД (капиллар, сплат). Парентеральный анамнез в течение 6 месяцев до заболевания не отягощен. Контакта с животными не отмечал.
Состояние при поступлении: средней степени тяжести. Кожные покровы и склеры желтушны. Периферических отеков нет. Живот незначительно увеличен в объёме за счёт подкожной жировой клетчатки, не вздут, мягкий, безболезненный во всех отделах. Печень увеличена в размерах (выступала из-под края реберной дуги на 3-4 см), край её острый, эластичной консистенции. При ректальном исследовании - следы кала обычного цвета. Моча интенсивно окрашена.
Клинико-биохимические исследования. Отмечено снижение уровня гемоглобина и эритроцитов с умеренным ростом числа лейкоцитов при отсутствии существенного сдвига влево, нарастание интенсивности цитолитического синдрома с преобладанием в первые дни пребывания в стационаре АСТ, а затем -АЛТ. Коагулопатия (наряду с гипопротеинемией и гипоальбуминемией) расценивалась как проявление поражения печени и усугубляла тяжесть течения болезни.
Сопутствующие заболевания - стеатоз печени (длительный прием лекарственных препаратов, дислипидемия), латентно протекающий сахарный диабет 2 типа.
Лабораторное подтверждение диагноза ГЕ.Выявлены антитела к HAV IgG в отсутствие анти-ВГАIgM, что свидетельствовало о перенесенном ранее ГА.Маркерыинфицирования ВГВ и ВГС, ЦМВ и ВЭБ не обнаружены. В сыворотке крови выявлены анти-ВГЕIgM. РНК ВГЕ в сыворотке крови и фекалиях не обнаружена (исследование проводилось спустя 4 недели от начала желтушного периода).
Течение и исход заболевания.Несмотря на дезинтоксикационную,противовоспалительную, симптоматическую терапию, состояние пациента критически ухудшалось. Тяжесть состояния усугубляларазвившаяся железодефицитная анемия (снижение гемоглобина со 166 г/л до 63 г/л), которая сочеталась с внутрисосудистым гемолизом (неконъюгированный билирубин достигал 153 мкмоль/л), развитием печеночной энцефалопатии, гепаторенального синдрома (олигоурия - 250 мл). Сохранялась интенсивная желтуха с высоким уровнем активности аминотрансфераз и выраженная коагулопатия.Констатирована смерть вследствие развития полиорганной недостаточности,аутопсия по просьбе родственников не проводилась.
Посмертный диагноз: гепатит Е (anti-HEV IgM+ и IgG +), фульминантное течение. Причина смерти -полиорганнаянедостаточность.
Эпидемиологический анамнез. В течение всей своей жизни проживал в городе, в доме с централизованным водопроводом и канализацией. В течение 6 месяцев, предшествующих заболеванию, злоупотреблял алкоголем. За последние 5 лет контакты с животными отсутствовали. В пищу употреблял мясные (в том числе свинину) и молочные продукты. Некипяченую воду не употреблял. За пределы города никогда не выезжал; контакт с лихорадящими и/или желтушнымибольными, а также гепатит (желтуха) в анамнезене установлены. В течение последнего года отмечал увеличение живота в объеме и уменьшение диуреза. К врачам по этому поводу не обращался.
Состояние при поступлении среднетяжелое. Печень выступала из-под правого края реберной дуги на 3-5 см. При пальпации плотная, болезненная, край заострен. Спленомегалия. Асцит, отеки отсутствовали. Однако диурез был снижен.
Клинико-биохимические исследования. Эритроциты -4,1 х 10 12 /л, без существенного снижения гемоглобина (133 г/л), лейкоцитоз (до 28,0 х 10 9 /л) со сдвигом лейкоцитарной формулы влево, выраженная тромбоцитопения (до 68 х 10 9 /л). Выраженные изменения функциональных проб печени подтверждали предположение о наличии гепатита сложного генеза (алкогольного и вирусного), что подтверждалось увеличением содержания билирубина (в 28 раз выше нормативных значений), наличием гиперферментемии(АЛТ -в 5 раз выше нормативных значений, ЩФ - в 2 раза и ГГТП -в 6 раз). Тяжесть состояния усугублялась вследствие нарастании азотемии,коагулопатии, гипопротеинемии (общий белок - 55 г/л) с гипоальбуминемией.
По данным УЗИ брюшной полости: портальная гипертензия (v.рorta - 15 мм). Диффузные изменения печени, гепатоспленомегалия. Стенки желчного пузыря слоистые, утолщены - 5,5 мм. Просвет анэхогенен. Холедох диаметром до 5 мм. Диффузные изменения желчного пузыря, поджелудочной железы.
ЭГДС: варикозное расширение вен нижней трети пищевода (I-IIст.). Катаральный гастрит.
Лабораторное подтверждение диагноза ГЕ. При повторномисследовании маркеры ВГВ,ВГС, ВИЧ не обнаружены. Выявлены антитела к ВГАIgM и IgG, что свидетельствовало о наличии у больного острого ГА.Анти-ВГЕIgM и IgGпри динамическом наблюдении оказались положительными (8, 14 и 25 день болезни). Это позволило диагностировать острую коинфекцию ГА и ГЕ у больного с алкогольным циррозом печени.РНК HAV и HEV в сыворотке крови и фекалиях не исследовались.
Течение и исход заболевания. Несмотря на лечение,состояние больногопрогрессивно ухудшалось: желтуха, асцит нарастали, отмечался выраженный кожный зуд. Вялость, сонливость периодически сменялась агрессией. Появились гематомы в местах инъекций. Больной переведен в отделение реанимации.Смерть наступила вследствие острой печеночной недостаточности.При исследовании аутопсийного материала печени сделано заключение о наличии в печени признаков острого гепатита с развитием множественных некрозов, выраженного холестаза.
Посмертный диагноз: цирроз печени алкогольной этиологии. Острый вирусный гепатит А(anti-HАV IgM+ и IgG +) и Е (anti-HEV IgM+ и IgG +), фульминантное течение.
Обсуждение
Существование летальных случаев ГЕ в Европейских странах и Японии [2,8] представлено в научной литературе. Проведенные нами исследования свидетельствуют о наличие фульминантных случаев этиологически доказанного острого автохтонного ГЕ и на территории России.
Все пациенты, включенные в описание, мужского пола, в возрасте от 65 до 86 лет. При оценке эпидемиологическогоанамнезапациентовбыло установлено, что никто из них не выезжал за пределы РФ и не посещал регионы, эндемичные по ГЕ. Этот факт позволяет расценить случаи инфекции как автохтонные, т.е. заражение произошло на территории данной местности.
Все пациенты поступили в стационар в состоянии средней тяжести и не имели клинических предвестников развития фульминантного течения. Уровень цитолиза и холестаза у пациентов в начале заболевания и в разгар клинических проявлений не предполагал возможность развития острого ГЕ. Непосредственной причиной летальных исходов у всех больных явилось нарастание печеночно-клеточной недостаточности вследствие тяжелого течения острого ГЕ (холестатический вариант), развитие гепаторенального синдрома.
На наш взгляд, значимым наблюдением является то, что 2 пациента злоупотребляли алкоголем. Считается, что состояния иммунодефицита, которое возникает при алкогольной болезни, при наличии сопутствующих хронических заболеваний является фактором, способствующим развитию тяжелых форм ГЕ. Можно предположить, что у описанных нами пациентов сочетание таких факторов риска, как пол, возраст, сопутствующие заболевания и злоупотребление алкоголя привели к развитию фульминантного течения ГЕ, завершившегося летальным исходом.
Заключение
Факт существования случаев фульминантного ГЕ диктует необходимость привлечь внимание клиницистов к проблеме развития тяжелых форм ГЕ у пациентов старшего возраста. На этапе постановки диагноза всем больным, относящимся к группе риска по инфицированию ВГЕ, а поступающим как в инфекционные, так и в отделения другого профиля, в алгоритм обследования следует включать определение маркеров ВГЕ (IgM,IgG)и РНК ВГЕ.
Рецензенты:
Эсауленко Е.В., д.м.н., профессор, заведующаякафедройинфекционныхболезнейвзрослых и эпидемиологииГБОУВПОСПбГПМУМинздраваРоссии, г.Санкт-Петербург.

Цель исследования.
Оценить изменение иммунологических показателей у крыс с хроническим токсическим гепатитом под влиянием адопции аллогенного ликвора, обладающего различной степенью иммунотропной активности.
Материал и методы исследования.
В работе приведены данные, полученные от 32 крыс линии Brown Norway, весом 160-180г. Оперативное вмешательство осуществлялось под гексеналовым наркозом (доза - 70мг./кг., внутрибрюшинно). Для воспроизведения модели хронического токсического гепатита (ХТГ) был использован гелиотрин, вводимый внутрибрюшинно в дозе 50 мг/кг массы тела один раз в неделю в течение 35 дней [2]. Адопция цереброспинальной жидкости (ЦСЖ) в III желудочек мозга проводилась раз в сутки согласно стандартной стереотопографии на аппарате WPI (Berlin, Germany) [6]. Количественное определение показателей иммунного статуса проводили с использованием набора дифференцировочных маркеров (Sandoz Pharma AG, Switzerland). Статистическая обработка результатов проводилась с расчетом критерия Стъюдента, различия считали достоверными при значении p≤0,05.
Полученные результаты и их обсуждение.
В проведенных ранее экспериментах было показано, что крысы Brown Norway (BN) с ХТГ имеют достоверно сниженные показатели иммунного статуса по сравнению с нормальными показателями интактных крыс. Примечательно, что при двукратном (в среднем) снижении количества клеток оцениваемых лейкоцитарных элементов, процентное соотношение показателей иммунограммы не изменялось. Вероятно, число всех типов клеток лейкоцитарного звена уменьшилось за счет генерализованного угнетения метаболической функции печени и последующего подавления центральных звеньев иммунорегуляции, что подтверждается исследованиями отдельных авторов [10]. В этой связи, проведено три серии экспериментов направленных на определение степени вовлеченности иммунокомпетентного микроокружения гипоталамуса в механизмы супрессирования иммунной системы при ХТГ.
Задачей первой экспериментальной группы крыс являлось изучение влияния адопции аллогенного ликвора, полученного от интактных крыс линии Sprague Dawley (SD) на показатели иммунного статуса при ХТГ. Полученные данные свидетельствуют, что ни один из оцениваемых показателей, за исключением общего пула лимфоцитов, каких-либо значимых количественных изменений не претерпел, количество нейтрофилов, мононуклеаров, В-лимфоцитов, Т-лимфоцитов, NK-клеток и лейкоцитов в целом незначительно колебалось в ту или иную сторону. Лишь абсолютное число лимфоцитов в периферической крови животных изучаемой группы достоверно возросло на 9% в сравнении с их количеством в крови контрольной группы крыс с ХТГ, но без манипуляций с составом ЦСЖ. (табл.1).
Таблица 1. Влияние адопции аллогенного ликвора на иммунный статус крыс с ХТГ
показатели иммунитета (×10 6 /L)
крысы с ХТГ (контроль)
ХТГ + адопция интактной ЦСЖ
ХТГ + адопция ЦСЖ от крыс с ХТГ
крысы без ХТГ + адопция ЦСЖ от крыс с ХТГ
Примечания: во всех сравниваемых группах n = 8
a - достоверно по отношению к контрольной группе крыс
b - достоверно по отношению к группе крыс с адопцией аллогенной интактной ЦСЖ
* - достоверно по отношению к группе интактных крыс
Таким образом, исследованиями продемонстрировано, что аллогенная адопция ЦСЖ полученной от интактных крыс, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ. По данным ряда авторов, стимуляция центральных звеньев иммунорегуляции ведет к избирательной модуляции нарушенных звеньев периферической иммунной системы, возвращая супрессированные либо гиперактивированные механизмы реализации иммунных процессов к физиологически нормальным значениям [5]. Казалось бы, внутрижелудочковое введение нормальной ЦСЖ, имеющей физиологичный состав иммунотропных компонентов и обладающей способностью модулировать подавленную активность центра поддержания иммунного гомеостаза, должно ослабить интенсивность иммуносупрессии у крыс с токсическим гепатитом, однако этого не произошло. Отсутствие какого-либо воздействия адопции ЦСЖ на активность иммунитета экспериментальной группы крыс, возможно, обусловлено неспособностью периферической иммунной системы прореагировать на смену вектора центральной эфферентной импульсации (в условиях "искусственной оптимизации" состава ЦСЖ), за счет тотального подавления анаболических (пластических) процессов в организме реципиентов ЦСЖ, имеющих печеночную дисфункцию.
Результаты, полученные во второй серии экспериментов, направленных на изучении роли ликвора полученного от аллогенных крыс-доноров, на которых за 14 дней до забора ЦСЖ была воспроизведена аналогичная модель ХТГ, демонстрируют, что животные изучаемой группы с ХТГ (реципиенты ЦСЖ) подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора. Так, количество лейкоцитов в изучаемой группе было достоверно снижено в сравнении с контрольной группой крыс с ХТГ (без адопции ЦСЖ) и в сравнении с группой крыс (первой экспериментальной серии) с ХТГ и с адопцией ЦСЖ от интактных животных линии SD. Аналогичные изменения были характерны и в отношении нейтрофилов и клеток мононуклеарного ряда. Общий пул лимфоцитов, включая Т- и В-популяции и натуральные киллеры, также подвергся значительному снижению числа клеток в периферической крови. Анализ показателей иммунограммы позволяет предполагать, что адопция аллогенной ЦСЖ в гипоталамическое ликворное микроокружение крыс реципиентов ЦСЖ ведет к угнетению активности иммуноцитов периферической крови за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Указанное подавление иммунитета крыс реципиентов ликвора, полученного от особей с моделью патологии усугубленной с течением времени, возможно, обусловлено замещением собственного ликвора, донорским ликвором, с составом биоактивных субстанций (главным образом цитокинов) истощенным моделью токсического гепатита более прогрессировавшего у крыс доноров ЦСЖ. Таким образом, адопция "декомпенсированного" ликвора от крыс с прогрессировавшей с течением времени моделью токсического гепатита индуцирует ускорение повреждения функций периферической иммунной системы реципиентов ЦСЖ, за счет экспериментально спровоцированной дезрегуляции механизмов поддержания иммунного гомеостаза в гипоталамусе, как результат адопции "декомпенсированного" (истощенного) ликвора. С другой стороны, возможен и иной механизм снижения активности периферической иммунной системы. По утверждению ряда авторов, угнетение периферических иммунных процессов может являться результатом компенсаторного действия центральных иммунотропных импульсов, направленных на предотвращение цитокиновой гиперсекреции в условиях патологии [4;9].
В третьей серии экспериментов оценивалось влияние адопции аллогенной ЦСЖ от крыс с моделью ХТГ на состояние иммунной системы изначально интактных крыс. Анализ полученных данных позволяет судить о том, что аллогенная адопция ЦСЖ от крыс с моделью патологии ведет к повышению показателей иммунограммы у крыс реципиентов ЦСЖ. В частности, общее количество лейкоцитов повысилось на 13% в сравнении с тем же показателем у интактных крыс. Число нейтрофилов, клеток мононуклеарного ряда и общий пул лимфоцитов также статистически значимо возросли. Среди клеток лимфоцитарного ряда достоверное увеличение клеточности имело место среди В-популяции лимфоцитов и натуральных киллеров. В то же время, общее число Т-лимфоцитов и, в частности, их хелперная и эффекторная субпопуляции не проявили значимого увеличения, однако тенденция к повышению числа клеток наблюдалась для обеих оцениваемых субпопуляций Т-клеток. Таким образом, показано, что центральное введение ЦСЖ, полученной от доноров с моделью гепатита, стимулирует рост показателей активности периферической иммунной системы. Возможным механизмом действия адоптированной ЦСЖ является адаптационное усиление интенсивности иммунорегуляторных импульсов со стороны центра поддержания иммунного гомеостаза в гипоталамусе. Указанная интенсификация иммуностимулирующих гипоталамических импульсов, возможно, обусловлена составом адоптированной ЦСЖ, свидетельствующим о глубоком подавлении активности периферической иммунной системы, вызванном моделью токсического гепатита в организме донора ЦСЖ. Вероятно, обедненный цитокиновый состав адоптированной ЦСЖ индуцирует компенсаторное повышение концентрации цитокинов в ЦСЖ и, следовательно, периферической крови реципиентов ликвора, т.е. происходит активация иммунной системы экспериментальной группы крыс без ХТГ, обусловленная искусственно спровоцированной ложной афферентной сигнализацией в центр поддержания иммунного гомеостаза. Предложенная гипотетическая схема стимуляции иммунитета изначально интактных крыс реципиентов ЦСЖ согласуется с утверждением отдельных авторов о том, что введение различных иммунологически активных субстанций в ІІІ желудочек мозга позволяет изменять вектор иммунотропных влияний гипоталамуса в желаемом направлении [7;8].
Заключение.
- Адопция аллогенной интактной ЦСЖ в гипоталамическое ликворное микроокружение, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, смоделированным за 14 дней до адопции, ведет к угнетению активности иммуноцитов периферической крови за счет интенсификации сбоя центральных механизмов поддержания иммунного гомеостаза у крыс реципиентов ликвора с аналогичной моделью ХТГ, вызванной позднее.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, индуцирует компенсаторное повышение количества иммуноцитов периферической крови у изначально интактных реципиентов ликвора, т.е. имеет место активация иммунной системы крыс без ХТГ, обусловленная ложной активирующей афферентной сигнализацией в центр поддержания иммунного гомеостаза.
Читайте также:


