Тест на вирус чумы



Экспресс тест для определения вируса чумы собак
по применению экспресс-теста для дифференциальной диагностики чумы собак CDV Ag.
Экспресс-тест для дифференциальной диагностики чумы собак CDV Ag в секреторных жидкостях, сыворотке или кале. Время исследования: 5-10 минут.
СБОР ИССЛЕДУЕМЫХ ОБРАЗЦОВ И ПОДГОТОВКА
Секреторные жидкости или сыворотка.
- 10 × фольгированных упаковок, каждая из которых содержит одну кассету, одну пипетку и осушитель
- 10 × пробирок с буферным раствором (0,7 мл каждая)
- Руководство по эксплуатации
1. Соберите аппликатором необходимые образцы.
2. Вставьте аппликатор с образцом в емкость с буфером и перемешайте.
3. При использовании сыворотки разведите образец в 2 раза буфером, входящим в состав набора.
4. Выньте кассету из защитной упаковки. Обозначьте тест-систему данными пациента или иным идентификатором и используйте как можно быстрее.
5. С помощью капельницы нанесите 3 капли (
6. Подождите 5 – 10 минут и считайте результаты. Важно, чтобы перед считыванием результата фон был чистым. Необходимо считать результат не позднее 10 минут!

> Отрицательный: Только одна окрашенная полоса в контрольной зоне (C). Нет окрашенной полосы в тестовой зоне (T).
> Положительный: Вдобавок к розовой полосе в контрольной зоне (C) появляется отдельная розовая полоса в тестовой зоне (T).
> Непригодный результат: Полное отсутствие полос или отсутствие полосы в контрольной зоне (C). Непригодный результат может быть следствием неправильного проведения анализа или непригодности тест-системы.
Повторите анализ на новой тест-системе.

1. Результаты тестов должны учитываться врачом совместно со всеми доступными клиническими данными. Точный клинический диагноз может быть установлен только врачом на основании оценки всех имеющихся клинических и лабораторных данных.
2. Данная тест-система предназначена для дифференциальной диагностики чумы собак CDV в секреторных жидкостях, сыворотке и кале. Эта тест-система предназначена только для in vitro диагностики. Данный тест является качественным и не предназначен для количественного определения уровня или повышения количества антигена.
3. Данная тест-система позволяет выявить наличие антигена чумы собак CDV Ag в пробе и не может быть единственным основанием для постановки диагноза.
4. Если результаты теста отрицательные при наличии клинической симптоматики, рекомендуется использовать дополнительные методы исследования. Отрицательный результат не может в различные периоды исключить возможность наличия одного из вышеуказанных вирусов.
ХРАНЕНИЕ И СТАБИЛЬНОСТЬ ТЕСТ-СИСТЕМЫ
Тест-систему необходимо хранить при температуре 2 - 30C в пределах указанного на упаковке срока годности. Следует избегать воздействия на тест-систему прямых солнечных лучей, сырости и тепла.
1. Только для in vitro диагностики.
2. Не используйте тест-систему с истекшим сроком годности.
3. Тест-система не может быть использована повторно.
4. Не всегда возможно сравнивать результаты от различных тест-систем.
5. Используйте новую пробирку и пипетку для забора каждой пробы, чтобы предотвратить смешивание образцов и обеспечить точность результатов.
Используйте меры предосторожности и помещайте все использованные материалы в контейнер для биологически опасных отходов.

Экспресс-тест VetExpert CDV Ag – твердофазный иммунохроматографический анализ для качественного обнаружения антигена Canine Distemper virus.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
- Принцип: ИХА прямым сэндвич методом
─ Моноклональные антитела против CDV (связывание) CDV антиген в образце Моноклональные антитела против CDV (обнаружение)
- Назначение: Выявление антигена вируса чумы собак
- Образцы: Секрет конъюнктивы (предпочтительный), сыворотка и плазма крови, моча собак
- Длительность анализа: 5 - 10 минут
- Чувствительность : 98,8 % по сравн. с RT-PCR
- Специфичность : 100% по сравн. с RT-PCR
- Отсутствуют кросс-реакции с CPV, CCV, ICH, PI2, с другими возбудителями заболеваний, подлежащих дифференциальной диагностике
- Пороговая чувствительность: 101.8 TCID50/0.1мл
- Срок хранения: 24 месяца
- Температура хранения : 2
ОСОБЕННОСТИ
- Высокая точность : 96%
- Очень высокая точность диагностики: 99.3 %
- Выявляет CDV в сыворотке крови уже через 3 дня после инфицирования
- Не обнаруживает вакцинный штамм CDV
- Выявляет все патогенные штаммы CDV
- Максимальный интервал для интерпретации результата: 10 минут
- Отличный индикатор для прогноза и коррекции терапии во время лечения зараженной CDV собаки (ослабление интенсивности окрашивания тестовой линии указывает на сокращение вирусной нагрузки)
ПРОЦЕДУРА ТЕСТА
1. Секрет конъюнктивы собрать в области третьего века (обозначена красным цветом)
2. Тампон поместить в пробирку с аналитическим разбавителем и перемешать круговыми движениями 10 раз
3. Извлекая тампон, отжать впитавшуюся пробу о стенки пробирки

4. Пипеткой взять надосадочную жидкость
5. Внести 4 капли в лунку (постепенно)

| Наименование | Цена, руб. | за ед |
|---|---|---|
| Экспресс-тест VetExpert CDV Ag чума собак (1 тест/уп) (усл.хр. +2. +30) | 873.40 | шт |
| Экспресс-тест VetExpert CDV Ag чума собак (5 тест/уп) (усл.хр. +2. +30) | 3637.70 | шт |
| Экспресс-тест VetExpert CDV Ag чума собак (10 тест/уп) (усл.хр. +2. +30) | 6806.80 | шт |
Доставка ветеринарных препаратов не производится.
Доставка грузов по г. Москва:
- внутри МКАД, но снаружи ТТК (в т.ч. до транспортных компаний) 1000 руб
- внутри ТТК 1400 руб
- малогабаритный груз (до 2 кг, до 0.08 куб.м.) в районе действия метрополитена 500 руб
- доставка в пригород/область цена согласовывается по заявке , от 25 руб за км от МКАД дополнительно к московскому тарифу
Доставка грузов по г. Санкт-Петербург:
- в районе действия сети метрополитена (в т.ч. до транспортных компаний) 700 руб
- внутри административной границы цена согласовывается по заявке
- малогабаритный груз (до 2 кг, до 0.08 куб.м.) в районе действия метрополитена 500 руб
- доставка в пригород/область цена согласовывается по заявке
По г. Санкт-Петербург действует акция: доставка до ТК "Деловые Линии" бесплатно!
Ортопедические изделия ТД ВЕТ в аптеках: адреса аптек
- наличными
- безналичный расчет
(товарные чеки, товарные накладные, счета-фактуры)
- Главное меню
- О компании
- Каталог
- Оплата и доставка
- Новости
- Сотрудничество
- Контакты
- Оборудование для животноводства. Ветеринарное оборудование. Оборудование для ветэкспертизы. Нашим экспертам доверяют!
- Звоните:
495 620-58-59
812 424-37-97Москва, Балтийская, 11 на карте
Санкт-Петербург, Кирилловская, 21 на карте render time: 1.1620 s
Диагностика инфекционных заболеваний представляет определенную сложность в связи с большим разнообразием и появлением новых форм клинических проявлений инфекционной патологии.
Целесообразность проведения экспресс - тестов
Быстро выявить возбудителя и начать адекватную терапию - залог успеха при лечении инфекционного заболевания. Как специфические (сыворотки и глобулины), так и неспецифические противовирусные препараты (иммуномодуляторы) наиболее действенны при использовании в первые дни заболевания, впоследствии они малоэффективны. Ранняя диагностика позволяет своевременно начать терапию специфическими средствами или, напротив, не использовать препараты, противопоказанные при определенных патологиях.

В каких случаях показано использование экспресс - тестов
Цены, руб.| Экспресс диагностика пироплазмоза (мазок крови) | 500 |
| Экспресс тест на антитела к коронавирусу кошек | 500 |
| Экспресс тест для выяления дирофилярий | 500 |
| Экспресс тест на лейкемию кошек | 750 |
| Экспресс тест инфекционный перитонит кошек FCoV Ab | 860 |
| Tест система коронавирус IFA | 1000 |
| Tест система хламидиоз+токсоплазмоз IFA | 1600 |
| Экспресс диагностика на овуляцию собак | 2200 |
| Экспресс тест для выяления лямблии | 1400 |
| Экспресс тест на вирус иммунодифецита кошек | 1300 |
| Экспресс тест на антитела к иммунодифициту и лейкимия кошек | 1300 |
| Экспресс тест на антитела к иммунодифициту кошек | 1300 |
| Экспресс тест на боррелиоз собак | 1200 |
| Экспресс тест на короновирус кошек | 850 |
| Экспресс тест на короновирус собак | 1250 |
| Экспресс тест на панлейкопению кошек | 500 |
| Экспресс тест на чуму токсоплазмоз собак | 500 |
| Экспресс тест парвовирус и чума собак | 750 |
| Экспресс тест парвовирус собак | 900 |
| Экспресс тест парвовирус, короновирус собак | 1250 |
| Экспресс тест хламидиоз кошек | 1600 |
| Экспресс тест чума и аденовироз, парагрипп собак | 750 |
| Экспресс тест чума собак | 900 |
| Экспресс-тест калицивироз+герпес+панлейкопения IFA | 800 |
Здравствуйте. Взяли кота из приюта, возраст 2.5 лет. Иногда чихает, из носа идут в небольшом количестве водянистые выделения, во сне время от времени громко сопит. Аппетит нормальный, в приюте питался в основном сухим кормом, у нас же ест корм из пакетиков, дышит носом. В чем может заключаться проблема? Артур
Вопрос: кот чихает, выделения из носа, в чем может быть проблема?
Здравствуйте. Маленькая собака потеряла глаз (большая собака набросилась), сейчас она выглядит не красиво из-за этого. Хотелось бы что то сделать, чтоб люди не глазели косо. Вопрос: можно ли делать глазное протезирование маленькому чихуахуа мини 1,5 кг. 2 года? Юлия
Вопрос: возможно ли сделать глазное протезирование собаке?
У человека чума, особенно ее септическая (в результате попадания бактерий в кровоток) и легочная формы, без лечения может быть очень тяжелым заболеванием с коэффициентом летальности 30-100%. Без раннего начала лечения легочная форма всегда приводит к смерти. Она носит особенно контагиозный характер и способна вызывать тяжелые эпидемии, передаваясь от человека человеку воздушно-капельным путем.
В 2010-2015 гг. во всем мире было зарегистрировано 3248 случаев заболевания чумой, в том числе 584 случая со смертельным исходом.
Признаки и симптомы
У человека, заразившегося чумой, по прошествии инкубационного периода от 1 до 7 дней обычно развивается острое лихорадочное состояние. Типичными симптомами являются внезапное повышение температуры, озноб, головная боль и ломота в теле, а также слабость, тошнота и рвота.
В зависимости от пути проникновения инфекции различаются две основные формы чумной инфекции: бубонная и легочная. Все формы чумы поддаются лечению, если выявляются достаточно рано.
Где встречается чума?
Как болезнь животных чума встречается повсеместно, за исключением Океании. Риск заболевания чумой человека возникает тогда, когда отдельно взятая популяция людей проживает на месте, где присутствует естественный очаг чумы (т.е. имеются бактерии, животные резервуары и переносчики).
Эпидемии чумы случались в Африке, Азии и Южной Америке, однако с 1990-х годов большая часть заболеваний человека чумой имела место в Африке. К трем наиболее эндемичным странам относятся: Мадагаскар, Демократическая Республика Конго и Перу. На Мадагаскаре случаи бубонной чумы регистрируются практически каждый год во время эпидемического сезона (сентябрь-апрель).
Диагностика чумы
Для подтверждения диагноза чумы требуется лабораторное тестирование. Образцовым методов подтверждения наличия чумы у пациента является изоляция Y. pestis из образца гноя из бубона, образца крови или мокроты. Существуют разные методы выявления специфического антигена Y. pestis. Одним из них является лабораторно валидированный экспресс-тест с использованием тест-полоски. Этот метод сегодня широко применяется в странах Африки и Южной Америки при поддержке ВОЗ.
Лечение
Без лечения чума может приводит к быстрой смерти, поэтому важнейшим условием выживания пациентов и профилактики осложнений является быстрая диагностика и раннее лечение. При своевременной диагностике чума успешно лечится антибактериальными препаратами и поддерживающей терапией. Нелеченая легочная чума может закончиться летальным исходом через 18-24 часов после появления симптомов, однако обычные антибиотики для лечения болезней, вызванных энтеробактериями (грам-отрицательными палочками), могут эффективно излечивать чуму при условии раннего начала лечения.
Профилактика
Профилактические меры включают в себя информирование населения о наличии зоонозной чумы в районе их проживания и распространение рекомендаций о необходимости защищать себя от укусов блох и не касаться трупов павших животных. Как правило, следует рекомендовать избегать прямого контакта с инфицированными биологическими жидкостями и тканями. При работе с потенциально инфицированными пациентами и сборе образцов для тестирования следует соблюдать стандартные меры предосторожности.
Вакцинация
ВОЗ не рекомендует проводить вакцинацию населения, за исключением групп повышенного риска (например, сотрудников лабораторий, которые постоянно подвергаются риску заражения, и работников здравоохранения).
Борьба со вспышками чумы
- Обнаружение и обезвреживание источника инфекции: выявление наиболее вероятного источника инфекции в районе, где выявлен случай (случаи) заболевания человека, обращая особое внимание на места скопления трупов мелких животных. Проведение надлежащих мероприятий инфекционного контроля. Следует избегать уничтожения грызунов до уничтожения блох – переносчиков инфекции, поскольку с мертвого грызуна блохи перейдут на нового хозяина и распространение инфекции продолжится.
- Охрана здоровья медицинских работников: информирование и обучение работников здравоохранения мерам инфекционной профилактики и инфекционного контроля. Работники, находившиеся в непосредственном контакте с лицами, заболевшими легочной чумой, должны носить средства индивидуальной защиты и получать антибиотики в качестве химиопрофилактики в течение семи дней или по меньшей мере в течение времени, когда они подвергаются риску, работая с инфицированными пациентами.
- Обеспечение правильного лечения: обеспечение получения пациентами надлежащего антибиотического лечения, а также наличия достаточных запасов антибиотиков.
- Изоляция пациентов с легочной чумой: пациенты должны быть изолированы, чтобы не распространять инфекцию воздушно-капельным путем. Предоставление таким пациентам защитных лицевых масок может сократить риск распространения инфекции.
- Эпиднадзор: выявление и отслеживание лиц, находившихся в близком контакте с больными легочной чумой, и проведение среди них химиопрофилактики в течение 7 дней.
- Получение образцов, которые следует собирать с осторожностью, соблюдая все профилактические меры и процедуры инфекционного контроля, после чего отправить в лаборатории для тестирования.
- Дезинфекция: рекомендуется регулярно мыть руки водой с мылом или использовать спиртосодержащие гели для дезинфекции рук. Для дезинфекции больших площадей можно использовать 10-процентный раствор бытового отбеливателя (раствор следует обновлять ежедневно).
- Соблюдение мер предосторожности при захоронении умерших: распыление антисептиков на лицо/грудь трупов больных, предположительно умерших от легочной чумы, является нецелесообразным и не рекомендуется. Следует накрывать территорию пропитанными антисептиком тканью или абсорбирующим материалом.
Эпиднадзор и контроль
Для осуществления эпиднадзора и контроля необходимо проводить обследование животных и блох, вовлеченных в чумной цикл в регионе, а также разработку программ по контролю за природными условиями, направленных на изучение природного зоонозного характера цикла инфекции и ограничение распространения заболевания. Активное продолжительное наблюдение за очагами проживания животных, сопровождаемое незамедлительными мерами реагирования во время вспышек заболевания среди животных, позволяет успешно уменьшить число вспышек заболевания чумой среди людей.
Для эффективного и результативного реагирования на вспышки чумы важным условием является наличие информированных и бдительных кадров здравоохранения (и местного сообщества), что позволит быстро диагностировать случаи болезни и оказывать надлежащую помощь инфицированным, выявлять факторы риска, вести непрерывный эпиднадзор, бороться с переносчиками и их хозяевами, лабораторно подтверждать диагнозы и передавать компетентным органам информацию о результатах тестирования.
Ответные действия ВОЗ
Целью ВОЗ является предупреждение вспышек чумы путем проведения эпиднадзора и оказания содействия странам повышенного риска в разработке планов обеспечения готовности. Поскольку резервуар инфекции среди животных может быть разным в зависимости от региона, что оказывает влияние на уровень риска и условия передачи инфекции человеку, ВОЗ разработала конкретные рекомендации для Индийского субконтинента, Южной Америки и стран Африки к югу от Сахары.
ВОЗ сотрудничает с министерствами здравоохранения для оказания поддержки странам, где происходят вспышки заболевания, в целях принятия на местах мер по борьбе со вспышками.
Эпидемия, бунт и власть в императорской Москве 250 лет назад
Чума: путь в Москву
Считается, что в Москву эту заразу (строго говоря, чума — не вирусная, а бактериальная инфекция) занесли с театра русско-турецкой войны, из Молдавии и Валахии. В августе 1770 года зараза достигла Киева, затем Брянска.
Увертюра в военном госпитале. Без паники!

Карантин: монастыри и генералы
Рядом с Большим Каменным мостом располагалась крупнейшая московская мануфактура того времени — Большой суконный двор. С 1 января по 9 марта 1771 года на фабрике умерли 130 человек. Фабричная администрация то ли не поняла поначалу, от чего, то ли слишком хорошо поняла: объяви, что на Суконном чума, и о сбыте продукции придется забыть .
В момент врачебной проверки в марте на Суконном дворе обнаружилось 16 больных с сыпью и чумными бубонами, а сколько разбрелось по городу, уже никто не узнал.
Фабрику закрыли, здоровых рабочих перевели на другие предприятия, а больных увезли в подмосковный Николо-Угрешский монастырь, ставший первым чумным госпиталем. При этом Суконный двор так и не был окружен караулами, и многие рабочие сбежали после оглашения диагноза.
Генерал-поручику Еропкину придется вскоре воевать в Кремле и на Красной площади, и отнюдь не с чумой.
От весны до осени: Москва зачумленная

Императрица одной из первых поняла и другую вещь: настала пора заботиться о том, чтобы зараза не дошла до Петербурга. Интересны детали.
Велено было также не пропускать проезжающих из Москвы не только к Санкт-Петербургу, но и в местности между столицами. Карантины были устроены в Твери, Вышнем Волочке, Бронницах.
Все эти меры помогли предотвратить превращение московского бедствия в общероссийское. Есть данные, что чума попала из Москвы в Воронежскую, Архангельскую, Казанскую и Тульскую губернии, но общенациональной пандемии не случилось.
Однако стоило в июле установиться теплой погоде, иллюзии рухнули. Смертность стала превышать 100 человек за сутки, вымирали целые улицы в Преображенской, Семеновской и Покровской слободах.
На улицах круглосуточно горели костры из навоза или можжевельника.
Бывало, что трупы выбрасывали на улицу или тайно зарывали в огородах, садах и подвалах, несмотря на указ императрицы с угрозой вечной каторги за сокрытие информации о заболевших и умерших.

Фото: Hulton Archive / Getty Images
В обреченном городе не осталось власти, полиции и войска — и немедленно начались бесчинства и грабежи.

Фото: WestArchive / Vostock Photo
Рассказ мгновенно распространился по Москве, и толпы горожан устремились к Варварским воротам в надежде вымолить прощение у Богородицы. Священники, оставив храмы, служили молебны прямо на площади. Люди по очереди лазали к иконе, стоявшей над проемом ворот, по лестнице, просили исцеления, ставили свечи, целовали образ, оставляли пожертвования в специальном сундуке.
Московский митрополит Амвросий, понимая опасность скопления народа в разгар эпидемии, решил его прекратить: икону убрать в храм Кира и Иоанна на Солянке, а сундук с деньгами передать в Воспитательный дом.
Бой в Кремле и на Красной площади
Расправившись с митрополитом, мятежники двинулись на Остоженку, в дом генерал-поручика Еропкина, сохранившийся доныне. Еропкин оказался не робкого десятка; он продемонстрировал, что если в борьбе с чумой к сентябрю 1771 года власти особых успехов не добились, то с бунтовщиками справляться они умеют.

В ноябре, когда чума уже утихала, в Москве состоялась экзекуция: четыре человека, в том числе убийцы митрополита Амвросия, были повешены, 72 человека были биты кнутом, 89 человек высекли плетьми и отправили на казенные работы.
Граф Орлов. Последнее средство
Восстанавливать порядок в Москву Екатерина отправила графа Григория Орлова, который приехал в первопрестольную 26 сентября. Вслед за Орловым шли четыре полка лейб-гвардии.
Орлов снискал славу избавителя Москвы от мора. Принципиально новых санитарных мер, кроме укрепления застав и карантинов, он не ввел. Но пришла на помощь природа: начались ранние холода, и эпидемия стала понемногу сходить на нет.
Впрочем, стоит отдать графу Орлову должное: он начал с верного шага, не свойственного отечественным администраторам,— прибыв в Москву, сразу собрал консилиум специалистов и следовал его указаниям. Орлов велел заново разбить Москву на 27 санитарных участков, открыть дополнительные больницы и карантины. Орлов лично обходил все больницы, следил за лечением и питанием пациентов.
Более того. Понимая, что нищета и болезнь тесно связаны, Орлов организовал общественные работы по укреплению Камер-Коллежского вала вокруг Москвы: мужчинам платили по 15, а женщинам по 10 копеек в день. Боролся Орлов и с бродягами, разносившими заразу: их отправляли в Николо-Угрешский монастырь.

Фото: Alamy / Vostock Photo
По официальной статистике, с апреля по декабрь 1771 года в Москве умерли от чумы 56 672 человека. Но это не все — первые три месяца 1772 года чума в Москве, над которой в Петербурге уже отпраздновали победу, продолжалась, правда ежемесячное количество умерших снизилось до 30 человек. Об окончательном прекращении эпидемии было объявлено только в ноябре 1772 года.
А в одном из писем за границу сама Екатерина сообщала: чума в Москве похитила более 100 тысяч жизней. Это можно, пожалуй, рассматривать как невольное признание в том, что противостоять нежданной напасти по большому счету не смогли ни власти, ни общество.
Мазлум Али, Власова Н.Н., Аронова Е.В., Иголкин А.С. ФГБУ"ВНИИЗЖ", г. Владимир
Кривонос Р.А. департамент ветеринарии Краснодарского края, г. Краснодар
Черных О.Ю. ГБУКК"Кропоткинская краевая ветеринарная лаборатория", г. Кропоткин
Введение. Метод, позволяющий определять количество инфекционных единиц вируса в различных образцах, является необходимым инструментом в вирусологии. В исследовательских лабораториях титр вируса, вызывающего цитопатический эффект в культуре клеток, обычно рассчитывают, исходя из количества пораженных единиц культуры клеток (лунки, флаконы), после внесения в них серийных разведений исходного вируссодержащего материала и выражают в тканевых цитопатических дозах - ТЦД50, если эффект наблюдается у половины инфицированных проб [13].
Использование данного метода требует продолжительного периода времени: от 3 до 10 дней в зависимости от свойств исходного вируса. С появлением новых технологий для определения титра вируса в пробе все чаще применяют метод ПЦР в реальном времени (ПЦР-РВ). По данным Van Guilder HD, Vrana KE, Freeman WM (2008) ПЦР-РВ (или количественная ПЦР) лабораторный метод, основанный на циклической амплификации определенных фрагментов генома, который используется для одновременной индикации возбудителя и измерения количества молекул ДНК. В свою очередь, после проведения соответствующих расчетов его результаты позволяют определить титр вируса в испытуемой пробе [22].
Возбудителем африканской чумы свиней (далее, АЧС) является ДНК-содержащий вирус семейства Asfarviridae, рода Asfivirus [2, 3, 8, 12]. Поскольку геном вируса АЧС представлен ДНК, в отличие от детекции геномов РНК-содержащих вирусов, для его обнаружения методом ПЦР-РВ не требуются получения кДНК, что, как минимум, на 1 час сокращает время исследований и составляет с этапом выделения ДНК 2 часа 30 минут.
Для титрования вируса АЧС используют первичные культуры клеток (культура клеток костного мозга свиней, культура лейкоцитов свиней, альвеолярных макрофагов свиней, почек свиней и селезенки свиньи), обладающие высокой чувствительностью [3, 4].
При культивировании в первичных культурах клеток свиньи вирус АЧС вызывает специфическую гемадсорбцию и оказывает цитопатогенное воздействие. Постановка реакции гемадсорбции (РГАд) является наиболее специфичным и чувствительным методом идентификации вируса АЧС, поскольку ни один из вирусов, поражающих свиней, не вызывает проявления гемадсорбции. Согласно рекомендации МЭБ, РГАд используется в качестве референтной методики выявления вируса АЧС, несмотря на трудоемкость постановки и продолжительность реакции (5-7 дней) [3, 4, 16, 20].
Исходя из вышеизложенного, при выполнении ряда лабораторных исследований и определении количества вируса в пробе в определенных случаях целесообразно заменить традиционные методы и использовать такие технологии, как ПЦР-РВ для проведения быстрого и эффективного анализа уровня накопления вируса.
Порогового значение цикла (Ct), фиксируемое в результате ПЦР-РВ, дает точные и воспроизводимые результаты с низкими стандартными отклонениями [21, 22].
Кроме того, ПЦР-РВ позволяет проводить абсолютную количественную оценку содержания нуклеиновых кислот в пробе при наличии референтной матрицы ДНК с известной концентрацией и количеством копий [24].
К другим преимуществам ПЦР-РВ относится быстрая и эффективная возможность сравнения и качественной оценки исследуемых образцов.
Так, в зарубежной литературе представлен ряд работ, в которых 4 демонстрируется определение вирулентности вируса по его содержанию в крови, отмечая, что скорость изменения С (соответственно, скорость увеличения титра в крови) у аттенуированного вируса ниже, чем у вирулентного [14, 18].
В своей работе Lacasta Anna et al. показали, что у животных, инфицированных аттенуированным штаммом вируса АЧС, наблюдалась более поздняя регистрация вирусной ДНК. Они выявляли вирус в назальных экскретах и крови только на 7-й день после инфицирования, причем, титр накопления вируса был в среднем ниже на 4-5 lg, чем у свиней, инфицированных вирулентным штаммом E75, и не превышал значений 104-5 ГАдЕ50/мл [18].
В другой работе Lewis T. et. al. показали, что делеция гена 9GL у вируса АЧС изолята Malawi Lil-20/1 (MAL) влияет на созревание ви-риона и репродукцию вируса в макрофагах и ослабляет вирусную инфекцию у свиней. Животные, инфицированные этим аттенуированным изолятом, оставались клинически здоровыми и демонстрировали увеличение значения Ot, выявляемое в ПЦР-РВ, что соответствовало снижению титра вируса в крови в 100-10 000 раз по сравнению с неделетированным изолятом Malawi Lil-20/1 [14].
Использование ПЦР-РВ в диагностике АЧС имеет еще одно преимущество перед РГАд, так как при постановке последнего невозможно выявление негемадсорбирующих вариантов вируса, как правило, у свиней с хронической или бессимптомной формой течения болезни. Следует также учитывать, что специфическая ГАд, хотя и является характерным признаком вирулентных вариантов вируса АЧС, отдельные негемадсорбирующие изоляты также могут быть высоковирулентными [15].
Таким образом, целью наших исследований являлось определение корреляции показателя Ct в ПЦР в режиме реальном времени и значений титра вируса, устанавливаемого в реакции гемадсорбции, а также расчета количества копий генома вируса АЧС в пробе.
Расчет титра вируса проводили по методу Рида и Менча, или по методу Кербера в модификации Ашмарина через 7 дней после начала эксперимента [9, 10].
В качестве источника геномной ДНК и для заражения культуры клеток или титрования исходного вируса в работе использовали вирус АЧС изолят Krasnodar 07/17, выделенный в июле 2017 года из пробы селезенки павшей домашней свиньи (Краснодарский край). Накопление вируса осуществляли путем его пассирования в первичной культуре клеток СС в течение 2-3 пассажей.
Для получения и накопления ПЦР-продукта использовали: матричную ДНК вируса АЧС изолят Krasnodar 07/17 в объеме 5 мкл на реакцию, Taq-ДНК-полимеразу - 0,5 мкл, 10*буфер с (NH4)2SO4 - 2 мкл, смесь дезоксинуклеотидтрифосфатов 10 мМ - 0,5 мкл (Fermentas), праймеры, фланкирующие ген B646L (табл. 1) (по 10 пМ каждого), и 2 мкл 25мМ MgCl2. Объем деионизированной воды рассчитывали, исходя из общего объема реакционной смеси, равного 20 мкл. Режим амплификации использован согласно работе Neilan J.G. и др., 2004 [19].
Таблица 1. Праймеры, использованные для амплификации гена B646L вируса АЧС
Последовательность 5' 3'
Результаты амплификации гена B646L оценивали с помощью электрофореза в 1,0% агарозном геле.
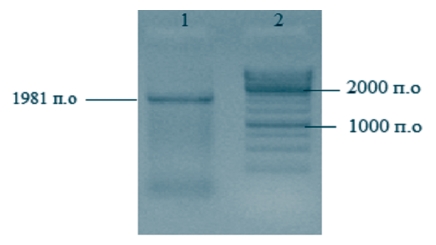
Рис. 1. Результаты электрофоретического разделения в 1% геле агарозы ПЦР-продукта (вирус АЧС изолят Krasnodar 07/17): трек 1 - электрофорез ПЦР-продукта полноразмерного гена B646L; трек 2 - маркер 1к (производитель ThermoFisher) с линейкой фрагментов от 10000 п.о. до 250 п.о.
Поскольку размер амплифицированного фрагмента 1981 п.о. и его концентрация после очистки из агарозного геля составляла 25,1 нг/мкл, рассчитанное количество копий гена составляло 1,17x1с11 копий/мкл.
На втором этапе исследований приготовили 10 десятикратных разведений образца ПЦР-продукта и провели их анализ в ПЦР-РВ с трехкратной повторностью. Результаты представлены в таблице 2.
Таблица 2. Значение Ct в ПЦР-РВ при разных концентрациях амплификата гена B646L вируса АЧС (n=3)
| Разведение пробы | Концентрация ДНК амплификата гена B646L (нг/мкл) | Значение Ct | Количество копий гена в 1мкл | Результат |
|---|---|---|---|---|
| 1 | 25,1Ч10-1 | -* | 1,17Ч19 | Ложн.отр |
| 2 | 25,1Ч10-2 | -* | 1,17Ч18 | Ложн.отр |
| 3 | 25,1Ч10-3 | -* | 1,17Ч17 | Ложн.отр |
| 4 | 25,1Ч10-4 | 5.8 | 1,17Ч16 | Пол. |
| 5 | 25,1Ч10-5 | 8.2 | 1,17Ч105 | Пол. |
| 6 | 25,1Ч10-6 | 11.34 | 1,17Ч104 | Пол. |
| 7 | 25,1Ч10-7 | 15.15 | 1,17Ч103 | Пол. |
| 8 | 25,1Ч10-8 | 18.09 | 1,17Ч102 | Пол. |
| 9 | 25,1Ч10-9 | 21.11 | 1,17Ч101 | Сомн. |
| 10 | 25,1Ч10-10 | 25.00 | 1,17 | Сомн |
Полученные результаты ПЦР-РВ продемонстрировали обратно пропорциональную линейную зависимость показателя Ct от количества копий гена B646L вируса АЧС, когда снижение концентрации в 10 раз приводит к увеличению Ct на 3 цикла (рисунок 2).
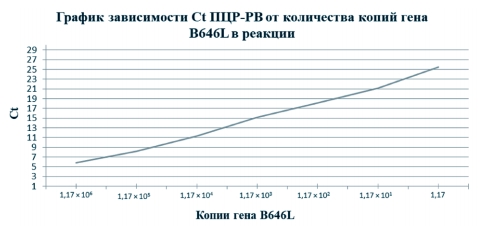
Рис. 2. Корреляция значений Ct ПЦР-РВ с количеством копий гена B646L
Таким образом, в результате экспериментов было установлено, что при высокой концентрации ДНК в образцах (>1,17x10 копий генома) реакция ПЦР-РВ может приводить к ложно отрицательному результату, поскольку чрезмерное количество исходной матрицы препятствует отжигу праймеров на амплифицированных матрицах, а когда количество копий снижается ПЦР-РВ позволяет обнаруживать геном вируса АЧС вплоть до минимального количества копий - 11,7 копии/мкл. Так как для постановки реакции используется 10 мкл матричной ДНК, чувствительность ПЦР-РВ в данных опытах составляет 117 копий.
На следующем этапе для наиболее точного определения титра вируса АЧС в пробе с помощью реакции гемадсорбции, провели сравнительный анализ чувствительности первичных культур клеток.
С этой целью параллельно заразили культуры клеток СС и КМС вирусом АЧС изолят Krasnodar 07/17 в дозе 103 ГАдЕ50 на матрас (объем 50 мл), и наблюдали за репродукцией вируса в культуре клеток. Из каждого матраса на седьмые сутки отобрали по 300 мкл культуральной жидкости, исследовали данные образцы методом ПЦР-РВ и определяли титр вируса АЧС в обеих культурах клеток в РГАд. Р результате титр вируса АЧС в культуре клеток СС составил 106 ГАдЕ50, а титр вируса АЧС в культуре клеток КМС составил 105 ГАдЕ50, то есть на 1lg ниже. Полученные данные также были подтверждены методом ПЦР-РВ, где значение Ct на седьмой день в культуре клеток СС составило 12,2, а в культуре клеток КМС 15,9.
Поскольку обе культуры клеток были использованы для заражения одной и той же дозой вируса, а репродукция вируса АЧС в культуре клеток СС показала более высокую чувствительность данной культуры к вирусу, для выполнения дальнейших этапов работы была выбрана культура клеток СС, как наиболее соответствующая целям исследований.
Таблица 3. Значение Ct ПЦР в реальном времени при разных разведениях вируса АЧС (n = 3)
| Титр | Разведение | Ct/ВКВ* | Среднее** | Стандартное отклонение*** | 95% доверительный интервал**** |
|---|---|---|---|---|---|
| 107 ГАдЕ 50 | исходный | 20,54 | 8,03 | ±0,12 | 7,67 – 8,39 |
| 106 ГАдЕ50 | 1 | 22,71 | 11,95 | ±0,136 | 11.54 – 12,36 |
| 105 ГАдЕ50 | 2 | 23,38 | 16,23 | ±0,542 | 14,6 – 17,86 |
| 104 ГАдЕ50 | 3 | 23,61 | 19,84 | ±0,138 | 19,43 – 20,25 |
| 103 ГАдЕ50 | 4 | 23,83 | 23,86 | ±0,565 | 22,17 – 25,56 |
| 102 ГАдЕ50 | 5 | 23,48 | 27,37 | ±0,574 | 25.65 – 29.07 |
| 10 ГАдЕ50 | 6 | 25,26 | Н.З | Н.З | Н.З |
| 0,1 ГАдЕ50 | 7 | 24,38 | Н.З | Н.З | Н.З |
Примечание: Н.З - нет значения Ct; * - внутренний контроль выделения ДНК; ** - среднее значение рассчитано по формуле:

Для определения формулы расчета титра вируса построили линию регрессии и рассчитали коэффициент корреляции между логарифмом титра вируса и логарифмом Ct с помощью программы Statistica (рисунок 3)
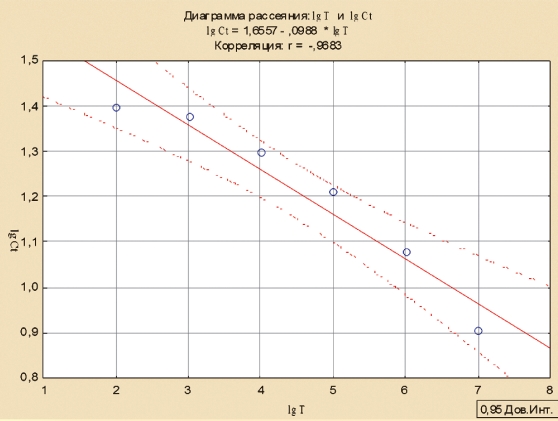
Рис. 3. График зависимости между логарифмом титра вируса АЧС и логарифмом значения Ct ПЦР-РВ
В наших исследованиях, коэффициент корреляции составил 0,9683, что свидетельствует о высокой достоверности (точности) исследований и позволяет производить вычисление титра вируса в пробе.
Таким образом, при анализе корреляции между показателями Ct ПЦР-РВ и результатами титрования проб в культуре клеток СС удалось установить близкую к линейной зависимость показателя Ct от титра вируса АЧС. Необходимо отметить, что в данном случае снижение концентрации на 1,0 lg, приводило к увеличению Ct на 4 цикла (рисунок 4).
Следующим этапом нашей работы являлось определение аналогичного соответствия показателей Ct ПЦР-РВ с титром вируса, полученного из крови инфицированного животного вирусом АЧС изолят Krasnodar 07/17, павшего на 7 сутки после заражения (титр вируса в крови составлял 7,0 lg ГАдЕ/см3). Аналогично опытам с изолятом Krasnodar 07/17 в культуре клеток СС, образцы крови также использовали для приготовления 7 десятикратных разведений для исследования методом ПЦР-РВ в 3 повторностях. Сравнение результатов экспериментов и определение соотношения значений Ct и титра вируса продемонстрировало практически полную идентичность полученных результатов (рисунок 4).
Рис. 4. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
Результаты Ct обоих экспериментов в культуре клеток и в крови показали высокий уровень достоверности.
По результатам, представленным на рисунке 4, видно равномерное снижение значения Ct на 4 цикла при каждом последующем десятикратном разведении (то есть при увеличении титра на один логарифм). Следовательно, корреляция выражается в линейной зависимости соотношения Ct и титра вируса, подъем значения Ct каждые 4 цикла соответствовал снижению титра вируса на 1 lg.
Рис. 5. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
Однако, считаем необходимым обратить внимание, что значение циклов Ct могут изменяться в зависимости от чувствительности набора, целевого детектируемого участка генома вируса АЧС, и чувствительности культуры клеток, на которой проводится определение титра вируса.
Заключение. Как правило, уровень репродукции вируса АЧС определяется титрованием в культуре клеток, поскольку чувствительность РГАд в 10 раз выше (1 ГАдЕ - 10-12 вирионов), чем чувствительность ПЦР-РВ (10 ГАдЕ или
117 копий), но постановка этой реакции более трудоемка и длительна (7-10 сутки) по сравнению с ПЦР-РВ (2 час 30 минут). Кроме того, несмотря на то, что титрование более чувствительный метод, в определенных случаях, точность результата зависит от чувствительности культуры клеток и квалификации исполнителя.
Выявленная корреляция между значением Ct и титром вируса в пробе позволяет в лабораторной практике использовать ПЦР-РВ для количественного определения содержания вируса в образце, а также, дает возможность детального изучения ряда биологических свойств возбудителя АЧС.
При необходимости использование ПЦР-РВ также дает возможность определить количество копий генома вируса в исследуемых образцах, с поправкой на то, что корреляция должна быть изучена и оптимизирована для определенного набора.
Ключевые слова: вирус африканской чумы свиней, полимеразная цепная реакция в режиме реального времени, реакция гемадсорбции, значения Ct, культура клеток СС, культура клеток КМС, геном вируса АЧС, корреляция, количество копий, биологические свойства, количественный метод.
Читайте также:



