Системная терапия гепатита с
Having trouble reading this email? View it in your browser
| ||||
Апрель, 2018 годДанный выпуск посвящается новостям с ежегодной встречи Европейской ассоциации исследователей заболеваний печени (EASL) - Международного конгресса по заболеваниям печени. Конгресс проходил в Париже с 11 по 15 апреля 2018.
Chiara Mazzarelli- исследователь гепатотранспантолог - на Международном конгрессе по заболеваниям печени 2018. Фотограф Лиз Хайлимэн Противовирусные препараты прямого действия (ПППД) высокоэффективны в лечении вирусного гепатита С, хотя конечная задача терапии заключается в профилактике развития отдаленных осложнений гепатита С и снижения уровня смертности. Результаты Обзорного когортного систематического анализа 2017 подвергло сомнению благоприятное влияние излечения вирусного гепатита С (ВГС) при помощи ПППД на жизненный прогноз излеченных пациентов. Данные этого анализа показали отсутствие достаточных доказательств в поддержку утверждения, что излечение ВГС инфекции приводит к уменьшению числа печеночных осложнений и снижению показателя смертности. Результаты анализа подверглись серьезной критике экспертов. Так, результаты широкомасштабного проспективного исследования, проведенного в Италии, предоставило совершенно очевидные данные, подтверждающие, что излечение ВГС приводит к снижению риска смерти по причине печеночных осложнений. Исследование показало, что пациенты с компенсированным циррозом (стадия А по классификации Чайлд - Пью) были в 15 раз более склонны к развитию смертельных осложнений, если у них не удавалось достичь стойкого вирусологического ответа при использовании ПППД. Представители этой группы населения также были предрасположены к более высокому риску смерти по причине сердечно-сосудистых заболеваний. Шотландское исследование, в ходе которого проводилось наблюдение за всеми пролеченными пациентами с ВГС показало, что показатель декомпенсированной недостаточности печени на фоне цирроза печени среди лиц с хроническим ВГС снизился на 29% за период с 2013 по 2016 гг.. В течение этого периода 94% пролеченных пациентов с ВГС достигли стойкого вирусологического ответа на лечение. Также, в ходе Европейского наблюдения за пациентами, подвергшихся трансплантации печени было выявлено, что несмотря на сохраняющуюся стабильность показателя проведенных трансплантаций печени в Европе за период между 2007 и 2017 годами, доля этих операций по причине цирроза печени на фоне вирусного гепатита С сократилась с 23% до 11%. Снижение числа трансплантаций по причине ВГС-ассоциируемых осложнений стало очевидным после 2014 года и особенно четко прослеживалось в подгруппе лиц с декомпенсированным циррозом. Показатель выживаемости после трансплантации печени среди лиц с ВГС также улучшился.
EASL экспертная комиссия на Международном конгрессе по заболеваниям печени 2018. Фотограф Лиз Хайлимэн Рекомендации предназначены для всех европейских стран и включают в себя новейшие одобренные схемы для лечения вирусного гепатита С (ВГС) с поправкой на то, что ранее рекомендуемые схемы все еще могут быть использованы при отсутствии доступа к новейшим препаратам. Рекомендации упрощают лечебно-диагностический процесс за счет введения новейших схем терапии, позволяющих в большинстве случаев избежать необходимости в проведении генотипического тестирования ВГС и необходимости в проведении мониторинга терапевтического ответа. Как и в предшествующем издани Клинических рекомендаций, EASL рекомендует проводить лечение всем лицам с ВГС, включая случаи несостоятельности предшествующих курсов терапии и случаи реинфекции. Экспертная комиссия также разработала рекомендации по проведению повторных курсов терапии для лиц с декомпенсированным циррозом, а также рекомендации по проведению терапии до или после трансплантации печени. Для дополнительной информации см. полный текст статьи о новых рекомендациях.
Экспертная комиссия EASL по лечению рака печени на Международном конгрессе по заболеваниям печени 2018. Фотограф Лиз Хайлимэн Рак печени занимает 5 место среди наиболее часто встречающихся видов рака и 2 место среди видов рака, приводящих к смерти: так ежегодно в мире регистрируется 854 000 новых случаев ГЦК и 810 000 смертельных исходов. Около 85% всех случаев регистрируются в странах Восточной Азии и субтропической Африки. На долю ГЦК приходится около 90% всех случаев первичного рака печени. Экспертная комиссия рекомендует проводить программы усиленного скрининг-контроля для выявления лиц с повышенным риском ГЦК. Регулярное наблюдение рекомендуются для лиц с циррозом печени и для лиц с фиброзом печени (стадия F3). Для этого рекомендуется проводить УЗИ брюшной полости каждые 6 месяцев. Резекция печени и трансплантация печени рекомендуются в качестве терапии первого выбора на ранних стадиях рака печени. Радиочастотная термическая аблация относится к стандартному виду оказания помощи на ранних стадиях ГЦК для лиц с противопоказаниями к оперативному лечению. Этаноловая аблация является дополнительным вариантом терапии. Обнадеживающие результаты показывает метод микроволновой аблации. В то же время существует недостаточно данных в поддержку эффективности радиотерапии с использованием внешнего источника излучения. После хирургического лечения часто возникают рецидивы опухоли, по этой причине контрольные наблюдения в течение первого года после лечения рекомендуется проводить каждые 3-4 месяца. Со времени выхода в свет Рекомендаций 2012 года, наибольшим изменениям подверглась терапия с использованием препаратов системного действия (системная терапия). Сорафениб (Нексавар) - стандартный вариант системной терапии первого выбора для лиц с распространенной ГЦК или для лиц с ранними стадиями заболевания, но с противопоказаниями к проведению локальной терапии либо с рецидивом заболевания после проведения локальной терапии. Согласно Рекомендациям, в качестве альтернативного варианта в запущенных случаях ГЦК у лиц с сохранной функцией печени возможно также использовать ленватиниб (Ленвима), эффективность которого не уступает эффективности сорафениба. Регорафениб (Стиварга) рекомендуется в качестве препарата второго выбора для лиц с прогрессирующим заболеванием на фоне применения сорафениба. Исследования также показывают, что кабозантиниб (выпускаемый в виде таблеток под названием Кабометикс или в капсулах под названием Кометрик) улучшает показатель выживаемости в этой группе пациентов.
Йенс Риккэ (Jens Ricke) на Международном конгрессе заболеваний печени 2018. Фотограф Лиз Хайлимэн Рецидивы гепатоцеллюлярной карциномы (ГЦК) наблюдались в ранее проводимых исследованиях с участием лиц с ВГС, получавших терапию на основе противовирусных препаратов прямого действия (ПППД). В 2016 году итальянские исследователи заявили о неожиданно высоком уровне рецидивов рака печени у лиц, пролеченных ПППД, и предупредили о необходимости проведения тщательного мониторинга на ГЦК среди пациентов, пролеченных ПППД. Последующее наблюдение не выявило повышенного риска ГЦК после лечения ПППД. Три исследования (два многоцентровых и одно ретроспективное исследование), проведенные в Италии, сообщили на конференции о потенциальном риске рецидива заболевания. Результаты исследований показали:
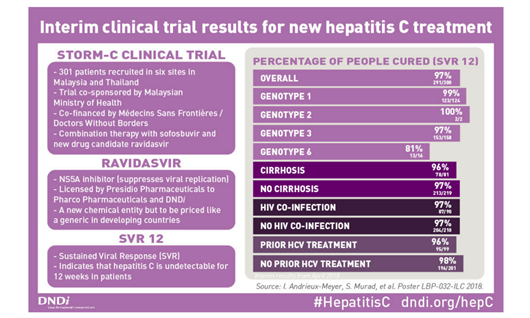
В мире насчитывается около 70 миллионов человек с вирусным гепатитом С, хотя доступ к терапии ограничен высокими ценами на препараты и отсутствием инвестиций государства в здравоохранение и в лечебно-профилактические программы. Доступный по цене пангенотипичный вариант терапии позволит многим странам с низким и средним уровнем дохода населения расширить доступ населения к терапии ВГС без необходимости в проведении генотипирования, что позволит снизить стоимость обследования и лечения каждого пациента. Показатель излечиваемости оказался на очень высоком уровне. По результатам анализа всех участников, у 97% удалось достичь стойкого вирусологического ответа (у 99% с генотипом 1а, у 100% с генотипом 1b и 2 и у 97% с генотипом 3). Уровень излечиваемости среди лиц с генотипом 6 был несколько ниже и составил 81%.
Скотт Джонсон (Scott Johnson) на Международном конгрессе заболеваний печени 2018. Фотограф Лиз Хайлимэн При начале ВГС-терапии на стадиях фиброза печени F0 / F1, пожизненный риск развития декомпенсированного цирроза составит всего 4%. Этот показатель повысится до 11,6%, если терапия будет начинаться на стадии F4 фиброза. Отсрочка лечения даже до появления признаков фиброза F2 приведет к повышению риска декомпенсированного цирроза до 8,9%. Повышение пожизненного риска развития гепатоцеллюлярного карциномы (ГЦК) и смертельного исхода особенно четко будет прослеживаться среди лиц, начинающих терапию в стадии F4 фиброза. Модель показала, что риск развития ГЦК и риск смертельного исхода по причине любых печеночных осложнений в этой группе населения составит 35,2% и 41,1% соответственно. Затраты на медицинское обслуживание пациентов, начинающих терапию на стадии F0/F1, составит £32 966. Отсрочка терапии до стадии F4 приведет к повышению затрат до £60 963 за счет дополнительных затрат, необходимых для лечения цирроза печени. Проведение терапии будет высокоэкономичным при начале терапии на стадиях фиброза F0/F1 или F2/F3.
Алисон Бойле (Alison Boyle) на Международном конгрессе заболеваний печени 2018. Фотография из архива: @katjc1 Успешное лечение случаев ВГС генотипа 3 может быть завершено в течение 8 недель у лиц без признаков цирроза - по данным трех исследований, представленных на Конгрессе.
Маркус Корнберг на Международном конгрессе заболеваний печени 2018. Фотограф Лиз Хайлимэн Предварительные результаты были доступны у 314 участников из группы 8-недельной терапии, у которых к этому времени уже были получены результаты контрольного анализа на 4 неделе после завершения терапии (СВО4) и у 44 участников, у которых уже были доступны окончательные результаты контрольных анализов СВО12. В каждой группе, только у одного представителя на этом этапе определялся рецидив заболевания, что по данным СВО4 и СВО12 приравнивался к уровню излечиваемости 99,7% и 97,7% соответственно.
|