Синтез днк на матрице и-рнк у вирусов

ТРАНСКРИПЦИЯ (от лат. transcriptio, букв-переписывание), биосинтез РНК на матрице ДНК; первая стадия реализации генетич. информации, в ходе к-рой нуклеотидная последовательность ДНК считывается в виде нуклеотидной последовательности РНК (см. Генетический код ). В основе этого процесса лежит принцип комплементарного спаривания пуриновых и пиримидиновых оснований (см. Комплементарность ). Т. осуществляется с участием фермента РНК-полимеразы , использующей в качестве субстратов рибонуклеозидтрифосфаты. Кроме того, в транскрипции участвует большое число вспомогат. белков, регулирующих работу РНК-полимеразы.
Т. происходит на участках ДНК, наз. единицами Т. или трапскриптонами. В начале и конце транскрилтона расположены специфич. нуклеотидные последовательности -соотв. промотор и терминатор. Существование множества транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У животных, растений и др. эукариот в состав транскриптона, как правило, входит один ген. Транскриптоны бактерий обычно наз. оперонами; мн. из них содержат по неск. генов, обычно функционально связанных (напр., кодирующих неск. ферментов, участвующих в синтезе той или иной аминокислоты).
Процесс синтеза РНК можно разделить на четыре основные стадии: 1) связывание РНК-полимеразы с промотором, 2) начало синтеза цепи РНК (инициация), 3) рост цепи РНК (элонгация), 4) завершение синтеза цепи РНК (терминация).
Связывание РНК-полимеразы с промотором включает по крайней мере два этапа. На первом РНК-полимераза образует с промотором закрытый комплекс, в к-ром ДНК сохраняет двухспиральную структуру, а РНК-полимераза еще не способна начать синтез РНК. На втором закрытый комплекс превращается в открытый, в к-ром РНК-полимераза расплетает примерно один виток двойной спирали ДНК в районе стартовой точки-нуклеотида, с к-рого начинается комплементарное копирование матрицы.
При наличии субстратов РНК-полимераза в открытом комплексе осуществляет инициацию. Первый нуклеотид (обычно это аденозин- или гуанозинтрифосфат) входит в состав цепи целиком, а последующие присоединяются к группе 3'-ОН предыдущего нуклеотида с образованием фосфодиэфирной связи и освобождением пирофосфата (см. Нуклеиновые кислоты ). На стадии инициации образующаяся РНК связана с матрицей и ферментом непрочно и может отделиться от комплекса. В этом случае РНК-полимераза, не покидая промотора, снова инициирует РНК (такой синтез коротких рибонуклеотидов наз. абортивным). Стадия инициации завершается, когда цепь РНК достигает критич. длины (от 3 до 9 нуклеотидов на разных промоторах); при этом от РНК-полимеразы отделяется s -субъединица.
Считают, что в процессе элонгации примерно 13 нуклеотидов РНК образуют гибридную спираль с матричной нитью расплетенной ДНК (всего на этой стадии в ДНК расплетено примерно 18 нуклеотидов). По мере движения РНК-полимеразы по матрице впереди нее происходит расплетание, а позади восстановление двойной спирали ДНК. Одновременно происходит вытеснение очередного звена растущей цепи РНК из комплекса с матрицей.
Цепь РНК растет в направлении 5' : 3' по мере продвижения РНК-полимеразы по цепи ДНК в направлении от 3'-конца к 5'-концу. Средняя скорость роста цепи РНК у бактерии Escherichia coli (E. coli) составляет 40-45 рибонуклеотидов в секунду. В процессе удлинения цепи РНК фермент движется по ДНК с непостоянной скоростью. В нек-рых участках матрицы происходят длительные задержки в его продвижении, т. наз. паузы (нек-рые стадии Т. показаны на рис.).

На стадии злонгации в состав транскрибирующего комплекса входит ряд дополнит. белков, от к-рых зависит протекание завершающей стадии транскрипции -терминации. Один из таких белков, кодируемых геном nusA E . coli, занимает в РНК-полимеразе место s -субъединицы. Др. бактериальный фактор терминации r взаимод. с РНК.
Терминация Т., как правило, происходит в строго определенных участках матрицы - терминаторах, в к-рых от матрицы отделяются РНК и РНК-полимераза; последняя, объединившись со свободной s -субъединицей, может вступить в следующий цикл Т. В терминаторах, для узнавания к-рых РНК-полимеразе не требуется фактора р, нуклеотидная последовательность характеризуется двумя особенностями: по ходу Т. перед точкой терминации расположен участок, богатый парами dG-dC (дезоксигуанозин-дезоксицитидин), а затем участок, состоящий из 4-8 расположенных подряд остатков дезоксиадениловой к-ты. Предполагают, что после прохождения РНК-полимеразой участка, богатого dG-dC, в РНК возникает шпилька, к-рая препятствует продвижению фермента и разрушает часть спирали РНК-ДНК транскрибирующего комплекса. Оставшаяся часть гибридной спирали, включающая концевую полиуридиловую последовательность РНК, легко плавится (разрушается) ввиду крайней нестабильности комплементарной пары уридин-дезоксиаденозин, что и приводит к освобождению РНК.
Мн. терминаторы узнаются РНК-полимеразой только с помощью белковых факторов терминации. Из них наиб. изучен фактор r E. coli-олигомерный белок с мол. м. 46 тыс. Фактор r присоединяется к определенным участкам синтезируемой РНК (не имеющим протяженных двухспиральных структур) до того, как РНК-полимераза достигает терминатора. Предполагается, что фактор r передвигается вдоль РНК вслед за РНК-полимеразой, используя для этого энергию гидролиза нуклеозидтрифосфатов, и способствует диссоциации гибрида РНК с матричной нитью ДНК.
Скорость Т. разл. генов может отличаться в тысячи раз; в столь же больших пределах может изменяться скорость Т. одного и того же гена в разных тканях многоклеточного организма или в одной клетке в зависимости от изменяющихся внеш. условий или внутр. программы. На стадии инициации регуляция Т. осуществляется благодаря наличию особых белков-регуляторов (см. Регуляторные белки ), способных присоединяться к определенным участкам ДНК и тем самым препятствовать или помогать РНК-полимеразе инициировать синтез РНК на промоторе.
У прокариот регуляция Т. часто осуществляется на стадии терминации в особых терминаторах (называемых аттенюаторами), расположенных в начале или внутри оперонов.
Существует также обратная Т.-синтез ДНК на матрице РНК. Такой синтез осуществляется у ретровирусов (семейство РНК-содержащих вирусов) с участием фермента ревертазы (обратная транскриптаза). В ходе обратной Т. образуется вначале гибрид РНК-ДНК, к-рый реплицирует под действием ДНК-зависимой ДНК-полимеразы (см. Полидезоксирибонуклеотид-синтетазы ) с образованием двухцепочечной спирали ДНК. Последняя также подвержена репликации и способна включаться в геном инфицированной клетки и служить там матрицей для вирусной РНК. Т. обр., поток генетич. информации у ретровирусов направлен от РНК к ДНК и затем обратно к РНК.
РНК-полимеразу открыли С. Вейс, Ж. Гурвиц и О. Стивене в 1960; ими же установлено ее значение в синтезе РНК. Концепцию транскриптона (оперона) сформулировали Ф. Жакоб и Ж. Моно в 1961. X. Темин и Д. Балтимор в 1970 открыли обратную транскриптазу и механизм синтеза ДНК на РНК-матрице.
Лит.: Пташне М., Переключение генов: регуляция генной активности и фаг l , пер. с англ., М., 1988; Молекулярная биология. Структура и биосинтез нуклеиновых кислот, М., 1990. В. Г. Никифоров .
ДНК-зависимая РНК-полимераза может осуществлять транскрипцию ДНК нормальных клеток и ДНК-вирусов. Как же осуществляется синтез РНК у тех вирусов, которые в геноме вместо ДНК содержат РНК? Оказывается, в этих случаях вирусная РНК индуцирует образование в клетках хозяина (например, у Е. coli) РНК-зависимой РНК-полимеразы, которая участвует в репликации вирусной РНК (отсюда второе название фермента – РНК-репликаза). Фермент также используется нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. Этот синтез должен пройти через стадию образования репликативной формы. Следовательно, на I стадии РНК-репликаза на матрице РНК-вируса специфически строит комплементарную, с противоположной полярностью цепь РНК. Последняя на II стадии служит матрицей для синтеза РНК, совершенно однотипной исходной вирусной РНК. Обе стадии катализируются одним и тем же ферментом, хотя в каждой из них участвуют различные белковые факторы. Следует особо подчеркнуть, что, поскольку РНК-репликаза имеет отношение только к вирусам, очевидно, на этом основании могут быть разработаны эффективные антивирусные лекарственные препараты.
Синтез РНК из нуклеозиддифосфатов. М. Грюнберг-Манаго и С. Очоа в 1955 г. в клетках Е. coli открыли особый фермент – полинуклеотид-фос-форилазу. Этот фермент наделен способностью синтезировать in vitro полимерную молекулу РНК из однотипных или разных рибонуклеозид-дифосфатов (НДФ). Реакция, являющаяся обратимой, протекает по уравнению:
Рибонуклеозидтрифосфаты и дезоксирибонуклеозидтрифосфаты не являются субстратами фермента. Фермент не нуждается в матрице, однако для синтеза необходима затравочная цепь РНК (НМФ)n со свободной 3'-гидроксильной группой, к которой присоединяются остатки моно-нуклеотидов. Образовавшаяся полимерная молекула РНК не имеет заданной специфической последовательности мононуклеотидов, но содержит 3'–>5' фосфодиэфирные связи, легко разрываемые рибонуклеазой. Относительно биологической роли этого фермента у бактерий предполагают, что он катализирует, скорее всего, обратную реакцию – расщепление мРНК с образованием нуклеозиддифосфатов.
Полученные в лаборатории С.С. Дебова данные свидетельствуют о более широком распространении полирибонуклеотид-фосфорилазы в живых организмах, чем это признавалось ранее. Фермент открыт также в клетках животных. Кроме того, получены экспериментальные доказательства синтетической функции полинуклеотид-фосфорилазы. Вполне правомерно допущение, что этот фермент может принимать участие в синтезе коротких полирибонуклеотидов в клетках эукариот в норме и в некоторых экстремальных условиях. Кроме того, в лабораторных условиях фермент может найти применение для синтеза РНК-праймеров, используемых далее при синтезе ДНК.
Проблемы генетической инженерии. Генетическая инженерия, по определению А.А. Баева, представляет собой систему экспериментальных приемов, позволяющих создавать в лаборатории (в пробирке) искусственные биологические структуры. В качестве инструментов для генно-инженерных операций применяются созданные самой природой ферменты: одни из них рассекают молекулу ДНК в строго определенных участках (рестриктазы), другие, напротив, сшивают разрозненные участки в единое целое (лигазы). Конечной целью генетической инженерии является получение организмов (животных и растений) с новыми наследственными свойствами с помощью лабораторных приемов. Для достижения этой пока еще отдаленной цели необходимо проведение огромной работы на уровне отдельного гена или генов. Ген, представленный определенным участком ДНК и соответствующий определенному белку, можно или выделить из другого организма, или синтезировать химическим либо биологическим путем. Впервые в 1969 г. из Е. coli был выделен участок ДНК с геном, ответственным за синтез фермента, катализирующего усвоение молочного сахара (лактозы),– так называемый лактозный оперон. Химический синтез гена аланиновой тРНК впервые осуществил Хар Гобинд Корана в 1970 г. Состоящий из 72 нуклеотидов, этот ген, однако, лишен функциональной активности, так как в клетках тРНК синтезируется не в готовом виде, а в форме предшественника. Эти данные послужили для Кораны основой для синтеза гена-предшественника тирозиновой тРНК (из 126 нуклеоти-дов), хотя сама тирозиновая тРНК состоит из 85 нуклеотидов. Ввиду громоздкости, а также недостаточной эффективности химического синтеза в последние годы все большее место занимают биологические методы синтеза генов при помощи обратной транскриптазы (ревертазы). Для этого необходимо иметь мРНК, с помощью которой можно воспроизвести соответствующий ген. Синтезированы ДНК-копии на мРНК, кодирующие синтез белка глобина (человека, кролика, мыши, голубя, утки), иммуноглобулина, белка хрусталика глаза и др. Однако на этом пути синтеза генов встречаются большие трудности, связанные с выделением из огромного разнообразия клеточных мРНК, нужной для синтеза гена.
Следующий этап генетической инженерии – перенос генов в клетку – осуществляется тремя способами: трансформацией (перенос генов посредством выделенной из клеток и освобожденной от примесей ДНК), трансдукцией (перенос генов посредством вирусов) и гибридизацией клеток, полученных из разных организмов (высших животных, микроорганизмов и др.) (рис. 13.7, 13.8). Заключительный этап этих экспериментов сводится к адаптации введенного гена в организме хозяина, но он почти не зависит от искусства экспериментатора.
Исследования в области генетической инженерии могут служить основой для решения практических задач здравоохранения и сельского хозяйства. Полученные в лаборатории искусственные гены, помимо широкого использования в микробиологической и фармацевтической промышленности для приготовления кормового белка и лекарственных препаратов (инсулин, интерферон, гормон роста, гормоны щитовидной железы, стимуляторы иммунитета и др.), возможно, смогут применяться при лечении многих наследственных заболеваний (их насчитывается около 5000), генетический дефект которых точно известен пока только для небольшого числа (не более 50) болезней.
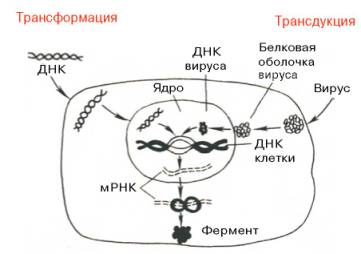
Рис. 13.7. Схематическое изображение двух способов введения генов в клетку – трансформации и трансдукции (по А. А. Баеву).
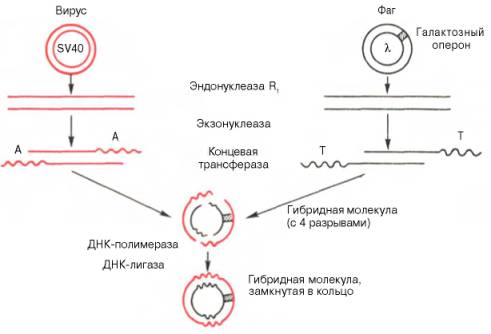
Рис. 13.8. Получение гибридной молекулы, содержащей одновременно ДНК вируса SV40, ДНК фага λ, и галактозный оперон (схема по А.А. Баеву).
Под действием эндонуклеазы R1Е. coli кольцевые ДНК разрываются в одной точке, в результате образуются линейные нити. Под действием другого фермента - экзонуклеазы (из фага) укорачиваются нити ДНК с противоположных концов. Далее при помощи фермента концевой трансферазы наращиваются нити ДНК, причем у одной ДНК новые концы состоят из адениловых (А), у другой - из тимидиловых (Т) остатков. При смешивании молекул концевые остатки А и Т образуют комплементарные пары, замыкая линейные молекулы в кольца. Вначале эти кольца содержат 4 разрыва, которые затем закрываются при участии еще одного фермента - ДНК-лигазы.

ТРАНСКРИПЦИЯ (от лат. transcriptio, букв-переписывание), биосинтез РНК на матрице ДНК; первая стадия реализации генетич. информации, в ходе к-рой нуклеотидная последовательность ДНК считывается в виде нуклеотидной последовательности РНК (см. Генетический код ). В основе этого процесса лежит принцип комплементарного спаривания пуриновых и пиримидиновых оснований (см. Комплементарность ). Т. осуществляется с участием фермента РНК-полимеразы , использующей в качестве субстратов рибонуклеозидтрифосфаты. Кроме того, в транскрипции участвует большое число вспомогат. белков, регулирующих работу РНК-полимеразы.
Т. происходит на участках ДНК, наз. единицами Т. или трапскриптонами. В начале и конце транскрилтона расположены специфич. нуклеотидные последовательности -соотв. промотор и терминатор. Существование множества транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У животных, растений и др. эукариот в состав транскриптона, как правило, входит один ген. Транскриптоны бактерий обычно наз. оперонами; мн. из них содержат по неск. генов, обычно функционально связанных (напр., кодирующих неск. ферментов, участвующих в синтезе той или иной аминокислоты).
Процесс синтеза РНК можно разделить на четыре основные стадии: 1) связывание РНК-полимеразы с промотором, 2) начало синтеза цепи РНК (инициация), 3) рост цепи РНК (элонгация), 4) завершение синтеза цепи РНК (терминация).
Связывание РНК-полимеразы с промотором включает по крайней мере два этапа. На первом РНК-полимераза образует с промотором закрытый комплекс, в к-ром ДНК сохраняет двухспиральную структуру, а РНК-полимераза еще не способна начать синтез РНК. На втором закрытый комплекс превращается в открытый, в к-ром РНК-полимераза расплетает примерно один виток двойной спирали ДНК в районе стартовой точки-нуклеотида, с к-рого начинается комплементарное копирование матрицы.
При наличии субстратов РНК-полимераза в открытом комплексе осуществляет инициацию. Первый нуклеотид (обычно это аденозин- или гуанозинтрифосфат) входит в состав цепи целиком, а последующие присоединяются к группе 3'-ОН предыдущего нуклеотида с образованием фосфодиэфирной связи и освобождением пирофосфата (см. Нуклеиновые кислоты ). На стадии инициации образующаяся РНК связана с матрицей и ферментом непрочно и может отделиться от комплекса. В этом случае РНК-полимераза, не покидая промотора, снова инициирует РНК (такой синтез коротких рибонуклеотидов наз. абортивным). Стадия инициации завершается, когда цепь РНК достигает критич. длины (от 3 до 9 нуклеотидов на разных промоторах); при этом от РНК-полимеразы отделяется s -субъединица.
Считают, что в процессе элонгации примерно 13 нуклеотидов РНК образуют гибридную спираль с матричной нитью расплетенной ДНК (всего на этой стадии в ДНК расплетено примерно 18 нуклеотидов). По мере движения РНК-полимеразы по матрице впереди нее происходит расплетание, а позади восстановление двойной спирали ДНК. Одновременно происходит вытеснение очередного звена растущей цепи РНК из комплекса с матрицей.
Цепь РНК растет в направлении 5' : 3' по мере продвижения РНК-полимеразы по цепи ДНК в направлении от 3'-конца к 5'-концу. Средняя скорость роста цепи РНК у бактерии Escherichia coli (E. coli) составляет 40-45 рибонуклеотидов в секунду. В процессе удлинения цепи РНК фермент движется по ДНК с непостоянной скоростью. В нек-рых участках матрицы происходят длительные задержки в его продвижении, т. наз. паузы (нек-рые стадии Т. показаны на рис.).

На стадии злонгации в состав транскрибирующего комплекса входит ряд дополнит. белков, от к-рых зависит протекание завершающей стадии транскрипции -терминации. Один из таких белков, кодируемых геном nusA E . coli, занимает в РНК-полимеразе место s -субъединицы. Др. бактериальный фактор терминации r взаимод. с РНК.
Терминация Т., как правило, происходит в строго определенных участках матрицы - терминаторах, в к-рых от матрицы отделяются РНК и РНК-полимераза; последняя, объединившись со свободной s -субъединицей, может вступить в следующий цикл Т. В терминаторах, для узнавания к-рых РНК-полимеразе не требуется фактора р, нуклеотидная последовательность характеризуется двумя особенностями: по ходу Т. перед точкой терминации расположен участок, богатый парами dG-dC (дезоксигуанозин-дезоксицитидин), а затем участок, состоящий из 4-8 расположенных подряд остатков дезоксиадениловой к-ты. Предполагают, что после прохождения РНК-полимеразой участка, богатого dG-dC, в РНК возникает шпилька, к-рая препятствует продвижению фермента и разрушает часть спирали РНК-ДНК транскрибирующего комплекса. Оставшаяся часть гибридной спирали, включающая концевую полиуридиловую последовательность РНК, легко плавится (разрушается) ввиду крайней нестабильности комплементарной пары уридин-дезоксиаденозин, что и приводит к освобождению РНК.
Мн. терминаторы узнаются РНК-полимеразой только с помощью белковых факторов терминации. Из них наиб. изучен фактор r E. coli-олигомерный белок с мол. м. 46 тыс. Фактор r присоединяется к определенным участкам синтезируемой РНК (не имеющим протяженных двухспиральных структур) до того, как РНК-полимераза достигает терминатора. Предполагается, что фактор r передвигается вдоль РНК вслед за РНК-полимеразой, используя для этого энергию гидролиза нуклеозидтрифосфатов, и способствует диссоциации гибрида РНК с матричной нитью ДНК.
Скорость Т. разл. генов может отличаться в тысячи раз; в столь же больших пределах может изменяться скорость Т. одного и того же гена в разных тканях многоклеточного организма или в одной клетке в зависимости от изменяющихся внеш. условий или внутр. программы. На стадии инициации регуляция Т. осуществляется благодаря наличию особых белков-регуляторов (см. Регуляторные белки ), способных присоединяться к определенным участкам ДНК и тем самым препятствовать или помогать РНК-полимеразе инициировать синтез РНК на промоторе.
У прокариот регуляция Т. часто осуществляется на стадии терминации в особых терминаторах (называемых аттенюаторами), расположенных в начале или внутри оперонов.
Существует также обратная Т.-синтез ДНК на матрице РНК. Такой синтез осуществляется у ретровирусов (семейство РНК-содержащих вирусов) с участием фермента ревертазы (обратная транскриптаза). В ходе обратной Т. образуется вначале гибрид РНК-ДНК, к-рый реплицирует под действием ДНК-зависимой ДНК-полимеразы (см. Полидезоксирибонуклеотид-синтетазы ) с образованием двухцепочечной спирали ДНК. Последняя также подвержена репликации и способна включаться в геном инфицированной клетки и служить там матрицей для вирусной РНК. Т. обр., поток генетич. информации у ретровирусов направлен от РНК к ДНК и затем обратно к РНК.
РНК-полимеразу открыли С. Вейс, Ж. Гурвиц и О. Стивене в 1960; ими же установлено ее значение в синтезе РНК. Концепцию транскриптона (оперона) сформулировали Ф. Жакоб и Ж. Моно в 1961. X. Темин и Д. Балтимор в 1970 открыли обратную транскриптазу и механизм синтеза ДНК на РНК-матрице.
Лит.: Пташне М., Переключение генов: регуляция генной активности и фаг l , пер. с англ., М., 1988; Молекулярная биология. Структура и биосинтез нуклеиновых кислот, М., 1990. В. Г. Никифоров .
§ 15. ПЕРЕНОС ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ В КЛЕТКЕ:
РЕПЛИКАЦИЯ, ТРАНСКРИПЦИЯ
В процессе размножения клеток генетическая информация передается от одного поколения клеток другому. При этом все клетки получают одинаковую информацию. Это, возможно, вследствие того, что перед делением клетки осуществляется репликация (удвоение) ДНК, в результате образуются две идентичные молекулы ДНК, которые и передаются потомкам. В структуре ДНК заложена способность этой молекулы к копированию.
Закодированная в ДНК генетическая информация реализуется в результате экспрессии генов. Экспрессия генов включает транскрипцию (копирование информации с ДНК на синтезируемую РНК) и последующую трансляцию (синтез на матрице РНК соответствующего белка).
Возможен поток информации и в направлении от РНК к ДНК, этот процесс носит название обратная транскрипция. В то же время информация не передается от белков нуклеиновым кислотам. Однако следует отметить, что белки играют важную роль в осуществлении процессов передачи информации, как между нуклеиновыми кислотами, так и от нуклеиновых кислот к белкам.
Описанные информационные взаимоотношения между ДНК, РНК и белками могут быть представлены в виде схемы:
Рассмотрим более подробно процессы репликации, транскрипции и трансляции.
Интересно знать! В 1982 году Р.Д.Пальмитер с коллегами опубликовали фотографию, на которой рядом сидели две мыши. Одна из них была трансгенной, в ее ДНК встроили ген гормона роста крысы, другая была обычной мышкой. Трансгенная мышь в сравнении с обычной имела в два раза большие размеры. Причиной тому была экспрессия гена гормона роста, в результате которой у мыши синтезировался соответствующий гормон, который и определил ее гигантские размеры.
Рис. 44. В результате репликации образуются две дочерние молекулы ДНК.
Репликация ДНК
В основе репликации, или удвоения, ДНК лежит принцип комплементарности. Репликация начинается с разделения цепей, каждая из которых становится матрицей, определяющей нуклеотидную последовательность новой комплементарной цепи (рис. 44). В результате репликации образуются две дочерние молекулы ДНК, нуклеотидные последовательности которых идентичны между собой и с материнской молекулой ДНК. При этом две дочерние молекулы ДНК содержат одну вновь синтезированную (дочернюю) и одну материнскую цепи ДНК.
Субстратом для синтеза ДНК являются дезоксинуклеотид-5’-трифосфаты: дАТФ, дГТФ, дЦТФ и дТТФ. Уравнение этой реакции в простейшей виде выглядит так:
Данную реакцию катализирует фермент ДНК-полимераза. Она последовательно добавляет нуклеотиды к 3’-концу полинуклеотидной цепи. Следовательно, синтез новой цепи происходит в направлении от 5’-конца к 3’-концу. ДНК-полимераза может только наращивать цепь ДНК, начать же синтез ДНК с нуля она не может, т.е. для ее работы требуется цепь-затравка. ДНК-полимераза способна удлинять цепь только в присутствии цепи, играющей роль матрицы (рис. 45.). Нуклеотиды присоединяются к цепи-затравке в соответствии с принципом комплементарности, напротив аденина всегда будет встроен тимин, а напротив гуанина – цитозин.
Итогом репликации является образование двух дочерних молекул ДНК, являющихся точными копиями материнской. Благодаря этому возможна передача идентичной генетической информации от клетки к клетке.
Рис. 45. ДНК-полимераза наращивает цепь в направлении 5’
3’.
Для этого ей нужны матрица и затравка
Транскрипция
В результате транскрипции происходит синтез цепи РНК, нуклеотидная последовательность которой комплементарна одной из цепей ДНК; при этом генетическая информация, содержащаяся в ДНК, передается молекуле РНК. В результате транскрипции образуются три класса РНК: иРНК, тРНК, рРНК. Поскольку в основе транскрипции лежит принцип комплементарности, этот процесс имеет определенное сходство с репликацией. Однако между ними существует и важное различие. Если в процессе репликации копируется вся молекула ДНК, то при транскрипции транскрибируется только ее незначительная часть. Катализирует синтез РНК фермент РНК-полимераза. Транскрибируемый участок ДНК ограничен со стороны 3’-конца промотором, – участком с которым связывается РНК-полимераза, со стороны 5’-конца – терминатором – участком, в котором прерывается синтез РНК. Последовательность ДНК, ограниченная промотором и терминатором, представляет собой единицу транскрипции – транскриптон (рис. 46).
Рис. 46. Транскриптон
РНК-полимераза в качестве субстратов для синтеза РНК использует рибонуклеозид-5’-фосфаты (АТФ, ГТФ, ЦТФ и УТФ). Она удлиняет цепь, присоединяя нуклеотиды к 3’-концу, т.е. так же, как и ДНК-полимераза, наращивает цепь в направлении5’®3’. Этот фермент требует для своей работы в качестве матрицы одну из цепей ДНК. Из двух цепей ДНК транскрибируется только одна. В отличие от ДНК-полимеразы, РНК-полимераза не нуждается в затравке. Удлинение цепи РНК описывается уравнением:
Нуклеотиды присоединяются к цепи в соответствии с принципом комплементарности. Напротив аденина матричной цепи ДНК в растущую цепь РНК всегда будет встроен урацил, напротив гуанина – цитозин, напротив тимина – аденин и напротив цитозина – гуанин соответственно. Т.о., образовавшаяся в результате транскрипции РНК комплементарна матричной цепи ДНК (рис. 47).
Рис. 47. Образовавшаяся в результате транскрипции РНК комплементарна матричной цепи ДНК
В процессе транскрипции выделяют три стадии: инициацию, элонгацию и терминацию. На стадии инициации РНК-полимераза, взаимодействуя с промотором, вызывает расхождение цепей ДНК и начинает синтез молекулы РНК. В ходе элонгации новосинтезированная цепь РНК образует (за счет спаривания ее оснований с основаниями матричной цепи ДНК) короткие отрезки гибридной двойной спирали ДНК – РНК, которые необходимы для правильного считывания цепи ДНК. Как только РНК-полимераза достигнет терминирующих последовательностей, запускается последняя стадия – терминация. По ее завершении происходит освобождение вновь синтезированной цепи РНК (рис. 48).
Рис. 48. Стадии транскрипции
Синтезированные молекулы РНК могут подвергаться посттранскрипционным ковалентным модификациям, так называемому процессингу (созреванию). Наиболее ярко процессинг выражен у эукариот.
Процессинг РНК
Рассмотрим процессинг иРНК эукариот.
иРНК синтезируется в виде предшественника пре-иРНК. Модификация пре-иРНК начинается на стадии элонгации, в это время происходит кэпирование 5’-конца. Остаток ГТФ присоединяется своим 5’-концом к 5’-концу пре-иРНК с образованием так называемого кэпа. После завершения транскрипции к 3’-концу присоединяется полиА-последовательность, состоящая из 100 – 200 последовательно соединенных адениновых нуклеотидов. В составе пре-иРНК могут содержаться интроны и экзоны. Интроны при созревании РНК вырезаются, концы экзонов соединяются друг с другом. Этот процесс называется сплайсингом. В результате сплайсинга зрелая молекула иРНК становится приблизительно в 4 раза короче пре-иРНК. Этапы процессинга иРНК представлены на рис. 49. Процессинг для иРНК прокариот не характерен.
Рис. 49. Процессинг иРНК
рРНК и тРНК также синтезируются в виде более длинных предшественников, которые затем расщепляются и модифицируются. У прокариот рРНК представлены тремя молекулами: 16S-рРНК, 23S-рРНК и 5S-рРНК, у эукариот – четырьмя: 18S-рРНК, 28S-рРНК, 5,8S-рРНК и 5S-рРНК. рРНК как прокариот, так и эукариот образуются из предшественников – пре-рРНК. Предшественник расщепляется, образуя индивидуальные рРНК (рис. 50). рРНК и тРНК не содержат кэпа и полиА-последовательности. У эукариот рРНК и тРНК могут подвергаться сплайсингу. В процессе созревания у некоторых предшественников тРНК наряду с удалением концевых последовательностей может происходить и присоединение нуклеотидных последовательностей, играющих важную роль в их функционировании.
Рис.50. Процессинг рРНК.
Обратная транскрипция
Синтез ДНК при использовании в качестве матрицы РНК носит название обратной транскрипции. Данный процесс катализирует фермент обратная транскриптаза или ревертаза. Существование обратных транскриптаз в составе РНК-содержащих вирусов было показано Г.Темином и Д. Балтимором. Обнаружение обратной транскриптазы позволило ответить на вопрос: как генетическая информация РНК-содержащих вирусов может включиться в ДНК клетки-хозяина. Процесс обратной транскрипции, катализируемый ревертазой, и последующая интеграция генетического материала в геном клетки хозяина представлены на рис. 51. В процессе обратной транскрипции вначале образуется дуплекс РНК – ДНК, затем РНК в составе этого дуплекса разрушается, синтезированная цепь ДНК далее служит матрицей для синтеза второй цепи ДНК. На заключительной стадии происходит интеграция ДНК, синтезированной в результате обратной транскрипции, в ДНК клетки-хозяина. Обратные транскриптазы способны синтезировать ДНК, комплементарную самым различным РНК. Благодаря этой особенности ревертаза нашла широкое применение в научных исследованиях. С помощью обратной транскриптазы можно получить, например, искусственный ген, используя в качестве матрицы иРНК.
Читайте также:


