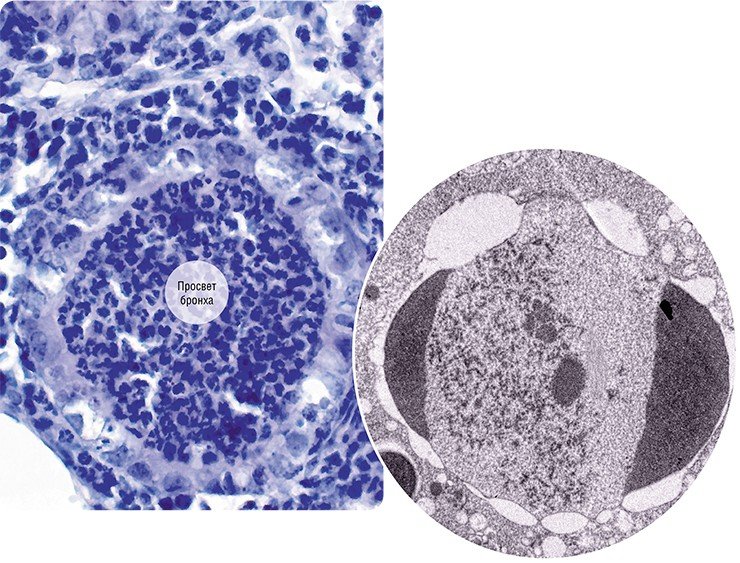
Репликация вируса гриппа происходит в эпителиоцитах
С поверхностными белками (H, N) связана высокая антигенная изменчивость вирусов гриппа. Она определяет рецидивы эпидемической агрессивности вируса типа А, меньше проявляется у вируса типа В и, по-видимому, не имеет практического значения для гриппа С (см. ниже).
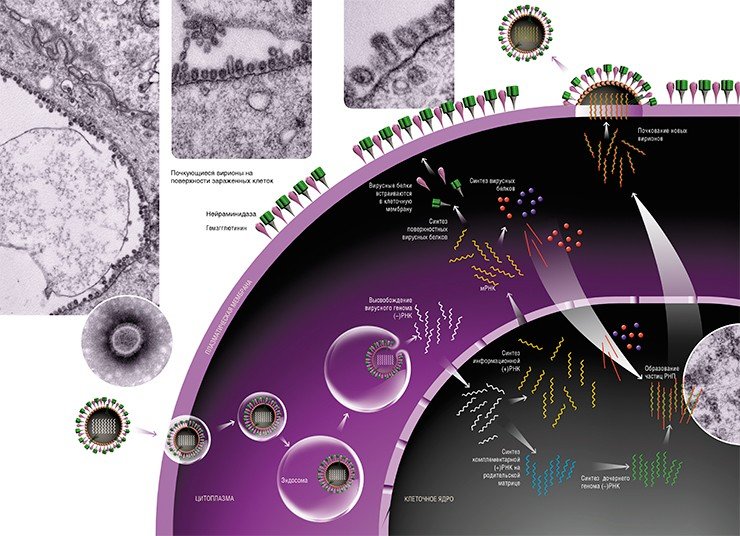
Вирус проникает в клетку путем эндоцитоза после связывания гемагглютинина с сиалированными клеточными рецепторами. Фагосома (эндосома), в которую заключен вирус, сливается с лизосомами. Кислая среда внутри фаголизосомы меняет конформацию гемагглютинина, обнажая пептиды, вызывающие слияние вирусной и эндосомальной мембран. Благодаря этому нуклеокапсид освобождается от суперкапсида и выходит в цитоплазму. Отсюда вместе с М-белком он быстро транспортируется в ядро, где уже через несколько минут после заражения появляются первые РНК-транскрипты. Число разновидностей мРНК соответствует количеству сегментов геномной РНК, хотя спектр синтезируемых белков несколько больше: к структурным белкам вириона добавляется 3 неструктурных белка, принимающих участие в репликации вируса. Расширение генетической емкости РНК достигается благодаря изящному механизму — повторной трансляции одной и той же мРНК со сдвигом рамки считывания ее генетического кода.
Ортомиксовирусы едва ли не единственные из РНК-вирусов, манипулирующие со своей геномной молекулой в ядре зараженной клетки. Клетки не умеют транскрибировать РНК, поэтому операции такого рода обязан производить сам вирус. Толчок дает полимеразный комплекс вириона, позже начинают работать вновь синтезированные ферменты. Белки РВ1 и РВ2 обеспечивают копирование геномных фрагментов с образованием неполных и полных по длине транскриптов. Укороченные копии выполняют функции мРНК. Для этого они подвергаются доработке, обретая облик, привычный для мРНК клетки (присоединение к 5`-концу шапочки из метилированных нуклеотидов и полиаденилирование 3`-конца). Не располагая собственными ресурсами для прямого решения этой задачи, вирус находит обходной путь. Он подключает свою эндонуклеазу (возможно, белок РА), которая откусывает недостающие фрагменты от мРНК клетки-хозяина и переносит их на вирусные РНК-транскрипты. Столь необычное и тонкое проявление молекулярного паразитизма объясняет природу внутриядерной репликации вирусов гриппа: только здесь они могут найти свежие (еще не связавшиеся с белком) мРНК, чувствительные к вирусной эндонуклеазе.
Полные по длине РНК-транскрипты не модифицируются и поэтому не могут работать как мРНК. Они остаются в ядре и служат матрицей для образования репликативных РНК, идущих на построение новых нуклеокапсидов. В этом принимает участие РНК-полимераза, образующаяся при помощи первых мРНК.
Готовые мРНК переправляются в цитоплазму, где транслируются на рибосомах в вирусные белки. Часть синтезированных белков вновь переходят в ядро и после комплексации с репликативными РНК образуют нуклеокапсиды. Гемагглютинин и нейраминидаза включаются в плазматическую мембрану, готовя фрагменты будущего суперкапсида. С внутренней стороны липидного бислоя к ним присоединяется М-белок, который ориентирует закрепление нуклеокапсидов в зонах почкования новых вирионов. При отделении от клеток вирус получает суперкапсид с его важнейшими атрибутами — гемагглютинином и нейраминидазой (рис. 4, 5).
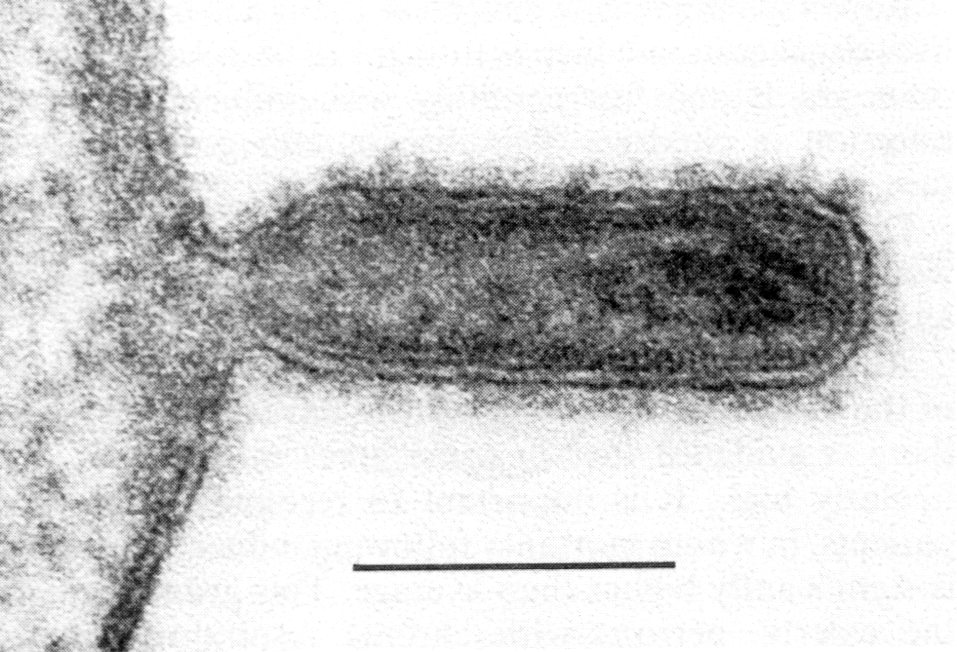
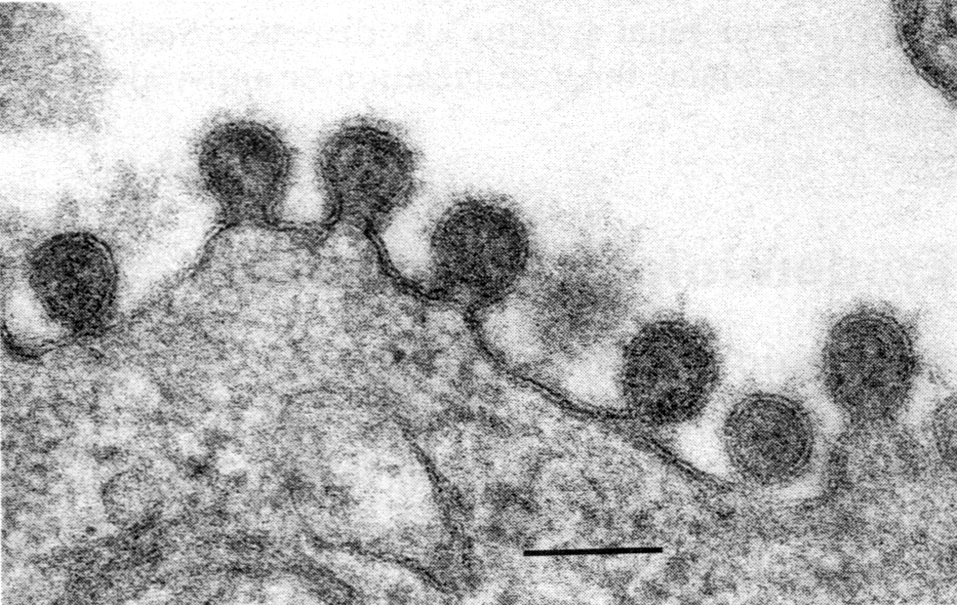
Рис. 4. Почкование вируса гриппа (палочковидные и сферические частицы). Электронограмма. Полоска
соответствует 100 нм 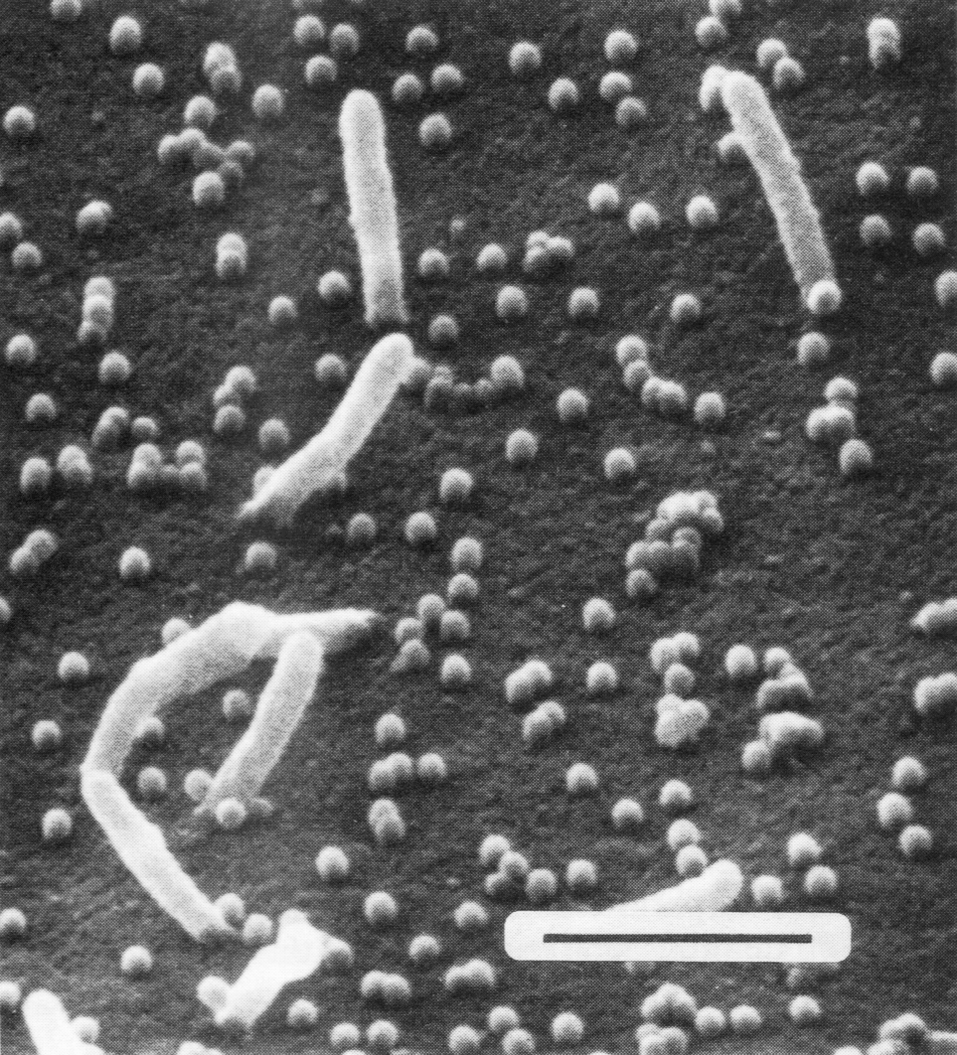
Рис. 5. Сканирующая электронограмма почкующихся вирусов гриппа. Удлиненные структуры являются микроворсинками клетки, почкующиеся вирионы выглядят как сферические частицы. Полоска соответствует 1 мкм
Как уже говорилось, гемагглютинин синтезируется в виде предшественника, который активируется клеточными протеазами (здесь корень формальной логики, породившей иллюзию о возможности лечения вирусных инфекций банальными ингибиторами протеаз). Сбрасывание созревших вирионов и их распространение на соседние клетки усиливается нейраминидазой. Репликация в чувствительных клетках происходит очень быстро, и уже через 6—8 ч в среде появляется вирусное потомство.
Впрочем, в последние годы зарегистрированы случаи заражения людей птичьими штаммами вируса А. Реальная тревога возникла в 1997 г. в Гонконге, когда 18 человек напрямую заразились от домашних птиц вирусом H5N1; 6 человек погибло. В 2003 г. высоковирулентные штаммы птиц H5N1 и H7N7 спровоцировали фатальные случаи гриппа среди жителей Южной Азии. К счастью, они не получили распространения, но тем не менее очертили круг задач, решение которых необходимо для профилактики новых гриппозных пандемий.
Вирусы типов В и С являются сугубо человеческими и в естественных условиях не инфицируют других хозяев.
Вирусы гриппа проникают в респираторный тракт с каплями аэрозоля и частицами пыли. Чем мельче их величина, тем глубже проникает вирус; самые мелкие частицы достигают бронхиол и альвеол. Главным местом размножения вируса служат реснитчатые и бокаловидные клетки слизистой оболочки верхних дыхательных путей, но инфекция может охватить весь респираторный тракт — от носовых ходов до терминальных бронхиол и альвеол. Благодаря короткому репликативному циклу из каждой вирусной частицы к концу первых суток возникает огромное потомство — 10 27 . Это объясняет короткий инкубационный период (1—3 сут) и острейшее начало гриппа.
Повреждение зараженных эпителиоцитов индуцирует воспалительную реакцию, в которой преобладают макрофаги и лимфоциты. Подвергаясь активации, они секретируют множество флогогенных начал (прежде всего цитокинов), которые вызывают общую интоксикацию и поддерживают местный воспалительный процесс. В типичных случаях после внезапного недомогания, озноба с быстрым повышением температуры до 38—40 о С, головной и часто мышечных болей развиваются симптомы поражения верхних (ринит, фарингит) и глубжележащих (ларингит, трахеобронхит) дыхательных путей. Общая интоксикация характерна для гриппа, но часто доминируют местные проявления. Наиболее тяжело протекает грипп А (хотя история эпидемий убеждает в вариабельности этого признака); вирусы типа В и, особенно, С менее агрессивны. В целом, опираясь только на клинику, отличить грипп от других ОРЗ практически невозможно. Без лабораторного подтверждения это удается лишь в сочетании с эпидемиологическим диагнозом, на фоне вспышки гриппа среди населения.

Острые респираторные вирусные инфекции (ОРВИ) из всех заболеваний являются наиболее частыми. С ними на амбулаторном приеме сталкиваются врачи всех специальностей. В современных условиях, когда развита миграция населения, концентрация населения в мегаполисах, активные коммуникации, вирусы широко распространяются и вызывают различные заболевания[(7]).
Среди всех инфекционных заболеваний распространенность гриппа и ОРВИ составляет 90-–95%. Доля гриппа в разные эпидемии в России варьирует от 10 до 60% [(3]). Кроме эпидемических вспышек в прошлом столетии, в мире зафиксированы 4 пандемии [(23]). Широкая распространенность заболевания обусловлена легкостью передачи источника инфекции воздушно-капельным путем. Актуальность проблемы обусловлена не только высокими цифрами распространенности, но и высокими цифрами смертности от, казалось бы, безобидного заболевания, которые составляют от 250 до 500 тыс.яч человек. в год [(12]). Случаи инвалидности и смерти пациентов от ОРВИ составляют 6% [(22]).
Кроме того, ОРВИ – экономическая проблема, ущерб от которой составляет 86% от приносимого ущерба всеми инфекционными заболеваниями [(3]).
Этиологическая диагностика в ежедневной практике затруднена. Врач на первичном приеме не может точно определить, каким вирусом вызвана инфекция у конкретного пациента. Имея время лишь для сбора жалоб и анамнеза при классической клинической картине, врач может только предположить влияние того или иного вируса. Поэтому практические врачи вынуждены опираться на данные литературы. При ее анализе мы столкнулись с разными позициями, которые содержатся в российских и зарубежных источниках. Российские данные приведены в таблице 1 [(2)].
При попадании вируса в эпителиоциты, чаще всего в реснитчатый эпителий носовой полости, происходит его размножение. Затем эпителиоцит гибнет, происходит нарушение целостности слизистой оболочки носа, что клинически выражается в появлении еёе отека. В зоне остиомеатального комплекса, отек способствует присоединению бактериальной инфекции и развитию риносинусита. Созданные условия способствуют также, распространению вирусной инфекции. Один из медиаторов воспаления, участвующий в реакции на респираторную вирусную инфекцию, –- гистамин. Доказано, что концентрация гистамина на 3-–5 сутки. ОРВИ достигает концентрации, сравнимой с аллергическим воспалением [(24]). Возможно, поэтому клиника ОРВИ и аллергического ринита по ряду симптомов сходна.
Основным симптомом ОРВИ является ринорея. Выделения из носа, как правило, слизистого характера. Возможно появление болей и першения в горле. Кроме того, страдает общее состояние: лихорадка, слабость, головные боли (не лицевые боли). Различные возбудители определяют особенности клинической картины (табл. 3).
Очень частое осложнение на фоне ОРВИ – острый риносинусит (ОРС).
ОРС – это воспаление слизистой оболочки носа и околоносовых пазух [(18]).
В Европейских рекомендациях по лечению острого и хронического риносинусита опубликована классификация ОРС (табл. 4) [(18]). (табл. 4)
Этиотропную лабораторную диагностику проводить в ежедневной практике трудно.
К сожалению, во время рутинного приема врачам первичного звена приходится ориентироваться на клинические признаки.
Рентгенография ОНП входит в российские стандарты диагностики ОРС. Но, учитывая, что бактериальный риносинусит чаще всего развивается к 10-му дню ОРВИ, желательно проводить рентгенографию ОНП не ранее 7-го дня заболевания ОРВИ или при выраженных симптомах, которые указывают на наличие гноя в ОНП. Значимость рентгенографии околоносовых пазух (ОНП) равна правильно собранному анамнезу [(18]).
Показаниями для проведения КТ ОНП при ОРС являются: подозрение на внутричерепные и орбитальные осложнения [(18]). Еще одно показание для проведения КТ ОНП – рецидивирующий риносинусит, когда необходимо установить причину рецидивов ОРС.
Оториноларингологи находятся в более выгодной позиции по сравнению с врачами общей практики и терапевтами, т.ак как. в их арсенале имеется передняя риноскопия и эндоскопической осмотр полости носа и носоглотки.
При проведении эндоскопического осмотра носа и носоглотки возможно не только выявить наличие гнойного отделяемого в носовых ходах (рис. 1), но и предположить локализацию воспалительного процесса в околоносовых пазухах. При наличии гнойного отделяемого в носовых ходах и других клинических признаках бактериального риносинусита, которые описаны выше, необходимо назначать системную антибиотикотерапию. Если при эндоскопическом осмотре, отделяемое в носовой полости слизистого характера, визуализируется отек слизистой оболочки (рис. 2), при этом срок заболевания ОРВИ не превышает 5 дней, то назначение системной антибиотикотерапии не требуется.
Лечение
На сегодняшний день тревогу вызывает глобальная проблема – избыточное назначение системных антибиотиков при ОРВИ. Применение АБ у пациентов с ОРЗ не ускоряет выздоровление и не рекомендуется. Это подтверждается исследованиями с самым высоким уровнем доказательной медицины (уровень А). Исследования, в которых бы оценивалась эффективность применения антибиотиков для профилактики осложнений ОРЗ, не проводились. Раннее назначение антибиотиков детям с ОРЗ не предотвращает развитияе пневмонии или острого отита [(19]).
Этиологическое лечение должно включать различные эффективные противовирусные препараты. К ним относятся амантадин [(Hayetal. 1985)(26]), ингибиторы нейроаминидазы [(CalfeeandHayden 1998)(27)–29] и аналоги нуклеозидов(Fyleetal. 1978 (28); Hruskaetal. 1990 (29)). С одной стороны, такая терапия имеет ограниченную эффективность, с другой стороны, побочные эффекты и системная токсичность ограничивают их применение, особенно в педиатрии и в гериатрии, а также у скомпрометированных пациентов [(Reusser 1996 (30); Baconetal.2003 (31); Haydenetal. 1983 (32); Janaietal. 1990 (33); Englundetal.1990 (–34)]. В связи с этим проявляется огромный интерес к растительным составам с низкой токсичностью и хорошей переносимостью. Также в терапии гриппа применяются вирулицидные препараты (оксолиновая кислота), интерфероны и индукторы интерферона.
Противовирусные препараты, пригодные для лечения гриппа
Препараты, непосредственно влияющие на вирусы (производные адамантана, подавляющие нейроаминидазу, метилфенилтиометил-диметиламинометил-гидроксиброминдол карбоновой кислоты этиловый эфир и др.)
Производные адамантана обладают активностью против гриппа А. Механизм действия: блокирование М2-каналов эпителиоцитов, что, возможно, препятствует проникновению вируса гриппа А в клетки ресничного эпителия носовой полости.
Нейраминидаза — поверхностный гликопротеин вируса гриппа, является одним из ключевых ферментов, участвующих в репликации вирусов гриппа А и В. Она обеспечивает высвобождение вирусных частиц из инфицированной клетки и ускоряет проникновение вируса через слизистый барьер к поверхности эпителиальных клеток, обеспечивая тем самым инфицирование др.угих клеток дыхательных путей. Прием препаратов- ингибиторов нейраминидазы вирусов гриппа типа А и В (осельтамивир, занамивир), начатый не позднее 2 суток. от момента появления симптомов гриппа, оказывает терапевтический эффект.
Метилфенилтиометил-диметиламинометил-гидроксиброминдол карбоновой кислоты этиловый эфир обладает комбинированным действием: иммуностимулирующим и противовирусным. Ингибирует слияние липидной оболочки вируса с клеточными мембранами при контакте вируса с клеткой. Обладает интерферониндуцирующими свойствами, стимулирует гуморальные и клеточные реакции иммунитета, фагоцитарную функцию макрофагов, повышает устойчивость организма к вирусным инфекциям. Активен в отношении вирусов гриппа А и B.
Интерфероны и индукторы интерферона
Интерфероны выпускаются под несколькими торговыми наименованиями в форме капель, спрея, геля, суппозиториев. Применяются у взрослых и детей при первых признаках заболевания и с целью профилактики ОРВИ и гриппа: при контакте с больным и/или при переохлаждении. Для профилактики и лечения ОРВИ применяются индукторы интерферона тилорон, кагоцел [(6]).
Препараты для лечения ОРВИ должны отличаться надежностью противовирусного действия при минимальном повреждающем воздействии на клетки макроорганизма. Однако пока методы применения противовирусных средств ограничены недостаточными знаниями их фармакокинетики. Учитывая вышеизложенное, нельзя недооценивать симптоматическое лечение ОРВИ. С этой целью применяются:
• нестероидные противовоспалительные средства,
• сосудосуживающие препараты,
• антимикробные препараты,
• мукоактивные препараты,
• антигистаминные препараты,
• вакцины,
• увлажняющие и гигиенические средства,
• вяжущие препараты,
• комбинированные лекарственные препараты.
Поскольку наряду с ринореей самыми частыми жалобами пациентов и основными причинами их обращения за медицинской помощью являются лихорадка и боли различной локализации, возникает необходимость применения лекарственных средств из многочисленной группы ненаркотических анальгетиков (ННА) и нестероидных противовоспалительных средств (НПВС). Ввиду популярности среди пациентов и врачей и высокой частоты применения комбинированных средств, содержащих жаропонижающий и противовоспалительный компоненты, остановимся на их рассмотрении. Хотя одновременный прием двух средств одной группы традиционно считается нерациональным, разнонаправленность терапевтических эффектов некоторых НПВС делает подобную комбинацию не только возможной, но и желательной. Так, парацетамол, благодаря центральному механизму действия быстро снижает температуру, а ибупрофен за счет перифиерического действия дает более медленный жаропонижающий эффект, при этом имеет выраженное обезболивающее действие. Благодаря этому комбинация парацетамола и ибупрофена снижает температуру быстрее и продолжительнее, чем монопрепараты. Проведенное исследование эффективности и безопасности применения фиксированной комбинации ибупрофен/парацетамол при купировании лихорадочного и болевого синдромов различного происхождения в амбулаторно-поликлинических условиях по сравнению с терапией указанных патологических состояний монопрепаратами ибупрофен и парацетамол показало, что комбинация ибупрофен/парацетамол после первого приема оказывает выраженное антипиретическое действие, которое нарастает после второго и третьего приемов препарата в течение первых суток наблюдения, а со второго дня лечения достоверно превышает аналогичные эффекты у монопрепаратов. У пациентов с болевым синдромом комбинация ибупрофен/парацетамол после первого приема демонстрирует выраженный анальгетический эффект, который сохраняется несколько дольше, чем у монопрепаратов, прогредиентно нарастает после второго и третьего приемов в течение первых суток, а с третьего дня лечения становится устойчивым и достоверно превышает аналогичные показатели монопрепаратов [38].
Поэтому комбинация парацетамола с ибупрофеном, реализованная в препарате Ибуклин, позволяет добиться скорейшего, более длительного и выраженного лечебного эффекта при ОРВИ, нежели применение отдельных НПВС [(36]). Особо стоит отметить, что при суммировании обезболивающего эффекта побочные явления не усиливаются.
Парацетамол и ибупрофен, входящие в состав комбинированного препарата, отвечают критериям высокой эффективности и безопасности и официально рекомендуются ВОЗ и национальными программами в качестве жаропонижающих средств [(37]).
Ибуклин содержит 400 мг ибупрофена и 325 мг парацетамола. Препарат оказывает жаропонижающее, противовоспалительное, анальгезирующее действие, обусловленное неселективным ингибированием ЦОГ-–1 и ЦОГ-–2 и подавлением синтеза ПГ. Ибуклин применяется внутрь по 1 таблетке 3 раза/ в сутки. Длительность лечения – не более 3 дней в качестве жаропонижающего средства.
Помимо купирования лихорадочного синдрома, препарат может быть использован в лечении болевого синдрома средней интенсивности.
Лечение ОРВИ у пациентов с аллергопатологией
У многих пациентов отмечается латентное течение заболевания.
Между тем, ОРВИ на фоне аллергопатологии (даже скрытого течения) протекает тяжелее, характеризуется затяжным течением, торпидностью к традиционным схемам лечения ОРВИ и частым развитием осложнений.
Это обусловлено особенностями иммунного ответа у этих пациентов: снижением синтеза γ-интерферона, повышением уровня межклеточных адгезивных молекул, которые являются рецепторами к риновирусам [(22]). В свою очередь, вирусная инфекция является триггером для обострения аллергических заболеваний. Вирусы усиливают реакции гиперчувствительности как замедленного, так и немедленного типа в ответ на аллергенную стимуляцию. Блок соустий околоносовых пазух при ОРВИ у пациентов, склонных к аллергическим реакциям, наступает быстрее из-за наличия аллергического воспаления.
Основным клиническим симптомом ОРВИ и аллергического ринита (АР) является ринорея. Поэтому необходимо тщательно проводить дифференциальную диагностику этих заболеваний. Данные представлены в таблице 3.
У пациентов с аллергопатологией в анамнезе ОРВИ очень часто осложняется ОРС. Поскольку в патогенезе данного осложнения немалая доля принадлежит аллергическому компоненту, антигистаминные препараты включаются в схему лечения ОРВИ у этих пациентов [(18]).
При выборе антигистаминного препарата необходимо учитывать следующие современные требования к этой группе препаратов [(15]).
Современные требования к выбору антигистаминного препарата
• способность селективно блокировать H1-рецепторы;
• дополнительная противоаллергическая активность;
• отсутствие взаимодействия с другими лекарственными веществами и продуктами питания;
• отсутствие взаимодействия с цитохромом Р450;
• отсутствие седативного эффекта и токсических реакций, возможность назначения препарата при наличии сопутствующих заболеваний;
• быстрота развития клинического эффекта и длительное действие (на протяжении 24 часов), что позволяет назначать препарат один раз в сутки;
•
• низкая вероятность развития толерантности к препарату (тахифилаксия).
Цетрин® начинает действовать уже через 20 минут. Продолжительность эффекта более 24 часов. После курсового лечения эффект сохраняется в течение 3 суток.
Цетрин® отличается хорошей переносимостью: он практически не вызывает седативного эффекта, что позволяет его использовать пациентам, профессии которых связаны с повышенной концентрацией внимания.
Цетрин не блокирует М-холинорецепторы, поэтому его можно использовать для лечения пациентов с сопутствующей бронхиальной астмой, аденомой предстательной железы, глаукомой. Кроме того, Цетрин® не нарушает реологические свойства слизи, что важно для пациентов с продуктивным кашлем и ОРС. Препарат не обладает кардиотоксичным эффектом, не взаимодействует с другими препаратами, а также не метаболизируется в печени. Поэтому его при необходимости можно назначать одновременно с системными антибиотиками, системными кортикостероидами и другими лекарственными средствами, которые проходят метаболизм при участии цитохрома Р450.
У Цетрина® низкая вероятность развития толерантности к препарату, что позволяет применять его длительно. Применяется 1 раз в сутки, что повышает комплаентность лекарственного средства.
- 1-я группа (получала симптоматическое лечение ОРВИ и Цетрин®);
- 2-я группа (получала только симптоматическое лечение ОРВИ).
Были получены следующие результаты исследования: длительность ОРВИ в 1-й группе была значительно ниже, также в 1-первой группе не зафиксировано возникновение такого осложнения, как ОРС. Был сделан вывод, что антигистаминные препараты, в частности Цетрин®, необходимо включать в схему терапии ОРВИ у пациентов с АР [(14]).
Профилактика и лечение больных ОРВИ – актуальная и трудная задача. Несмотря на то, что ОРВИ часто протекают легко и без осложнений, все-таки эти инфекции заслуживают внимания и лечения из-за возникновения осложнений. Применение системных антибиотиков следует ограничить только бактериальными риносинуситами. Доказательная база по использованию ряда препаратов отсутствует, поэтому рекомендации для их использования остаются на уровне D.
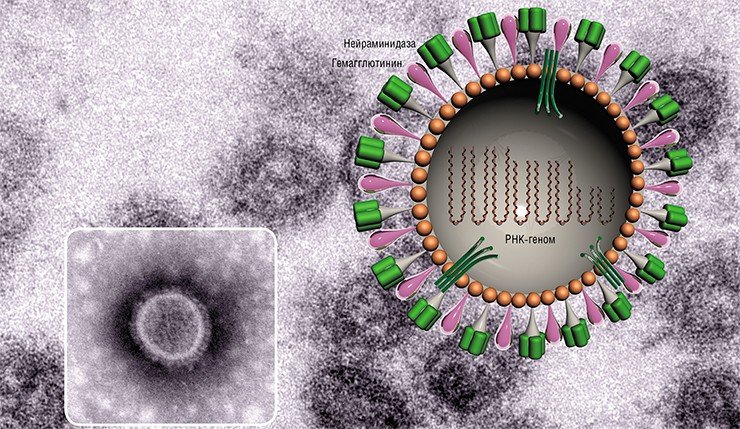
Внешне вирус гриппа выглядит как пузырек или вытянутая палочка. Под мембранной оболочкой скрывается необычный РНК-геном, состоящий из восьми отдельных частей. Поверхность щетинится шипиками, представляющими собой наружные части встроенных в мембрану белков – гемагглютинина и нейраминидазы. Именно молекулы этих двух гликопротеинов ответственны за связывание вирусной частицы с рецепторами клетки-хозяина.
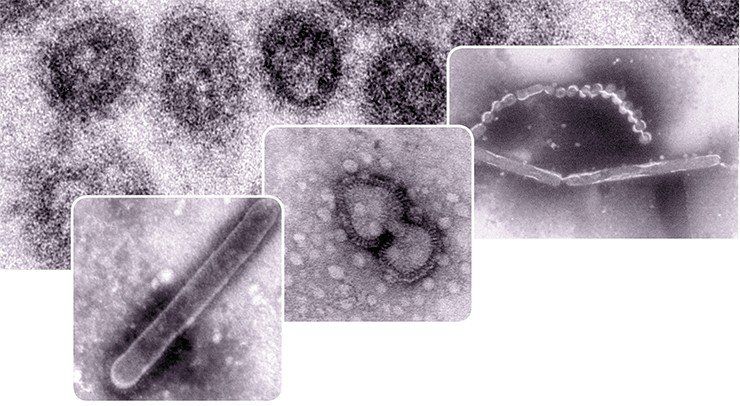
Опасные связи
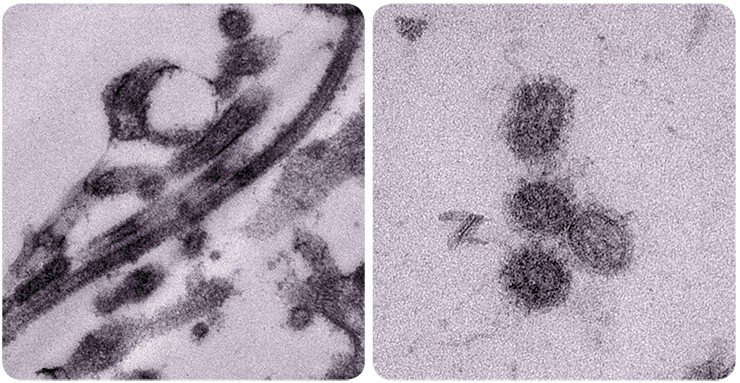
Добавим, что на стадии проникновения в клетку вирус гриппа использует еще и разные пути эндоцитоза, что повышает воздействие инфекции и позволяет с большей вероятностью избежать атаки иммунной системой.
Поэтому в ядре зараженной клетки на матрице вирусной (–)РНК сначала образуются две формы с положительной полярностью (+)РНК. Первая – комплементарная вирусная (+)РНК, которая впоследствии служит шаблонном для синтеза дочерней (–)РНК. Вторая – информационная вирусная (+)РНК, которая после сложной цепи превращений с участием клеточных ферментов транспортируется в цитоплазму клетки для будущего синтеза вирусных белков. Разумеется, все эти перемещения также обеспечиваются транспортными системами клетки.
Вот теперь все основные детали для конвейера по производству миллионов вирусных клонов готовы.
Клеточная фабрика
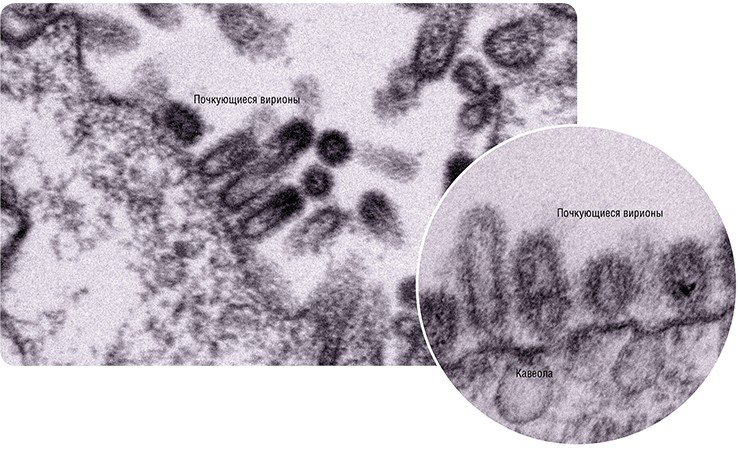
Готовые молекулы мембранных вирусных белков гемагглютинина и нейраминидазы объединяются и в таком виде транспортируются к внешней границе клетки специальными транспортными пузырьками, которые обеспечивают включение вирусных молекул в особые участки плазматической мембраны – липидные рафты (кавеолы).
На сборочном конвейере
Наступает финальный этап вирусной репродукции – формирование новых вирионов. Для того чтобы это произошло, необходимо, чтобы вирусный геном – все восемь частиц РНП, а также остальные вирусные белки, встретились в строго определенном месте.
В организме вирусное потомство оказывается в слое слизи, покрывающей внутреннюю поверхность носоглотки, и человек, чихая и кашляя, распространяет вирус с капельками слизи. Клетки, естественно, пытаются защититься от агрессора, включая механизмы интерференции и апоптоза, однако эта защита, как правило, запаздывает, и паразит успевает размножиться и заразить новые клетки. Поэтому так важно применять препараты интерферона в первые сутки (а лучше – в первые часы заболевания), чтобы предотвратить массовое заражение клеток и остановить развитие заболевания.
Нужна ли вакцинация против гриппа?
Познакомившись со сложным взаимодействием вируса гриппа с отдельной клеткой, поражаешься той виртуозности, с которой этот паразит эксплуатирует клеточные системы.
Если же перейти на уровень организма, то здесь взаимодействие вируса с хозяином определяется множеством дополнительных факторов, которые могут привести, а могут и не привести к заболеванию. Главный из этих факторов – реакция иммунной системы, и споры о том, надо ли стимулировать эту реакцию вакцинацией, не только не утихают, но становятся со временем все более острыми.
Compans R.W., Dimmock N.J. An electron microscopic study of single-cycle infection of chick embryo fibroblasts by influenza virus// Virology. 1969. V. 39. P. 499—515.
Harris A., Cardone G., Winkler D.C. et al. Influenza virus pleiomorphy characterized by cryoelectron tomography //PNAS. 2006. V. 103. P. 19123—19127.
Kim J.H., Skountzou I, Compans R, Jacob J. Original antigenic sin responses to influenza viruses// J. Immunol. 2009. V. 183. P. 294—301.
Leser G.P., Lamb R.A. Influenza virus assembly and budding in raft-derived microdomains: a quantitative analysis of the surface distribution of HA, NA and M2 proteins// Virology. 2005. V. 342. P. 215—227.
Matrosovich M., Matrosovich T., Uhlendorff J. et al. Avian-virus-like receptor specificity of the hemagglutinin impedes influenza virus replication in cultures of human airway epithelium// Virology. 2007. V. 361. P. 384—390.
Morris S.J., Nightingalea K., Smithb H. et al. Influenza A virus-induced apoptosis is a multifactorial process: Exploiting reverse genetics to elucidate the role of influenza A virus proteins in virus-induced apoptosis// Virology. 2005. V. 335. P. 198—211.
Noda T., Sagara H., Yen A. et al. Architecture of ribonucleoprotein complexes in influenza A virus particles// Nature. 2006. V. 439. P. 490—492.
В публикации использованы фотографии автора.
Автор выражает благодарность Ю. Спицыной и О. Таранову (ИХБФМ СО РАН) за помощь в обработке фотографий
Ветряная оспа: причины, симптомы, диагностика и лечение
Высокая заразность ветряной оспы (практически 100% после контакта ранее не болевшего и не привитого человека с источником инфекции) обусловлена особыми свойствами ее возбудителя – вируса варицелла зостер (Varicella Zoster) из семейства вирусов Herpesviridae. Этот вирус обладает по меньшей мере двумя редкими свойствами, одно из которых можно назвать без преувеличения уникальным:
- во-первых, в отличие от подавляющего большинства других болезнетворных вирусов, варицелла зостер имеет столь крупные размеры, что виден в обычный микроскоп,
- во-вторых, вирус ветрянки способен вызывать два заболевания, весьма отличающихся по клиническим проявлениям: 1) собственно ветряную оспу, которая развивается после первого проникновения вируса варицелла зостер в человеческий организм и 2) опоясывающий лишай или опоясывающий герпес. Второе заболевание является результатом реактивации вируса, который на протяжении многих лет может находиться в организме в латентном состоянии. Опоясывающий лишай практически всегда развивается у взрослых, переболевших ветрянкой в детском возрасте.
Возможность развития опоясывающего лишая связана с тем, что иммунитет, который развивается после перенесенной ветрянки, имеет свои особенности – он является нестерильным, то есть повторное заражение вирусом невозможно, однако после болезни не происходит полной элиминации вируса из организма
Подобно другим герпесвирусам вирус варицелла зостер проникает в ткань нервных волокон, где и пребывает в спящем состоянии на протяжении всей жизни человека.
Однако при переохлаждении или снижении активности иммунитета вирус активируется и вызывает клинические проявления опоясывающего лишая, которые значительно отличаются от проявлений ветрянки. Вместе с тем, у большинства людей, переболевших ветрянкой в детстве, на протяжении жизни реактивации вируса ветрянки не происходит.
Вместе с тем, вирус, вызывающий ветряную оспу, очень нестоек – вне человеческого организма он погибает очень быстро, в течение 10 минут. (Для сравнения: вирус полиомиелита может выживать в таких условиях на протяжении нескольких дней, а в воде – до 90-100 суток). Вирус варицелла зостер очень чувствителен к нагреванию и воздействию ультрафиолетовых лучей.
Как происходит заражение ветрянкой
Основной путь передачи вируса ветряной оспы – воздушно-капельный. Больной в период наивысшей заразности выделяет множество вирусов с капельками слюны и слизи из носоглотки при разговоре, чихании или кашле. Вместе с тем, в отличие, скажем, от вируса гриппа, передача возбудителя ветрянки через предметы практически исключается из-за его очень низкой способности выживать во внешней среде.
Человек, инфицированный вирусом варицелла зостер, представляет наибольшую опасность для окружающих в течение нескольких последних дней инкубационного периода перед появлением сыпи и на протяжении 5-6 дней после ее появления.
Такое стремление родителей и родственников заразить ребенка в детстве связано с тем, что дети в подавляющем большинстве случаев переносят ветряную оспу легко и у них в отличие от взрослых она очень редко вызывает осложнения.
Обычно вирус попадает в организм человека через слизистую оболочку носоглотки. Затем с током крови варицелла зостер проникает в клетки поверхностного слоя кожи, где и происходит его репликация до ее подавления иммунной системой.
Для людей, не болевших ветрянкой, существует опасность заражения варицелла зостер от больных опоясывающим лишаем, в организме которых произошла реактивация вируса.
Симптомы ветряной оспы
Почти 50% пациентов с ветрянкой – это дети в возрасте от 5 до 9 лет. 40% больных – дети в возрасте 1-4 лет и 10-14 лет. На долю подростков старше 15 лет и взрослых приходится не более 10% всех случаев ветряной оспы.
Для ветрянки характерна сезонность: подавляющее большинство новых случаев заболевания (до 90%) приходится на холодное время года – осень и зиму. Из-за высокой плотности городского населения и большого количества детей дошкольного и школьного возраста заболеваемость ветрянкой значительно выше в городах по сравнению с сельской местностью.
После проникновения инфекции в организм симптомы болезни появляются не сразу, а по истечению инкубационного периода, продолжительность которого может составлять от 1 до 3 недель.
Для ветряной оспы характерны 4 этапа заболевания:
- инкубационный период,
- продромальный период – 1-2 дня до появления сыпи,
- появление характерных высыпаний,
- период выздоровления (реконвалесценции).
Выраженный продромальный период при ветрянке чаще наблюдается у взрослых больных – на этом этапе пациенты жалуются на головную боль, боли в мышцах, повышение температуры тела. У детей продромальный период обычно протекает стерто – в детском возрасте ветрянка как правило, сразу проявляется сыпью.
В процессе репликации вируса в клетках эпителия происходит гибель эпителиоцитов с последующим образованием полостей, в которых появляется экссудат – в таких местах на коже и слизистых оболочках (например, при поражении вирусом слизистой рта) образуются везикулы, пузырьки диаметром до 5 мм.
Через 2-3 дня после появления везикулы начинают подсыхать с образованием корочки, которая отпадает примерно на 8-й день после начала подсыхания, причем рубцов на месте высыпаний ветряночных элементов практически никогда не бывает.
В редких случаях (например, при расчесывании везикул) возможно инфицирование везикул последующим нагноением и образованием мелких рубцов.
Лихорадочное состояние, обусловленное реакцией организма на вторжение вирусов, может сохраняться на протяжении 5-6 дней, после чего самочувствие больного постепенно улучшается.
Осложнения ветрянки
В подавляющем большинстве случаев ветрянка проходит бесследно – через 5-7 дней после начала болезни самочувствие начинает улучшаться и еще 2-3 недели спустя больной полностью выздоравливает. Однако, как и при любом другом инфекционном заболевании, у части больных (при ветрянке это около 5%) могут развиться осложнения.
Чаще всего осложнением становится инфицирование и нагноение элементов сыпи. Гораздо реже инфекция проникает через поврежденную кожу в кровеносную и лимфатическую систему, что приводит к развитию сепсиса.
Еще реже встречается ветряночная пневмония, вызванная поражением ткани легких вирусом варицелла зостер.В медицинской литературе встречаются описания и других осложнений ветрянки, риск развития которых, к счастью, очень незначителен; к ним относятся:
- миокардит,
- энцефалит,
- кератит (воспаление роговицы глаза),
- нефрит (поражение почек),
- гепатит,
- артрит.
Большой редкостью считается врожденная форма ветряной оспы. Обычно дети появляются на свет с пассивным иммунитетом против этой болезни – если мать в детстве перенесла ветрянку или получила прививку от этой болезни, то специфические антитела из ее организма поступают через плаценту в кровь плода и сохраняются на протяжении первого полугода жизни.
Однако если будущая мать заболевает ветрянкой за несколько дней до родов, то велика вероятность того, что ребенок появится на свет с врожденной формой болезни.
К сожалению, в подобных случаях болезнь может иметь тяжелое течение, что связано с незрелостью иммунной системы новорожденного.
Диагностика и лечение ветряной оспы
Из-за выраженной специфичности симптомов диагностика ветрянки не представляет затруднений и, как правило, даже не требует каких-либо лабораторных исследований. В некоторых случаях для полной уверенности в диагнозе врач может назначить лабораторный анализ содержимого везикул для выявления вируса.
До сих пор, несмотря на все успехи медицины, лечение ветряной оспы сводится в основном к симптоматической терапии, т.е. лечение направлено на уменьшение проявлений болезни, а не на ее первопричину. Связано это с трудностями создания препаратов, которые могли бы воздействовать на вирус герпеса 3-го типа после его проникновения в клетки организма.
Чуть более 40 лет назад была изобретена первая вакцина против ветряной оспы, однако в нашей стране такая прививка не включена в перечень обязательных. Вместе с тем, иммунизацию ребенка против ветрянки все же можно сделать в детской поликлинике. Для этого нужно самостоятельно приобрести соответствующий препарат в аптеке.
Читайте также:


