Противовирусные иммуностимулирующие препараты при впч
Перламутров Ю.Н., Чернова Н.И., МГМСУ
Введение
Вирус папилломы человека (ВПЧ) – чрезвычайно распространенная инфекция, преимущественно передаваемая половым путем. Эпидемиологические аспекты заболевания разноречивы. Частота папиломавирусной инфекции (ПВИ) в странах Европы по разным авторам колеблется от 6 до 47%, в Америке – от 1 до 90%, что определяется, безусловно, методами исследования и спецификой изучаемой популяции. В отечественной литературе имеются данные об изучении выявляемости ПВИ среди различных слоев населения, которые варьируют от 56% среди пациенток с патологией шейки до 95% среди больных инфекциями, предаваемыми половым путем. ВПЧ представляет собой одну из самых распространенных в мире групп вирусов, поражающих кожу и слизистые оболочки организма. Выявлено более 120 типов ВПЧ. Семейство состоит из вирусов "низкого онкогенного риска", связанных с доброкачественными новообразованиями, например бородавками и папилломами, и вирусов 16 и 18 "высокого онкогенного риска", вызывающих онкологические заболевания шейки матки в 80% случаев. Это второе по частоте злокачественное заболевание у женщин в возрасте до 45 лет после рака молочной железы. В Америке, была проведена оценка сокращения продолжительности жизни при раке шейки матки, примерно на 26,1 лет[23]. В ряде исследований выдвигалась гипотеза о том, что ВПЧ играет определенную роль в развитии других онкологических заболеваний, включая злокачественные новообразования в полости рта и заднем проходе. Реализации злокачественных заболеваний способствуют в первую очередь снижение иммунитета. Конечно, не у всех инфицированных ВПЧ развивается рак.
Доминирующим кофактором, способствующим развитию ВПЧ-инфекции, является сексуальная активность, которая сопряжена с инфицированием сексуальных партнеров в 60%. [8,9,12,15,17]. Кроме количества сексуальных партнеров, возможно влияние анальных актов, которые вызывают снижение местного иммунитета, а также ранний возраст полового дебюта до 16 лет.
Кроме поражения аногенитальной сферы у людей практикующих оральный секс возможны поражения в виде папилломатозов гортани, трахеи и бронхов [1,16, 17, 18]. При этом орально-генитальные контакты являются ведущим путем передачи вируса папилломы человека в полости рта [5,22,23]. Аспирация цервикального и вагинального отделяемого в родах, может приводить к развитию у новорожденных и детей младшего возраста, респираторных папилломатозов (с поражением гортани, трахеи и бронхов) [5,9]. Триггерными факторами для рецидивирования папилломавирусной инфекции кроме сексуального поведения могут быть: использование в практике половых отношений нетрадиционного секса, микротравмы, гормональные нарушения, проявляющиеся недостаточностью лютеиновой фазы, гипо- и авитаминозы, наличие герпес вирусной инфекции, кандидоза, бактериального вагиноза в анамнезе, курение, прием антибиотиков [7,8]. Последние факторы, (курение и микст-инфекция), также негативно влияют на результат терапии, сокращая межрецидивный период. Наряду с внешними факторами: курение или ИППП, влияющими на развитие ПВИ, большое значение имеют врожденные особенности организма, в первую очередь - его иммунной системы. Большое значение в противостоянии организма развитию ПВИ и связанных с ней патологических процессов в генитальном тракте придается иммунокомпетентным клеткам и гуморальным факторам, действующим как на системном, так и на локальном уровне. Одним из высокоэффективных неспецифических факторов противовирусной защиты организма является система интерферона.
В настоящее время к этиотропным препаратам против ВПЧ можно отнести отечественный противовирусный препарат растительного происхождения Панавир, который также оказывает иммуномодулирующее и регенерирующее действие и используется в комплексной терапии.
Согласно результатам исследований, Панавир оказывает цитопротективное действие, существенно снижает инфекционную активность вирусов, модулирует синтез интерферона и повышает жизнеспособность инфицированных клеток. После однократной внутривенной инъекции отмечалось повышение уровня интерферонов 2,7-3 раза. Комбинированное использование препарата и деструктивных методов лечения способствует удлинению межрецидивного периода, прекращению вирусовыделения, в том числе при выявлении нескольких серотипов, включая высоко онкогенные 16 и 18 тип, со слизистых оболочек мочеполовых органов и уменьшению количества местных деструктивных воздействий[12] .
Целью настоящего исследования явилось определение эффективности препарата Панавир в суппозиториях, в комплексной терапии пациентов с ПВИ.
Материалы и методы
Под наблюдением находилось 60 больных с рецидивирующей папилломавирусной инфекцией, в возрасте от 20 до 40 лет и давностью заболевания от 10 до 24 месяцев.У всех больных были исключены другие ИППП. ДНК ВПЧ диагностировали при помощи ПЦР с определением типов (с 6 по 70). Вирусную нагрузку определяли методом PCR real time .
Гамма-интерферон исследовали в крови, полученной из кубитальной вены.Осмотр кожи и слизистых гениталий проводили 1раз в 5 дней. Забор материала для лабораторных исследований проводился до и через месяц после окончания лечения.
Оценка объективных признаков ПВИ на коже и слизистых проводилась с учетом интенсивности проявлений вегетаций. До лечения отмечались множественные кондиломы с экзофитным ростом в области влагалища, нижней спайки, малых половых губ у женщин, на теле и на головке полового члена в ладьевидной ямке у мужчин.
Изучение эффективности, переносимости и безопасности препарата проводилось на основании исчезновения или уменьшения клинических проявлений, динамики показателей гамма-интерферона, наличия ДНК вируса после лечения при типировании методом ПЦР и длительности ремиссии.
Больные были разделены на 2 группы. В группе №1 30 больным назначили Панавир, после 3-й суппозитории использовали лазерную деструкцию. Панавир применялся по схеме: по одному суппозиторию вводился ректально на ночь. Процедура повторялась через день, 5 суппозиторий на курс. В группе №2 состоящей из 30 пациентов, терапия ПВИ проводилась при помощи лазерной деструкции.
Результаты
В результате исследовании соскобов из урогенитального тракта при помощи ПЦР и ПЦР real time у 60 пациентов ДНК ВПЧ в клинически значимом титре была идентифицирована у всех больных. Использовалась качественная методика, которая позволила выделить типы условно высокого (16,18,31,33,45), и низкого (6,11,42,43,44) онкогенного риска. У 51 больного обнаруживались высокоонкогенные типы ВПЧ, у 9 пациентов низкоонкогенные типы, у 42 пациентов имелись сочетания разных типов ВПЧ.
При этом у 3 пациентов обнаружено 5 типов вирусов, у 24 больных 4 типа, у 15 пациентов 2 типа и у 18 исследуемых по 1 типу. Наиболее часто выделялись 16 тип в 49 случаях, 52 тип в 40, 33 тип в 28.
При оценке показателей гамма-интерферона до лечения выявлены нарушения у всех 60 больных с рецидивирующей папилломавирусной инфекцией.
Таблица №1. Показатели гамма-интерферона у пациентов с РПВИ
Обзор препаратов, применяющихся при лечении ВПЧ и герпесе, — механизм действия, преимущества и свойства, о которых стоит предупредить клиента
Первый стол регулярно отпускает местные противовирусные и иммуномодулирующие препараты, показанные для лечения герпетической и/или папилломавирусной инфекции. Обе инфекции принадлежат к числу самых распространенных в мире патологий, передающихся половым путем. Как качественно и деликатно консультировать клиентов с этими болезнями, какие противовирусные препараты советовать при ВПЧ, какие от герпеса и на что обращать внимание — читайте в нашей статье.
ВПГ и ВПЧ: сходства и отличия
Прежде всего, важно понимать, что вирус простого герпеса (ВПГ) и вирус папилломы человека (ВПЧ), провоцирующие герпетическую и папилломавирусную инфекции соответственно, кардинально отличаются друг от друга.
- Выраженной элиминации вирусов из организма
- Повышению эффективности противовирусной терапии
- Сокращению периода высыпаний и ускорению процессов регенерации
- Увеличению продолжительности ремиссии
У взрослых и подростков старше 12 лет в комплексной терапии:
Суппозитории — 5 дней по 1 суппозиторию, затем по одному через день. Курс — 2 упаковки суппозиториев.

Таблетки подъязычные — 10 дней по 1 таблетке 4 раза в день. Затем продолжить прием через сутки в течение 10 дней по 4 таблетки в день.

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Несмотря на то, что специфического лечения ВПГ не существует, ряд препаратов может облегчить состояние при обострениях. Согласно отечественным и западным рекомендациям, с этой целью применяют пероральные противовирусные средства от герпеса на основе ацикловира и валацикловира. Однако в России также рекомендована местная терапия, не включенная в западные стандарты. За границей такие методы в рекомендациях отсутствуют ввиду их меньшей активности по сравнению с таблетками [3].
Несколько по‑другому обстоит ситуация с папилломавирусной инфекцией (ВПЧ). Она считается самым распространенным в мире заболеванием, передаваемым половым путем [4]. В какой‑то момент жизни ВПЧ заражается большинство взрослых людей, однако в 90 % случаев в течение двух лет после заражения происходит естественная элиминация вируса. В противном случае инфицированный становится пожизненным носителем.
К сожалению, лекарства от вируса папилломы человека не существует, так же как и в случае с вирусом простого герпеса. Однако первый, в отличие от второго, может быть смертельно опасен: ВПЧ 16‑го и 18‑го типов ассоциированы со злокачественными новообразованиями — в частности, с раком шейки матки и некоторыми другими опухолями. Единственное эффективное на сегодня лечение ВПЧ заключается в эрадикации кондилом, которые являются проявлениями клинической и субклинической форм инфекции. С этой целью при лечении вируса папилломы человека применяют ряд местных антивирусных препаратов, доказавших активность в исследованиях. В то же время в отечественной практике врачи назначают и ЛС, имеющие сомнительную доказательную базу. Рассмотрим их преимущества и недостатки более детально.
Локальные иммуномодуляторы
Интерферон альфа-2b имеет противовирусные, иммуномодулирующие и антипролиферативные свойства. Он подавляет репликацию РНК- и ДНК-содержащих вирусов, усиливает активность макрофагов, увеличивает цитотоксичность лимфоцитов к клеткам-мишеням. Применение содержащих интерферон альфа-2b средств сопровождается повышением уровня иммуноглобулинов типа А, нормализацией IgE [5]. Однако эти терапевтические эффекты в полной мере проявляются при системном введении препарата, когда достигается его высокая концентрация в крови. При этом следует заметить, что могут развиваться достаточно мощные побочные эффекты, в том числе лихорадка, потеря аппетита, головные, мышечные, суставные боли и множество других неблагоприятных реакций.
Из-за специфического профиля безопасности инъекционные препараты интерферона назначаются только в очень серьезных случаях, когда риск побочных эффектов оправдан — например, при лечении гепатитов, ряда онкологических заболеваний и пр. ВПГ и ВПЧ-инфекции к таким ситуациям не относятся и не являются показаниями для системного назначения интерферона. В то же время в РФ зарегистрирован весьма внушительный перечень местных форм интерферона альфа-2b, в том числе и мазей/кремов для обработки слизистых оболочек при генитальном герпесе.
Теоретически локальные препараты интерферона должны обладать всеми преимуществами инъекционных и не иметь их побочных эффектов, поскольку местные формы или очень незначительно всасываются в системный кровоток, или вовсе не проникают в кровь. Однако, на сегодня нет достаточно надежных доказательств эффективности интерферонов при местном применении. Тем не менее, в отечественной практике их довольно часто назначают в составе комплексного лечения рецидивов генитальной герпетической инфекции.
Наряду с местными формами, содержащими только интерферон альфа-2b, в РФ зарегистрировано и несколько комбинированных препаратов:
- Интерферон альфа-2b+ацикловир+лидокаин, мазь. Показания — ВПГ.
- Интерферон альфа-2b+таурин+бензокаин, суппозитории вагинальные и ректальные, рецептурные. Показания — ВПГ, ВПЧ. Таурин, по данным инструкции, выполняет в комбинации роль репаранта, антиоксидантного и противовоспалительного компонента.
+ Высокий профиль безопасности.
! Целесообразность применения местных форм ацикловира при генитальном герпесе подвергается серьезным сомнениям ввиду недостаточной активности, что подтверждено в западных рекомендациях [3].Препараты интерферона альфа-2b, как моно-, так и комбинированные, отпускаются как по рецепту, так и без — в зависимости от указания на правила отпуска в инструкции конкретного препарата. Важно обратить внимание посетителя на то, что препараты от ВПЧ первой линии лечения — пероральные формы ацикловира и валацикловира — должен выписать врач, поэтому нужно посоветовать незамедлительно обратиться за консультацией к доктору.
Синтетические противовирусные местные препараты
Эту группу ЛС можно условно разделить на средства, применяемые при генитальной герпетической инфекции, и антивирусные препараты, назначаемые для лечения папиллом и кондилом, связанных с папилломавирусной инфекцией.
Несколько ЛС, зарегистрированных в РФ, применяются для лечения и профилактики рецидивов генитального герпеса.
Противовирусный препарат от герпеса, производное адамантана (подобно известным противовирусным римантадину и амантадину). Ингибирует прикрепление вируса к поверхности клеточной мембраны, препятствуя проникновению возбудителя внутрь клетки. Предотвращает слияние клеток и затрудняет распространение вируса за счет изменения синтеза гликопротеинов [5]. Выпускается в форме геля для наружного применения, который можно наносить на слизистые оболочки при обострении ВПГ-инфекции [5].
Отпуск: без рецепта.
! Есть данные о развитии контактной аллергической реакции при использовании препарата [7].
Иммуномодулятор, способный регулировать активность клеток врожденного и приобретенного иммунитета, в том числе макрофаги, нейтрофилы и натуральные киллеры. При этом этот противовирусный препарат против герпеса повышает устойчивость организма к бактериальным, вирусным и грибковым инфекциям, сокращая их частоту, выраженность и длительность (5). Кроме того, препарат нормализует образование антител и регулирует выработку интерферонов, а также блокирует избыточный синтез провоспалительных цитокинов и снижает уровень оксидантного стресса (5).
Отпуск: Без рецепта
+ Высокий профиль безопасности (5).
Российский препарат, предположительно, проявляющий иммуностимулирующий эффект. По данным инструкции [5], напрямую влияет на фагоциты и естественные киллеры, стимулирует образование антител и синтез интерферона, проявляет антиоксидантные и детоксикационные свойства. В отечественной практике применяется при широком спектре заболеваний — от гриппа до злокачественных новообразований.
Вагинальные суппозитории азоксимера бромида применяются для профилактики рецидивов генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. По данным производителя [5], побочные эффекты не зарегистрированы.
! Суппозитории азоксимера бромида не показаны для лечения активной формы герпеса!
Местные препараты при папилломавирусной инфекции
Некоторые топические противовирусные ЛС, активные в отношении папилломавирусов, в отличие от ряда препаратов, помогающих от вируса герпеса, имеют прочную доказательную базу и применяются во всем мире для лечения проявлений ВПЧ — в частности, кондилом.
Модификатор иммунного ответа, не оказывающий противовирусного действия. Активность проявляет за счет способности индуцировать выработку интерферона-альфа и других цитокинов. Показан для лечения остроконечных кондилом в урогенитальной зоне [5].
Отпуск: по рецепту.
+ Прочная доказательная база. Препарат определенно снижает вирусную нагрузку. Доказано, что применение крема имихимода 5 %-ного 3 раза в неделю на ночь на протяжении 16 недель эффективно и безопасно для лечения кондилом. Частота рецидивов оценивается как низкая [8]. Имихимод рекомендован для лечения генитальных кондилом авторитетным американским регулятором FDA [8].
! При нанесении имихимода более чем в 10 % случаев наблюдаются зуд и боль [5], о чем следует предупредить покупателя.
Местные противовирусные средства растительного происхождения
Активный компонент препарата — активированную глицирризиновую кислоту — получают из корня солодки. Оказывает комплексное иммуностимулирующее, противовирусное, противовоспалительное, противозудное действие. Глицирризиновая кислота прерывает репликацию ряда ДНК и РНК вирусов, в том числе вируса простого герпеса, папилломы человека, цитомегаловируса [5].
Показана в качестве препарата для лечения папилломавирусной инфекции и вируса простого герпеса, в том числе и при инфицировании вирусами онкогенного типа. Выпускается в форме спрея, который распыляют на слизистые оболочки и пораженные участки кожи.
Отпуск: без рецепта.
+ Имеет широкий спектр показаний, среди которых профилактика и лечение кандидозного вульвовагинита, дискомфорт в области половых органов. Может применяться при беременности и кормлении грудью; хорошо переносится.
Активный компонент подофиллина, производного растительных экстрактов, выделяемых из корневищ с корнями подофилла щитовидного — растения семейства барбарисовых. Обладает выраженными противоопухолевыми и противовирусными свойствами, оказывает цитотоксическое действие. При наружном применении прижигает и мумифицирует кондиломы. Применяется в качестве препарата для местного лечения от вируса папилломы человека. Выпускается в форме раствора для обработки остроконечных кондилом [8].
Отпуск: по рецепту.
+ Доказанный эффект. По данным исследований, 0,5 %-ный раствор подофиллотоксина уменьшает число аногенитальных бородавок с 6,3 до 1,1, разрушая около 70 % образований [8].
! Необходимо соблюдать осторожность при применении — попадание на здоровую кожу может приводить к изъязвлению. Местные реакции при применении, аллергические реакции. Первостольник, отпуская этот противовирусный препарат от папиллом и кондилом, должен обратить внимание клиента на эту особенность и напомнить, что ЛС следует хранить в недоступном для детей месте.
Российский препарат. Активный компонент выделяют из растения копеечника альпийского или копеечника желтеющего.
Согласно инструкции, обладает противовирусной активностью в отношении ВПГ-1 и ВПГ-2, а также цитомегаловируса и некоторых других ДНК-содержащих вирусов. Кроме того, предположительно, препарат активирует клеточный и гуморальный иммунитет, ингибирует рост ряда бактерий и патогенных простейших, в том числе трихомонад, а также оказывает умеренное противовоспалительное действие. Применяют в форме мази в составе комбинированного лечения острых и рецидивирующих форм герпеса, в том числе генитального [5].
Отпуск: без рецепта.
+ Благоприятный профиль безопасности, возможность применять в составе комплексного лечения.
Рецептурный российский препарат, активный компонент получают из побегов паслена клубненосного. По данным инструкции, проявляет противовирусный эффект в отношении ВПГ-1 и ВПГ-2, способствует индукции интерферонов и повышает иммунный ответ [5]. Следует заметить, что фармакокинетические свойства препарата не изучались. Вагинальные суппозитории применяются в комплексной терапии генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. Побочные эффекты проявляются редко.
Противовирусный препарат от герпеса растительного происхождения, созданный из сухого экстракта травы десмодиума канадского. По данным инструкции, проявляет противовирусную активность в отношении вирусов герпеса, стимулирует выработку интерферона [5]. Мазь показана для применения при острых и рецидивирующих формах герпеса, в том числе урогенитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности — побочные эффекты не выявлены.
Российская разработка на основе экстракта листьев облепихи. По данным инструкции, активен в отношении вирусов простого герпеса, цитомегаловирусов и некоторых других [5]. Мазь, содержащая экстракт гипорамин, показана для лечения и профилактики эпизодов герпеса, в том числе и генитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности; возможность использовать во время беременности и лактации (после консультации с врачом).
По данным инструкции, проявляет противовирусную активность в отношении ВПГ, оказывает противовоспалительное действие [5]. Крем, содержащий экстракт листьев мелиссы, применяют при поражениях слизистых и кожи, в том числе и в урогенитальной зоне.
Отпуск: без рецепта.
+ Высокий профиль безопасности.
В заключение хочется еще раз подчеркнуть: широкий ассортимент позволяет первостольникам предлагать разные ЛС при запросах на местные средства для лечения проявлений ВПГ или лекарства от ВПЧ. Но при этом не следует забывать о необходимости рекомендовать посетителю обратиться к врачу, ведь именно доктор должен назначить препараты первой линии и подобрать при необходимости комплексную схему лечения.
Пятигорский научно-исследовательский институт курортологии
Актуальность. Вирусные инфекции гениталий – одна из актуальных проблем современного акушерства и гинекологии. Нередко именно наличие вирусных инфекций обуславливают развитие многих патологических процессов шейки матки [4,8,12-14]. Так, папилломавирусная инфекция провоцирует формирование йоднегативных очагов, гиперкератозов шейки матки [4,12]. Вирус-индуцированные патологические процессы шейки матки диктуют необходимость коррекции вирусоносительства или остро протекающих вирусных поражений слизистой шейки матки и влагалища, и в то же время не теряет актуальности применение деструктивных методов лечения патологических процессов шейки матки [2,9].
В настоящее время в терапии папилломавирусной инфекции нередко применяют иммуностимулирующий препарат изопринозин. Однако при его длительном применении обращается внимание исследователей на ряд возникающих побочных эффектов, отягощающих состояние больных [6,7,10]. Нередко применяют другие иммуномодуляторы и противовирусные препараты [5,11]. Эти аспекты определяют необходимость поиска других терапевтических подходов к лечению пациенток данной категории.
Цель исследования. Разработать эффективные методы терапии пациенток с выявленной папилломавирусной и другими вирусными инфекциями.
Материалы и методы. Наблюдались 78 пациенток с вирус-индуцированными патологическими процессами шейки матки (ШМ). Больные были разделены в две группы в зависимости от получаемого лечебного комплекса. Лечение проводилось в два этапа. На первом этапе женщины получали противовирусное лечение. Так, в первой группе наблюдения (42 человека) назначался изопринозин курсами по 10 дней в дозировке по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), перерывы между курсами приема препарата составляли 1 мес. Во второй группе (36 пациенток) назначался изоприназин по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), курс лечения - 10 дней; всего – 1 курс лечения, в сочетании с приемом препарата лавомакс (тилорон) по 125 мг 2 дня подряд, затем по 125 мг через день, на курс – 20 табл. Количество курсов приема изопринозина и лавомакса определялось нами при обследовании после каждого проведенного курса терапии. Критерием необходимости прекращения или продолжения приема препаратов были показатели полимеразной цепной реакции (ПЦР) и наличие сохраняющейся вирусной инфекции. На втором этапе лечения всем пациенткам проводилось радиоволновое хирургическое воздействие на ШМ.
Всем женщинам оценивались жалобы, проводилось гинекологическое исследование, микроскопия отделяемого из половых органов. Оценивалось состояние вагинального биоценоза по данным ПЦР-диагностики, проводимого для выявления трансмиссивных инфекций (ТСИ). При ПЦР оценивалось наличие хламидиоза, микоплазмоза, уреаплазмоза, вируса папилломы человека (ВПЧ) высокого риска, вируса Эпштейн-Бара (ВЭБ), герпеса, цитомегалловирусную инфекцию (ЦМВ), гарднерелез, трихомониаз, кандидоз до лечения, после каждого курса медикаментозной терапии и после окончания проводимого лечения [1]. До начала курсовой терапии по поводу выявленных при ПЦР-диагностике бактериальных инфекций всем пациенткам было проведено противовоспалительное лечение. Всем женщинам оценивалось состояние ШМ по данным кольпоскопии [3].
Результаты. Возраст женщин составлял в среднем 34,2±6,7 года. Все женщины предъявляли жалобы на выделения из половых путей, которые имели различные оттенки в отношении цветового диапазона – желтоватые, грязно-серые, молочно-белые, прозрачные или беловато-прозрачные. После проведения первого этапа курсового лечения у всех пациенток практически прекратились желтоватые или грязно-серые выделения из половых путей, отмечалось уменьшение слизисто-белых белей, а у части женщин бели подобного характера исчезли после курсового лечения, причем более заметно – во второй группе.
Боли при менструации, определяемые исходно у трети больных в каждой группе наблюдения, после обоих этапов курсового лечения уменьшались незначительно.
У женщин первой группы первый этап медикаментозного лечения был наиболее длительным. В большинстве случаев при приеме изопринозина у женщин наблюдались побочные эффекты: головные боли, боли в правом подреберье и верхних отделах эпигастрия, приступы тахикардии, выраженные боли в суставах и др. Первый курс приема изопринозина сопровождался подобными побочными эффектами только у части больных (табл. 1).
Таблица 1. Симптомы побочного действия курсового применения изопринозина
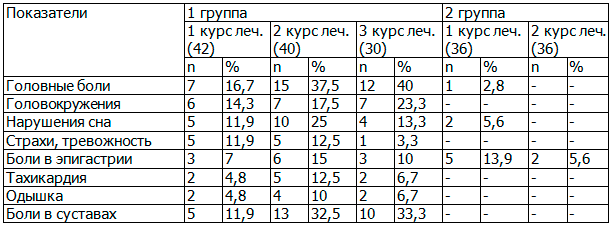
При приеме второго курса изопринозина патологические проявления усугублялись; две пациентки первой группы даже вынуждены были прервать второй курс приема изопринозина из-за нарастающей симптоматики побочных явлений. 10 пациенток первой группы в связи с плохо купируемыми побочными симптомами отказались от третьего курса приема изопринозина.
Во второй группе наблюдения на фоне приема изопринозина назначался лавомакс. При подобном сочетании препаратов у наблюдаемых нами больных побочные эффекты, характерные для приема изопринозина, отсутствовали полностью, что послужило поводом для рассмотрения вопроса о возможном сокращении курсов приема изопринозина.
Всем пациенткам после курсовой терапии проводилось гинекологическое исследование. Ни у одной женщины после первого медикаментозного этапа лечения не определялись воспалительные изменения тканей вульвы и влагалища. В то же время при осмотре ШМ в зеркалах у всех наблюдаемых пациенток во всех группах наблюдения после первого этапа проводимого лечения продолжали определяться патологические процессы ШМ по типу эрозий или белесоватых очагов по поверхности ШМ. После второго этапа лечения с использованием радиохирургического воздействия ни в одном случае наблюдения не было выявлено визуально определяемых признаков эрозий или белесоватых очагов по поверхности ШМ.
При оценке данных бактериоскопического исследования мазков влагалищного секрета IV и III степень чистоты влагалищных мазков после первого же этапа лечения не определялась ни у одной пациентки; II степень была у 9 женщин первой группы (21,5%), 7 – второй (16,7%). У остальных женщин уже после окончания первого этапа лечения определялась I степень чистоты влагалищных мазков. Эти же параметры сохранялись и после второго этапа курсовой терапии.
При ПЦР-диагностике до лечения выявлялся ряд бактериальных инфекций и во всех случаях наблюдения - вирусные инфекции. При обнаружении уреаплазмоза (у 46% женщин), гарднерелеза (у 37%), микоплазмоза (у 2,4% человек), хламидиоза (у 4,8%), кандидоза (у 58%) пациенткам до начала противовирусного лечения назначалось необходимое специфическое лечение. Затем назначалась противовирусная терапия.
После получения медикаментозной терапии и предварительного антибактериального лечения при ПЦР-диагностике случаи хламидиоза и микоплазмоза не были обнаружены. Значительно уменьшилась частота встречаемости уреаплазмоза, кандидоза, гарднерелеза.
После каждого курса медикаментозной терапии на первом этапе лечения оценивались данные ПЦР-диагностики в отношении вирусных инфекций. Обращало на себя внимание, что в первой группе наблюдения после приема первого курса изопринозина значительно уменьшилось содержание герпеса, снизились показатели цитомегалловирусной инфекции, ВПЧ высокого риска; почти не менялись значения данных по вирусу Эпштейн-Бара.
После второго курса приема изоприназина наблюдалось заметное снижение показателей при оценке уровня ВПЧ высокого риска и ЦМВ. После приема третьего курса изопринозина исследуемые вирусные инфекции у пациенток не выявлялись.
Во всех случаях наблюдения значительно снизился уровень показателей вирусных инфекций после всего этапа медикаментозной терапии у женщин первой группы.
Во второй группе наблюдения повторное проведение ПЦР-диагностики было выполнено после первого курса приема изопринозина в сочетании с первым курсом лавомакса. При ПЦР у пациенток второй группы были выявлены единичные случаи сохранившихся повышенных значений ВПЧ высокого риска, ЦМВ и ВЭБ; герпес не определялся ни в одном случае наблюдения (табл.2). В связи с этими изменениями, прием лавомакса был продолжен; все пациентки второй группы дополнительно получили еще 10 табл. лавомакса по 1 табл. через день; при этом повторный курс приема изопринозина не назначался.
Таблица 2. Уровни показателей трансмиссивных инфекций при ПЦР-диагностике
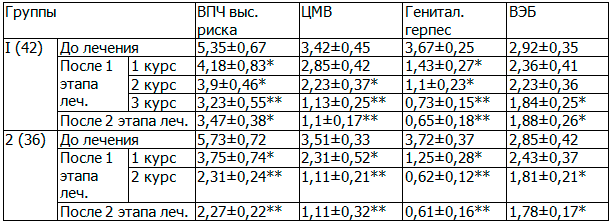
Примечания: показатели в сравнении с данными до лечения * - p
Читайте также:


