Острый алкогольный гепатит можно ли назвать сепсисом
Аннотация научной статьи по клинической медицине, автор научной работы — Ливзан М.А., Лялюкова Е.А., Лаптева И.В.
Алкогольная болезнь печени является серьезным и потенциально смертельным следствием употребления алкоголя. Диагностика заболевания основывается на выявлении характерных признаков поражения печени и наличии алкогольного анамнеза. Современная стратегия лечения включает отказ от потребления алкоголя, нормализацию нутритивного статуса пациента, рациональную фармакотерапию с учетом формы и тяжести заболевания, при наличии признаков декомпенсации цирроза трансплантацию печени.
Похожие темы научных работ по клинической медицине , автор научной работы — Ливзан М.А., Лялюкова Е.А., Лаптева И.В.
Gastroesophageal reflux disease: features in patients with metabolic syndrome
The article is a literature review of the major etiopathogenetic mechanisms and recent approaches to the treatment of gastroesophageal reflux disease in patients with metabolic syndrome . Recent data on the role of insulin resistance, impaired neurohumoral regulation of the upper gastrointestinal tract in patients with gastroesophageal reflux disease and metabolic syndrome is presented.
М.А. ЛИВЗАН, д.м.н., профессор, Е.А. ЛЯЛЮКОВА к.м.н., Омская государственная медицинская академия Минздрава России
АЛКОГОЛЬНАЯ БОЛЕЗНЬ ПЕЧЕНИ:
СОВРЕМЕННЫЕ АСПЕКТЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Алкогольная болезнь печени является серьезным и потенциально смертельным следствием употребления алкоголя. Диагностика заболевания основывается на выявлении характерных признаков поражения печени и наличии алкогольного анамнеза. Современная стратегия лечения включает отказ от потребления алкоголя, нормализацию нутритивного статуса пациента, рациональную фармакотерапию с учетом формы и тяжести заболевания, при наличии признаков декомпенсации цирроза - трансплантацию печени.
Ключевые слова: алкогольная болезнь печени, диагностика, лечение
По данным европейских исследований, потребление алкоголя является причиной 3,8% общей летальности (11,0% среди мужчин и 1,8% среди женщин) и 4,6% -инвалидности [1]. Алкоголь является причиной У всех случаев фиброза печени [2].
В странах Европы на протяжении последних десятилетий отмечается высокое потребление алкоголя на душу населения (11 л чистого этанола в год). Чрезмерное употребление алкоголя (более 40 г в день - мужчины и более 20 г - женщины) отмечено у 15% европейцев (58 млн граждан) [3, 4].
Показатели летальности от алкогольного цирроза печени варьируются с 15-кратным изменением между европейскими странами. В Австрии, Франции, Германии, Италии, Португалии, Испании, Венгрии и Румынии зарегистрировано снижение летальности от цирроза печени [3], тогда как в Финляндии, Ирландии, а также большинстве восточноевропейских стран, включая Эстонию [4], Литву, Польшу, Россию, при этом сохраняется устойчивая тенденция к росту алкогольного цирроза печени. Эпидемиологические особенности обусловлены как генетическими, так и факторами окружающей среды (доступностью алкоголя, распространенностью сопутствующих заболеваний печени).
Важный аспект политики здравоохранения относительно алкоголя - попытка установить безопасный порог для его потребления, что актуально в связи с обсуждаемой кардио-протективной дозой этанола [5, 6].
Исследования показали, что даже при умеренном потреблении алкоголя ( Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Развитие фиброза. Алкогольные метаболиты, такие как ацетальдегид, активируют непосредственно звездчатые клетки, главные коллагенопродуценты, а также паракринные | механизмы (через клетки Купфера).
Избыточное потребление алкоголя (более 30 г в день), как правило, является причиной АБП.
Определенную помощь в установлении диагноза АБП окажут общие признаки злоупотребления алкоголем, такие как двусторонняя гипертрофия околоушной железы, мышечное истощение, контрактура Дюпюитрена, периферическая невропатия.
Биопсия печени показана в случаях, когда диагноз ставится под сомнение, для исключения заболеваний печени другого генеза, уточнения тяжести поражения печени, определения прогноза и тактики ведения.
Типичные гистологические признаки на стадии стеатоза включают накопление жира в гепато-цитах по типу макровези-кулярного, реже - микровезикулярного (рис. 1).
Классические гистологические особенности алкогольного гепатита представлены некровос-палительными изменениями, которые наиболее вы ражены в центродоле-вой области ацинуса.
Инфильтрат состоит из полиморфно- и монону-клеарных клеток (рис. 2). Некровоспалительные изменения вызывают сжатие синусоидов и развитие обратимой портальной гипертензии. Помимо этого, у большинства пациентов с
Рисунок 1. Диффузным макровезикулярный стеатоз с перисинусоидальным фиброзом и лобулярной некровоспалительной реак-
Фиброз сопровождается диффузным увеличением количества соединительной ткани, внеклеточного матрикса (кол-лагеновой волокнистой ткани в перисинусоид-ном пространстве без перестройки структуры органа) (рис. 3).
Стеатоз в большинстве случаев протекает бессимптомно. Характерные ультрасонографиче-ские признаки включают гиперэхогенную печень с или без гепатомегалии.
Острый алкогольный гепатит. Острые эпизоды токсического некроза печени алкогольной этиологии развиваются после употребления большого количества алкоголя, обычно после запоя. Алкогольный гепатит бывает различной степени тяжести (умеренный, выраженный). Возможны варианты с преобладанием симптомов холестаза. При умеренном течении симптомы могут быть неспецифическими (табл. 1) и включают анорексию, потерю веса, боли в животе, вздутие, тошноту или рвоту. Недостаточность питания у больных с алкогольным гепатитом развивается вследствие сниженного потребления калорий и увеличенного катаболизма. При тяжелом течении симптомы более выражены, регистрируется лихорадка, выраженный астенический синдром, асцит, энцефалопатия. Уровни аспарагиновой трансаминазы (АсАТ), как правило, увеличиваются в 2-6 раз, характерны гиперби-лирубинемия, нейтрофильный лейкоцитоз, ускоренная СОЭ, гипоальбуминемия. Увеличивается протромбиновое время, международное нормализованное отношение. Пациенты с тяжелыми формами имеют высокий риск бактериальной инфекции, острой почечной недостаточности, желудочно-
кишечного кровотечения. Бактериальные инфекции - частые и трудно диагностируемые осложнения при АБП. Около У4 больных с тяжелым алкогольным гепатитом при госпитализации имеют бактериальные осложнения.
Изменения в анализах крови: снижение гематокрита, повышение уровня гамма-глютамилтранспептидазы (ГГТП) - указывают на ранние стадии АБП. Для поздних стадий характерна гипопротеинемия, удлинение протромбинового времени, гипербилирубинемия, тромбоцитопения (табл. 1).
Наиболее характерный лабораторный признак алкогольного повреждения печени - ГГТП [13]. Активность АсАТ обычно превышает норму в 2—10 раз (50%). Активность аланиновой трансаминазы (АлАТ) тоже повышена, но в меньшей степени, чем АсАТ (35%). Уровень гематокрита 52% [13]. Чувствительность ГГТП при ежедневном этаноловом потреблении (более 30 г в день) выше (73%), чем АсАТ. Специфичность 75; 82; 86 и 85% соответственно [139]. Являясь легко выполнимым и недорогим лабораторным тестом, ГГТП остается наиболее часто используемым маркером для диагностики хронического алкогольного употребления [13]. Серологическая активность ГГТП теряет свою специфичность при прогрессировании цирроза, т. к. его активность увеличена у пациентов с обширным фиброзом независимо от причины [13]. На уровень ГГТП влияет не только количество потребляемого алкоголя, но и индекс массы тела [13].
При АБП уровень АлАТ обычно ниже АсАТ. Отношение АсАТ/АлАТ, как правило, больше, чем 1, и может быть косвенным маркером прогрессирующего фиброза [13].
Оценка тяжести алкогольного гепатита. Индекс Маддрея остается широко используемым показателем для определения тяжести и риска ранней смертности у пациентов с острым алкогольным гепатитом. Индекс Маддрея = 4,6 х разность между протромбиновым временем у больного и в контроле + сывороточный билирубин в ммоль/л. У больных со значением более 32 вероятность летального исхода во время текущей госпитализации превышает 50%. При появлении или усилении фоновой печеночной энцефалопатии алкогольный гепатит всегда должен рассматриваться как тяжелый, что требует соответствующей коррекции терапии.
Неинвазивные методы диагностики фиброза печени. Для диагностики фиброза печени применяются лабораторные неинвазивные методы (Fibrotest, Fibrometer Enhanced Liver Fibrosis панель, Hepascore), основанные на регистрации определенных маркеров сыворотки крови. Так, Hepascore включает определение уровня билирубина, ГГТП с учетом показателей обмена веществ внеклеточного матрикса (гиалу-роновой кислоты, а2-макроглобулина), возраста и пола пациента [14]. Enhanced Liver Fibrosis включает определение таких параметров, как гиалуроновая кислота, тканевой ингибитор металлопротеиназ-1, проколлаген. Чувствительность составляет 80%, специфичность - 90%. Измерение ригидности печени (эластометрия) является надежным инструментом для оценки печеночного фиброза у больных с АБП. При интерпретации данных необходимо учитывать выраженность признаков цитолиза, холестаза, индекс массы тела, т. к.
указанные параметры влияют на показатели ригидности печени.
Лечение АБП. Выбор терапии зависит от формы и стадии АБП. Воздержание от алкоголя - краеугольный камень терапии АБП. Несколько метаисследований последних лет оценили эффективность различной политики в отношении сокращения потребления алкоголя [15]. Самой рентабельной оказалась та, которая уменьшала доступность алкоголя для населения через ценообразование, ограничение времени и места продажи, повышение возраста, с которого разрешалась продажа алкоголя.
Коррекция недостаточности питания. Энергетическая ценность диеты при наличии алкогольного гепатита должна быть не менее 2 000 кал/сут. Дополнительное энте-ральное питание в комбинации с кортикостероидами показало хорошие результаты по выживаемости пациентов с тяжелым алкогольным гепатитом [15]. Среди больных, добровольно принимавших более 3 000 ккал/сут, практически не было летальных исходов, в то время как в подгруппе, упот-
- КЛЮЧЕВЫЕ СЛОВА: цирроз печени, гепатит С, Гептор, адеметионин
Алкогольная болезнь печени (АБП) является серьезной клинической проблемой, поскольку печень – один из основных органов-мишеней, поражаемых при злоупотреблении алкоголем. Заболеваемость и летальность вследствие алкогольных поражений печени остаются на высоком уровне в течение многих лет не только в России, но и за рубежом [1, 2]. Распространенность циррозов печени (ЦП) алкогольной этиологии среди всех форм ЦП оценить так же трудно, как и дифференцировать смертность от алкогольного и неалкогольного цирроза печени. Как правило, врач, устанавливающий причину летального исхода, не упоминает об алкоголе в свидетельстве о смерти [3]. Именно поэтому необходимы дальнейшие крупные эпидемиологические исследования распространенности АБП в популяции.
По данным отделения гепатологии Центрального научно-исследовательского института гастроэнтерологии Московского клинического научно-практического центра (ЦНИИГ МКНЦ) Департамента здравоохранения г. Москвы, из 953 больных, находившихся на стационарном лечении, у 584 (61%) пациентов диагностированы различные формы АБП, причем у 385 (66%) из них ЦП алкогольной этиологии. Кроме того, у 105 (17,9%) пациентов отмечался сочетанный вирусно-алкогольный генез ЦП (рис. 1 и 2).
Одним из основных терапевтических мероприятий в лечении алкогольного ЦП и залогом повышения выживаемости данной категории пациентов является соблюдение ими режима полного отказа от алкоголя, что с учетом современных подходов требует координированных усилий гепатологов, гастроэнтерологов, врачей общей практики, с одной стороны, и наркологов – с другой. Если пациент не способен отказаться от алкоголя, с целью фармакокоррекции данного состояния врач может выбрать один из трех лекарственных препаратов с доказанной эффективностью – дисульфирам, налтрексон и акампросат. Последний в нашей стране не зарегистрирован. Пациенту рекомендуется предварительно пройти детоксикацию. Указанные препараты используются в комбинации с психосоциальной терапией для предотвращения рецидивов, то есть для сохранения полной трезвости. Однако в реальной клинической практике добиться стойкой абстиненции удается далеко не всегда. К тому же, как показывает практика, рецидив алкоголизации в течение первого года развивается в 67–81% случаев [4].
В то же время ряд экспертов указывают, что не все пациенты, принимающие алкоголь, настроены на полное воздержание от его употребления. Показано, что среди пациентов, страдающих хроническим алкоголизмом, 44–46% способны сократить употребление алкоголя до умеренного, но не готовы полностью отказаться от него [5, 6].
В настоящее время доказано, что ущерб от алкоголя (низкий, средний, высокий, чрезвычайно высокий) зависит от принимаемой суточной дозы алкоголя (Международное руководство Всемирной организации здравоохранения по мониторингу употребления алкоголя и связанного ущерба, 2000).
Данные факты послужили теоретической основой для смены парадигмы терапии алкогольной зависимости: вместо подхода, предполагающего полное воздержание от алкоголя, активно внедряется концепция уменьшения его употребления как цели терапевтического воздействия. В связи с этим одним из перспективных направлений считаются профилактические мероприятия по снижению алкогольной зависимости. В Европе внедряется в практику врачей разных специальностей инновационный подход, предусматривающий постепенное сокращение употребления алкогольных напитков при активном самоконтроле пациента. Это предполагает применение фармакоагентов, среди которых достаточно хорошей доказательной базой обладает налмефен (Селинкро) – антагонист мю- и дельта- и парциальный агонист каппа-опиоидных рецепторов. Эффективность и безопасность налмефена продемонстрирована в трех пилотных исследованиях почти у 2000 пациентов из 19 стран Европы [7–9]. Показано, что данный подход способен привести к сокращению употребления алкоголя на 60% после шести месяцев терапии. Внедрение в практику российских врачей такого подхода может значительно улучшить общую ситуацию.
В последнее время помимо различных фармакологических агентов, направленных на уменьшение степени алкогольной зависимости, в клинической практике рекомендуется применять так называемые краткосрочные вмешательства [10], проводимые в форме мотивационного интервью. Цель вмешательств – в доступной форме повысить осведомленность пациента о потенциальных проблемах и последствиях употребления алкоголя. Тем не менее, если пациент с ЦП возобновляет и продолжает прием алкоголя, наиболее вероятным представляется развитие у него алкогольного гепатита.
Для оценки степени тяжести алкогольного гепатита сегодня используются прогностические шкалы или индексы. Дискриминантная функция Мэддрея (The modified Maddrey's discriminant function – MDF) – это индекс, который используется в первую очередь. При тяжелых формах алкогольного гепатита его значение превышает 32. Без лечения выживаемость в течение месяца у больных с указанным значением индекса составляет от 50 до 65% [11, 12].
Кроме того, используются шкалы MELD (Model for End-stage Liver Disease – модель конечной стадии заболевания печени), GAHS (Glasgow Alcoholic Hepatitis Score – шкала алкогольного гепатита Глазго), ABIC (от Age, Bilirubin, INR, Creatinin – возраст, билирубин (общий), International Normalized Ratio (международное нормализованное отношение – МНО), креатинин).
О тяжелой форме алкогольного гепатита свидетельствуют показатели прогностических индексов:
справочника
Инфекционные болезни, фармакотерапия
МКБ-10: B17.1, B18.2
Гепатит C – антропонозное заболевание с парентеральным механизмом заражения, наиболее часто протекающее в виде посттрансфузионного гепатита с преобладанием безжелтушных форм и склонное к хронизации.
Вирус гепатита С (HCV, ВГС) представляет собой небольшой вирус размером 30-60 нм, относится к семейству флавивирусов (Flaviviridae), роду семейства тогавирусов. Содержит РНК, покрыт липидорастворимой оболочкой. Геном HCV кодирует структурные (С, El, E2/NS1) и неструктурные (NS2, NS3, NS4, NS5) белки. К структурным белкам относятся: сердцевинный (С-ядерный, core protein) и два гликопротеина оболочки (E1, E2 – envelope protein) соответственно, к четырем неструктурным белкам – ферменты, играющие роль в репликации вируса (в частности, NS3 – протеаза/геликаза, NS5 – РНК-полимераза). К каждому из этих белков вырабатываются антитела, циркулирующие в крови.
Внутри генома имеются вариабельные и гипервариабельные участки и, в зависимости от их строения, выделяют, по крайней мере, 6 различных генотипов HCV (на территории Украины преобладают 1а, 1в, 2, 3а, 3в). Генотипы вируса, по-видимому, различаются по иммуногенности, географическому распределению и, вероятно, влияют на течение HCV-инфекции и результаты лечения.
Сведения о чувствительности ВГС к внешним физико-химическим воздействиям весьма малочисленны, поскольку вирус вирусного гепатита С не размножается на культурах клеток. Вирус устойчив к нагреванию до 50 °С, но инактивируется растворителями липидов (хлороформ) и ультрафиолетовым облучением. Во внешней среде возбудитель нестоек, однако степень его устойчивости к инактивации выше, чем ВИЧ.
Резервуар и источник инфекции – больные хроническими и острыми формами болезни. Механизм передачи – парентеральный. При этом заражающая доза для ВГС в несколько раз больше, чем для ВГВ. HCV, прежде всего, передаётся через заражённую кровь и, в меньшей степени, – через другие биологические жидкости человека. РНК вируса обнаружена в слюне, моче, семенной и асцитической жидкостях. В отличие от возбудителя ГВ, естественные пути распространения вируса ГС имеют меньшее значение: риск инфицирования в быту, при половых контактах и при рождении ребенка от инфицированной матери относительно низок. Естественная восприимчивость высокая и в большой степени определяется инфицирующей дозой. В связи с вариабельностью генома HCV, y лиц, перенесших инфекционный процесс, не вырабатывается специфическая невосприимчивость к повторным заражениям. Возможно множественное инфицирование различными генотипами и субтипами возбудителя.
Частота выявления HCV низка в Северной Европе и США (0-1,6%), несколько выше – в Южной Европе и Азии (0-1,9%) и наиболее высока в Африке (13% и более). Японские исследователи определи, что частота выявления anti-HCV увеличивается с возрастом, составляя 0,2% среди доноров моложе 20 лет и 3,9% среди людей старше 51 года. В Украине, по данным Центральной СЭС МЗ, инфицировано 166-183 тыс. населения и ежегодно определяют 59-69 тыс. анти-HCV положительных людей.
При HCV-инфекции возможно появление разнообразных внепечёночных поражений, обусловленных иммунопатологическими реакциями иммунокомпетентных клеток, которые реализуются либо иммуноклеточными (гранулёматоз, лимфомакрофагальные инфильтраты), либо иммунокомплексными реакциями (васкулиты различной локализации).
Морфологические изменения в печени при вирусном гепатите С неспецифичны. Наблюдают преимущественно лимфоидную инфильтрацию портальных трактов с образованием лимфоидных фолликулов, лимфоидную инфильтрацию долек, ступенчатые некрозы, стеатоз, повреждение мелких жёлчных протоков, фиброз печени, которые встречают в различной комбинации и которые определяют степень гистологической активности и стадию гепатита. Воспалительная инфильтрация при хронической HCV-инфекции имеет свои особенности: в портальных трактах и вокруг очагов повреждения и гибели гепатоцитов преобладают лимфоциты, что отражает участие иммунной системы в патогенезе поражения печени. В гепатоцитах наблюдают жировую дистрофию, при этом стеатоз печени в большей степени выражен при инфицировании генотипом За, по сравнению с генотипом 1. Хронический гепатит С даже с невысокой степенью гистологической активности может сопровождать развитие фиброза печени. Фиброзу подвергаются не только портальные и перипортальные зоны долек, часто выявляют и перивенулярный фиброз. Тяжёлый фиброз ведёт к развитию цирроза (диффузный фиброз с образованием ложных долек), на фоне которого возможно развитие гепатоцеллюлярной карциномы. Цирроз печени развивается у 15-20% больных с выраженными воспалительными изменениями в ткани печени. В настоящее время, помимо морфологического описания полученных биоптатов, разработано несколько систем числовой оценки, которые позволяют проводить полуколичественное (ранговое) определение ИГА-активности воспалительно-некротического процесса в печени, а также стадии болезни, определяемой по степени выраженности фиброза (индекса фиброза), степень фиброза также оценивают по международной шкале METAVIR. На основании этих показателей определяют прогноз заболевания, стратегию и тактику противовирусной терапии.
Инкубационный период составляет 2-13 нед., однако, в зависимости от пути передачи, может удлиняться до 26 нед. Инфицирование вирусом гепатита С приводит к развитию острого гепатита С, в 80% случаев протекающего в безжелтушной форме без клинических проявлений, в результате чего острую фазу заболевания диагностируют редко.
• По наличию желтухи в острой фазе болезни: желтушный, безжелтушный.
• По длительности течения: острое (до 3 мес.), затяжное (более 3 мес.), хроническое (более 6 мес.).
• По тяжести: лёгкая, среднетяжёлая, тяжёлая, фульминантная.
• Осложнения: печёночная кома.
• Исходы: выздоровление, хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
Факторы риска хронизации HCV-инфекции: посттрансфузионное заражение (попадание большого количества вируса, в отличие от спорадических случаев), парентеральное заражение, массивные гемотрансфузии, трансфузии коммерческой крови, тяжелое течение острой инфекции, высокий уровень АЛТ во время острой инфекции, значительные колебания уровня АЛТ во время острой инфекции, мужской пол.
Большинство больных с биохимическими признаками хронического гепатита С (70%) имеет благоприятное течение (слабовыраженную или умеренную воспалительную активность в ткани печени и минимально выраженный фиброз). Отдалённый исход у этой группы пациентов пока неизвестен. У 30% больных хроническим гепатитом С болезнь имеет прогрессирующее течение, у части из них (12,5% – за 20 лет, 20-30% – за 30 лет) происходит формирование цирроза печени, который может быть причиной смерти. Вторым, не менее опасным исходом ХГС, есть гепатоцеллюлярная карцинома (ГЦК), которая чаще развивается на фоне цирроза печени. Риск ее развития через 20 лет после инфицирования составляет 1-5%.
Хроническую НСV-инфекцию может сопровождать нормальная активность АЛТ при повторных исследованиях в течение 6-12 мес., несмотря на продолжающуюся репликацию РНК HCV. Доля таких пациентов среди всех больных с хронической инфекцией составляет 20-40%. У части из этой категории больных (15-20%) при проведении биопсии печени можно выявить серьёзные фиброзные изменения.
Внепечёночные проявления вирусного гепатита С встречают, по данным разных авторов, у 30-75% больных. Они могут выходить на первый план в течении болезни и определять прогноз заболевания. Течение хронического гепатита С могут сопровождать такие иммуноопосредованные внепечёночные проявления, как смешанная криоглобулинемия, красный плоский лишай, мезангиокапиллярный гломерулонефрит, поздняя кожная порфирия, ревматоидные симптомы. Установлена роль HCV в развитии В-клеточной лимфомы, идиопатической тромбоцитопении, поражения эндокринных (тиреоидит) и экзокринных желёз (прежде всего, вовлечение в патологический процесс слюнных и слёзных желёз, в том числе в рамках синдрома Шёгрена), глаз, кожи, мышц, суставов, нервной системы и др.
В целом, в 85-90% случаев острой HCV-инфекции наступает хронизация и в 10-15% – выздоровление. Исходом ХВГС есть цирроз печени и ГЦК, причем вероятность этих заболеваний увеличивается с каждым годом.
Учитывая малосимптомное течение болезни, основой для постановки диагноза служит отягощенный эпидемиологический анамнез и лабораторная диагностика. Диагностика острого гепатита С основана на комплексной оценке данных эпидемиологического анамнеза в сроки, соответствующие инкубационному периоду, желтухи, увеличения показателей билирубина, повышения уровня АЛТ более чем в 10 раз, наличия впервые выявленных маркёров вирусного гепатита С (анти-HCV, РНК HCV). Диагноз острого гепатита С устанавливают в тех случаях, когда, наряду с характерными клинико-эпидемиологическими и биохимическими данными, при первичном исследовании сыворотки крови отсутствуют антитела к HCV, которые появляются спустя 4-6 и более недель от начала болезни. Для диагностики острого гепатита С можно прибегнуть к выявлению вирусной РНК методом ПЦР, так как её можно обнаружить уже в первые 1-2 нед. заболевания, в то время как антитела появляются только через несколько недель. Использование тест-систем третьего поколения, значительно более чувствительных и специфичных, позволяет выявить анти-HCV в сыворотке крови уже через 7-10 дней от начала желтухи. Анти-HCV можно обнаружить как при остром гепатите С, так и при хроническом гепатите С. Анти-HCV антител IgM иногда обнаруживают у больных как острым, так и хроническим гепатитом С. Таким образом, обнаружение анти-HCV IgM не может быть использовано как 100% маркер острой фазы вирусного гепатита С.
Диагноз хронического гепатита С ставят на основании эпидемиологических и клинических данных, динамического определения биохимических показателей, наличия в сыворотке крови анти-HCV и РНК HCV. Для постановления полного диагноза используют определение генотипа вируса, вирусной нагрузки, структурных и неструктурных антител. Однако золотой стандарт диагностики хронического гепатита С – пункционная биопсия печени, которая показана пациентам, имеющим диагностические критерии хронического гепатита.
Дифференциальный диагноз
Единственно достоверным подтверждением гепатита С служат результаты маркерной диагностики. Необходимо дифференцировать от других вирусных гепатитов, алкогольных и токсических поражений печени, лептоспироза и др.
Госпитализация показана при остром вирусном гепатите и подозрении на вирусный гепатит.
Режим полупостельный при лёгком и среднетяжёлом остром гепатите С. При тяжёлом течении острого гепатита С – строгий постельный режим. При хроническом гепатите С – соблюдение режима труда и отдыха.
Диета щадящая (по кулинарной обработке и исключению раздражающих веществ), стол № 5.
В качестве этиотропного средства при лечении острого гепатита С применяют стандартный интерферон альфа. Увеличить количество выздоровевших (до 80-90%) от острого гепатита С удаётся при использовании следующих схем лечения:
- интерферон альфа по 5 млн. ME внутримышечно ежедневно в течение 4 нед., затем по 5 млн. ME внутримышечно трижды в неделю в течение 20 нед.;
- интерферон альфа по 10 млн. ME внутримышечно ежедневно до нормализации уровня трансаминаз (что происходит обычно на 3-6-й неделе от начала применения препарата).
Эффективна монотерапия пегилированным интерфероном альфа в течение 24 нед.
Базисной терапией ХВГС являются пегилированные интерфероны α2α 180 мкг или пегилированные интерфероны α2в 1,5 мкг/кг один раз в неделю подкожно и рибавирин (200 мг) согласно массе тела ежедневно. Для 1 генотипа вируса длительность лечения – 48 недель, для 2, 3 – 24 недели.
Мониторинг лечения: ПЦР-НЕV (количественно) на 4-12-24-48 недели. Общий анализ крови ежедневно ТТГ, АNА, АТПО 1р/неделю.
Задачи противовирусной терапии: исчезновение HCV РНК из сыворотки крови и ткани печени; нормализация уровня аминотрансфераз; уменьшение/разрешение воспалительных изменений в печени; уменьшение фиброза; снижение/исчезновение инфекционности; исчезновение клинической симптоматики.
На этапе клинических испытаний находится тройная терапия с использованием пегилированного интерферона альфа-2, рибавирина и телапневира.
В настоящее время основными мерами профилактики вирусного гепатита С являются качественное и своевременное тестирование крови лабораторными методами, обеспечение лечебных учреждений разовым медицинским инструментарием, работа с наркоманами и подростками в рамках специальных образовательных и медицинских программ. Однако совершенно очевидно, что без создания надежных вакцинных препаратов остановить заболеваемость вирусным гепатитом С в ближайшее время не удастся.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Статья посвящена проблеме алкогольного гепатита и современным алгоритмам его диагностики и лечения
Для цитирования. Костюкевич О.И. Алкогольный гепатит: современные алгоритмы диагностики и лечения // РМЖ. 2016. № 3. С. 177–182.
Патогенетические аспекты алкогольного повреждения печени
В основе ПП лежат сразу несколько механизмов.
1. Прямое гепатотоксическое воздействие этанола.
Слабо поляризованный растворитель, этанол может растворять фосфолипиды мембран гепатоцитов и митохондрий. Именно повреждение митохондрий лежит в основе жировой дистрофии печени, т. к. последние теряют способность метаболизировать триглицериды.
2. Токсическое действие ацетальдегида.
Ацетальдегид является крайне токсичным субстратом для гепатоцитов. Он накапливается в гепатоцитах и приводит к разрушению плазматических мембран путем деполимеризации белков и активации продуктов перекисного окисления липидов (ПОЛ). Кроме того, ацетальдегид активирует клетки, что приводит к избыточной продукции коллагена. Именно этим объясняется развитие фиброза печени при ХАИ.
3. Задержка белков и воды в гепатоцитах.
Этанол подавляет секрецию из гепатоцитов вновь синтезированных белков, что приводит к накоплению белка, а вслед за этим и воды, – это ведет, наряду с жировой дистрофией, к развитию гепатомегалии.
4. Иммунное ПП.
Именно иммунными механизмами можно объяснить случаи прогрессирования АБП, несмотря на прекращение употребления алкоголя.
Клиническая картина АГ
Различают 4 основные клинические формы АГ: латентную, желтушную, холестатическую и фульминантную.
1. Латентная форма не дает самостоятельной клинической картины и диагностируется по умеренному повышению трансаминаз у злоупотребляющего алкоголем пациента. Могут иметь место такие неспецифические жалобы, как слабость, снижение аппетита, неустойчивый стул, тупая боль в правом подреберье и т. д.
2. Желтушная форма встречается наиболее часто. У пациентов отмечаются выраженная слабость, анорексия, тупая боль в правом подреберье, тошнота, рвота, диарея, похудание, желтуха, у половины больных наблюдается лихорадка.
3. Холестатическая форма характеризуется значительным повышением гамма-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ), сопровождается мучительным кожным зудом. Довольно редко, уже на стадии гепатита могут проявляться признаки транзиторной портальной гипертензии с развитием асцита.
4. Фульминантный (тяжелый) острый АГ характеризуется нарастающей энцефалопатией, выраженной желтухой, отечно-асцитическим и геморрагическим синдромами. Риск развития фульминантного АГ возникает при одновременном приеме гепатотоксичных лекарств (например, парацетамол). Характерен нейтрофильный лейкоцитоз до 15–25×109/л, повышение СОЭ до 30–50 мм/ч. Билирубин повышается преимущественно за счет прямой фракции. Уровень трансаминаз повышается в 5–10 раз. Возрастает активность ГГТП и ЩФ, повышена концентрация иммуноглобулина А (IgA).
Диагностика АГ
Диагностика АГ складывается из 4-х этапов:
1) верификация ПП (факт гепатита);
2) подтверждение факта злоупотребления алкоголем;
3) оценка тяжести гепатита и прогноз;
4) оценка степени фиброза.
Оценка состояния печени включает в себя определение структурных (УЗИ, КТ и МРТ брюшной полости, биопсия печени) и функциональных (лабораторная диагностика, сцинтиграфия печени) изменений. Основными критериями гепатита являются гепатомегалия и повышение сывороточных трансаминаз.
При УЗИ, КТ и МРТ печени выявляется гепатомегалия различной степени выраженности, в случае транзиторной портальной гипертензии может верифицироваться асцит, спленомегалия.
Золотым стандартом диагностики АГ по-прежнему остается биопсия печени. Показаниями к биопсии печени служит необходимость дифференциальной диагностики между алкогольным и иными ПП, определения стадии АПБ, выявления перивенулярного фиброза как прогностически неблагоприятного фактора перехода заболевания в цирроз у лиц, продолжающих злоупотреблять алкоголем.
На сегодняшний день точность диагноза алкогольного стеатогепатита может быть подтверждена только на основании биопсии печени (класс рекомендаций 1A).
Морфологическими признаками острого АГ являются:
• некрозы гепатоцитов;
• воспалительная инфильтрация;
• жировая и балонная дистрофия;
• алкогольный гиалин (тельца Мэллори);
• поражение центролобулярной области.
Для острого АГ характерны признаки острой воспалительной реакции: лейкоцитоз, ускорение скорости оседания эритроцитов (СОЭ) (20–50 мм/ч), повышение С-реактивного белка.
У пациентов с АГ можно выделить следующие клинико-лабораторные синдромы:
1) синдром цитолиза – собственно отражает факт повреждения гепатоцитов. Характеризуется повышением трансаминаз: аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), лактатдегидрогеназы. Степень повышения ферментов, как правило, коррелирует со степенью тяжести гепатита;
2) синдром холестаза – верифицируется как минимум при 3-кратном увеличении ЩФ и ГГТП;
3) желтуха – повышение билирубина преимущественно за счет прямой фракции;
4) синдром печеночно-клеточной недостаточности – прогрессирует параллельно с тяжестью заболевания, его маркерами являются снижение альбумина, протромбина, нарастающая энцефалопатия;
5) портальная гипертензия – также имеет место при остром АГ и, как правило, носит обратимый характер. Наличие стойкой портальной гипертензии свидетельствует о возможном цирротическом поражении печени.
Следующим важнейшим этапом диагностики является определение этиологического фактора гепатита. У всех без исключения пациентов, даже с указанием на злоупотребление алкоголем в анамнезе, обязательным является определение маркеров вирусных гепатитов и тщательный сбор лекарственного анамнеза.
Факт употребления этанола, истинные дозы алкогольных напитков часто скрываются самими пациентами, что порой направляет лечащего врача по ложному пути и приводит к постановке ложного диагноза. Знание объективных критериев ХАИ помогает не только в диагностике АБП, но и многих других соматических заболеваний.
Выявление ХАИ
I. Существуют несколько опросников, позволяющих с высокой достоверностью не только выявить факт злоупотребления алкоголем, но и учесть вклад ХАИ в генез соматической патологии.
1. Опросник CAGE (Cut down, Annoyed, Guilty, Eye-opener) – состоит всего из 4-х вопросов (табл. 1).

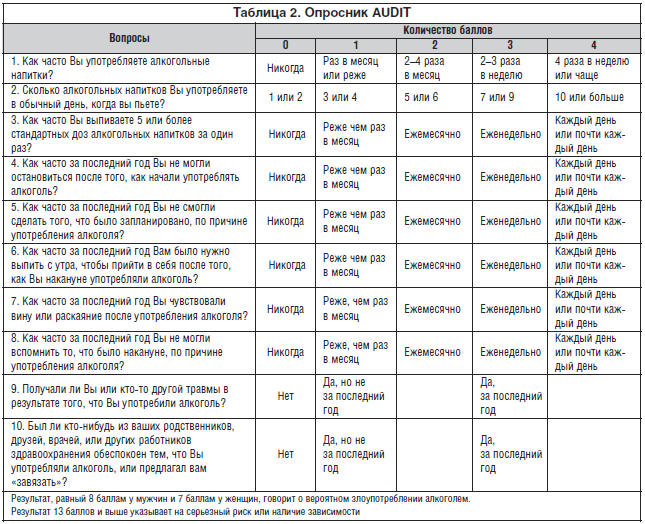
2. Опросник AUDIT (Alcohol Use Disorders Identification Test) – имеет международную стандартизацию, состоит из 10 вопросов (табл. 2).
Оценка степени тяжести и прогностические критерии АГ
Для оценки степени тяжести АГ и прогноза используют различные шкалы. Наибольшей популярностью пользуются следующие (табл. 6):

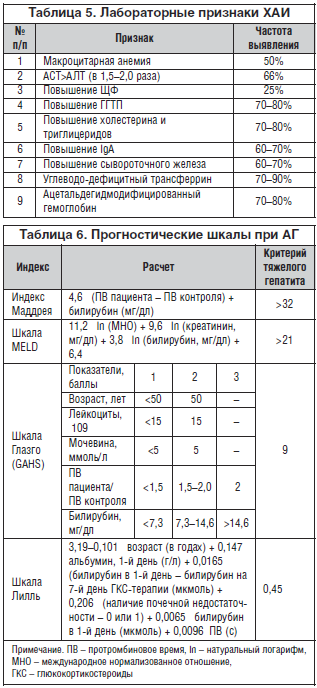
1. Индекс Маддрея, или дискриминантная функция (mDF) [5]. Показатель более 32 свидетельствует о тяжелом течении АГ и характеризуется высоким риском летального исхода в текущую госпитализацию (>50%).
2. Шкала MELD (Model for End-Stage Liver Disease), первоначально разработанная для определения очередности трансплантации печени.
3. Шкала Глазго оценки тяжести АГ (Glasgow alcoholic hepatitis score – GAHS). При значениях более 9 баллов к 28-му дню выживают 46% [6].
4. Шкала Лилль используется, как правило, для оценки целесообразности продолжения лечения кортикостероидами, т. к. при расчете используются лабораторные показатели до начала и через неделю терапии. При значении менее 0,45 выживаемость больных в течение 6 мес. составляет в среднем 25%.
Оценка степени фиброза
Выделяют инвазивные (биопсия печени) и неинвазивные методики: фибротест (определение сывороточных маркеров фиброза) и фиброскан, которые обладают довольно высокой чувствительностью и специфичностью.
Лечение АГ
Выбор лечебной тактики лечения АГ зависит, прежде всего, от степени тяжести заболевания. Поэтому перед началом терапии необходимо провести оценку тяжести и прогноза гепатита (индекс Маддрея).
Рациональные подходы к лечению АГ:
1) отказ от алкоголя;
2) нутритивная поддержка;
3) тщательный подбор кандидатов для короткого курса кортикостероидов;
4) назначение пентоксифиллина при невозможности приема кортикостероидов;
5) назначение поддерживающей терапии при легком и среднетяжелом течении АГ;
5) лечение осложнений АГ (портальная гипертензия, печеночная энцефалопатия, инфекционные осложнения).
Отказ от алкоголя. Обязательным условием лечения любой стадии АБП является абстиненция.
Нутритивная поддержка. Показано, что питательная недостаточность присутствует в той или иной степени у всех пациентов с АБП. В случае выраженных нарушений питательного статуса решается вопрос о нутритивной поддержке специализированными энтеральными питательными смесями.
Всем пациентам рекомендовано питание с суточной калорийностью 2000–3000 ккал, с содержанием белка не менее 1 г на 1 кг массы тела. Ограничение количества белка вводится только при явлениях печеночной энцефалопатии, в этом случае рекомендовано использовать аминокислоты с разветвленной цепью. Увеличение потребления белка с пищей способствует снижению катаболических процессов, нормализации иммунного статуса и непосредственно улучшению функции печени. Диета должна содержать достаточное количество витаминов (особенно группы В, фолиевой и липоевой кислот) и микроэлементов — цинка, селена. Установлено, что дефицит цинка (40% больных с АБП) занчительно усиливает проявления печеночной энцефалопатии. Известно также, что алкогольдегидрогеназа – цинкозависимый фермент, следовательно при дефиците цинка ее активность снижается.
Глюкокортикостероиды
Метаанализ 13 рандомизированных исследований, проведенный Mathurin в 2002 г., показал, что терапия глюкокортикоидными препаратами достоверно улучшает выживаемость пациентов с тяжелым острым АГ.
На сегодняшний день ГКС являются препаратами первой линии терапии тяжелого АГ при индексе Маддрея более 32 (уровень доказательности 1В) [7].
Преднизолон назначается перорально 40 мг/cут сроком до 4-х нед. с последующей быстрой заменой на 5 мг/нед.; обязательное условие – нормальный уровень креатинина.
Если в течение 7 дней снижения билирубина не произошло (оценка по шкале Лилль – 0,45), ГКС отменяют (уровень доказательности 1В).
При наличии противопоказаний к назначению ГКС целесообразно назначение пентоксифиллина (1В) 1200 мг/сут per os или 400–600 мг/сут внутривенно. Терапия пентоксифиллином имеет меньшую доказательную базу и используется только при невозможности терапии ГКС.
Читайте также:


