Обязательное морфологическое изменение печени при гепатите

Распространение вирусного гепатита В в мире охватывает более 2 миллиардов человек, имеющих маркеры перенесённой HBV-инфекции, более 400 миллионов человек является больными хроническим вирусным гепатитом В. В РФ количество больных ХВГВ составляет более 5 миллионов человек [6]. Одной из важных причин хронизации вирусных гепатитов является способность HBV к длительной персистенции в клетках печени.
В большинстве случаев хронического поражения печени, в том числе при инфекции гепатотропными вирусами, основным механизмом гибели клеток служит апоптоз [7]. При вирусном гепатите апоптоз может быть как результатом прямого воздействия вируса, так и опосредованным иммунной реакцией. Являясь универсальным биологическим механизмом, апоптоз при вирусных гепатитах может приводить к избыточной гибели не только гепатоцитов, но и других клеточных популяций, отражая либо системный иммуновоспалительный ответ на инфекцию, либо внепеченочную персистенцию вируса. Апоптоз лимфоцитов и гранулоцитов достоверно выше у больных ХВГВ по сравнению с контролем [1].
Фиброз печени - это локальное или диффузное увеличение количества соединительной ткани, внеклеточного матрикса (коллагеновой волокнистой ткани в перисинусоидном пространстве) и основной путь прогрессирования хронических диффузных заболеваний печени. Клетками, непосредственно задействованными в процессе фиброзирования, являются гепатоциты, клетки Купфера, синусоидальные эндотелиоциты, звездчатые клетки печени [3, 8]. Эволюция фиброза при вирусных гепатитах представляется как первичный фиброз портальных трактов с последующим распространением по направлению к центральной вене и соседним портальным трактам с образованием порто-портальных и порто-центральных септ [10]. На предрасположенность к активному фиброгенезу и быстрому прогрессированию заболевания влияют такие факторы, как: особенности генной регуляции синтеза и распада коллагена у носителей определённых генотипов [2].
Диапазон патогистологических изменений в морфологическом субстрате при вирусных гепатитах велик. Накоплены данные о том, что для больных ХГВ характерно повышение значений показателей ангиогенеза и экспрессии матриксных металлопротеиназ-2 (ММП), высокая пролиферативная активность клеток Ито. Проведение ПВТ ламивудином больных ХГВ приводит к положительной динамике морфологических данных, сопровождается снижением пролиферактивной активности клеток Ито, снижением уровня экспрессии ММП-7 и ММП-9, уменьшением значений ангиогенеза и активацией механизмов антиметаллопротеиназной защиты. Регресс морфологических данных при проведении ПВТ не зависит от степени фиброза печени и наличия HBeAg до лечения [5].
Синдром эндогенной интоксикации (СЭИ) регистрируется при многих патологических состояниях организма человека, в том числе и при вирусных гепатитах. Цитолиз гепатоцитов при поражении печени HBV приводит к снижению её дезинтоксикационной и белоксинтезирующей функции, что приводит к нарастанию синдрома эндогенной интоксикации. Состояние молекулы сывороточного альбумина, характеризующее ее связывающую способность, достоверно отражает течение СЭИ и может быть использовано в качестве критерия прогноза, тяжести течения и исхода заболевания, а также эффективности проводимой терапии. Существует три причины, способные изменить эффективную концентрацию альбумина (ЭКА): 1) потеря альбумина (снижение общей концентрации альбумина (ОКА)); 2) загрузка альбумина метаболитами (билирубином, токсинами и другими ароматическими метаболитами); 3) изменение конформации молекулы альбумина. Индекс резерва связывания альбумина (РСА=ЭКА/ОКА×100 %) не зависит от концентрации альбумина, характеризует только состояние его молекулы и расценивается как маркер интоксикации, достоверно отражающий статус интоксикации организма. Его динамика достоверно связана с морфофункциональным состоянием печени. Нарушение функции печени, как острое, так и хроническое, приводит к снижению РСА и повышению индекса токсичности (ИТ=ОКА/ЭКА-1). Доказано увеличение маркеров синдрома эндогенной интоксикации в зависимости от степени тяжести процесса. Отмечается сохранение маркеров эндогенной интоксикации при течении ХВГС в фазу репликации вируса [4].
В литературе нет данных, определяющих взаимосвязь между влиянием морфологических изменений в ткани печени на формирование и степень синдрома эндогенной интоксикации при вирусном гепатите В.
Цель исследования: определить характер гистиоструктурных изменений паренхимы печени и выраженность синдрома эндогенной интоксикации у больных хроническим вирусным гепатитом В в динамике заболевания и влияние комбинированной противовирусной терапии на изменение показателей связывающей способности сывороточного альбумина.
Материалы и методы
В исследование включены 54 пациента с впервые выявленным хроническим вирусным гепатитом В. Маркеры HBV (HBsAg, анти-HBs, анти-HBcore IgG+IgM, анти-HBcore-IgM, анти-HBe) определяли, используя отечественные и зарубежные коммерческие тест-системы. Для определения ДНК-ВГВ использовали наборы фирм: Интерлабсервис и Авиценна (с чувствительностями 1000 и 300 geq/мл соответственно).
Всем пациентам проведена двукратная чрескожная пункционная биопсия печени (ЧПБП). Пациенты были распределены на 2 группы. В I группу включён 21 пациент, не проходивший лечение, которым вторая ЧПБП проведена в интервале 2-3 года от первой. Пациенты, сформировавшие I группу, изначально готовились к проведению ПВТ, однако, в силу разных причин вынуждены были перенести терапию на более поздний срок. Во II группу вошло 33 человека, которым проведена ЧПБП до и после проведения противовирусной терапии.
Пациенты получали комбинированную противовирусную терапию (α-интерферон-2а 5 млн. ЕД ежедневно и ламивудин 100 мг/сутки). Показаниями к назначению комбинированной противовирусной терапии были: положительная ПЦР на ДНК HBV, маркеры вирусного гепатита В в ИФА, повышенный уровень трансаминаз. Продолжительность терапии составила 6 месяцев.
Гистологическое исследование проводили на парафиновых срезах. Материал подвергали стандартной гистологической обработке с окраской серийных срезов гематоксилином, эозином, пикрофуксином по Ван Гизону. Использовались обзорные морфологические описания структурных нарушений в печени.
В гепатобиоптатах определяли индекс гистологической активности (ИГА) по Knodell R.G.: 0-3 балла - низкая, 4-8 баллов - минимальная, 9-12 баллов - умеренная, 13-17 баллов - высокая активность ХВГ С, а также степень фиброза с использованием гистологического индекса склероза (ГИС) по Desmet J. V.: F1 - слабый, F2 - умеренный, F3 - тяжелый фиброз, F4 - цирроз печени. Оценивались гистологические критерии ХВГ: портальные тракты, лимфоидные фолликулы в портальных и перипортальных зонах печеночной дольки, гидропическая и жировая дистрофии гепатоцитов, пролиферация междольковых желчных протоков, наличие порто-портальных септ [9].
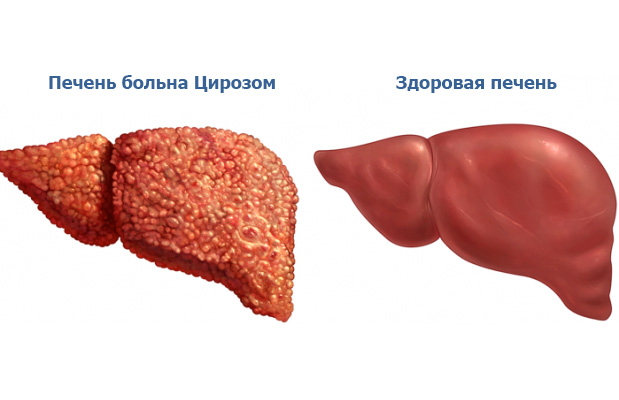
Цирроз – это заболевание печени, которое характеризуется структурными изменениями печени и формированием рубцовой ткани, снижением ее функциональности.
Цирроз печени - это диффузный процесс, для которого характерно наличие фиброза (то есть рубцовых изменений), узловой трансформации паренхимы (ткани печени), а также сочетание некротических и воспалительных изменений, приводящих к нарушению архитектоники печени (появлению ложных долек).
Наш опыт работы с больными циррозом печени, вызванным инфекцией, позволяет утверждать, что при правильно поставленном диагнозе, адекватной противовирусной терапии, в сочетании с комплексной коррекцией физиологических показателей можно добиться не только замедления темпов прогрессирования цирроза, но и его обратного развития.
Клинически это подтверждается нормализацией лабораторных показателей, улучшением общего самочувствия, а морфологически – снижением степени фиброза печеночной ткани и частичным восстановлением ее архитектоники.
Такой поворот происходит не сразу. Это - месяцы и даже годы жизни. Но, что очень важно – жизни полноценной, гармоничной, качественной.

Цирроз на начальных стадиях может протекать бессимптомно. Выраженность симптомов зависит от причин возникновения цирроза, степени поражения печени и активности патологического процесса.
Цирроз печени может проявляться следующим образом:
- Усталость, снижение работоспособности;
- Болезненные ощущения в правом подреберье;
- Ощущение переполненного желудка, тяжесть в желудке, тошнота;
- Кожный зуд;
- Желтуха: пожелтение кожных покровов и склер;
- Увеличение количества жидкости в животе.
Одним из важнейших показателей состояния печени является степень выраженности фиброза.
Первый и очень важный шаг в борьбе с циррозом - своевременная и всесторонняя диагностика состояния печени.

- Выявлять цирроз на ранних стадиях заболевания;
- Точно устанавливать причину его возникновения;
- Прогнозировать развитие цирроза и назначить наиболее эффективную терапию;
- Провести экспертную оценку в плане ранее установленных врачебных заключений.
Для этих целей мы проводим нашим пациентам комплексное обследование, включающее:
Как правило, возникновение цирроза печени связывают исключительно с чрезмерным употреблением алкоголя, но на самом деле, еще одной ключевой причиной появления цирроза является вирусный гепатит и в частности его разновидности В, С, D. Кроме того, причинами Цирроза печени являются:

- Заболевания желчных путей: сужение протоков, застой желчи;
- Нарушение обменных процессов;
- Хроническая сердечная недостаточность и застой венозной крови в печени;
- Длительный прием лекарственных препаратов, имеющих гепатотоксичный эффект и т.д.
- В общем анализе крови: снижение уровня тромбоцитов и лейкоцитов, повышенная СОЭ.
- В биохимическом анализе крови: высокие трансаминазы (АЛТ, АСТ), низкий уровень альбумина.
- Анализ кала: положительный результат на скрытую кровь.
- При физикальном осмотре: увеличение селезенки, увеличение (уменьшение) границ печени.
- При гастроскопии: выявление расширенных вен пищевода.
- На УЗИ: увеличение диаметра воротной и селезеночной вены.
Одной из самых частых причин внезапной смерти при циррозе печения является кровотечение из расширенных вен пищевода.
Поэтому, в первую очередь, мы проводим нашим пациентам комплекс лечебных мер, направленных на:
- снижение риска внезапной смерти;
- нормализацию биохимических показателей крови;
- поддержание иммунной системы организма.
Только после этого мы назначаем этиотропную (то есть направленную на причину болезни) терапию.
У больных циррозом печени, как правило, снижен уровень белка крови и число клеточных элементов. Это состояние чревато развитием инфекционных осложнений при проведении противовирусной терапии. Поэтому перед тем как назначить основные препараты, мы проводим подготовительное лечение, направленное на восполнение имеющегося дефицита в плазме крови, стимуляцию клеточных ростков крови, а также назначаем лекарства, поддерживающие постоянство ее реологических свойств.
| В 19-й хромосоме человека, в локусе Rs 129179160 есть ген, который отвечает за синтез интерлейкина 28В. На сегодняшний день известны три возможных варианта полиморфизма этого гена - ТТ, СТ, СС. |
У жителей России и Европы (представителей европеоидной расы) с СС-генотипом достижение устойчивого вирусологического ответа (более 80%) возможно при лечении стандартной двухкомпонентной схемой препаратов. У носителей СТ и ТТ генов – это 40% и 30% случаев – соответственно. Однако указанные цифры зависят также от стадии цирроза печени, чем она больше, тем меньше шансов добиться так называемого SVR–статуса, при котором отсутствие вируса в организме отмечается с 12-й недели терапии и до 6 месяцев после ее окончания.
При сочетании цирроза и ТТ-генотипа (СТ) стандартные схемы являются неэффективными. В этом случае мы проводим трехкомпонентное лечение пегелированными препаратами, что во много раз увеличивает шансы избавить больного от вируса и добиться обратного развития патологического фирогенеза.
Наш опыт в лечении цирроза печени, позволяет утверждать, что при правильно поставленном диагнозе, адекватной противовирусной терапии, в сочетании с комплексной коррекцией физиологических показателей можно добиться не только замедления темпов прогрессирования цирроза, но и его обратного развития.
- Нормализацией лабораторных показателей;
- Улучшением общего самочувствия пациента;
- Снижением степени фиброза печеночной ткани и частичным восстановлением ее структуры.
Такой поворот происходит не сразу. Это - месяцы и даже годы жизни. Но, что очень важно – жизни полноценной, гармоничной, качественной.
Врачи клиники МедЭлит разработают индивидуальную программу лечения цирроза печени.
Запишитесь на прием ежедневно с 9 до 21: 8 495 646-07-47
Или оставьте ваш номер телефона, мы вам перезвоним в удобное для вас время


Проверен временем! Ультразвуковая система для проведения исследований с экспертной диагностической точностью.
В настоящее время в связи с развитием высокоразрешающей ультразвуковой диагностической аппаратуры значительно повышается интерес к возможностям эхографии в дифференциальной диагностике диффузных болезней печени. В работах ряда авторов [l,2] представлены эхо- и доплерографические критерии оценки печени при вирусных гепатитах и циррозах печени. Однако в России в структуре хронических гепатитов у детей 2% приходится на долю аутоиммунного гепатита, что составляет значительную величину и привлекает активное внимание гепатологов [3].
Аутоиммунный гепатит - прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характеризующееся наличием перипортального гепатита, гипергаммаглобулинемии, печеночноассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию [4]. Девочки и женщины составляют 75% больных [5]. Этиология аутоиммунного гепатита неизвестна, а патогенез изучен недостаточно. В качестве возможных пусковых факторов возникновения заболевания обсуждается роль вирусов Эпштейна-Барр, гепатитов А и С, а также лекарств. Не исключается возможность возникновения аутоиммунного гепатита вследствие первично обусловленного нарушения иммунного ответа, когда появление "запрещенных клонов" аутореактивных клеток происходит без воздействия триггерных факторов [6]. Обязательным для постановки диагноза аутоиммунного гепатита является наличие аутоантител в сыворотке крови: антинуклеарных (ANA), и/или антигладкомышечных (SМА) антител при аутоиммунном гепатите I типа; аутоантител к микросомам печени и почек (anti-LKM I) при аутоиммунном гепатите II типа, гипергаммаглобулинемии, а также отсутствие признаков вирусных и метаболических болезней печени [7]. В исходе аутоиммунного гепатита не редко формируется цирроз печени в относительно короткие сроки после первой манифестации процесса. У детей цирроз печени встречается в 74% при аутоиммунном гепатите I типа и в 44% случаев при аутоиммунном гепатите II типа [5]. У взрослых ситуация об ратная: при аутоиммунном гепатите II типа чаще развивается цирроз печени, чем при аутоиммунном гепатите I типа (82% против 43%, со ответственно) [6].
Учитывая актуальность проблемы и отсутствие в доступной литературе данных о возможностях ультразвуковой диагностики в распознавании аутоиммунного гепатита, целью работы явилось определение эхографических изменений печени при аутоиммунном гепатите у детей.
Наблюдались 36 детей (31 девочка и 5 мальчиков) в возрасте от 7 до 15 лет с диагнозом аутоиммунный гепатит. Средняя продолжительность наблюдения 31,4±19,8 месяцев. К моменту поступления продолжительность заболевания была от 1 месяца до 8 лет.
Всем детям проводили лабораторное об следование, включающее общий анализ крови, биохимический анализ крови, определение содержания иммуноглобулинов (Ig) классов А, М, G, маркеров вирусных гепатитов А, В, С (anti-HAV IgM, HbsAg, anti-HBc, anti-HBe, anti-HBs, anti-HCV) методом ИФА, ДНК вируса гепатита В и РНК вируса гепатита С методом полимеразной цепной реакции (ПЦР). Были выявлены нарушения пигментного обмена, признаки цитолиза и изменений иммунологической активности. У 33 пациентов (91,7%) диагностирован аутоиммунный гепатит I типа, характеризующийся наличием ANA и SMA, но отсутствием anti-LKM I в сыворотке крови и у 3 (8,3%) детей - аутоиммунный гепатит II типа.
Пункционная биопсия печени проведена у 27 из 36 больных. Морфологическое исследование ткани печени свидетельствовало о наличии хронического гепатита у 8 больных; признаки цирроза печени были выявлены у 19 больных. У 9 больных в связи с отказом от проведения пункционной биопсии печени формирование цирроза печени было установлено на основании клинико-лабораторных данных. Таким образом, у 28 из 36 детей с аутоиммунным гепатитом был цирроз печени. Эндоскопическое исследование при поступлении в клинику выявило варикозное расширение вен пищевода 12 степени у 19 пациентов с циррозом печени и еще у 6 больных через 1-1,5 года с момента начала наблюдения.
Контрольную группу составили 25 здоровых сверстников. В качестве группы сравнения обследовано 56 детей с вирусным гепатитом В и 42 ребенка с вирусным гепатитом С в возрасте от 7 до 15 лет. Всем проводили ультразвуковое исследование органов брюшной полости и забрюшинного пространства. Использовались датчики частотой 3,5-5,0 МГц. Выполнялась обще принятая методика эхографической оценки печени и кровотока в цветовом и импульсном режимах. Исследование печени включало измерение левой доли (переднезадний, медиально-латеральный и верхненижний размеры), правой доли (верхненижний размер).
Доплерографическое исследование сосудов портальной системы и чревного ствола проводилось по воротной вене - в области ствола, по печеночным и селезеночным артериям - в месте их выхода из чревного ствола, по селезеночной вене - в области ворот селезенки, по средней печеночной вене - отступая 2-3 см от места ее впадения в нижнюю полую вену. Основными критериями оценки кровотока являлись показатели объемного кровотока, индекса резистентности по артериям и пульсового индекса по печеночной вене. Полученные результаты обрабатывались статистически по общепринятым методикам вариационнй статистики. Достоверность различий изучаемых показателей определяли по критерию Стьюдента.
У всех детей с аутоиммунным гепатитом на стадии хронического гепатита наблюдалось диффузное увеличение печени. Четкой зависимости от активности процесса или давности заболевания не прослеживалось. Увеличение правой доли составило в среднем 20%, а левой доли - 8% по верхненижнему и 20% по медиально-латеральному размерам по сравнению с нормальными возрастными показателями. Контур печени был ровный, но с выраженной дольчатостью. Углы долей соответствовали нормальному контуру печени. Отмечалась гиперэхогенность паренхимы. Неоднородность ее была обусловлена гипер- и гипоэхогенными участками сред них размеров (3-5 мм), гиперэхогенной тяжистостью по ходу ветвей воротной вены, что создавало впечатление сетчатости печеночного рисунка (рис. 1 а). Визуализировались единичные печеночные вены с небольшой протяженностью от места впадения в нижнюю подую вену, тонкие, горизонтально направленные, с ровным контуром (косой срез печени). Ослабления ультразвука не наблюдалось, и паренхима печени хорошо прослеживалась до заднего контура. Диаметр ствола воротной вены оставался в пределах допустимых значений. Имела место гиперэхогенность стенок как ствола, так и мелких ветвей воротной вены. У одного ребенка определялось не большое раскрытие пупочной вены (до 2 мм) без признаков кровотока в ней.
Дельта-гепатит, так же как и гепатит В, имеет практически повсеместное, но неравномерное распространение. Частота случаев коинфекции колеблется в различных странах от спорадической регистрации до 25—30%от числа заболевших острым HBsAg-позитивным гепатитом (рис.17).
Показателем широты распространения дельта-инфекции служит и частота выявления антител к дельта-антигену (анти-BГD) среди носителей ВГВ и больных хроническим гепатитом. Считается, что около 5% HBsAg-носителей (приблизительно 15 миллионов человек) инфицированы дельта-вирусом. По уровню распространения дельта-инфекции регионы, территории и страны могут быть условно отнесены к одной из четырех зон:
— зоне высокой эндемичности, с частотой обнаружения анти-BГD свыше 20% у носителей HBsAg и более 60% среди больных хроническим гепатитом В (некоторые страны Африки:
Кения, Центрально-Африканская республика, Нигер; Тайвань, а также Венесуэла; Южная Италия, Румыния, Южные районы Молдовы);
- зоне средней эндемичности анти-BГD - 10 -19% у носителей HBsAg и от 30 до 60% среди больных хроническим гепатитом В (некоторые страны Африки: Нигерия, Сомали, Уганда, Бурунди; некоторые районы США — Калифорния; Россия - Якутия, Тува);
- низкой эндемичности от 3 до 9% среди носителей HBsAg и от 10 до 30% среди больных хроническим гепатитом В (Либерия, Эфиопия, ЮАР, Литва, Эстония, Латвия, Европейская часть России, США);
- очень низкой эндемичности до 2% среди носителей HBsAg и менее 10% среди больных хроническим гепатитом В (Страны Северной и Центральной Европы, Китай, Япония, Уругвай, Чили, Аргентина, Южная часть Бразилии, Австралия).
Уровень эндемичности дельта-инфекции связан с широтой распространения гепатита В на данной территории, однако, эта связь не абсолютна. Так, несмотря на высокую интенсивность циркуляции вируса гепатита В среди эскимосов Аляски, дельта-инфекция там регистрируется на низком уровне.
Заражение дельта-вирусом (как при коинфекции, так и суперинфекции) приводит к развитию острого заболевания. На начальном этапе изучения дельта-гепатита подчеркивалась взаимосвязь между наличием дельта-инфекции и тяжестью заболевания. Однако, исследования, проведенные в эндемичных по дельта-гепатиту регионах, продемонстрировали, что значительный процент носителей HBsAg с наличием антител к дельта-антигену не имеет абнормальных клинических или биохимических показателей. Эти и другие данные позволили утверждать, что дельта-гепатит может ассоциироваться с широким спектром клинических проявлений заболевания от бессимптомного носительства до фульминантного гепатита и цирроза печени. Анализ данных гистологического исследования биопсии печени больных хроническим дельта-гепатитом в Италии выявил два типа течения заболевания. При первом приблизительно у 10% пациентов регистрировали непрогрессирующий гепатит. При втором в 90% случаев отмечали хронический гепатит высокой активности или активный цирроз печени.
Начало желтушного периода совпадает с появлением пожелтения кожных покровов и склер, темной мочи и светлого стула, нарастанием симптомов интоксикации, болями в правом подреберье. При суперинфекции в течение 3-5 дней регистрируется лихорадка. Печень и селезенка увеличены.
Более чем у половины больных, суперинфицированных вирусом гепатита D, на 15-32 день от начала желтухи регистрируется повторное повышение уровня трансаминаз, нарастание интоксикации, боли в правом подреберье, увеличение размеров печени. Высказывается предположение, что первый подъем уровня сывороточных трансаминаз связан с репликацией вируса гепатита В, а повторный - с действием вируса гепатита D.
Острый дельта-гепатит может заканчиваться выздоровлением или развитием хронического гепатита. Период реконвалесценции обычно продолжается дольше (несколько месяцев), чем при гепатите В. У переболевших длительное время сохраняется повышенная утомляемость и вялость. Так же как и при других вирусных гепатитах, большое значение для постановки диагноза и контроля за течением заболевания имеют диагностические маркеры инфицирования. К ним относят: дельта-антиген, антитела к нему класса IgG и IgM, РНК BГD.
В настоящее время в качестве основы диагностической тест-системы применяют дельта-антиген, полученный генно-инженерным способом. Определение дельта-антигена осуществляется после обработки сыворотки, содержащей BID неионными детергентами, что приводит к высвобождению дельта-антигена.
Успешное клонирование генома дельта-вируса в Е.соli позволило разработать тест точечной гибридизации для выявления РНК дельта-вируса в сыворотке крови больных острой и хронической дельта-инфекцией. Идентификация РНК BГD возможна и при использовании метода амплификации кДНК ВГD
Наличие двух форм инфицирования дельта-вирусом и его связь с вирусом гепатита В определяет наличие различных серологических профилей инфекции.
Серологический профиль маркеров инфицирования вирусом гепатита В при коинфекции соответствует острой инфекции гепатита В. HBsAg, HBeAg, анти-НВс, ДНК ВГВ удается определять в инкубационный период заболевания до появления серологических маркеров дельта-инфекции.
При суперинфекции в остром периоде заболевания дельта-антиген выявляется в сыворотке крови кратковременно, а в некоторых случаях вовсе не обнаруживается, хотя результаты исследования гепатоцитов свидетельствуют о длительном его синтезе. В остром периоде заболевания идентифицируют также антитела класса IgM. В отличие от коинфекции при суперинфекции антитела к дельта-антигену класса IgG регулярно выявляются уже в остром периоде болезни, причем их титр превышает 1:1000 по данным иммуноферментного метода. Этот показатель является одним из лабораторных критериев дифференциации коинфекции и суперинфекции дельта-вирусом. Анти-дельта могут длительно обнаруживаться в периоде реконвалесценции и на протяжении нескольких лет в процессе хронического гепатита (рис. 19 ).
Взаимодействие вирусов гепатита В и гепатита D находит свое отражение и при суперинфекции в динамике и характере выявления диагностических маркеров инфицирования вирусом гепатита В. Так, установлено, что суперинфицирование дельта-вирусом проводит к снижению концентрации циркулирующего HBsAg.
В большинстве случаев хронический дельта-гепатит сопровождается отечно-асцитическим синдромом, связанным с нарушением белково-синтетической и дезинтоксикационной функции печени. Типичным для заболевания являются и так называемые “немотивированные” ознобы с повышением температуры до 38—39 °С в течение 1—3 дней без катаральных явлений с патологическим повышением активности трансаминаз. Течение заболевания имеет волнообразный характер с чередованием периодов обострения и ремиссий.
При хроническом дельта-гепатите (особенно в периоды обострении) происходит изменение иммунологических показателей: уменьшение количества Т-лимфоцитов со снижением их функциональной активности, уменьшение интерферонпродуцирующей способности лимфоцитов. Иммунный ответ организма формируется не только в отношении BГD, но и продуктов разрушения гепатоцитов.
Морфологически хронический дельта-гепатит имеет следующие признаки: расширенные портальные тракты, обильно инфильтрированные фибробластами и лимфогистиоцитарными элементами; ступенчатые и мостовидные некрозы; полиморфно-дистрофически измененные гепатоциты; гепатоциты в состоянии коагуляционного некроза, не окруженного элементами воспалительного инфильтрата. При тяжелых формах хронического дельта-гепатита регистрируется активное разрастание соединительной ткани как в портальных трактах, так и в паренхиме печени.
Обобщенная схема динамики выявления диагностических маркеров инфицирования вирусами гепатитов D и В при хронической дельта-вирусной инфекции следующая. В сыворотке крови, наряду с HBsAg и анти-НВс, циркулируют антитела к дельта антигену, представленные иммуноглобулинами классов G и М, причем уровень анти-BГD IgM достаточно высок, в среднем 1:10 4 , по данным ИФА. В период обострении болезни регистрируется повышение титров анти-BГD IgM, а в периоды ремиссии их снижение. Стойкое увеличение концентраций этих антител в процессе хронизации является маркером хронического дельта-гепатита. Дельта-антиген и РНК BГD могут быть выявлены в течение длительного времени как в сыворотке, так и в гепатоцитах.
В большинстве случаев у больных хронической дельта-инфекцией наряду с показателями активной репликации BГD (анти-BГD IgM и дельта-антигеном) отсутствуют маркеры активной репликации ВГВ (HBeAg и анти-НВс IgM). У значительно меньшей части больных регистрируется активная репликация BГD и ВГВ, показателем чего служит одновременное выявление анти-BГD IgM и HBeAg и анти-НВс IgM. В процессе длительного течения заболевания может происходить сероконверсия от HBeAg к анти-НВе, что отражает естественный процесс развития ВГВ-инфекции.
Представляется чрезвычайно важным, что более тяжелые поражения печени чаще регистрируются у больных хроническим дельта-гепатитом, у которых отсутствуют (или снижены) показатели активной репликации ВГВ. Подтверждением этому служит и достоверно более частое развитие у них хронического агрессивного гепатита в сочетании с циррозом печени по сравнению с теми больными, у кого отмечается активная репликация BID и ВГВ. Кроме того, летальность у больных с наличием HBeAg значительно ниже по сравнению с лицами, у которых циркулируют анти-НВе. Вызывает интерес то, что среди больных СПИДом в сочетании с хроническим дельта-гепатитом может быть зарегистрирован атипичный серологический профиль маркеров инфицирования дельта-вирусом: наличие дельта-антигена и РНК BГD при отсутствии или низком содержании антител к дельта-антигену и, в некоторых случаях, без выявления HBsAg.
Первичный гепатоцеллюлярный рак печени у больных хроническим дельта-гепатитом регистрируется реже, чем у больных с хроническим гепатитом В. Предполагается, что больные с хронической дельта-инфекцией погибают раньше от этого заболевания, не оставляя времени, необходимого для развития рака печени.
Гепатит D, так же как гепатит В - строго антропонозная инфекция. Сохранение инфекции в природе обусловлено стабильной циркуляцией вируса гепатита D в человеческой популяции. Обязательное наличие репликации вируса гепатита В для проявления гепатитной D инфекции определяет общие эпидемиологические закономерности распространения этих двух инфекций, а также индивидуальные особенности гепатита D.
Источниками вируса являются больные острой и хронической дельта-вирусной инфекцией. Заболеть дельта-инфекцией может человек любого возраста, не имеющий антител против HBsAg и/или HBcAg [при коинфицировании], или носители HBsAg [при суперинфицировании], ранее не болевшие дельта-инфекцией. С эпидемиологической точки зрения, в распространении дельта-инфекции суперинфицирование играет центральную роль, т. к. при этой форме заражения часто развивается хроническая инфекция с длительной персистенцией вируса гепатита D. В отличие от суперинфицирования, исходом коинфекции является выздоровление, сопровождающееся элиминацией из организма вирусов гепатитов D и В. Повторные случаи дельта-гепатита не зарегистрированы.
Распространение гепатита D происходит естественным и искусственным путями передачи, обеспечивая попадание заразного начала в организм человека с кровью, содержащей вирус гепатита D. По сравнению с гепатитом В для заражения дельта-гепатитом требуются более высокие концентрации возбудителя, что, видимо, определяет меньшую интенсивность распространения этой инфекции.
Другим естественным путем передачи дельта-вируса является вертикальный путь, т. е. заражение ребенка от матери. Описаны случаи развития инфекции у новорожденных детей, чьи матери были инфицированы дельта-вирусом. Механизм заражения детей до конца не изучен. Считается, что даже в регионах, эндемичных по дельта-гепатиту, вертикальный путь передачи не столь интенсивен, как при гепатите В.
При дельта-гепатите имеются семейные очаги инфекции. Распространение дельта-вируса среди членов одной семьи происходит при тесном бытовом контакте через микротравмы, причем заражение может происходить не только между супругами, но и между другими родственниками. Интенсивность передачи возбудителя в семейных очагах зависит от концентрации вируса у источника инфекции, а также социально-экономического и культурного уровня семьи.
Возможность распространения вируса гепатита D через кровососущих насекомых не отрицается. Однако случаи такой передачи крайне редки и возможны только в эндемичных по этой инфекции регионах.
Наибольшее значение в распространении дельта-гепатита имеют искусственные пути передачи инфекции. Их реализация происходит при попадании вируса в кровь человека при многочисленных медицинских манипуляциях, которые нарушают целостность слизистых и кожных покровов. В первую очередь, передача возбудителя происходит при использовании медицинского инструментария (иглы, шприцы, хирургические инструменты и др. ), который не достаточно обеззаражен. Случаи посттрансфузионного гепатита D регистрируются значительно реже, чем посттрансфузионного гепатита В. Очевидно, это связано с тем, что подавляющее большинство лиц с хронической дельта-инфекцией имеют клинически выраженную симптоматику заболевания и не допускаются к донорству. Кроме того, обязательное тестирование крови доноров на наличие HBsAg снижает вероятность переливания крови, контаминированной дельта-вирусом. Заражение гепатитом D может произойти при пересадке органов и тканей в случаях, когда их донор инфицирован вирусами гепатитов D и В. Эпидемиологически гепатит D имеет такое же проявление как гепатит В. Крупные вспышки тяжелого дельта-гепатита описаны среди местных жителей Венесуэлы, Колумбии, Бразилии, Перу, Индии и Центрально-Африканской Республики. Так, при вспышке дельта-инфекции в регионе Санта-Марта Колумбии была зарегистрирована высокая смертность (до 20% заболевших) при суперинфицировании вирусом гепатита D носителей HBsAg. Пути столь интенсивного распространения инфекции при этой и других вспышках не были окончательно выявлены. Однако исключение искусственных путей передачи позволило утверждать о непарантеральном распространении инфекции.
Вспышки дельта-гепатита зарегистрированы среди наркоманов, применяющих наркотики внутривенно.
Тот факт, что лица, имеющие антитела к HBsAg в результате перенесенного заболевания или вакцинации против гепатита В не заболевают дельта-гепатитом позволяет считать вакцину против гепатита В также средством профилактики дельта-инфекции в случаях коинфицирования. Вакцина, защищающая носителей HBsAg от суперинфицирования дельта-вирусом, до сих пор не создана. Отсутствие такого препарата выдвигает на первый план мероприятия по максимальному уменьшению действия факторов риска быть инфицированным вирусом гепатита D.
Рис. 17. Географическое распространение дельта инфекции в мире (Полиш, Галагнер, Филдз и Хадлер, 1993)
Рис. 18. Временные соотношения лабораторных показателей (маркеров инфицирования вирусами гепатитов В и D) при коинфицировании вирусами гепатита В и D
Рис. 19. Временные соотношения лабораторных показателей (маркеров инфицирования вирусами гепатита В и D) при суперинфицировании вирусом гепатита D носителя вируса гепатита В
Читайте также:


