Морфология при гепатите в

Распространение вирусного гепатита В в мире охватывает более 2 миллиардов человек, имеющих маркеры перенесённой HBV-инфекции, более 400 миллионов человек является больными хроническим вирусным гепатитом В. В РФ количество больных ХВГВ составляет более 5 миллионов человек [6]. Одной из важных причин хронизации вирусных гепатитов является способность HBV к длительной персистенции в клетках печени.
В большинстве случаев хронического поражения печени, в том числе при инфекции гепатотропными вирусами, основным механизмом гибели клеток служит апоптоз [7]. При вирусном гепатите апоптоз может быть как результатом прямого воздействия вируса, так и опосредованным иммунной реакцией. Являясь универсальным биологическим механизмом, апоптоз при вирусных гепатитах может приводить к избыточной гибели не только гепатоцитов, но и других клеточных популяций, отражая либо системный иммуновоспалительный ответ на инфекцию, либо внепеченочную персистенцию вируса. Апоптоз лимфоцитов и гранулоцитов достоверно выше у больных ХВГВ по сравнению с контролем [1].
Фиброз печени - это локальное или диффузное увеличение количества соединительной ткани, внеклеточного матрикса (коллагеновой волокнистой ткани в перисинусоидном пространстве) и основной путь прогрессирования хронических диффузных заболеваний печени. Клетками, непосредственно задействованными в процессе фиброзирования, являются гепатоциты, клетки Купфера, синусоидальные эндотелиоциты, звездчатые клетки печени [3, 8]. Эволюция фиброза при вирусных гепатитах представляется как первичный фиброз портальных трактов с последующим распространением по направлению к центральной вене и соседним портальным трактам с образованием порто-портальных и порто-центральных септ [10]. На предрасположенность к активному фиброгенезу и быстрому прогрессированию заболевания влияют такие факторы, как: особенности генной регуляции синтеза и распада коллагена у носителей определённых генотипов [2].
Диапазон патогистологических изменений в морфологическом субстрате при вирусных гепатитах велик. Накоплены данные о том, что для больных ХГВ характерно повышение значений показателей ангиогенеза и экспрессии матриксных металлопротеиназ-2 (ММП), высокая пролиферативная активность клеток Ито. Проведение ПВТ ламивудином больных ХГВ приводит к положительной динамике морфологических данных, сопровождается снижением пролиферактивной активности клеток Ито, снижением уровня экспрессии ММП-7 и ММП-9, уменьшением значений ангиогенеза и активацией механизмов антиметаллопротеиназной защиты. Регресс морфологических данных при проведении ПВТ не зависит от степени фиброза печени и наличия HBeAg до лечения [5].
Синдром эндогенной интоксикации (СЭИ) регистрируется при многих патологических состояниях организма человека, в том числе и при вирусных гепатитах. Цитолиз гепатоцитов при поражении печени HBV приводит к снижению её дезинтоксикационной и белоксинтезирующей функции, что приводит к нарастанию синдрома эндогенной интоксикации. Состояние молекулы сывороточного альбумина, характеризующее ее связывающую способность, достоверно отражает течение СЭИ и может быть использовано в качестве критерия прогноза, тяжести течения и исхода заболевания, а также эффективности проводимой терапии. Существует три причины, способные изменить эффективную концентрацию альбумина (ЭКА): 1) потеря альбумина (снижение общей концентрации альбумина (ОКА)); 2) загрузка альбумина метаболитами (билирубином, токсинами и другими ароматическими метаболитами); 3) изменение конформации молекулы альбумина. Индекс резерва связывания альбумина (РСА=ЭКА/ОКА×100 %) не зависит от концентрации альбумина, характеризует только состояние его молекулы и расценивается как маркер интоксикации, достоверно отражающий статус интоксикации организма. Его динамика достоверно связана с морфофункциональным состоянием печени. Нарушение функции печени, как острое, так и хроническое, приводит к снижению РСА и повышению индекса токсичности (ИТ=ОКА/ЭКА-1). Доказано увеличение маркеров синдрома эндогенной интоксикации в зависимости от степени тяжести процесса. Отмечается сохранение маркеров эндогенной интоксикации при течении ХВГС в фазу репликации вируса [4].
В литературе нет данных, определяющих взаимосвязь между влиянием морфологических изменений в ткани печени на формирование и степень синдрома эндогенной интоксикации при вирусном гепатите В.
Цель исследования: определить характер гистиоструктурных изменений паренхимы печени и выраженность синдрома эндогенной интоксикации у больных хроническим вирусным гепатитом В в динамике заболевания и влияние комбинированной противовирусной терапии на изменение показателей связывающей способности сывороточного альбумина.
Материалы и методы
В исследование включены 54 пациента с впервые выявленным хроническим вирусным гепатитом В. Маркеры HBV (HBsAg, анти-HBs, анти-HBcore IgG+IgM, анти-HBcore-IgM, анти-HBe) определяли, используя отечественные и зарубежные коммерческие тест-системы. Для определения ДНК-ВГВ использовали наборы фирм: Интерлабсервис и Авиценна (с чувствительностями 1000 и 300 geq/мл соответственно).
Всем пациентам проведена двукратная чрескожная пункционная биопсия печени (ЧПБП). Пациенты были распределены на 2 группы. В I группу включён 21 пациент, не проходивший лечение, которым вторая ЧПБП проведена в интервале 2-3 года от первой. Пациенты, сформировавшие I группу, изначально готовились к проведению ПВТ, однако, в силу разных причин вынуждены были перенести терапию на более поздний срок. Во II группу вошло 33 человека, которым проведена ЧПБП до и после проведения противовирусной терапии.
Пациенты получали комбинированную противовирусную терапию (α-интерферон-2а 5 млн. ЕД ежедневно и ламивудин 100 мг/сутки). Показаниями к назначению комбинированной противовирусной терапии были: положительная ПЦР на ДНК HBV, маркеры вирусного гепатита В в ИФА, повышенный уровень трансаминаз. Продолжительность терапии составила 6 месяцев.
Гистологическое исследование проводили на парафиновых срезах. Материал подвергали стандартной гистологической обработке с окраской серийных срезов гематоксилином, эозином, пикрофуксином по Ван Гизону. Использовались обзорные морфологические описания структурных нарушений в печени.
В гепатобиоптатах определяли индекс гистологической активности (ИГА) по Knodell R.G.: 0-3 балла - низкая, 4-8 баллов - минимальная, 9-12 баллов - умеренная, 13-17 баллов - высокая активность ХВГ С, а также степень фиброза с использованием гистологического индекса склероза (ГИС) по Desmet J. V.: F1 - слабый, F2 - умеренный, F3 - тяжелый фиброз, F4 - цирроз печени. Оценивались гистологические критерии ХВГ: портальные тракты, лимфоидные фолликулы в портальных и перипортальных зонах печеночной дольки, гидропическая и жировая дистрофии гепатоцитов, пролиферация междольковых желчных протоков, наличие порто-портальных септ [9].

Сологуб Т. В., Романцов М. Г., Кетлинская О. С., Петров А. Ю., Комиссаров С. Н., Кремень Н. В., Александрова Л. Н., Суханов Д. С., Ледванов М. Ю., Стукова Н. Ю., Козько В. М., Бондарь А. Е.,
Изучены морфологические данные, полученные от 49 пациентов с ХВГС и у 20 пациентов с ХВГВ различной степени активности. Определены индекс гистологической активности (ИГА) по Knodell и гистологический индекс фиброза (ГИС) по Desmet.
Все обследованные пациенты с ХВГС мужчины, а среди пациентов с ХВГВ 19 мужчин и 1 женщина. Средний возраст больных ХВГС составил 20,9±3,9 лет, больных ХВГВ 21,5±7,9 лет.
Хронический гепатит рассматривается как диффузный воспалительно-дистрофический процесс, характеризующийся мононуклеарной инфильтрацией паренхимы печени при сохранении её дольковой архитектоники. Воспалительная реакция является следствием опосредованной цитокинами активации синусоидных клеток печени, экспрессии молекул адгезии, мобилизации клеток крови. Основное взаимодействие происходит между макрофагами, T-лимфоцитами, эндотелием и гепатоцитами. Кроме того, поступление цитокинов в системный кровоток вызывает различные изменения в организме с появлением общих симптомов, которые не всегда соответствуют тяжести поражения печени. Ключевыми цитокинами, участвующими в патогенезе хронического гепатита являются IL-1, 2, 4, 6, 10, 12, TNF-α, TGF-β, σ-INF. Единственная возможность оценить реальное повреждение печени, определить стадию болезни, возможный прогноз связана с выполнением пункционной биопсии печени.
В образцах печёночной ткани обнаруживают изменения, характерные для хронического вирусного гепатита. Морфологические изменения в печени влияют на клиническую картину болезни, определяют возможность появления различных внепечёночных синдромов, так как распространённый фиброз ухудшает клиренс циркулирующих антигенов в печени и нарушает взаимодействие между гепатоцитами и иммуннокомпетентными клетками.
Морфологические признаки ХВГС включают лимфоидную инфильтрацию портальных трактов с образованием лимфоидных фолликулов, лимфогистиоцитарную инфильтрацию перипортальной области, ступенчатые некрозы, жировую дистрофию гепатоцитов, повреждение мелких желчных протоков, гиперплазию ретикулоэндотелиальной системы.
У 32 обследованных больных (из 49 человек) отмечены характерные морфологические признаки ХВГС. Фиброз портальных трактов обнаружен у 21 пациента (65,6%). Портальная, перипортальная и внутридольковая лимфогистиоцитарная инфильтрация различной степени обнаружена у всех 32 пациентов (100%). У 4 пациентов обнаружены лимфоидные фолликулы в портальных трактах (12,5%). Внутридольковые некрозы были у 8 пациентов (25%). Гиперплазия купферовских клеток у 30 человек (93,8%). Жировая дистрофия гепатоцитов у 7 человек (21,9%). Пролиферация билиарного эпителия у 2 человек (6,3%). Флебиты печёночных вен у 30 больных (93,8%). Дистрофические изменения гепатоцитов обнаружены у всех больных (100%).
Представленные данные отражают основные патогенетические механизмы HCV-инфекции: прямое цитопатическое действие вируса на клетки печени, активацию синусоидных клеток печени и лимфоцитов с гиперпродукцией цитокинов и факторов роста, иммунопатологические нарушения, усиление регенерации печёночных клеток.
Таким образом, лимфогистиоцитарная инфильтрация различной степени выраженности встречалась в обеих группах больных со сходной частотой. В то же время внутридольковые некрозы встречались значительно чаще у больных с ХВГС. Портоперипортальная лимфогистиоцитарная инфильтрация отражает иммунный компонент воспаления, а изменения внутри печёночных долек связаны с цитопатическим действием вирусов. Исходя из этого, можно предположить, что у больных с ХВГС повреждение печёночных клеток связано и с цитопатическим эффектом вируса гепатита C, и с иммунным цитолизом гепатоцитов. Соотношение между этими процессами на разных этапах болезни может быть различным. При этом выраженные иммунопатологические нарушения у больных с ХВГС отражают наличие у больных лимфоидных фолликулов в перипортальной области. Двойной механизм повреждения печени подтверждает обнаружение у пациентов с ХВГС жировой дистрофии гепатоцитов, по частоте сходной с внутридольковыми некрозами. В противоположность этому, у больных ХВГВ повреждение печени связано исключительно с иммунным лизисом гепатоцитов при отсутствии дополнительных повреждающих факторов. По тяжести фиброза две группы не имели статистически значимых различий, но обращает на себя внимание, что у больных с ХВГВ чаще встречались портопортальные и портоцентральные фиброзные септы, отражающие возможность быстрого прогрессирования болезни. Обнаружение у пациентов с ХВГС пролиферации билиарного эпителия может быть признаком патологической регенерации гепатоцитов, так как стволовые клетки печени находятся в мелких желчных протоках. Дистрофия гепатоцитов и активация звёздчатых ретикулоэндотелиоцитов встречались и у больных ХВГС, и у больных ХВГВ. Были распространены флебиты печёночных вен. Подобные изменения отражают принципиально сходные механизмы развития хронического воспаления в печени с развитием в итоге, вне зависимости от этиологии, цирротической трансформации печени.
Полученные данные, как у больных с ХВГС, так и у больных с ХВГВ подтверждают отсутствие зависимости между тяжестью поражения печени и клинической картиной болезни. Это может быть связано с большими компенсаторными возможностями печени, когда при повреждении 40-50% паренхимы печень обеспечивает метаболические потребности организма и выполняет свои основные функции. Кроме того, появление ведущих симптомов у больных ХВГС и ХВГВ является следствием несбалансированной продукции цитокинов, которые образуются в синусоидных клетках печени и поступают в системный кровоток. Эти факты объясняют ситуацию, когда при тяжёлых морфологических изменениях в печени клинические симптомы отсутствуют и, наоборот, у больных с минимальными морфологическими изменениями могут быть многочисленные клинические проявления.
Среди больных с ХВГВ преобладали пациенты с нормальным уровнем трансаминаз. Кроме того, при различной биохимической активности гистологические данные колебались в довольно широких пределах от слабо выраженной до высокой степени активности. При нормальном уровне трансаминаз регистрировали умеренную активность воспалительного процесса в печени.
Таким образом, индекс гистологической активности складывается из двух компонентов, которые включают лимфогистиоцитарную инфильтрацию и некроз гепатоцитов.
В представленных биоптатах печени у больных ХВГС внутридольковые некрозы регистрировались гораздо реже, чем лимфогистиоцитарная инфильтрация, а именно с ними связано повышение трансаминаз. Таким образом, индекс гистологической активности слабо связан с уровнем трансаминаз.
При изучении морфологических данных больных ХВГС обнаружены некоторые особенности. Средний индекс гистологической активности (ИГА) у пациентов с ХВГС составлял 8,9±3,2 баллов, а гистологический индекс фиброза 3,0±1,8 баллов. У больных с минимальной степенью активности средний ИГА составил 3,0±0,0 баллов, а ГИС 0,8±1,1 баллов, со слабо выраженной степенью активности средний ИГА был 6,9±1,1 баллов, средний ГИС 2,4±1,9 баллов. Среди больных с умеренной степенью активности средний ИГА был 10,5±1,1 баллов и средний ГИС 3,6±1,3 баллов, а у пациентов с максимальной активностью воспалительного процесса средний ИГА был 13,7±0,5 баллов, при среднем ГИС 4,3±0,5 баллов. Среди больных ХВГС чаще всего регистрировалась умеренная гистологическая активность у 19 человек (38,8%), у 18 больных был слабо выраженная гистологическая активность (36,7%). Значительно меньше было больных с высокой гистологической активностью 7 человек (14,3%) и минимальной гистологической активностью у 5 человек (10,2%). В то же время, у 43 больных был слабый фиброз (87,8%) и лишь у 6 больных регистрировались признаки умеренного фиброза (12,2%).
Средний индекс гистологической активности у больных хроническим вирусным гепатитом B составил 8,6±2,7 баллов, а гистологический индекс фиброза - 3,3±2,6 баллов. Средний ИГА у больных со слабо выраженной активностью составлял 6,5±1,2 баллов, а ГИС 2,3±1,5 баллов. У больных с умеренной активностью ИГА был оценен в 10,6±0,8 баллов, а ГИС - в 4,1±3,2 балла. При высокой активности воспаления средний ИГА был 13,0±0,0 баллов, а ГИС - 6,0±2,8 балла. Среди больных с ХВГВ у большинства была слабо выраженная и умеренная гистологическая активность, соответственно 11 человек (55%) и 7 человек (35%), у 2 больных (10%) была высокая гистологическая активность. У 17 больных ХВГВ был слабый фиброз (85%), у 2 больных умеренный фиброз (10%) и у 1 больного тяжёлый фиброз (5%).
Таким образом, среди больных с ХВГВ также преобладала слабо выраженная и умеренная гистологическая активность, слабый и умеренный фиброз, но регистрировался и тяжёлый фиброз. Определялась средняя корреляционная связь между степенью воспаления и тяжестью фиброза в печени больных ХВГВ (r=0,5; p
- КЛЮЧЕВЫЕ СЛОВА: печень, гепатит
За последние десятилетия были значительно усовершенствованы неинвазивные методы диагностики хронических заболеваний печени. Благодаря появлению чувствительных и специфичных сывороточных маркеров, накоплению опыта в проведении ультразвуковой эластографии печени (с помощью аппарата FibroScan) и разработке магнитно-резонансной эластографии пункционную биопсию для диагностики хронических заболеваний печени, в частности для определения стадии фиброза, стали применять реже [1–3]. Тем не менее для ряда патологических процессов (измененные показатели функции печени неясного генеза, системные или метаболические нарушения (гемохроматоз, болезнь Вильсона – Коновалова)) она остается золотым стандартом.
Биопсию используют в диагностике хронических заболеваний печени (первичный билиарный цирроз, первичный склерозирующий холангит, аутоиммунный гепатит) и очаговых образований (диспластические изменения, доброкачественные и злокачественные опухоли, опухолеподобные процессы). Биопсия позволяет оценить повреждения печени, вызванные лекарственными препаратами. Иногда без гистологического исследования трудно объяснить гепатомегалию неясного генеза, а также установить выраженность воспаления, фиброза и дистрофии гепатоцитов при хронических заболеваниях печени, таких как алкогольная болезнь печени, неалкогольный стеатоз и стеатогепатит, хронические вирусные гепатиты [4].
Существует несколько методов выполнения биопсии печени, но наиболее надежным и информативным остается чрескожная пункционная биопсия подреберным доступом [5].
Прежде чем приступить к гистологическому исследованию, врач-морфолог должен изучить ряд клинических и лабораторных показателей, позволяющих адекватно оценить биоптат печени. Эти показатели должны быть указаны в направлении биопсийного материала на гистологическое исследование. Наиболее значимы из них пол и возраст пациента, его иммунный статус и серологические данные (HBc, HBs, HIV), наличие признаков холестаза и цитолиза, количество тромбоцитов, давность симптомов и лабораторных изменений, наличие аутоантител (AMA, ANA, SMA, LKM), данные о приеме лекарств. Важны также результаты методов визуализации, проведенное лечение (диализ, облучение, парентеральное питание) [6].
Без правильной обработки и фиксации материала, его адекватного количества (длина биоптата должна быть не менее 20 мм и содержать не менее 10 портальных трактов), указания места взятия биопсии изучение патологического процесса бывает крайне затруднительным. При адекватно представленном материале для диагностики иногда достаточно рутинной окраски гематоксилином и эозином. Но, как показывает практика, обычно используется ряд гистохимических и иммуногистохимических окрасок – liver panel [7].
К нозологиям, требующим проведения биопсии печени, относят хронические гепатиты. Последние годы ознаменовались значительным прогрессом в понимании сути хронических гепатитов – его этиологии и патогенеза, что определило направление поиска новых диагностических приемов и средств лечения. Стала очевидной несостоятельность существующих морфологических подходов к оценке хронических гепатитов, некорректность клинико-морфологических сопоставлений. Появились терминологические разночтения при оценке каждого типа хронического гепатита. Как следствие, в 1994 г. (Международный конгресс гастроэнтерологов в Лос-Анджелесе) была разработана классификация хронических гепатитов, в основу которой легла не морфологическая характеристика таких гепатитов, а вызывающий их этиологический фактор и особенности патогенеза. С тех пор классификация не менялась.
Хронические гепатиты представляют собой клинико-морфологический и этиологический синдром. Их современная классификация предусматривает четыре основных критерия оценки – этиологию, патогенез, степень активности и стадию болезни. Согласно классификации к хроническим гепатитам относят следующие нозологии:
вирусные гепатиты (гепатотропные А, В, С, Е);
другие вирусы (EBV, CMV);
аутоиммунный гепатит (типы 1, 2, 3);
первичный склерозирующий холангит;
первичный билиарный цирроз;
недостаточность альфа-1-антитрипсина и др. [8, 9].
Заключение врача-морфолога основывается прежде всего на морфологических синдромах, характеризующих хронический гепатит в различных отделах ацинуса и дольки [10]. В зависимости от степени поражения того или иного отдела ацинуса или дольки врач-морфолог определяет наличие хронического гепатита и степень его выраженности. Так, в группу гепатитов с преимущественным поражением портальных трактов входят аутоиммунный гепатит, хронический гепатит С, неспецифический реактивный гепатит.
К гепатитам преимущественно с перипортальным воспалением причисляют аутоиммунный гепатит, хронический вирусный гепатит B, недостаточность альфа-1-антитрипсина, болезнь Вильсона – Коновалова. При микроскопическом исследовании биоптатов печени могут быть выявлены воспалительные инфильтраты и некрозы в дольках различной степени выраженности (очаговые, сливающиеся, мостовидные), нередко сочетающиеся с баллонной дистрофией гепатоцитов. Наиболее часто такие изменения выявляют при остром вирусном гепатите, хронических вирусных гепатитах, аутоиммунных и лекарственных гепатитах.
Для оценки активности гепатита и стадии фиброза используют различные шкалы (классификации). Шкала METAVIR наиболее популярна, широко применяется морфологами-гепатологами, основана на оценке активности воспаления и фиброза в изучаемом биоптате [11]. Данная классификация предусматривает четыре степени активности (А0–А3) гепатитов и четыре стадии фиброза (F1–F4). Шкала METAVIR удобна и достаточно проста в использовании. Один из ее основных недостатков – отсутствие переходных форм между стадиями фиброза F3 и F4.
Применяются и другие классификации – R. Knodell (1981), К. Ishak (1995), К. Batts и J. Ludwig (1995), которые, как и METAVIR, имеют преимущества и недостатки.
В настоящее время неалкогольный стеатогепатит – одно из заболеваний, предрасполагающих к развитию гепатоцеллюлярного рака. Как правило, этиопатогенетическими факторами его развития считаются диабет, ожирение, гиперлипидемия. Основные микроскопические признаки данной нозологии – стеатоз, воспаление и повреждение гепатоцитов в отсутствие алкогольного анамнеза [13].
Стадии активности неалкогольного стеатогепатита и стадии оценки фиброза иные, чем при других хронических гепатитах. В данной классификации учитывается степень стеатоза и баллонной дистрофии, при оценке стадии фиброза указывается его локализация.
повышение уровня щелочной фосфатазы в течение шести месяцев;
наличие антимитохондриальных антител в сыворотке крови.
Гистологические признаки ПБЦ включают в себя повреждение мелких желчных протоков (дуктулопения) с наличием воспалительных инфильтратов, реакцию желчных протоков (пролиферация), а также признаки хронического холестаза. Если морфологическое исследование не так важно для установления диагноза ПБЦ, то для оценки его активности и стадии биопсия играет ключевую роль. Установление стадии ПБЦ морфологически проводят по двум шкалам (на выбор) – Batts – Ludwig и Scheuer.
Одним из наиболее сложных патологических процессов, диагностика которых трудна как на клиническом, так и на морфологическом уровне, считается аутоиммунный гепатит (АИГ). В зависимости от аутоантител выделяют три типа АИГ:
тип 1: наиболее распространенная форма, анти-SMA, анти-ANA позитивный, возраст 10–20 лет, 45–70 лет;
тип 2: анти-LKM-I позитивный, наиболее характерен для детей, но встречается и у взрослых;
тип 3: анти-SLA позитивный или анти-LP, обычно встречается у взрослых (30–50 лет).
При морфологическом исследовании выделяют признаки, составляющие классическую триаду АИГ: лимфоплазмоцитарную инфильтрацию портальных трактов, эмпериполез (внедрение лимфоцита в цитоплазму гепатоцита и ее разрушение), формирование розеткоподобных структур. Упрощенные критерии активности и выраженности фиброза приняты группой по изучению АИГ [15, 16]. Отношение к выполнению биопсии при данной патологии неоднозначно.
В статье, опубликованной в 2011 г. группой ученых из Швеции и Японии и посвященной необходимости проведения биопсии, отмечается, что при классическом течении АИГ биопсия не требуется [17]. Она небезопасна и дорога. Однако существует мнение, что данный диагноз нуждается в гистологическом подтверждении при типичном течении АИГ [18, 19], а также в случае, когда необходимо исключить другое заболевание, в частности лекарственный гепатит.
К патологическим процессам, требующим гистологического исследования, можно отнести и так называемый перекрестный синдром (overlap syndrome), характеризующийся сочетанием клинических, серологических и гистологических признаков двух аутоиммунных заболеваний печени у одного пациента. Выделяют несколько вариантов перекрестного синдрома – АИГ в сочетании с первичным билиарным циррозом, АИГ в сочетании с первичным склерозирующим холангитом, АИГ в сочетании с аутоиммунным холангитом, а также хронический вирусный гепатит С с аутоиммунным компонентом. Наиболее распространенные варианты – сочетание АИГ и первичного билиарного цирроза или сочетание АИГ и первичного склерозирующего холангита.
Единых и общих критериев диагностики и ведения пациентов не существует. Задача гепатолога в данном случае – заподозрить наличие такого синдрома у пациентов при наличии морфологических признаков обоих заболеваний [20].
К особой форме холангиопатий из группы первичных склерозирующих холангитов относят и так называемый Ig4-склерозирующий холангит, связанный с другими Ig4-ассоциированными фибросклерозирующими заболеваниями (аутоиммунный панкреатит) с первичным поражением внепеченочных желчных протоков и выявлением Ig4 + -клеток [21].
Несмотря на расширение диагностических возможностей, гистологическое исследование остается первоочередным в гепатологии.
Гепатит В – инфекционное заболевание человека, характеризуется избирательным поражением печени и вызывается гепадновирусом (семейство Hepadnaviridae, род Orthohepadnavirus).
Суперкапсид HВV состоит из главного или основного S-белка, среднего М-белка и большого или длинного L-белка; имеется внутренний нуклеокапсид (ядро) диаметром 25-27 нм, фермент ДНК-полимераза и HBc АГ, который содержится в сердцевине вирионов. При протеолитическом гидролизе белка капсида образуется полипептид – НВе АГ – который отщепляется от НВс АГ при прохождении его через мембрану гепатоцитов и обнаруживается в крови.
В составе поверхностного HBs АГ имеется один общий АГ а и две пары взаимоисключающих детерминант d/у и w/r. Известны геномы HВV четырех основных субтипов, названные по сочетанию АГных эпитопов HBs Аg: adw, ayw, adr, ayr. АГы обеспечивают формирование общего перекрестного иммунитета ко всем субтипам вируса. Субтипы вируса имеют различное распространение в регионах мира. HBs АГ, его полипептидный фрагмент preS2, играет важную роль в прикреплении вируса к гепатоцитам за счет связывания их с альбуминовым рецептором. Полипептид preS1 обладает иммуногенными свойствами и используется для приготовления вакцины. В зараженной клетке HBs АГ синтезируется в цитоплазме и участвует в сборке вирионов. Наряду с полными вирионами (частицами Дейна) в сыворотке инфицированных лиц присутствует свободный HBs Аg в виде сферических частиц диаметром 20-22 нм или волокнистых образований до 200 нм. Эти частицы не содержат вирусной ДНК и являются неинфекционными. Ядерный АГ HBс АГ в свободной форме локализован в ядре гепатоцитов и экспрессируется на поверхности зараженных гепатоцитов, на которых и может быть обнаружен, но не выявляется в сыворотке крови больного.
При попадании HBс АГ в кровь он трансформируется в HBе АГ, что свидетельствует о высокой инфекционной опасности больного.
HBх АГ менее изучен. Считают, что он имеет отношение к раковой трансформации гепатоцитов.
Резистентность. Вирус гепатита В обладает высокой устойчивостью к температуре, выдерживает кипячение в течение 15-20 минут, 60 0 С – несколько часов, в комнатной температуре сохраняет жизнеспособность в течение 3 месяцев, в замороженном виде – несколько лет. Вирус погибает при обработке 3% Н2О2, 5% хлорамином, при УФ-облучении, при обработке сухим жаром при 180°С в течение 60 минут.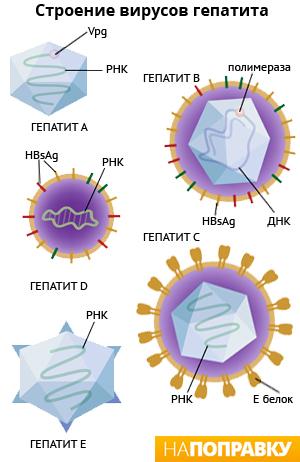
Эпидемиология. Источником заражения является больной человек и вирусоноситель. Заражение может происходит при медицинских манипуляциях, при переливании крови; при половом контакте, плод может заражаться трансплацентарно или через инфицированные пути матери. Инфицирование возможно через зубные щетки.
Патогенез и клиника. Входными путями служат кровеносные сосуды слизистых оболочек. Вирус попадает в кровь, заносится в печень и фиксируется на гепатоцитах. Вирус не обладает цитопатогенным действием, поэтому патологический процесс в печени возникает не с момента внедрения возбудителя в гепатоциты, а только после распознования иммуноцитами его АГов на клеточной мембране, которые индуцируют появление аутоантител и Т-киллеров к клеткам печени. Поэтому развивающийся хронический гепатит и цирроз печени можно рассматривать как аутоиммунное заболевание.
При развитии иммунного ответа, представленные на мембране макрофагов вирусные АГы индуцируют гуморальный ответ, при котором образуются АТ IgM и IgG-классов к HBs АГ, HBс АГ, HBе АГ. Одновременно появляются АГспецифические Т-киллеры, разрушающие гепатоциты, на месте которых развивается соединительная ткань, печень подвергается склерозу, функция ее нарушается.
Опасность представляет переход болезни в хроническую форму, который возможен у 15% взрослых больных и до 90% новорожденных от больных матерей. В свою очередь, хронический В-гепатит является фактором риска развития цирроза и гепатоцеллюлярной карциномы.
Для диагностики применяют определение АГ и АТ в ИФА, РИА, ПЦР:
- НВs АГ – основной маркер острой или хронической формы инфекции, а также вирусоносительства;
- ДНК НВV – непосредственный показатель инфицирования НВV, свидетельствует о репликации вируса;
- Нbе АГ – маркер острой формы гепатита, кратковременно выявляемый в крови; его сохранение более 2 месяцев служит признаком развития хронического гепатита;
- IgМ АТ анти-НВс – главный маркер острой формы заболевания;
- АТ анти-НВs, анти-НВс, анти-НВе – маркеры завершения острой формы инфекции, указывающие на формирование иммунитета к НВV; наличие только IgG анти-НВs АГ может быть результатом предшествующей вакцинации или ранее перенесенной инфекции.
Вакцинировать необходимо также лиц, которые имеют повышенный риск инфекции: персонал медицинских учреждений, больных, которым проводилось переливание крови и др. Для экстренной пассивной иммунопрофилактики используют гамма-глобулин.
Для леченияинтерферон, ингибитор обратной транскрипции ламивудин, а также глюкокортикостероиды.
Читайте также:


