Методы обнаружения и идентификации вируса

ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ , комплекс методов исследования, позволяющих распознать этиологию вирусного заболевания и изучить его возбудителя.
Осн. этапами В. и. являются выделение вируса от больных и павших животных (взятие, консервирование, пересылка и подготовка материала, заражение им животных, куриных эмбрионов, культуры клеток); титрование вирусов для определения их кол-ва в исследуемых материалах; культивирование вирусов на восприимчивых домашних и лабораторных животных, особенно на развивающихся куриных эмбрионах и культурах тканей (гл. обр. первичнотрипсинизированных).
С помощью морфологич. методов выявляют элементарные тельца, внутриклеточные включения (напр., Бабеша — Негри при бешенстве, Боллингера при оспе птиц). Иммунохимич. методы (гл. обр. метод флуоресцирующих антител) позволяют определить специфич. вирусный антиген в заражённых [зараженных] клетках тканевой культуры или органов и тканей инфицир. животных. С помощью серологич. методов проводят видовую и группоспецифич. идентификацию вируса и антител в сыворотках переболевших животных. С этой целью используют реакции нейтрализации, РСК, реакцию гемагглютинации, задержки гемагглютинации, диффузионной преципитации, торможения гемадсорбции. Реакция нейтрализации позволяет улавливать антигенные различия сходных между собой вирусов даже в пределах одноимённой [одноименной] группы. РСК применяют для обнаружения вирусных антигенов в материалах от больных и павших животных, идентификации выделенного вируса, изучения антигенных связей между различными вирусами и определения антител у переболевших животных. Реакции гемагглютинации и задержки гемагглютинации широко применяют в В. и. для диагностич. целей и типирования возбудителей болезни Ньюкасла, гриппа птиц, парагриппа и нек-рых аденовирусов; непрямую реакцию гемагглютинации используют для выявления адено- и миксовирусов, хламидий. Реакцией прицепитации в агаре изучают антигенную структуру вирусов, выявляют антитела в сыворотке и антигены в исследуемом материале. Реакцию гемадсорбции применяют для предварительной индикации и титрования вирусов в культуре клеток, особенно тех, к-рые не вызывают цитопатич. действия. Гемадсорбция наступает раньше проявления цитопатогенного действия, поэтому её [ее] используют как ранний метод предварительной индикации вирусов. Гемадсорбция островковая (адсорбция эритроцитов на отдельных участках монослоя клеток) типична для гриппа свиней, эпидемич. паротита; диффузная (адсорбция эритроцитов на клетках всего монослоя)— для классич. чумы кур, болезни Ньюкасла, афр. чумы свиней и др. Методы очистки и концентрации вирусов используют при изучении физич., химич. и морфологич. свойств вирусов. Фазовые системы, образованные полимерами, используют для концентрации вирусов из больших объёмов [объемов] вируссодержащих жидкостей, выделения нуклеиновых к-т вирусов. Радиобиологич. методы применяют в В. и. для изучения распределения и локализации вирусов (антител) в организме и особенно для изучения процессов онтогенеза вирусов. С помощью электронной микроскопии обнаруживают вирионы в исследуемом материале и специфич. конгломераты вирусов и антител (иммунная электронная микроскопия). Иммуноэлектроосмофорез обусловлен одновременным встречным движением в геле агара антигена и антитела в результате разной величины электрич. заряда с образованием комплекса антиген — антитело в виде линии преципитации и последующей его денатурацией. Метод применяют при изучении антигенной структуры вируса. Изоэлектрич. фокусирование основано на способности белков переходить в инертное (в отношении электрофоретич. подвижности), а затем агрегированное состояние в изоэлектрич. точке. Метод применяют для изучения белков вирусов. При иммуноферментативном методе происходит присоединение фермента к антителам с последующим образованием комплекса фермент — антитело — антиген, к-рый выявляют в клетке с помощью цитохимич. реакции на фермент (пероксидазу, щелочную и кислую фосфотазу, глюкозооксидазу). Метод используют с диагностич. целью для выявления вирусных антигенов в культурах клеток, мазках-отпечатках, криостатных срезах, а также для изучения тонкой структуры антигенов вируса, патогенеза вирусных болезней и др. См. также Вирусоскопия .
Лит.: Тихоненко Т. И., Методические основы биохимии вирусов, М., 1973, с. 152—58; Лабораторная диагностика вирусных и риккетсиозных заболеваний, пер. с англ., ред. Э. Леннет и Н. Шмидт, М., 1974.
Вирусологические методы исследования основаны также на иммунологических процессах (взаимодействие антигена с антителами), биологических свойствах вируса (способность к гемагглютинации, гемолизу, ферментативная активность), особенностях взаимодействия вируса с клеткой-хозяином (характер цитопатического эффекта, образование внутриклеточных включений и т.д.).
В диагностике вирусных инфекций, при культивировании, выделении и идентификации вирусов, а также при получении вакцинных препаратов широко применяют метод культуры клеток. Для выделения вирусов применяют заражение восприимчивых лабораторных животных, куриных эмбрионов, но чаще всего используют культуру ткани. Наличие вируса обычно определяют по специфической дегенерации клеток (цитопатический эффект), образованию симпластов и синцитиев, обнаружению внутриклеточных включений, а также специфического антигена, выявляемого с помощью методов иммунофлюоресценции, гемадсорбции, гемагглютинации (у гемагглютинирующих вирусов) и т.д. Эти признаки могут обнаруживаться лишь после 2—3 пассажей вируса.
Для выделения ряда вирусов, например вирусов гриппа, используют куриные эмбрионы, для выделения некоторых вирусов Коксаки и ряда арбовирусов — новорожденных мышей. Идентификацию выделенных вирусов проводят с помощью серологических реакций и других методов.
При работе с вирусами определяют их титр. Титрование вирусов проводят обычно в культуре клеток, определяя наибольшее разведение вируссодержащей жидкости, при котором происходит дегенерация ткани, образуются включения и вирусоспецифические антигены. Для титрования ряда вирусов можно использовать метод бляшек. Бляшки, или негативные колонии вирусов, представляют собой очаги разрушенных под действием вируса клеток однослойной культуры ткани под агаровым покрытием. Подсчет колоний позволяет провести количественный анализ инфекционной активности вирусов из расчета, что одна инфекционная частица вируса образует одну бляшку. Бляшки выявляют путем окрашивания культуры прижизненными красителями, обычно нейтральным красным; бляшки не адсорбируют краситель и поэтому видны как светлые пятна на фоне окрашенных живых клеток. Титр вируса выражают числом бляшкообразующих единиц в 1 мл.

-
Более 80 курсов для обучения Всего 20 минут в день на занятия Персональный преподаватель
Очистку и концентрацию вирусов обычно осуществляют путем дифференциального ультрацентрифугирования с последующим центрифугированием в градиентах концентраций или плотности. Для очистки вирусов применяют иммунологические методы, ионно-обменную хроматографию, иммуносорбенты и т.д.
Лабораторная диагностика вирусных инфекций включает обнаружение возбудителя или его компонентов в клиническом материале; выделение вируса из этого материала; серодиагностику. Выбор метода лабораторной диагностики в каждом отдельном случае зависит от характера заболевания, периода болезни и возможностей лаборатории. Современная диагностика вирусных инфекций основана на экспресс-методах, позволяющих получать ответ через несколько часов после взятия клинического материала в ранние сроки после заболевания, К ним относятся электронная и иммунная электронная микроскопия, а также иммунофлюоресценция, метод молекулярной гибридизации, выявление антител класса lgM и др.
Электронная микроскопия вирусов, окрашенных методом негативного контрастирования, позволяет дифференцировать вирусы и определять их концентрацию. Применение электронной микроскопии в диагностике вирусных инфекций ограничивается теми случаями, когда концентрация вирусных частиц в клиническом материале достаточно высокая (105 в 1 мл и выше). Недостатком метода является невозможность отличать вирусы, принадлежащие к одной таксономической группе. Этот недостаток устраняется путем использования иммунной электронной микроскопии. Метод основан на образовании иммунных комплексов при добавлении специфической сыворотки к вирусным частицам, при этом происходит одновременная концентрация вирусных частиц, позволяющая идентифицировать их. Метод применяют также для выявления антител. В целях экспресс-диагностики проводят электронно-микроскопическое исследование экстрактов тканей, фекалий, жидкости из везикул, секретов из носоглотки. Электронную микроскопию широко используют для изучения морфогенеза вируса, ее возможности расширяются при применении меченых антител.
Метод молекулярной гибридизации, основанный на выявлении вирусоспецифических нуклеиновых кислот, позволяет обнаружить единичные копии генов и по степени чувствительности не имеет себе равных. Реакция основана на гибридизации комплементарных нитей ДНК или РНК (зондов) и формировании двунитчатых структур. Наиболее дешевым зондом является клонированная рекомбинантная ДНК. Зонд метят радиоактивными предшественниками (обычно радиоактивным фосфором). Перспективно использование колориметрических реакций. Существует несколько вариантов молекулярной гибридизации: точечная, блот-гибридизация, сэндвич-гибридизация, гибридизация in situ и др.
Серологические методы в вирусологии основаны на классических иммунологических реакциях: реакции связывания комплемента, торможения гемагглютинации, биологической нейтрализации, иммунодиффузии, непрямой гемагглютинации, радиального гемолиза, иммунофлюоресценции, иммуноферментного, радиоиммунного анализа. Разработаны микрометоды многих реакций, техника их непрерывно совершенствуются. Эти методы используют для идентификации вирусов с помощью набора известных сывороток и для серодиагностики с целью определения нарастания антител во второй сыворотке по сравнению с первой (первую сыворотку берут в первые дни после заболевания, вторую — через 2—3 нед.). Диагностическое значение имеет не менее чем четырехкратное нарастание антител во второй сыворотке. Если выявление антител класса lgM свидетельствует о недавно перенесенной инфекции, то антитела класса lgC сохраняются в течение нескольких лет, а иногда и пожизненно. Антитела класса lgM появляются раньше, чем антитела класса G (на 3—5-й день болезни) и исчезают через несколько недель, поэтому их обнаружение свидетельствует о только что перенесенной инфекции. Антитела класса lgM выявляют методом иммунофлюоресценции или с помощью иммуноферментного анализа, используя анти- m-антисыворотки (сыворотки против тяжелых цепей lgM).
а.ч. ыЕЧЮХЛ, у.ч. вХТЮХ
рПУМЕ РПСЧМЕОЙС РЕТЧПЗП РЕТУПОБМШОПЗП ЛПНРШАФЕТБ Й РПМЕЪОПЗП РТПЗТБННОПЗП ПВЕУРЕЮЕОЙС (ПРЕТБГЙПООЩЕ УЙУФЕНЩ, ПЖЖЙУОЩЕ РТЙМПЦЕОЙС Й ДТ.) РПСЧЙМПУШ Й ЧТЕДПОПУОПЕ - ФБЛ ОБЪЩЧБЕНЩЕ "ЧЙТХУЩ". уМПЧП "ЧЙТХУЩ" ДБЧОП Й ИПТПЫП ЪОБЛПНП РПМШЪПЧБФЕМСН ЛПНРШАФЕТПЧ. пОП ДБЧОП РЕТЕТПУМП УЧПЕ РЕТЧПОБЮБМШОПЕ ЪОБЮЕОЙЕ Й ФЕРЕТШ ЮБУФП ХРПФТЕВМСЕФУС ДМС ПВПЪОБЮЕОЙС МАВЩИ ЧТЕДПОПУОЩИ РТПЗТБНН, УРПУПВОЩИ "ТБЪНОПЦБФШУС", ТБУРТПУФТБОССУШ У ЛПНРШАФЕТБ ОБ ЛПНРШАФЕТ Й ЪБТБЦБС РПДЮБУ ГЕМЩЕ ЛПНРШАФЕТОЩЕ УЕФЙ - ЧРМПФШ ДП ЗМПВБМШОЩИ ЬРЙДЕНЙК Ч йОФЕТОЕФЕ.
ьФП "ЛМБУУЙЮЕУЛЙЕ" ЧЙТХУЩ, УЕФЕЧЩЕ Й РПЮФПЧЩЕ ЮЕТЧЙ, "ФТПСОУЛЙЕ ЛПОЙ", backdoor-РТПЗТБННЩ Й ДТ.
ч ДБООПК УФБФШЕ ТЕЮШ РПКДЕФ П НЕФПДБИ ПВОБТХЦЕОЙС ЧЙТХУОПК БЛФЙЧОПУФЙ, ФБЛ ОБЪЩЧБЕНЩИ "ЮЕТЧЕК", - ЧЙТХУПЧ, ЛПФПТЩЕ УБНПТБУРТПУФТБОСАФУС РП УЕФЙ йОФЕТОЕФ, ЙУРПМШЪХС ЛБЛЙЕ-МЙВП ХСЪЧЙНПУФЙ Ч РТПЗТБННОПН ПВЕУРЕЮЕОЙЙ, МЙВП РПМШЪХСУШ ДПЧЕТЮЙЧПУФША Й МАВПРЩФУФЧПН ОЕПРЩФОЩИ РПМШЪПЧБФЕМЕК.
рТЕЦДЕ ЮЕН ЗПЧПТЙФШ П НЕФПДБИ ПВОБТХЦЕОЙС, УМЕДХЕФ РПУФБЧЙФШ УЕВС ОБ НЕУФП ЧЙТХУПРЙУБФЕМС Й РПРТПВПЧБФШ РТЕДУФБЧЙФШ УЕВЕ ЧУЕ ДЕКУФЧЙС, ЛПФПТЩЕ НПЦЕФ ЙУРПМШЪПЧБФШ ЧЙТХУ ДМС УБНПТБУРТПУФТБОЕОЙС.
пВЩЮОП ДПУФБФПЮОП ОБКФЙ ОЕДБЧОАА ОБКДЕООХА ЛЕН-МЙВП ХСЪЧЙНПУФШ Ч РПРХМСТОПН РТПЗТБННОПН ПВЕУРЕЮЕОЙЙ Й РПУФБТБФШУС ЙУРПМШЪПЧБФШ ЕЕ РПРХМСТОПУФШ ДМС ТБУРТПУФТБОЕОЙС ЧЙТХУБ. рТЕДУФБЧЙЧ УЕВЕ ФБЛПЕ ХУМПЧЙЕ, НЩ ПРТЕДЕМСЕН ЛТХЗ ОЕЛПФПТЩИ ЪБДБЮ, ЛПФПТЩЕ ОЕПВИПДЙНП ЧЩРПМОЙФШ "ЧЙТХУХ": УЛБОЙТПЧБОЙЕ МЙВП РПРЩФЛБ УПЕДЙОЕОЙС У ЛБЛЙН-МЙВП БДТЕУПН Ч УЕФЙ йОФЕТОЕФ ОБ РПТФ РПРХМСТОПЗП РТПЗТБННОПЗП РТПДХЛФБ, Ч УМХЮБЕ ХУРЕЫОПЗП УПЕДЙОЕОЙС РТПЙУИПДЙФ РПРЩФЛБ ЙУРПМШЪПЧБОЙС ХСЪЧЙНПУФЙ РТПЗТБННОПЗП РТПДХЛФБ ДМС УБНПЛПРЙТПЧБОЙС Й ДБМШОЕКЫЕЗП ТБУРТПУФТБОЕОЙС "ЮЕТЧС".
бМЗПТЙФН УМЕЗЛБ ПФМЙЮБЕФУС ДМС, ФБЛ ОБЪЩЧБЕНЩИ "РПЮФПЧЩИ ЮЕТЧЕК". пУОПЧОЩЕ ПФМЙЮЙС Ч ФПН, ЮФП "ХСЪЧЙНЩН" РТПЗТБННОЩН РТПДХЛФПН СЧМСЕФУС SMTP УЕТЧЕТ - РТПЗТБННОЩК РТПДХЛФ, ПФЧЕЮБАЭЙК ЪБ ДПУФБЧЛХ ЬМЕЛФТПООПК РПЮФЩ. хСЪЧЙНПУФША Ч ПВПЙИ УМХЮБСИ НПЦЕФ УЮЙФБФШУС, ЛБЛ ПЫЙВЛБ Ч ЛПДЕ РТПЗТБННЩ, ФБЛ Й ПЫЙВЛБ ДПРХЭЕООБС РТЙ ЕЕ ЛПОЖЙЗХТБГЙЙ.
уХЭЕУФЧХЕФ ОЕУЛПМШЛП ЧЙДПЧ ПВОБТХЦЕОЙС РПДПВОПК БЛФЙЧОПУФЙ:
- чПЪТПУЫБС УЕФЕЧБС БЛФЙЧОПУФШ.
- цБМПВЩ РПМШЪПЧБФЕМЕК-ЦЕТФЧ.
- ч УМХЮБЕ ХЦЕ ЙЪЧЕУФОЩИ ЧЙТХУПЧ ПВОБТХЦЕОЙЕ ЧПЪНПЦОП ВМБЗПДБТС БОФЙЧЙТХУОЩН ЖЙМШФТБН, ЛБЛ ОБ РПЮФПЧЩИ(Sнфт) УЕТЧЕТБИ, ФБЛ Й ХУФБОПЧМЕООЩИ РПМШЪПЧБФЕМЕН.
еУМЙ УП ЧФПТЩН УМХЮБЕН УДЕМБФШ ЮФП-ФП ДПЧПМШОП ФТХДОП, ФП Ч РЕТЧПН Й ФТЕФШЕН УМХЮБСИ БДНЙОЙУФТБФПТХ УЕФЙ РТЕДПУФБЧМСЕФУС ДПЧПМШОП ЫЙТПЛЙК ЧЩВПТ ХЦЕ УХЭЕУФЧХАЭЙИ НЕФПДПЧ ВПТШВЩ У "ЧЙТХУОПК ЬРЙДЕНЙЕК", ОБЮЙОБС ПФ ХУФБОПЧЛЙ БОФЙЧЙТХУОЩИ РТПЗТБНН ОБ УЕТЧЕТБ, Й ЛПОЮБС ПВЩЛОПЧЕООПК ВМПЛЙТПЧЛПК ФТБЖЙЛБ РТЙ РПНПЭЙ УЕФЕЧПЗП ЬЛТБОБ (firewall). бОФЙЧЙТХУЩ ПВЩЮОП РТЕДОБЪОБЮЕОЩ ДМС ЛБЛПЗП-МЙВП ЛПОЛТЕФОПЗП УЕТЧЙУБ, ЮЕТЕЪ ЛПФПТЩК НПЗХФ ТБУРТПУФТБОЙФШУС ЧЙТХУЩ: РПЮФБ, УЛБЮБООЩЕ ЙЪ УЕФЙ ЖБКМЩ (http, ftp РТПФПЛПМЩ). рТЙНЕОЙФШ БОФЙЧЙТХУ ДМС ЖЙМШФТБГЙЙ ЧУЕЗП ФТБЖЙЛБ ДПУФБФПЮОП ФТХДОПТЕБМЙЪХЕНП, ТЕУХТУПЕНЛП Й ОЕ ЗБТБОФЙТХЕФ РПМОПК ЙДЕОФЙЖЙЛБГЙЙ ЙЪ-ЪБ ЧПЪНПЦОПУФЙ ЫЙЖТПЧБОЙС ФТБЖЙЛБ. фБЛ ЦЕ УХЭЕУФЧХАФ ФБЛ ОБЪЩЧБЕНЩЕ "УЙУФЕНЩ ПВОБТХЦЕОЙС ЧФПТЦЕОЙС". йИ ПУПВЕООПУФША СЧМСЕФУС ФП, ЮФП ПОЙ, ЙУРПМШЪХС МЙВП ЧПЪНПЦОПУФЙ УЕФЕЧПЗП ЬЛТБОБ МЙВП ФБЛ ОБЪЩЧБЕНЩЕ "МПЧХЫЛЙ"(honeypot) ДМС ПВОБТХЦЕОЙС ЧФПТЦЕОЙС (ЧЙТХУ ФПЦЕ ЧФПТЦЕОЙЕ!). йНЕООП ОБ ЬФЙИ УЙУФЕНБИ НЩ Й ПУФБОПЧЙНУС РПДТПВОЕЕ.
бЧФПТЩ ДБООПК УФБФШЙ РТЙДХНБМЙ УЧПК НЕФПД ПВОБТХЦЕОЙС ЧЙТХУОПК БЛФЙЧОПУФЙ. пУОПЧПК ЕЗП СЧМСЕФУС ПРЙУБОЙЕ ТБВПФЩ ПВЩЮОПЗП TCP-УПЕДЙОЕОЙС.
пВЩЮОП ХУФБОПЧЛБ TCP-УПЕДЙОЕОЙС РТПЙУИПДЙФ Ч ФТЙ УФБДЙЙ (3-way handshake): ЛМЙЕОФ ЧЩВЙТБЕФ Й РЕТЕДБЕФ УЕТЧЕТХ РПТСДЛПЧЩК ОПНЕТ (sequence number, ОБЪПЧЕН ЕЗП C-SYN), Ч ПФЧЕФ ОБ ЬФП УЕТЧЕТ ЧЩУЩМБЕФ ЛМЙЕОФХ РБЛЕФ ДБООЩИ, УПДЕТЦБЭЙК РПДФЧЕТЦДЕОЙЕ (у-бул) Й УПВУФЧЕООЩК РПТСДЛПЧЩК ОПНЕТ УЕТЧЕТБ (S-SYN). фЕРЕТШ ХЦЕ ЛМЙЕОФ ДПМЦЕО ЧЩУМБФШ РПДФЧЕТЦДЕОЙЕ (S-ACK). рПУМЕ ЬФПЗП УПЕДЙОЕОЙЕ УЮЙФБЕФУС ХУФБОПЧМЕООЩН Й ОБЮЙОБЕФУС ПВНЕО ДБООЩНЙ. рТЙ ЬФПН ЛБЦДЩК РБЛЕФ ЙНЕЕФ Ч ЪБЗПМПЧЛЕ РПМЕ ДМС РПТСДЛПЧПЗП ОПНЕТБ Й РПДФЧЕТЦДЕОЙС. дБООЩЕ ЮЙУМБ ХЧЕМЙЮЙЧБАФУС РТЙ ПВНЕОЕ ДБООЩНЙ Й РПЪЧПМСАФ ЛПОФТПМЙТПЧБФШ ЛПТТЕЛФОПУФШ РЕТЕДБЮЙ. ч УМХЮБЕ ЧЙТХУПЧ, ДПЧПМШОП ЮБУФП TCP-УПЕДЙОЕОЙЕ РТПУФП ОЕ ДПИПДЙФ ДП ПВНЕОБ ДБООЩНЙ, ПЗТБОЙЮЙЧБСУШ ОБЮБМШОЩН C-SYN Й ОЕ РПМХЮБС ПВТБФОПЗП. фБЛЙН ПВТБЪПН, УЮЙФБС ЛПМЙЮЕУФЧП SYN РБЛЕФПЧ Ч ПВЕ УФПТПОЩ (ЧИПДСЭЙЕ Й ЙУИПДСЭЙЕ) Й ЙНЕС УХЭЕУФЧЕООХА ТБЪОЙГХ (3, 5, 10 ТБЪ-ХУФБОБЧМЙЧБЕФУС ЬЛУРЕТЙНЕОФБМШОП) Ч ЛПМЙЮЕУФЧЕ, НЩ НПЦЕН РТЕДРПМПЦЙФШ ОЕОПТНБМШОХА УЕФЕЧХА БЛФЙЧОПУФШ Й, МЙВП ВМПЛЙТПЧБФШ ФТБЖЙЛ, МЙВП РТЕДРТЙОЙНБФШ ДБМШОЕКЫЙЕ НЕТЩ ПВОБТХЦЕОЙС Ч ГЕМСИ ДЕФБМШОПК ЙДЕОФЙЖЙЛБГЙЙ РТЙЮЙО ЧПЪОЙЛОПЧЕОЙС РПДПВОПК БЛФЙЧОПУФЙ.
оБ ПУОПЧЕ ЧЩЫЕПРЙУБООПЗП НЕФПДБ БЧФПТБНЙ РТЕДРПМБЗБЕФУС УПЪДБФШ УЙУФЕНХ ПВОБТХЦЕОЙС ЧЙТХУОПК УЕФЕЧПК БЛФЙЧОПУФЙ Ч ГЕМСИ РТЕДПФЧТБЭЕОЙС ЧЙТХУОЩИ ЬРЙДЕНЙК Ч МПЛБМШОПК УЕФЙ уф "вПФЙЛ", сТПУМБЧУЛБС ПВМБУФШ, З. рЕТЕУМБЧМШ-ъБМЕУУЛЙК. рЕТЧБС ФЕУФПЧБС ЧЕТУЙС ХЦЕ УПЪДБОБ Й РТПИПДЙФ ТЕЦЙН ФЕУФЙТПЧБОЙС.
Многие вирусы могут очень долго присутствовать в организме и циркулировать в крови, до поры до времени не вызывая никаких неприятностей. Однако это вовсе не значит, что они безопасны. Лабораторные анализы на вирусы позволяют выявить наличие последних, даже если никаких симптомов нет.
Анализы на вирусы: какие инфекции они выявляют
Для выявления вирусов лаборатории проводят исследования крови несколькими методами. Наибольшее распространение на сегодня получили ПЦР и иммуноферментный (ИФА) анализы.
Иммуноферментный анализ крови определяет наличие антител к вирусам (или антигенов к ним) в крови — иммуноглобулины (lgA, lgG, lgM) вырабатываются при заражении вирусами и являются своеобразными маркёрами инфекции.
Анализ на ДНК вируса, или ПЦР-исследование, позволяет выявить тип инфицирующего агента.
В качестве биоматериала для исследования обычно берут кровь. Анализ крови может подтвердить гепатит, герпес и вирус Эпштейна-Барра, аденовирус, различные половые инфекции (в том числе и сифилис), вирус иммунодефицита человека (ВИЧ) и другие инфекции. Однако кровь не единственный биоматериал, пригодный для выявления вирусных поражений. В зависимости от заболевания и симптомов, для анализа на вирусы сдают соскоб слизистой оболочки, кал, мочу, мазок, слюну.
Как мы уже отмечали, исследование крови на вирусы можно проводить двумя разными способами. Расскажем о них подробнее.
Иммуноферментный метод анализа на вирусы позволяет установить форму болезни, вызванной вирусом (хроническая, острая или бессимптомная), а также оценить эффективность противовирусной терапии. Это один из самых распространенных и точных методов для выявления половых инфекций, в частности ВИЧ и ВПЧ, гепатита В.
Для анализа на вирусы чаще всего сдается кровь. Обязательно предупредите врача, если вы недавно проводили вакцинацию, — этот факт может отразиться на точности анализов. Рекомендуется не принимать пищу на протяжении 8-ми часов перед забором биоматериала, а также воздержаться от употребления алкоголя и от курения.
Время ожидания результатов зависит от типа вируса, на который проводится анализ, и от методики работы лаборатории. Обычно результаты готовы через 1–3 дня, но иногда приходится ждать и 2 недели.
Рассказать о том, каким образом следует трактовать результаты анализов на все виды вирусов, в рамках одной статьи невозможно. Далее мы поговорим лишь о наиболее известных заболеваниях и о часто назначаемых исследованиях.
В случае проведения анализа методом ИФА наличие IgG в крови на гепатит говорит о том, что этот вирус в организме присутствовал, но иммунная система выработала к нему антитела. Присутствие одновременно антител класса IgM и IgG говорит о заболевании в острой форме. Иммуноглобулины только класса IgM — признак первичного инфицирования.
При проведении исследования методом ПЦР определяется РНК вируса. Результаты могут быть приведены в следующем формате:
- РНК вируса не выявлена.
- РНК вируса выявлена в концентрации ниже предела количественного определения (менее15 МЕ/мл). Сомнительный результат.
- РНК вируса гепатита С выявлена (от 15 и выше 100000000 МЕ/мл).
Для выявления этого вируса гепатита чаще всего назначается ИФА. Если в крови присутствуют антитела IgG и IgM, это значит, что вирус очень активен или же заражение произошло недавно.
В случае проведения ПЦР-анализа определяется концентрация фрагментов ДНК вируса гепатита В. Пациент получает результат с одной из приведенных трактовок:
- Не обнаружено.
- Сомнительный результат (результат положительный с концентрацией ДНК вируса гепатита В на границе точности метода).
- Обнаружено.
Если говорить о трактовке ИФА, то наличие антител, обозначаемых как Anti-HSV-IgG, говорит не об иммунитете к вирусу, а о том, что вы уже были когда-то инфицированы. Этот маркёр наблюдается у большинства пациентов. Если показатель anti-HSV-IgG в пробах, взятых в динамике за 2-недельный период, заметно растет, это значит, что заражение произошло недавно. О рецидиве говорит высокий показатель IgG.
Расшифровка анализа крови на ВИЧ очень проста — если результат отрицательный, это значит, что вирус не обнаружен, если положительный — увы, вирус в крови есть. Но следует знать, что сегодня даже самые надежные методы точны лишь на 98–99%, то есть всегда остается шанс, что результат будет, например, ложноположительным.
При анализе на аденовирус, вызывающий респираторные заболевания, применяется в основном ИФА. В ходе анализа подсчитываются IgG-антитела. Если показатель менее 0,8 условных единиц — результат отрицательный, более 0,8 — положительный.

Не пренебрегайте профилактическими анализами на вирусы. Раннее выявление инфекции позволяет отсрочить или подавить развитие заболевания. В случае же беременности сдача биоматериала на анализ с целью выявления вирусных инфекций является обязательной процедурой. Поводом для прохождения исследования также может стать повышенный уровень лейкоцитов в крови, сдвиг лейкоцитарной формулы, увеличение количества нейтрофилов (палочкоядерных), миелоцитов и метамиелоцитов, снижение числа лимфоцитов при высокой СОЭ в результатах клинического анализа крови.
Не существует методов лечения и профилактики АЧС, поэтому быстрая диагностика, строгий контроль состояния здоровья животных и противоэпизоотические мероприятия являются основой борьбы против АЧС.
Прогресс в области диагностики, связан с развитием высоко чувствительных методов, позволяющих надежно диагностировать острую, хроническую и инапарантную форму болезни в течение нескольких часов.
Существует множество методов обнаружения вируса и специфических антител. Наиболее часто используемыми в настоящее время методами диагностики АЧС являются: ПЦР (стандартная и в режиме реального времени) для обнаружения вируса; ИФА и имммуноблотинг для исследования сывороток. Дальнейшая схема показывает методы и их применение наиболее часто используемые в референтных лабораториях.

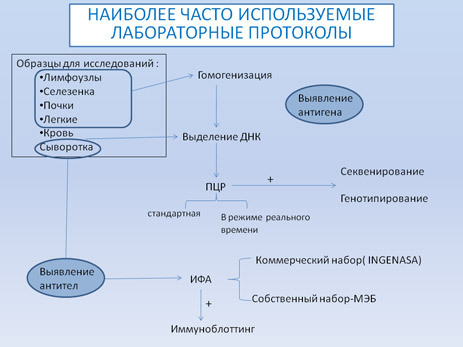
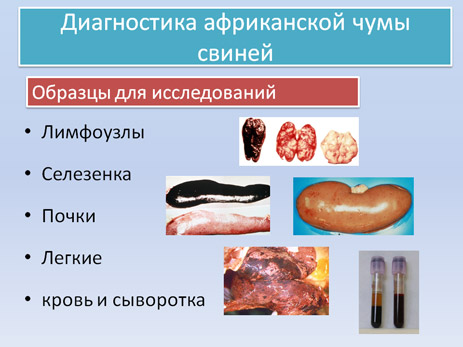
Требования к образцам направляемым в лабораторию
Для подтверждения/исключения АЧС в лабораторию направляют образцы селезенки, почек, лимфатические узлы. Также могут быть направлены образцы крови с антикоагулянтом (ЭДТА) от животных с повышенной температурой. Сыворотку от животных используют в серологических реакциях.
К направляемым образцам должна прилагаться сопроводительная документация с описанием клинического состояния животного.
Сопроводительная документация должна содержать:
- Имя и адрес владельца.
- Подозреваемую болезнь.
- Вид животного и время его нахождения на ферме (в хозяйстве). Это очень важно для обнаружения новых больных животных в хозяйстве.
- Дата обнаружения первых признаков болезни.
- Распространение болезни на ферме.
- Количество павших и животных с признаками болезни.
- Тип содержания и система производства.
- Лечебные мероприятия и вакцинации, проведенные в последние несколько дней.
- Перечень направляемых образцов.
МЕТОДЫ ВЫДЕЛЕНИЯ И ОБНАРУЖЕНИЯ ВИРУСА
Наиболее часто используемыми методами являются реакция гемадсорбции, реакция прямой иммунофлюоресценции и ПЦР.
Вирус АЧС выделяют с использованием первичной культуры клеток свиных макрофагов. В организме животного вирус инфицирует и реплицируется в лейкоцитах периферической крови, где вызывает развитие цитопатического эффекта в зараженных макрофагах. До наступления лизиса клеток вызванного вируса можно отметить феномен гемадсорбции. Микроскопические наблюдения показывают образование морул и розет из эритроцитов вокруг лейкоцитов.
Цитопатический эффект: цитопатический эффект можно наблюдать начиная с 12 после заражения клеток. Он выражается в группировании клеток, вауолизацией эндоплазматической сети и увеличением лизосомальных структур в клетке, приводящие в итоге к лизису клетки. Изменения в ядре клетки характеризуются конденсацией хроматина и появлением фибриллярных структур.
Гемадсорбция: Гемадсорбция представляет собой адсорбцию красных клеток крови вокруг инфицированных вирусом макрофагов. Не все штаммы вируса АЧС вызывают гемадсорбцию.
Некоторые штаммы АЧС являются не гемадсорбирующими. В этих случаях, должны быть проведены дополнительные исследования осадка клеток методами ПЦР и РПИФ, чтобы подтвердить наличие вируса.
Отсутствие гемадсорбции: Если цитопатический эффект в инфицированной культуре клеток проявляется без феномена гемадсорбции, это может быть связано с наличием негемадсорбирующего штамма АЧС, присутствием других вирусов (например при болезни Ауески) или даже от токсического эффекта от заражающего материала. В связи с этим, чтобы подтвердить наличие вируса АЧС, другие методы такие как ПЦР и РПИФ должны быть использованы.
Реакция гемадсобции является наиболее специфичным и чувствительным методом идентификации, поскольку ни один из вирусов поражающих свиней не вызывает развитие феномена гемадсорбции. Она является референтной методикой несмотря на трудности в постановке и продолжительности выполнения (5-10 дней). Обычно используется только в референтных лабораториях.
РПИФ рекомендуется использовать при отсутствии возможности проведения ПЦР. Данный метод лучше использовать совместно с другими серологическими тестами (ИФА и иммуноблотинг), что бы исключить ложноотрицательные результаты, вызванные блокировкой антителами.
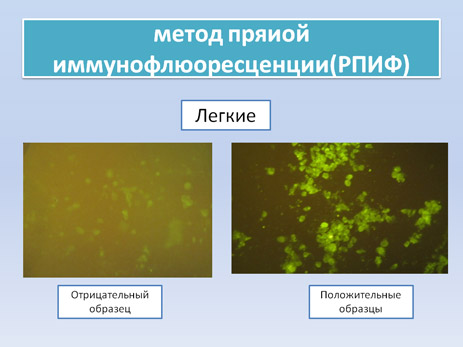
РПИФ основана на обнаружении вирусных антигенов в срезах тканей или мазках-отпечатках при взаимодействии с флюоресцентным конъюгатом. Это очень быстрый, простой и чувствительный метод, который также может быть использован при исследовании зараженных культур клеток. Микроскопические наблюдения показывают интенсивную флюоресценцию цитоплазматических включений в инфицированных клетках. При активном развитии инфекции флюоресценция может иметь зернистый вид.
В регионах где АЧС является эндемичной, и подострая и хронические формы болезни являются предоминантными, чувствительность данного метода уменьшается и составляет всего 40% при исследовании срезов органов и мазков-отпечатков.
Уменьшение чувствительности: при подострой и хронической формах болезни связано с наличием высокого уровня специфических антител. Они в свою очередь блокируют вирусные антигены и предотвращают специфическое связывание антивирусного флюоресцентного конъюгата.
Совместное использование РПИФ и РИФ или ИФА позволяет обнаруживать от 85% до 95% от всех случаев болезни (даже при наличии антител) менее чем за 1 час 15 минут. Не существует коммерческих наборов для данного метода.

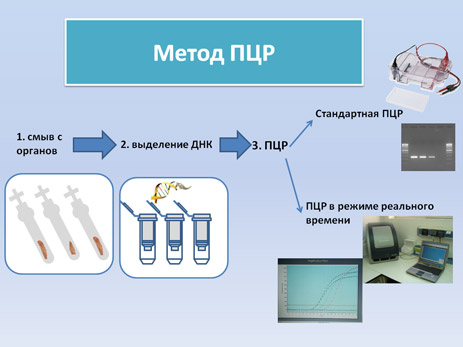
ПЦР (полимеразная цепная реакция) наиболее часто используемая техника для обнаружения вируса. Она требует профессиональных навыков и достаточного опыта для постановки реакции, чтобы исключить контаминацию образцов и ложноположительные результаты. ПЦР является очень чувствительной и специфичной техникой обнаружения вируса , путем амплификации вирусной ДНК из исследуемого образца. В настоящее время широко используется референтными лабораториям для диагностики и подтверждения АЧС. ПЦР используется при исследовании образцов тканей и сывороток от животных с клиническими признаками болезни. Вирус припомощи ПЦР удается обнаруживать в крови больных животных начиная со 2 дня после заражения и в течение нескольких недель.

Референтные лаборатории:
Dr J.M. Sánchez-Vizcaíno
Facultad de Veterinaria, Laboratorio de Vigilancia Sanitaria (VISAVET), HCV Planta sótano, Universidad Complutense
Avda. Puerta de Hierro s/n, 28040 Madrid
ESPAÑA
Tel: (34.91) 394.40.82 Fax: (34.91) 394.39.08
Email: jmvizcaino@visavet.ucm.es
Dr Chris Oura
Institute for Animal Health, Pirbright Laboratory
Ash Road, Pirbright, Woking, Surrey GU24 ONF
REINO UNIDO
Tel: (44.1483) 23.24.41 Fax: (44.1483) 23.24.48
Email: chris.oura@bbsrc.ac.uk
Dr Baratang Alison Lubisi
Onderstepoort Veterinary Institute, Agricultural Research Council
Private Bag X5, Onderstepoort 0110
SUDÁFRICA
Tel: (27.12) 529.92.33 Fax: (27.12) 529.94.18
Email: Lubisia@arc.agric.za
Данный метод основан на применение праймеров комплементарных консервативному участку генома АЧС и позволяет обнаруживать широкий диапозон известных изолятов вируса АЧС, включая как гемадсорбирующие так и не гемадсорбирующие штаммы.
ПЦР может быть использована для исследования образцов плохого качества и малопригодных для исследований другими методами. При помощи ПЦР результаты могут быть получены в течение 5-6 часов.
Существует два различных метода ПЦР-диагностики вируса АЧС. Для обоих из них необходимым является этап пробоподготовки и выделения ДНК перед непосредственным проведением ПЦР (смотри видео):
Стандартная ПЦР (смотри видео) (протокол): продукты реакции, полученные в результате амплификации вирусной ДНК, анализируются при помощи электрофореза в агарозном геле и УФ света.
ПЦР в режиме реального времени (смотри видео) (протокол): Для данного метода необходимо использование специального оборудования для детекции флюоресцентного сигнала. ПЦР в режиме реального времени имеет несколько преимуществ: анализ результатов в ходе реакции (реальном времени), возможность количественного определения вирусной ДНК, не требует постановки электрофореза.
Дальнейшее секвенирование ПЦР продуктов позволяет подтвердить положительные результаты реакции, и также определить генотип вируса при амплификации некотрых фрагментов генома вируса (ген p72, ген p54, центральный вариабельный регион -CVR).
СЕРОЛОГИЧЕСКИЕ МЕТОДЫ ОБНАРУЖЕНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ ВИРУСА АЧС.
Ввиду отсутствия вакцин против АЧС, наличие специфических антител к вирусу показывает наличие болезни.
Специфические антитела: антитела к вирусу АЧС обнаруживаются с 7 дня после заражения, и циркулируют месяцы даже годы. Данный факт очень полезен при диагностике подострой и хронической форм инфекции, а также для контроля и ликвидации болезни.
Большое количество серологических методов диагностики АЧС было разработано в последние годы, включая методы позволяющие выполнять диагностику в полевых условиях. В настоящее время наиболее используемыми являются реакция непрямой флюоресценции (РИФ), непрямой вариант ИФА и иммуноблотинг (ИБ).
Серологические методы являются основой лабораторной диагностики АЧС и используются в программах контроля и ликвидации болезни, благодаря их высокой чувствительности и специфичности.
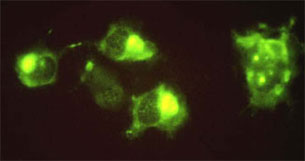
Данный метод является достаточно быстрым и обладает хорошей чувствительностью и специфичностью. Специфические к вирусу антитела находящиеся в сыворотке или экссудатах взаимодействуют с клетками инфицированными вирусом АЧС. В настоящее время практически не используется ввиду отсутствия коммерческих наборов для постановки реакции. Время постановки реакции занимает около 2 часов.
В случае положительного образца на клеточном монослое наблюдают флюоресценцию перинуклеарной области клеток, где расположен центр репликации вируса.
Этот метод используется для проведения широкомасштабного эпизоотического мониторинга и исследований при программах контроля болезни. Метод обладает высокой чувствительностью и специфичностью, простотой и быстротой выполнения и экономичностью. Хорошей воспроизводимостью результатов и легкостью интерпретации.
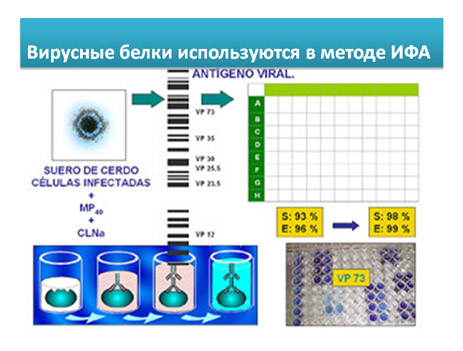
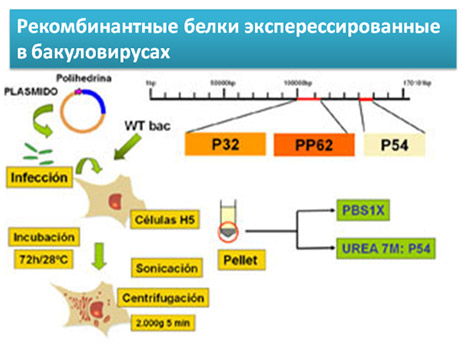
Недавно разработаны новые варианты ИФА, содержащие неинфекционные реагенты на основе рекомбинантных белков вируса p32, p54 и pp62. Они имеют большую чувствительность и специфичность при исследовании сывороток плохого качества.
Разработаны два варианта ИФА для обнаружения специфических к вирусу АЧС антител:
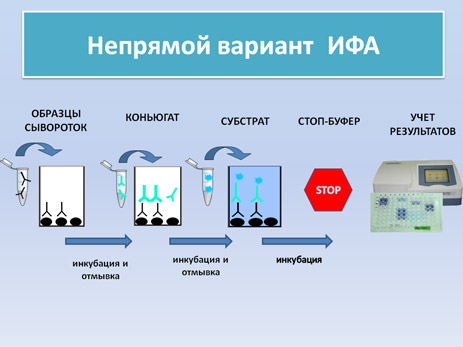
-Hепрямой вариант ИФА-OIE: данный метод разработан в лаборатории CISA-INIA и является официальным методом диагностики одобренным OIE: (смотри видео) (протокол)
Настоящий метод ИФА основан на применение растворимого вирусного антигена содержащего большинство вирусных белков.
Рекомбинантные белки: Белки p32 и p54 являются высокоиммуногенными структурными белками вируса; полипротеин pp62 эксперссируется позднее и продуцирует два структурных белка p35 and p15. Перечисленные белки были получены методами генной инженерии путем клонирования кодирующих их генов в бакуловирусной системе.
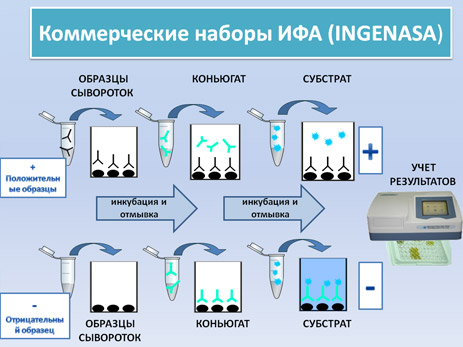
- Коммерческие наборы ИФА (INGENASA): (смотри видео) (протокол)
Это конкурентный вариант ИФА для обнаружения антител к белку vp73 вируса АЧС ( структурного компонента с высокой антигенной силой).
В данном ИФА наборе, на плашках иммобилизован белок vp73. После добавления исследуемой сыворотки, добавляются моноклональные анти-vp73 антитела, меченые пероксидазой. Моноклональные анти-vp73 антитела сорбируются на свободной от специфических антител поверхности плашки. Интерпретация результатов реакция прямо противоположна предыдущему варианту ИФА. Более интенсивная окраска лунки свидетельствует о меньшем количестве антител в сыворотке и наоборот.
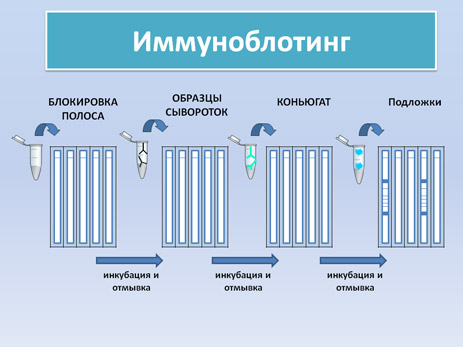
Является иммунофрементным методом основанном на применении нитроцеллюлозных фильтров, несущих предварительно сорбированные на них вирусные белки. Специфические к вирусу антитела взаимодействуют с иммобилизованными вирусными белками и получившийся комплекс выявляется при помощи меченого пероксидазой протеина А.
Вирусные белки: Белки используемые в ИБ для диагностики АЧС имеют молекулярную массу между 23.5 and 35 кДа, продуцируются клетками инфицированными вирусом. Именно эти белки первыми реагируют в ИБ на 7 день после заражения животного и обеспечивают постоянство антител у всех больных животных.
Иммуноблотинг позволяет определить реактивность антител против различных белков индуцируемых вирусом АЧС в сыворотках свиней. Таким образом, наряду с высокой чувствительностью и объективностью получаемых результатов, иммуноблотинг является идеальным методом для подтверждения африканской чумы свиней.
Этот метод выскочувствительный, легко выполним и не требует использования специального оборудования, но также не существует коммерческих наборов. Время постановки реакции занимает около 3 часов.
Другим преимуществом данного метода является возможность хранения стрипов, содержащих антиген, при комнатной температуре, без потери активности в течении более чем одного года, что означает безопасную возможность транспортировки реагентов.
Читайте также:


