Лимфаденопатия брюшной полости при гепатите с
Артюшкевич А.С., зав. кафедрой челюстно-лицевой хирургии БелМАПО, д.м.н., профессор
Миранович С. И., доцент, к.м.н., кафедры челюстно-лицевой хирургии БГМУ
Черченко Н. Н. доцент, к.н.м., кафедры челюстно-лицевой хирургии БГМУ
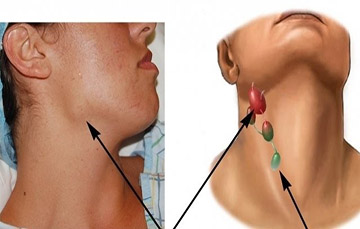
Лимфаденопатии - это большая группа заболеваний, отличающихся как по характеру возбудителя, эпидемиологическим, этиологическим, патогенетическим особенностям, так и клиническим проявлениям и прогнозу. Изменения в лимфатических узлах свидетельствуют об активности и состоянию ответа организма на патологический агент. Поэтому так трудна диагностика и так важна своевременная постановка диагноза, так как от этого зависит и прогноз.
За последние годы значительно увеличилось количество пациентов с лимфаденитами, особенно это увеличение отмечается в детском возрасте. Довольно часто причину проявления лимфаденита бывает непросто выявить. Увеличение лимфоузлов отмечается при заболеваниях крови, злокачественных опухолях, а также при хронических специфических воспалительных процессах.
Анатомия лимфатического аппарата лица и шеи. Лимфа из области головы и шеи собирается в яремные лимфатические стволы, проходя через регионарные лимфатические узлы, в которые впадают поверхностные лимфатические сосуды (рис.1) [1,2].
Классификация лимфаденопатий. В теле человека насчитывается около 600 лимфатических узлов, однако в норме пальпаторно могут определяться только подчелюстные, подмышечные и паховые лимфоузлы [5,6].
В зависимости от распространенности различают такие варианты лимфаденопатий (ЛАП):
- локальную ЛАП – увеличение одного ЛУ в одной из областей (единичные шейные, надключичные и т. д.);
- регионарную ЛАП – увеличение нескольких ЛУ в одной или двух смежных областях (надключичные и подмышечные, шейные и надключичные и т. д.);
- генерализованную ЛАП – увеличение ЛУ более чем в трех областях (шейные, надключичные, подключичные, подмышечные и др.).
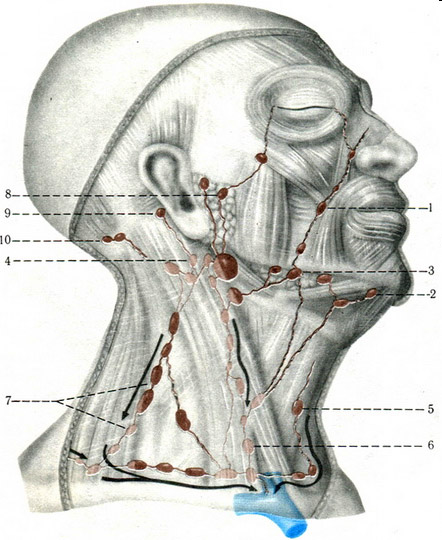
Рис. 1. Лимфатические узлы головы и шеи:
1 – щечные лимфатические узлы;
2 – подбородочные лимфатические узлы;
3 – поднижнечелюстные лимфатические узлы;
4, 5, 6, 7 – шейные лимфатические злы;
8 – внутрижелезистые лимфатические узлы;
9 – заушные лимфатические узлы;
10- затылочные лимфатические узлы.
Регионарная ЛАП отмечается при стрептококковой, стафилококковой инфекции, туляремии, туберкулезе, сифилисе, генитальном герпесе. Генерализованное увеличение ЛУ описано при инфекционном мононуклеозе, цитомегаловирусной инфекции, токсоплазмозе, бруцеллезе, туберкулезе, ВИЧ/СПИДе, болезнях накопления и др. При этом ЛАП возникает в результате попадания в ЛУ бактерий либо вирусов и их токсинов лимфогенным, гематогенным и контактным путями.
В клинической практике также часто выделяют острую ЛАП, которая характеризуется коротким продромальным периодом, лихорадкой, локальной болезненностью при пальпации, и хроническую ЛАП, отличающуюся большей длительностью, как правило, отсутствием болезненности или ее малой выраженностью. При хроническом воспалении, в отличие от острого, ЛУ обычно не спаяны с окружающими тканями. При развитии острой ЛАП отмечается серозный отек, а воспалительные явления не выходят за пределы капсулы ЛУ, однако при деструктивных процессах воспаление может переходить на окружающие ткани и по характеру быть серозным и/или гнойным [5,6].
Инфекционные заболевания, наиболее часто протекающие с вовлечением лимфоидной ткани:
- Бактериальные (все пиогенные бактерии, сифилис, туляремия, болезнь кошачьих царапин).
- Микобактериальные (туберкулёз, лепра).
- Грибковые (гистоплазмоз, кокцидиомикоз).
- Хламидийные (венерическая лимфогранулёма).
- Паразитарные (токсоплазмоз, трипаносомоз, филяриоз).
- Вирусные (вирус Эпштейна — Барр, цитомегаловирус, корь, гепатит, ВИЧ).
Клиника лимфаденопатии. Основным симптомом лимфаденопатии является увеличение лимфатических узлов, которое может быть локальным, регионарным либо генерализованным. Дополнительными симптомами могут быть:
- ночная потливость;
- потеря веса;
- сопутствующее длительное повышение температуры тела;
- частые рецидивирующие инфекции верхних дыхательных путей (фарингиты, тонзиллиты, ангины и т. п.);
- патологические изменения на рентгенограмме легких;
- гепатомегалия;
- спленомегалия.
Клиническое обследование. При наличии локализованной ЛАП необходимо исследовать области, от которых лимфа оттекает в данную группу лимфоузлов, на предмет наличия воспалительных заболеваний, поражений кожи, опухолей. Необходимо также тщательное обследование всех групп лимфоузлов, в том числе несмежных для исключения генерализованной лимфаденопатии. В случае обнаружения увеличенных лимфоузлов необходимо отметить следующие их характеристики: размер, болезненность, консистенция, связь между собой, локализация.
У пациентов с генерализованной ЛАП клиническое обследование должно фокусироваться на поиске признаков системного заболевания. Наиболее ценным является обнаружение высыпаний, поражения слизистых оболочек, гепато-, спленомегалии, поражения суставов. Спленомегалия и ЛАП встречаются при многих заболеваниях, включая мононуклеозоподобный синдром, лимфоцитарную лейкемию, лимфому, саркоидоз.
Алгоритм параклинического обследования пациента с синдромом ЛАП
При первичном осмотре пациента проводится обязательное лабораторно-инструментальное обследование, включающее в себя:
- общий анализ крови;
- общий анализ мочи;
- определение маркеров гепатита В и С, ВИЧ, RW;
- биохимическое исследование крови с определением острофазных белков;
- рентгенографию органов грудной клетки;
- УЗИ органов брюшной полости.
Так, лейкоцитоз и сдвиг формулы влево свидетельствуют в пользу бактериального поражения ЛУ (стафилококковой, стрептококковой, синегнойной, гемофильной этиологии); лимфоцитоз и моноцитоз обычно характерны для заболеваний вирусной этиологии (герпес, цитомегаловирус, вирус Эпштейна–Барр и др.).
При углубленном обследовании пациента с ЛАП возникает необходимость в использовании дополнительных инструментальных и лабораторных методов исследования. Одним из них является ультразвуковое исследование (УЗИ) ЛУ, которое позволяет уточнить их размеры, определить давность патологического процесса и его остроту. При остром воспалении определяется гипоэхогенность и однородность ЛУ. Спаянные ЛУ позволяют предположить продолжительность заболевания более 2 мес. При хроническом течении процесса эхогенность ЛУ повышается.
В биоптатах ЛУ могут обнаруживаться различные по своей природе морфологические изменения: явления гиперплазии при антигенной стимуляции; признаки острого и хронического воспаления с диффузным поражением ЛУ или очаговыми специфическими и неспецифическими изменениями вследствие реакции на вирусы, бактерии, грибы или паразитов; изменения, характерные для разнообразных опухолей ЛУ и метастазов в них опухолей из других органов.
Таким образом, в практической деятельности врачам различных специальностей часто приходится сталкиваться с синдромом лимфаденопатии, для диагностики которого необходимо использовать комплекс клинических, лабораторных и инструментальных методов исследования, правильный выбор которых позволит оптимизировать этиологическую диагностику заболевания.
ЛИТЕРАТУРА
- Марков А.И., Байриков И.М., Буланов С.И. Анатомия сосудов и нервов головы и шеи. – Ростов н/Д: Феникс, 2005. – С. 41-46.
- Будылина С.М. Физиология челюстно-лицевой области: Учебник / Под ред. С.М. Будылиной, В.П. Дегтярева. – М.: Медицина, 2000. – С. 23.
- Пасевич И.А. Инфракрасное низкоинтенсивное лазерное излучение в диагностике и комплексном лечении острого неспецифического лимфаденита лица и шеи у детей. Автореф. дис… канд. мед. наук. – Смоленск, 1996. – 18 с.
- Шаргородский А.Г. Клиника, диагностика, лечение и профилактика воспалительных заболеваний лица и шеи (руководство для врачей) / Под ред. А.Г. Шаргородского. – М.: ГЭОТАР-МЕД, 2002. – С. 347-356.
- Дворецкий Л.И. Дифференциальный диагноз при лимфаденопатиях // Справочник поликлинического врача. - 2005. - Т. 3. - № 2. - С. 3–9.
- Зайков С.В. Дифференциальная диагностика синдрома лимфаденопатии // Клиническая иммунология. Аллергология. Инфектология. - 2012. – №4. - С. 16-24.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Основная проблема дифференциальной диагностики при ЛДП заключается прежде всего в сходстве клинической картины опухолевых и неопухолевых ЛДП. Лимфадениты и реактивные гиперплазии ЛУ являются важной составляющей синдрома ЛДП. По данным исследования в Гематологическом научном центре Минздравсоцразвития России, неопухолевые ЛДП составляют 30% среди причин первичных обращений к гематологу по поводу увеличенных ЛУ. Нозологический диагноз устанавливается лишь в 50% случаев у больных с неопухолевыми ЛДП.
Основными патологическими процессами, вызывающими увеличение ЛУ, являются инфекции, опухолевые поражения (первичные или метастатические), иммунопролиферативные и дисметаболические процессы (рис. 1).
ЛДП инфекционного происхождения могут быть обусловлены непосредственным инфекционным поражением ЛУ с внедрением инфекционного агента гематогенным или лимфогенным путем в ткань ЛУ (туберкулез, актиномикоз, гнойные лимфадениты, вирусные инфекции) или реактивным воспалением в ответ на инфекционный очаг в соответствующей зоне (подмышечный лимфаденит при панариции, паховый лимфаденит при рожистом воспалении нижней конечности или генитальной инфекции, подчелюстной лимфаденит при ротоглоточной инфекции и т. д.). Четкое разграничение этих 2-х форм в известной степени условно и связано с уровнем диагностического обследования (морфологический, иммунологический, использование ПЦР и др.). При одной и той же инфекции ЛДП может носить как инфекционный, так и реактивный характер (первичный туберкулезный аффект, туберкулез ЛУ).
Опухолевое поражение ЛУ может быть первичным (лимфопролиферативные опухоли) либо вторичным – при лейкозах или раке (метастатический процесс). Опухолевые ЛДП составляют около 70% всех обращений больных в специализированные отделения по поводу увеличения ЛУ.
Иммунопролиферативные ЛДП. Этот термин не является общепринятым и может употребляться в тех случаях, когда увеличение ЛУ не связано ни с инфекцией, ни с опухолевым процессом. При этом в ЛУ происходит пролиферация иммунокомпетентных клеток или гранулематозное воспаление вследствие различных нарушений в системе клеточного, гуморального и неспецифического иммунитета.
Дисметаболические ЛДП обусловлены пролиферацией фагоцитирующих мононуклеаров в ЛУ или отложением амилоида при соответствующих заболеваниях.
Направление диагностического поиска при ЛДП определяется прежде всего клинической ситуаций, т. е. информацией, полученной при первичном осмотре больного (анамнез, физикальное обследование), данными рутинного лабораторного исследования – главным образом показателями периферической крови. При дифференциальной диагностике ЛДП основными ориентирами являются:
- возраст больных;
- анамнестические сведения;
- характер ЛДП (локализация, распространенность, размеры, консистенция, болезненность, подвижность ЛУ);
- наличие других клинических признаков (увеличение селезенки, лихорадка, кожные высыпания, суставной синдром, поражение легких и др.);
- показатели периферической крови.
Каждый из вышеназванных признаков имеет различное и неоднозначное диагностическое значение. Так, лихорадка или анемия у больного с ЛДП могут быть проявлением не только инфекционного и опухолевого процесса, но и некоторых системных васкулитов (системная красная волчанка (СКВ), болезнь Стилла и др.). В то же время выявление в периферической крови бластных клеток практически однозначно свидетельствует о наличии у больного острого лейкоза и требует лишь уточнения его морфологического варианта. Диагностический поиск при ЛДП условно может включать несколько этапов, на каждом из которых решаются конкретные задачи для реализации конечной цели – нозологической диагностики у больного с наличием синдрома ЛДП.
I этап диагностического поиска. Выявление
увеличенного ЛУ и отличие его
от нелимфоидных образований
II этап диагностического поиска.
После верификации выявленного образования увеличенного ЛУ необходимо определить различную локализацию и оценить распространенность ЛДП. Это может иметь значение в определении направления дальнейшего диагностического поиска.
Локализация увеличенных ЛУ позволяет заподозрить круг заболеваний с целью проведения дальнейшего целенаправленного исследования. Так, заднешейные ЛУ обычно увеличиваются при инфекциях волосистой части головы, токсоплазмозе и краснухе, в то время как увеличение передних (околоушных) ЛУ предполагает инфекцию век и конъюнктивальной оболочки. Часто выявляемое местное увеличение шейных ЛУ является следствием инфекций верхних дыхательных путей, носоглотки, инфекционного мононуклеоза, однако при этом необходимо также исключать как лимфопролиферативные опухоли (лимфогранулематоз), так и метастазы в ЛУ опухолей различной локализации (голова и шея, легкие, молочная и щитовидная железы). В то же время увеличение надключичных и предлестничных ЛУ практически никогда не бывает реактивным, а чаще связано с лимфопролиферативными опухолями (лимфогранулематоз), метастатическим опухолевым процессом (опухоли желудка, яичников, легких, молочных желез).
В зависимости от распространенности следует различать следующие варианты ЛДП:
- локальная – увеличение одного ЛУ в одной из областей (единичные шейные, надключичные ЛУ);
- региональная – увеличение нескольких ЛУ одной или двух смежных областей (надключичные и подмышечные, надключичные и шейные, затылочные и подчелюстные ЛУ и т. д.);
- генерализованная – увеличение ЛУ трех и более областей (шейные, надключичные, подмышечные, паховые и др.).
При всей относительности такого разделения распространенность ЛДП может иметь значение при выдвижении предварительной диагностической гипотезы после первичного осмотра больного.
Анатомическое положение ЛУ при локализованной ЛДП позволяет во многих случаях сузить дифференциально-диагностический поиск. Так, например, для болезни кошачьих царапин характерно поражение шейных и подмышечных, а при инфекциях, передающихся половым путем, – паховых ЛУ. Увеличение одного ЛУ чаще требует исключения первичного или метастатического опухолевого процесса; может являться реактивным ответом на местный инфекционно-воспалительный процесс в соответствующей области (реактивный паховый лимфаденит при генитальных инфекциях, увеличение подчелюстных ЛУ при остром тонзиллите и т. д.). Регионарная ЛДП с преимущественным увеличением затылочных и заднешейных ЛУ более характерна для инфекционного мононуклеоза. Генерализованная ЛДП выявляется при различных заболеваниях: инфекционных (вирусные инфекции, токсоплазмоз), системных (СКВ), лимфопролиферативных опухолях (хронический лимфолейкоз).
Наряду с распространенностью ЛДП необходимо оценить размеры и консистенцию ЛУ. Это не является определяющими признаками, однако может служить обоснованием при выдвижении предварительной диагностической гипотезы (подозрение на опухолевый процесс при наличии плотного ЛУ размером более 1 см, болезненность при воспалении, флуктуация при абсцедировании и т. д.).
III этап диагностического поиска.
При определении направления диагностического поиска важным является наличие у больного дополнительных клинических признаков, выявляемых при первичном осмотре (анамнестические, клинические) и проведении рутинного лабораторно-инструментального исследования (рентгенография грудной клетки, общий анализ крови).
Анамнестические сведения (травма конечностей, оперативные вмешательства, наличие имплантата, путешествия, контакт с некоторыми больными и т. д.) позволяют определить направление диагностического поиска, а в ряде случаев могут приобретать решающее значение при дифференциальной диагностике ЛДП (наличие у больного заболевания, проявляющегося увеличением ЛУ, прием некоторых медикаментов).
Клинические признаки. Необходимо тщательное клиническое обследование пациента с ЛДП с целью выявления различных дополнительных симптомов, среди которых диагностически наиболее важными являются:
- поражения кожи и слизистых (макулезно-папулезные высыпания, геморрагии, царапины, укусы, язвы и др.);
- увеличение печени;
- спленомегалия;
- суставной синдром;
- лихорадка;
- респираторная симптоматика;
- изменения со стороны ЛОР-органов;
- урогенитальные симптомы.
Выявление увеличенной селезенки у больного ЛДП более характерно для вирусных инфекций (инфекционный мононуклеоз), острого и хронического лимфолейкоза, системных заболеваний (СКВ, болезнь Стилла у взрослых). Суставной синдром чаще ассоциируется с системными заболеваниями (ревматоидный артрит, СКВ, болезнь Стилла). Наличие кожных высыпаний в первую очередь требует исключения вирусных инфекций, СКВ, болезни Стилла.
IV этап диагностического поиска.
Исследование периферической крови
Среди рутинных лабораторных методов дифференциальной диагностики у больных ЛДП обязательным является исследование показателей периферической крови. При трактовке выявленных изменений периферической крови необходимо учитывать их неодинаковую специфичность. Так, стойкий абсолютный лимфоцитоз с наличием клеток Гумпрехта является патогномоничным лабораторным признаком хронического лимфолейкоза, а наличие бластных клеток в крови может свидетельствовать либо о лимфобластном лейкозе, либо о лейкемизации лимфом. Такие признаки, как нейтрофильный лейкоцитоз, лейкопения (нейтропения), тромбоцитопения не являются специфичными, поскольку могут встречаться при более широком круге заболеваний, сопровождающихся ЛДП (табл. 1).
Наряду с общим анализом периферической крови при первичном обращении больного с ЛДП обязательными исследованиями являются: рентгенологическое исследование грудной клетки, УЗИ органов брюшной полости, иммуно-серологические исследования (сифилис, ВИЧ-инфекция, гепатит В и С). На рисунках 2 и 3 представлены алгоритмы диагностического поиска при локальных (регионарных) и генерализованных ЛДП.
Трудности дифференциальной диагностики при локальной или регионарной ЛДП заключаются прежде всего в умении выявлять местный воспалительный процесс инфекционного (чаще) или неинфекционного характера и ассоциировать выявленную местную патологию с увеличением ЛУ соответствующей области. Наиболее частыми местными воспалительными процессами, сопровождающимися увеличением регионарных ЛУ, на выявление которых необходимо ориентироваться, являются следующие:
- острый тонзиллит (тонзиллофарингит);
- стоматит;
- средние отиты;
- экземы лица, конечностей;
- конъюнктивит;
- острые тромбофлебиты конечностей;
- рожистое воспаление (лицо, конечности);
- фурункулы, карбункулы;
- панариции;
- царапины, укусы;
- воспалительный процесс наружных гениталий.
При выявлении местного воспалительного процесса у больных с увеличением регионарных ЛУ ситуация расценивается как реактивный лимфаденит. Методы цитологической и гистологической диагностики в острой фазе заболевания малоинформативны из-за трудностей трактовки морфологической картины на фоне реактивной гиперплазии лимфоидной ткани. Для окончательной верификации природы ЛДП необходима оценка динамики локального воспаления и регионарной ЛДП на фоне проводимой терапии (антибиотики, хирургическое лечение) или спонтанного обратного развития. В случаях сохраняющегося увеличения ЛУ, несмотря на регрессию местного воспалительного процесса, особенно при наличии ЛУ плотной консистенции, показана биопсия ЛУ для гистологического исследования. На рисунке 4 представлено диагностическое значение дополнительных клинических признаков, выявляемых при первичном осмотре у больных ЛДП.
Дополнительные методы обследования следует применять с учетом предварительной диагностической гипотезы, выдвинутой на основании характера ЛДП, наличия дополнительных признаков (анамнестических, клинических, лабораторных). Назначение антибиотиков больным с ЛДП показано только в случаях доказанной бактериальной инфекции. Применение глюкокортикоидов при неясных ЛДП нецелесообразно.
Литература
Только для зарегистрированных пользователей


Легкость и удобство в новом объеме.
У постели пациента, в операционной или на спортивной площадке - всегда готов к использованию.
При хроническом лимфолейкозе в патологический процесс вовлекаются многие органы и системы, наблюдается увеличение лимфатических узлов различных регионов, в том числе внутрибрюшных. Однако на первых порах увеличение печени, селезенки, лимфатических узлов может быть минимальным и недоступным физикальным методам исследования. Между тем важность выявления истинных размеров печени и селезенки, определения выраженности лимфаденопатии диктуется необходимостью уточнения прогноза болезни и выбора адекватной терапии 2. В клиническом течении хронического миелолейкоза выделяют 3 фазы: хроническую, прогрессирующую и фазу бластного криза. Первичная диагностика хронического миелолейкоза может совпадать с клинической картиной, присущей любой из них. Однако чрезвычайно важно верифицировать хронический миелолейкоз в хронической фазе, т.е. на начальных этапах становления болезни, когда лечение более эффективно. Характерным признаком хронического миелолейкоза является гепатоспленомегалия, хотя на начальных этапах болезни увеличение этих органов минимально, что весьма трудно, а иногда и невозможно обнаружить физикальными методами обследования. Выявление в лейкограмме небольшого лейкоцитоза, зачастую регистрируемого случайно, может быть расценено как признак бактериальной инфекции. В таких ситуациях весьма актуальным представляется определение размеров селезенки и печени при помощи ультразвукового метода. При прогрессировании хронического миелолейкоза бластные клетки выходят за пределы костного мозга и метастазируют не только в селезенку, печень, но и в лимфатические узлы, другие органы, что также можно выявить ультразвуковым методом [6/10].
Цель настоящего исследования - разработка дифференциально-диагностических ультразвуковых признаков поражения печени, селезенки и лимфатических узлов при хроническом миело- и лимфолейкозе.
Ультразвуковое исследование (УЗИ) проведено у 200 больных хроническим лимфолейкозом и 100 больных хроническим миелолейкозом. Больные хроническим лимфолейкозом разделены на 2 группы: 1 группу составили 60 пациентов с длительностью заболевания от 3 мес. до 5 лет, 2 - 140 больных с длительностью болезни 5-12 лет. Международная система классификации (11) выделяет следующие стадии хронического лимфолейкоза: А, В, С. В наших исследованиях больные в стадиях А и В объединены в 1 группу, так как по ультразвуковым характеристикам они практически не отличались, а больные в стадии С отнесены ко 2 группе.
Больные хроническим миелолейкозом в зависимости от фазы опухолевого процесса распределены на 3 группы. В 1 группу вошли 30 больных, находящихся в хронической фазе, длительностью заболевания 1-4 мес. (эти пациенты обследованы до начала цитостатической терапии); 2 группу составили 50 больных, у которых диагностирована прогрессирующая фаза. Длительность заболевания варьировала от 1,5 до 8 лет. В 3 группу вошли 20 больных в фазе бластного криза, длительность их заболевания колебалась от 1,5 до 8 лет. Всем больным производили эхографию печени, селезенки, оценивали их размеры и эхоструктуру, одновременно исследовали забрюшинное пространство с целью выявления увеличенных лимфатических узлов. При измерении размеров правой и левой доли печени определяли также угол наклона левой доли печени [6].
При УЗИ у всех больных 1 группы хроническим лимфолейкозом выявлено увеличение правой доли печени и у 70% - левой. Нормальные размеры селезенки определялись только в 13% случаев. У 66,6% больных в брюшной полости обнаруживаются увеличенные лимфатические узлы. Однако угол наклона левой доли печени мало отличался от физиологического и составлял 45-50º. В то же время при прогрессировании лимфопролиферативного процесса наблюдалось утолщение левой доли и расширение ее угла наклона, который у больных 2 группы достигал 60-70º. При этом отмечалось и более отчетливое увеличение размера правой доли с закруглением ее краев. Анализ гепатограмм показал, что у больных 1 группы эхогенность органа снижалась, иногда обнаруживались участки, резко обедненные эхоструктурами, а звукопроводимость их возрастала (рис. 1). При прогрессировании болезни одновременно с ростом печени, заметно усиливалась ее эхогенность (рис. 2). В паренхиме печени выявлялось большое количество звуковых сигналов крупного и среднего размера, что объясняется разрастаниями в печени соединительной ткани и ее фиброзированием. Отмечалось повышение уровня сигналов от стенок сосудов и портальных трактов. Количество сосудов уменьшалось, особенно у пациентов, страдающих хроническим лимфолейкозом более 5-6 лет, вены плохо наполнялись кровью и нередко были смещены и разветвлялись под тупым углом.

Рис. 1. Эхограмма печени больной хроническим лимфолейкозом (стадия А).
1 - левая доля печени; 2 - правая доля печени.

Рис. 2. Эхограмма печени больной хроническим лимфолейкозом (стадия С).
1 - правая доля печени; 2 - левая доля печени; 3 - лимфатические узлы.
Селезенка определялась увеличенной, но у больных 1 группы - это умеренная спленомегалия. Эхоструктура характеризовалась однородностью, малым количеством звуковых сигналов, а звукопроводимость органа повышалась (рис. 3). У больных 2 группы контур селезенки лоцировался выпуклым, неровным, в паренхиме визуализировались соединительно-тканные включения, множество крупных эхосигналов (рис. 4). При исследовании вен портальной системы обнаруживалось их расширение, более заметное у больных с длительным течением опухолевого процесса. Весьма важным признаком является расширение нижней полой вены, которая нередко достигает 26 мм (норма до 15 мм), причем теряется способность вены реагировать на фазы вдоха и выдоха. Одновременно у больных этой группы значительно чаще обнаруживались увеличенные лимфатические узлы в брюшной полости (89%). Они образовывали крупные "пакеты" или конгломерты (рис. 5), сдавливали и смещали сосуды, желудок, кишечник, мочевой пузырь, что сопровождалось болями в животе, чувством тяжести и дискомфорта, учащением мочеиспускания. Между спаянными узлами выявлялись гиперэхогенные перегородки. У больных 1 группы лимфатические узлы представлялись небольших размеров и реже образовывали крупные "пакеты". Увеличенные лимфатические узлы при хроническом лимфолейкозе располагались у 30% больных вдоль аорты, у 25% - в области ворот селезенки, у 27,5% - по ходу подвздошных сосудов, у 10% - в области ворот почек, у 30% - в области ворот печени. Лимфатические узлы, обнаруженные в воротах печени, нередко сдавливали устье желчного пузыря и нарушали отток желчи, что способствовало образованию конкрементов (рис. 6). Такую картину чаще мы наблюдали у больных 2 группы, при этом конкременты обнаруживались в 30% случаев, против 10% у больных 1 группы. Одновременно отмечалось расширение холедоха и утолщение стенки желчного пузыря.

Рис. 3. Эхограмма селезенки больного хроническим лимфолейкозом (стадия А).

Рис. 4. Эхограмма селезенки больного хроническим лимфолейкозом (стадия С).

Рис. 5. Эхограмма лимфатических узлов у больного хроническим лимфолейкозом (стадия С).
1 - желчный пузырь; 2 - правая доля печени; 3 - лимфатические узлы; 4 - левая доля печени.

Рис. 6. Эхограмма лимфатических узлов у больного хроническим лимфолейкозом (стадия С).
1 - правая доля печени; 2 - желчный пузырь; 3 - лимфатические узлы; слева стрелкой показан мелкий конкремент.
При ультразвуковом исследовании брюшной полости у большинства больных 1 группы хроническим миелолейкозом определялось увеличение печени и селезенки, а у больных 2 и 3 групп гепатоспленомегалия регистрировалась во всех наблюдениях. При оценке сонограмм органов на первых порах трудно выявить какие-либо характерные признаки, отмечается лишь равномерное и умеренное повышение их эхогенности (рис. 7). Но при прогрессировании миелопролиферативного процесса акустическая плотность органов возрастала, снижалась их эластичность. В паренхиме обнаруживались крупные эхосигналы, особенно в области ворот печени. У больных 2 группы регистрировалось повышение эхогенности селезенки и печени (рис. 8), появление очагов фиброза, расширялись вены портальной системы. Чем значительнее были размеры печени и селезенки, тем больше выявлялось крупных эхосигналов и очагов фиброза. Селезенка у таких больных постепенно принимала круглую форму, орган представлялся на экране монитора твердым, контуры его отчетливы, внутренние эхосигналы высокого уровня (рис. 9). У больных 3 группы наряду с гепатомегалией, гепатограммы характеризовались чередованием зон различной отражательной способности (рис. 10). Обнаруживалась неоднородность эхоструктры селезенки, наблюдались признаки портальной гипертензии. Ниже представлена ультразвуковая семиотика различных фаз хронического миелолейкоза.

Рис. 7. Эхограмма селезенки больной хроническим миелолейкозом (хроническая фаза).

Рис. 8. Эхограмма печени больного хроническим миелолейкозом (прогрессирующая фаза).
1 - правая доля печени; 2 - левая доля печени; 3 - хвостатая доля.

Рис. 9. Эхограмма селезенки больной хроническим миелолейкозом (прогрессирующая фаза).
1 - расширенная селезеночная вена; 2 - селезенка.

Рис. 10. Эхограмма печени больного хроническим миелолейкозом (фаза бластного криза).
1 - правая доля печени, 2 - левая доля печени.
- увеличение размеров печени - в 85%, селезенки - в 95% случаев;
- равномерное и умеренное повышение эхогенности паренхимы органов;
- умеренное расширение вен портальной системы.
- увеличение размеров печени, селезенки - в 100% случаев;
- усиление эхоструктуры органов, эхопозитивная исчерченность селезенки, уплотнение стенок внутрипеченочных сосудов, билиарных протоков, появление очагов фиброза;
- существенное расширение вен портальной системы.
- гепатограммы характеризуются чередованием зон различной отражательной способности (печень выглядит "пестрой");
- неоднородность селезенки, большое количество эхосигналов среднего и крупного калибра;
- ригидность внутриорганных сосудов, признаки портальной гипертензии.
Следует отметить, что иногда бластной криз дебютирует внекостно-мозговыми проявлениями, в виде поражения внутрибрюшных лимфатических узлов. При этом другие клинико-гематологические признаки (результаты анализов периферической крови, миелограммы, гистологического исследования) могут соответствовать либо хронической либо прогрессирующей фазе. Между тем выявление у больных хроническим миелолейкозом увеличенных лимфатических узлов свидетельствует о внекостно-мозговом варианте бластного криза и требует соответствующего лечения. В качестве иллюстрации приведем краткую выписку из истории болезни.
Больная Е., 40 лет, поступила в клинику с жалобами на слабость, похудение, тяжесть в левом подреберье, периодическое повышение температуры. После гематологического обследования больной поставлен диагноз прогрессирующей фазы хронического миелолейкоза. При УЗИ отмечалось увеличение размеров печени (правая доля 17,3 см, левая 6,1 см), наблюдалось усиление эхоструктуры и повышение акустической плотности паренхимы, регистрировалось множество крупных и средних эхосигналов. Селезенка больших размеров, внутренний контур выпуклый, передний край остроконечный, в паренхиме определялись сигналы высокого уровня. Как в печени, так и в селезенке визуализировались участки различной отражательной способности. Наряду с этим в области ворот селезенки был обнаружен "пакет" из увеличенных лимфатических узлов размером 5,7 см x 3,5 см. Таким образом, результаты эхографии предполагали выраженную лейкозную инфильтрацию печени и селезенки. Но наиболее важным представлялось обнаружение опухолевых инфильтратов в виде поражения внутрибрюшных лимфатических узлов, что, на наш взгляд, было признаком трансформации хронического миелолейкоза в фазу бластного криза. Предпринята попытка лечения больной по программе прогрессирующей фазы, которая, однако, оказалась безрезультатной. Поэтому больной было проведено 2 курса лечения по программе терапии бластного криза. В результате восстановились показатели крови и улушилось состояние костно-мозгового кроветворения. При эхографии обнаружено уменьшение размеров печени (правая доля 15 см, левая 5,7 см) и на 10 см - селезенки. "Пакет" из увеличенных лимфатических узлов в воротах селезенки не выявлялся.
Таким образом, изложенные данные показывают, что ультразвуковое исследование - необходимый метод обследования больных хроническим миелолейкозом и хроническим лимфолейкозом, особенно на начальных стадиях болезни. Использование УЗИ позволяет выявить не только увеличение размеров печени и селезенки, но и оценить сонограммы этих органов, которые имеют существенные различия в зависимости от тяжести, длительности и фазы лейкозного процесса. У больных хроническим лимфолейкозом длительностью заболевания более 5 лет наблюдается заметное увеличение размеров печени, угла наклона левой доли печени, закругление ее краев, уменьшается количество внутриорганных сосудов, которые плохо наполняются кровью, смещаются и имеют непостоянный калибр. Отличительной особенностью таких больных является потеря способности нижней полой вены изменять свой диаметр при дыхании. Существенной перестройке подвергается эхоструктура селезенки. Если в начальной стадии лейкозного процесса наблюдается ослабление эхогенности селезенки, то в дальнейшем параллельно нарастанию тяжести состояния больных и стадии заболевания эхогенность органа увеличивается. Гепатоспленомегалия и нарушение эхоструктуры органов обусловлены инфильтрацией печени и селезенки лейкозными клетками лимфоидного ряда, что отображается на сканограммах снижением эхогенности. С нарастанием инфильтрации, формированием соединительной ткани и фиброзированием паренхимы в результате как основного заболевания, так и действия проводимой химиотерапии наблюдаются повышение эхогенности и неоднородность органов.
У больных хроническим миелолейкозом в хронической фазе в отличие от больных хроническим лимфолейкозом в стадии А отмечается повышение эхогенности печени и селезенки. С прогрессированием миелопролиферативного процесса происходят фибротизация паренхимы этих органов, значительное повышение эхогенности, расширение просвета портальных вен и нарушение их функциональных свойств. У больных в фазе бластного криза существенно нарушалась эхоструктура печени и селезенки, которые на экране монитора зачастую выглядели "пестрыми". Появление опухолевых инфильтратов в брюшной полости - важный признак внекостно-мозгового бластного криза хронического миелолейкоза.
Подводя итоги изложенного материала по ультразвуковому исследованию брюшной полости у больных хроническими лимфолейкозом и миелолейкозом, следует отметить, что существуют четкие дифференциально-диагностические признаки, свойственные этим заболеваниям (таблица). Итак, проведенные нами исследования позволяют рекомендовать эхографию брюшной полости в качестве дополнительного метода диагностики хронических миелолейкоза и лимфолейкоза. Метод высокоинформативен, доступен и значительно расширяет диагностические возможности врачей-гематологов.
| Критерий | Норма | Хроническая фаза хронического миелолейкоза | Прогрессирующая фаза хронического миелолейкоза | Хронический лимфолейкоз А и В стадии | Хронический лимфолейкоз С стадия |
|---|---|---|---|---|---|
| Эхоструктура печени | Мелко- зернистая, гомогенная | Мелко- зернистая, гомогенная, эхогенность повышена | Средне- крупно- зернистая, эхогенность высокая | Мелко- зернистая, гомогенная, эхогенность снижена | Средне- зернистая, эхогенность высокая |
| Эластичность | Эластичная | Эластичная | Значительно снижена | Эластичная | Снижена |
| Толщина стенки желчного пузыря, мм | 2-3 | 3-4 | 5-8 | 5-6 | 6-9 |
| D холедоха, мм | 4-6 | 4-6 | 4-6 | 4-6 | 7-8 |
| Эхоструктура селезенки | Мелко- зернистая, гомогенная | Мелко- зернистая, эхогенность умеренно повышена | Крупно- зернистая, эхогенность высокая | Мелко- зернистая, эхогенность снижена | Средне- зернистая, эхогенность повышена |
| Край селезенки | Ровный, четкий | Двояко- выпуклый | Передний край остроконечный | Двояко- выпуклый | Передний край закруглен |
- Абдулкадыров K.М., Бессмельцев С.С. Ультрасонография в гематологической практике// Гематол. и трансфузиол.- 1989.-N3.- С. 51-55.
- Бессмельцев С.С., Абдулкадыров K.М. Диагностическое значение эхографии селезенки, абдоминальных лимфоузлов и сосудов при хроническом лимфо- и миелолейкозе // Тер. арх.- 1990.N 7.-С. 63-67.
- Волкова М.А. Амбулаторное лечение и диспансеризация больных хроническими лейкозами.М.: 1979.- 212 с.
- Kовалева Л. Г., Бычкова С.Н. Прогностические факторы течения хронического лимфолейкоза// 3-й Всесоюзный съезд гематологов и трансфузиологов. Тез. докл., 1991. -T.I. -С. 143-144.
- Файнштейн Ф.Э., Kозинец Г. И., Бахраpмов С.М., Хохлова М.П. Болезни системы крови.- Ташкент, 1987.- 662 с.
- Бессмельцев С.С., Абдулкадыров K.М. Ультразвуковая диагностика в гематологической практике. Санкт-Петербург: Из-во "KN", 1997.178 с.
- Bruneton J.N., Benozio М., Blery М. Ultrasonography of the spleen.-Springer-Verlag, 1988.- 89 с.
- Begeman H. Klinische Hamatologie.- Stutgart, 1975.- 175 с.
- Rehwald U., Heckemann R. Die Sonographische Untersuchung der Milz // Radiologie.- 1983.- H.23.S. 114-120.
- Kantarian H., Kaeting М., Talpaz М. Chronic myelogenous leukemia in blast crisis. Analysis of 242 patients// Am. J. Med. - 1987.- N. 1.-P. 669 - 680.
- International Workshop on CLL. Chronic Lymphocytic leukemia: proposals for a revised prognostic staging system// Brit. J. Haematol1981.-Vol.48.- P. 365-367.

Легкость и удобство в новом объеме.
У постели пациента, в операционной или на спортивной площадке - всегда готов к использованию.
Читайте также:


