Лечение рака вирусами отзывы
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.

У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
МОСКВА, 25 авг — РИА Новости, Альфия Еникеева. "Ученые обещают лечить рак одним уколом", "Открыто новое лекарство от рака", "Найдено универсальное средство от злокачественных новообразований" — подобные заголовки появляются в СМИ едва ли не каждую неделю. Однако врачи полагаются на давно опробованные методы: хирургическое удаление опухоли, химио- и лучевую терапию. Практически все онкологические заболевания неизлечимы. РИА Новости разбирается, куда пропадают сенсационные разработки и когда наука победит рак.
Небыстро, дорого
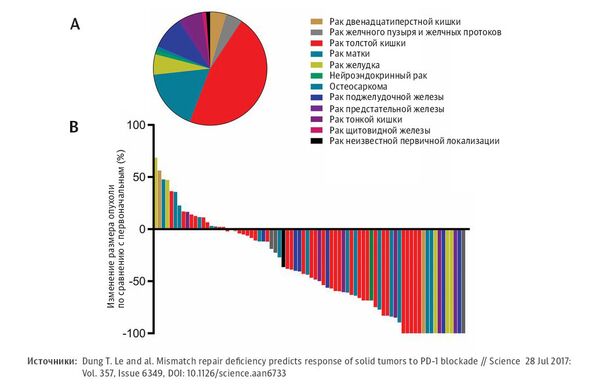
Единственное, что объединяло пациентов, — их опухоли не отвечали на стандартное лечение из-за редких мутаций в геноме. После приема нового лекарства — моноклональных антител, помогающих иммунной системе атаковать болезнь, — 66 из 86 участников исследования почувствовали себя лучше. Их опухоли значительно уменьшились в размерах и стабилизировались, прекратив рост. Восемнадцати пациентам повезло еще больше: рак покинул их навсегда.
И хотя тестирование проходило в урезанном виде, без обязательной в таких случаях контрольной группы, принимающей плацебо, уже через год FDA, главный регулятор лекарственных средств в США, рекомендовал его для лечения сразу нескольких видов рака у детей и взрослых. По мнению специалистов, скорость, с которой была дана рекомендация, — беспрецедентная, и государство могло пойти на такие уступки только в том случае, если разработка действительно оказалась прорывной.
На самом деле этой истории почти 11 лет, ведь пембролизумаб (так назывался новый препарат) Грегори Карвен, Ханс ван Эненнаам и Джон Дулос создали в 2007 году. К испытаниям приступили только в 2013-м, а с 2018-го пациенты, страдающие агрессивными видами рака, не отвечающими на стандартную терапию, могли рассчитывать на лечение. Конечно, это состоятельные люди: один курс стоит около 150 тысяч долларов.
Долгий путь из лаборатории к пациенту
На каждом из этих этапов лекарство может быть выбраковано из-за нулевой эффективности или — еще хуже — негативного воздействия на организм пациентов. Например, в 2017 году во время клинических испытаний препарата CAR-T один из участников исследования умер. Несмотря на доказанную несколькими месяцами ранее эффективность терапии при лечении множественной миеломы и лейкемии, эксперимент был немедленно прекращен.
Похожая история произошла и с инновационным методом лечения рака ROCKET. В ходе клинических испытаний второй фазы проверяли эффективность и безопасность биопрепарата JCAR015, предназначенного для лечения рецидивирующего или устойчивого к терапии В-клеточного острого лимфобластного лейкоза. В июле 2016 года тестирование приостановили на два месяца из-за смерти трех пациентов. Спустя год от исследований лекарства и вовсе отказались, так как еще двое участников исследования скончались по одной и той же причине — отек головного мозга.
Как заставить работать иммунитет

"Последние пять лет в онкологии — это триумф иммуноонкологических препаратов, которые делают опухоль доступной для собственной иммунной системы пациента. И мы еще в процессе активного изучения этих лекарств: подбираем оптимальное сочетание, время назначения, последовательность; смотрим, как они влияют на хирургические результаты", — уточняет Марина Секачева.
Каждый шестой умирает от рака
Как отмечают специалисты, помимо физических канцерогенов (например, ультрафиолетового излучения) и вредных химических веществ (табак, асбест) риск заболевания повышают генетические особенности. В последние годы открыли гены, у носителей которых больше вероятность возникновения рака. С другой стороны, злокачественная опухоль часто образуется у тех, кто когда-то перенес инфекции, вызываемые некоторыми вирусами, бактериями или паразитами. Четверть онкологических заболеваний в развивающихся странах вызваны гепатитом и вирусом папилломы человека.
Ежегодный экономический ущерб от рака, по некоторым оценкам, достигает триллиона долларов. На разработку препаратов из года в год тратятся миллиарды. Однако, несмотря на все усилия, говорить о том, что в ближайшем будущем рак будет побежден, не приходится.

Специалисты по терапии раковых заболеваний Всеволод Киселев, Игорь Самойленко и Петр Чумаков рассказывают, какие способы борьбы со злокачественными опухолями эффективны сейчас и как терапия рака будет развиваться в ближайшие годы.

Всеволод Киселев, доктор биологических наук, профессор, Заведующий лабораторией эпигенетики, Член-корреспондент РАН.
Примерно каждые десять лет наука совершает крупные открытия в исследовании рака. В изучение фундаментальных основ злокачественных процессов вкладываются огромные деньги. Новые знания используются для создания лекарственных препаратов, способных влиять на развитие опухолевого роста. В последние годы распространилось два типа терапии, которые, как казалось лет десять тому назад, существенно повлияют на эффективность лечения, — это таргетная терапия и иммунотерапия. Как это часто бывает, общая эйфория прошла, и оказалось, что эти типы лечения эффективны на определенных стадиях, при определенных обстоятельствах и лишь для некоторых типов рака, но вовсе не решают проблему целиком.
Параллельно с развитием фармацевтической индустрии продолжаются фундаментальные исследования, которые пытаются обнаружить механизмы, делающие опухоль неуязвимой для лечения.
Общая схема лечения рака такова: после постановки диагноза проводят химиотерапию в сочетании с хирургией или лучевой терапией. Опухоль первое время отвечает на введение препарата, а потом чаще всего становится устойчивой, адаптируется к его действию, и лечение перестает быть эффективным. Задача номер один — с фундаментальной точки зрения понять природу феноменальной адаптивности опухоли.
Кроме того, нужно более точное понимание, почему опухоль приобретает агрессивные формы развития. Она какое-то время может существовать в дремлющем, латентном состоянии, а потом начинается взрыв роста. Все клетки в организме делятся по четко заданной программе, не выбиваясь из общего генетического кода, а в какой-то момент появляются клетки, которые выходят из-под контроля и начинают агрессивно делиться. Вся терапия сводится к тому, чтобы попытаться погасить избыточную активность таких клеток. Мы до конца не понимаем все механизмы, благодаря которым происходят такие нарушения, и фундаментальная наука продолжает искать объяснения.
Некоторые из механизмов возникновения раковых клеток уже осмыслены, и против них разработаны лекарственные средства, но, как показывает практика, они чаще всего не решают проблему радикально. Лекарства позволяют продлить жизнь и на первых этапах погасить избыточное клеточное деление, но опухоль адаптируется, и все начинается сначала. Изучению закономерностей возникновения опухолевого роста, развития устойчивости и непрерывного рецидивирования посвящено много исследований. Важно не просто понять новые механизмы развития, но и, основываясь на этом понимании, разрабатывать и производить новые препараты.
Клетка выходит из-под контроля, так как в ней изменяется генетическая программа. Один из важнейших механизмов, благодаря которому в клетке возникают отклонения, — это эпигенетические изменения, прижизненные изменения генетической программы в отдельно взятой клетке или ткани. Механизм генетического перепрограммирования включается и когда опухоль начинают лечить. Опухоль приобретает новые генетические свойства, которые тоже приводят к устойчивости благодаря эпигенетическим механизмам. Механизмы перепрограммирования, в основе которых лежит эпигенетическое изменение, известны, и на них можно воздействовать. Мы занимаемся разработкой и производством препаратов, блокирующих механизм перепрограммирования клетки, из-за которого возникает ее озлокачествление и рак.

Игорь Самойленко, кандидат медицинских наук, старший научный сотрудник РОНЦ им. Н. Н. Блохина РАМН.
Химиотерапия — это способ лекарственного лечения опухоли, при котором вещества-цитостатики, оказывающие действие на делящиеся клетки, вводят в организм через капельницу, в таблетках или инъекциями под кожу. Основной смысл работы цитостатиков заключается в том, чтобы убить быстро делящиеся клетки. Поскольку в норме клетки организма тоже делятся, необходимо соблюдать баланс: нужно поражать именно опухолевые клетки и не затрагивать здоровые. В случае химиотерапии мы всегда балансируем на грани переносимости, между токсическим эффектом и лечебным эффектом.
Злокачественных опухолей много, и только некоторые из них вылечиваются химиотерапией. При лечении гематологических опухолей — лейкозов или лимфом — роль химиотерапии потрясающе высока. Для других видов раковых опухолей роль химиотерапии меньше, и основной вклад вносит хирургия или комбинация химиотерапии с лучевым лечением. Химиотерапия за последние пятьдесят-шестьдесят лет стала важным компонентом лечения многих злокачественных опухолей и на ранних стадиях болезни вносит существенный вклад в продление жизни.
В последнее время в лекарственном лечении опухолей развивается область таргетной терапии, иммуноонкологических и цитостатических препаратов. Цитостатики — это вещества, которые вызывают остановку деления клеток или их гибель, оказывая влияние на механизмы размножения клеток.
Есть ряд болезней, при которых действительно удается выделить чувствительную для опухоли мишень. Малая молекула, блокируя эту мишень, может аккуратно поражать только опухоль, не влияя на нормальную жизнедеятельность других органов и клеток, но таких случаев немного.
Впервые заговорили о таргетной терапии в середине 1990-х годов после изобретения иматиниба — вещества, блокирующего мутировавший белок BCR-ABL при хроническом миелолейкозе. Иматиниб эффективно действовал, и у пациентов исчезали из крови даже те следы этого белка, которые определяются молекулярно-генетическим образом, и наступала молекулярная ремиссия.
Чтобы добиться селективности препаратов, мы пытаемся найти нужные мишени: например, в опухоли находят мутацию в гене BRAF. Компании начинают разрабатывать вещества, которые будут блокировать мутантный BRAF, не влияя на нормальный тип этого белка.
Опухоль — живая система, и если вы действуете на один важный, но некритический механизм, происходит селекция. Даже если 99% клеток погибнут благодаря блокированию найденного механизма, тот единственный процент устойчивых клеток рано или поздно займет нишу, которую до этого занимали 99% чувствительных клеток. В этом состоит ограничение таргетной терапии: в большинстве случаев она требует постоянного и длительного приема лекарства, но из-за этого возникает селекция нечувствительных опухолевых клеток, которые могут манифестировать рецидивом болезни или ростом метастатических узлов.
Например, если мутация возникает в гене EGFR, рецептор эпидермального фактора роста начинает посылать сигнал внутрь клетки, стимулируя ее рост. Клетки начинают избыточно делиться. Если мы заблокируем этот механизм, то остановим важный для роста опухоли процесс, и она может уменьшиться в размерах. Но этот механизм оказывается не единственным, и другие механизмы, которые мы не так хорошо знаем, компенсируют заблокированный. Часть опухолевых клеток выживает, что может приводить к рецидиву болезни. В этом случае мы рассчитываем только на то, что за годы, пока происходит селекция, мы сможем найти новые мишени.

Перспективы таргетной терапии — это поиск новых мишеней и создание новых селективных молекул. Например, при лечении опухоли легкого препаратами анти-EGFR первого поколения возникает мутация, которая позволяет раковым клеткам выживать, — мутация T790M. Этот клон начинает размножаться, и его следы можно обнаружить в крови. В этом случае требуется следующий класс блокаторов EGFR, который будет направлен на клетки с приобретенной мутацией, — второе поколение препаратов.
Таргетная терапия будет порождать новые классы препаратов, чтобы побороть выжившие опухолевые клетки. Таким способом мы боремся с самой эволюцией, которая ускоренными темпами происходит на наших глазах в рамках одного организма. На сегодняшний день это выглядит как перспектива, где нет конечной точки, в которой мы могли бы остановиться и сказать, что вылечили всех пациентов таргетной терапией.
Сегодня два класса препаратов составляют большую часть затрат на лекарственную терапию опухоли — таргетные и иммунологические.
Иммунотерапия — это применение средств, которые либо пытаются настроить против опухоли собственную иммунную систему человека, либо дополняют и протезируют ее функцию.
Мы должны сделать настройку иммунной системы человека, которая по каким-то причинам допустила возникновение злокачественной опухоли. Возникновение опухолевых клеток происходит в организме постоянно, и они не превращаются в клинически значимую опухоль, так как по разным причинам элиминируются. Одна из причин — иммунный надзор. Иммунные клетки патрулируют разные части нашего тела и уничтожают измененные клетки. Если у человека уже возникла клинически определяемая опухоль, использовать собственные ресурсы организма будет странно, потому что в этом случае бой проигран иммунной системой.
Це зовнішні посилання і відкриються в новому вікні
Це зовнішні посилання і відкриються в новому вікні
Несколько пациентов неожиданно вылечились от рака, чем сильно удивили медиков. Корреспондент BBC Future задается вопросом, можно ли на основании этих редких случаев разработать методику для борьбы с раком.
История болезни одной пациентки озадачила всех, кто имел к ней какое-либо отношение. 74-летнюю женщину беспокоила сыпь, которая никак не проходила. К тому времени, как она добралась до больницы, нижняя половина ее правой ноги покрылась бугорками с восковым налетом и яркой красно-фиолетовой сыпью. Анализы подтвердили худшие подозрения: у женщины диагностировали карциному – одну из форм рака кожи.
Прогнозы выглядели неутешительно. Учитывая распространение опухоли, радиотерапия оказалась бы неэффективной, а удалить очаги воспаления из кожи доктора не могли. Скорее всего, лучшим решением оказалась бы ампутация, рассказывает лечащий врач пациентки Алан Ирвайн из больницы Св. Джеймса в Дублине – однако пожилой возраст женщины вряд ли позволил бы ей нормально адаптироваться к протезу. После долгой и откровенной дискуссии было решено подождать, пока будет выбран оптимальный вариант. "Мы долго мучились, что же делать", - объясняет Ирвайн.
А затем началось чудо. Хотя пациентку никак не лечили, опухоли уменьшались и съеживались буквально на глазах. "Мы наблюдали ее в течение нескольких месяцев, и опухоли просто исчезли", - говорит врач. Спустя 20 недель рак исчез. "Сомнений в ее диагнозе не было, - уточняет он. - Однако ни результаты биопсии, ни УЗИ не показали никаких следов карциномы".
Каким-то образом женщина излечилась от, пожалуй, самой страшной болезни наших дней. "Все были в восторге, но несколько озадачены, - сдержанно комментирует ситуацию Алан Ирвайн. - Получается, организм самостоятельно может избавиться от рака – даже если это случается крайне редко".
Вопрос в том, как именно это произошло? Пациентка Ирвайна была уверена, что помогло божественное вмешательство: она поцеловала религиозную святыню ровно перед тем, как начался процесс выздоровления. Однако ученых интересует биологическая подоплека произошедшего, так называемая спонтанная регрессия. Исследовав ее, они надеются найти зацепки, благодаря которым можно было бы провоцировать самоизлечение. "Если вообще получится обучить организм делать подобные вещи, подобная методика получит самое широкое применение", - считает Ирвайн.
Теоретически наша иммунная система должна вычислять и уничтожать мутировавшие клетки, предупреждая развитие рака. Однако иногда этим клеткам удается остаться незамеченными, и они начинают размножаться, что ведет к росту опухоли.
К тому моменту, когда рак привлекает внимание врачей, самостоятельно вылечиться пациент уже вряд ли сможет: по статистике лишь один из ста тысяч раковых больных избавляется от болезни без помощи медицины.
Внезапное исчезновение
Среди этих редких случаев попадаются и совершенно невероятные. Так, недавно была опубликована история пациентки одной из британских больниц, долгое время страдавшей от бесплодия. Спустя некоторое время врачи нашли у нее опухоль между прямой кишкой и маткой, но когда женщина была уже готова ложиться на операцию, ей наконец удалось забеременеть. Все прошло хорошо, родился здоровый ребенок. Обследование показало, что во время беременности рак мистическим образом улетучился. Через девять лет никаких следов рецидива не наблюдается.
Не менее впечатляющие истории выздоровления отмечались у пациентов с самыми разными видами рака, включая особо агрессивные формы – такие как острый миелоидный лейкоз, предполагающий патологическое размножение белых кровяных клеток. "Если пациента не лечить, он обычно умирает в течение нескольких недель, а иногда и дней", - рассказывает Армин Рашиди из Университета Вашингтона в Сент-Луисе. Однако ему удалось обнаружить 46 случаев, когда острый миелоидный лейкоз отступил сам. Правда, лишь в восьми из них удалось избежать последующего рецидива. "Если спросить случайно взятого онколога, может ли подобное произойти, 99% ответят, что нет, так не бывает", - говорит Рашиди, вместе с коллегой Стивеном Фишером опубликовавший исследование на эту тему.
Мучительное ожидание
В то же время случаи радикального излечения от детской формы рака под названием нейробластома происходят удивительно часто, что дает ученым простор для гипотез относительно причин спонтанной ремиссии. Этот вид рака характеризуется опухолями в нервной системе и эндокринных железах. Если он затем распространяется (дает метастазы), на коже могут появиться узлы, а в печени – новообразования. Из-за опухоли в брюшной полости ребенку становится сложно дышать.
Нейробластома крайне неприятное заболевание, однако порой оно исчезает так же быстро, как появилось, даже без медицинского вмешательства. Более того, если возраст пациента составляет меньше года, регрессия встречается так часто, что врачи обычно не начинают химиотерапию сразу, надеясь, что опухоль рассосется самостоятельно. "Помню три случая, когда на коже были видны внушительных размеров метастазы, а печень увеличилась, однако мы просто наблюдали больных – и они справились сами", - говорит Гарретт Бродер из Детской больницы Филадельфии.
Но принять решение сидеть сложа руки и наблюдать может быть непросто: хотя возможность избежать мучительного лечения одним родителям приносит облегчение, другим бездействие и беспомощность даются несладко. Бродер стремится понять причину исчезновения рака, чтобы избежать подобных страданий. "Мы хотим разработать конкретный препарат, который может запустить механизм регрессии – чтобы нам не приходилось ждать милости природы или "божественного вмешательства", - поясняет он.
Ключи к пониманию
К настоящему моменту Гарретту Бродеру удалось обнаружить несколько интересных зацепок. Так, в отличие от других нервных клеток, клетки опухоли при нейробластоме, похоже, научились выживать в отсутствие так называемого "фактора роста нервов" (NGF) – секретируемого организмом белка, который стимулирует развитие и активность нейронов. Спонтанная ремиссия может быть вызвана естественными изменениями в опухолевых клетках нейробластомы – не исключено, что в этом процессе участвуют клеточные рецепторы, с которыми связывается NGF. Каковы бы ни были изменения, это может значить, что клетки не смогут дальше выживать без важнейшего для них питательного вещества.
В таком случае лекарство, воздействующее непосредственно на рецепторы, могло бы способствовать выздоровлению других пациентов. По словам Бродера, две фармацевтические компании уже подобрали несколько возможных вариантов, и он надеется, что вскоре начнутся клинические испытания. "Оно бы избирательно уничтожало опухолевые клетки, чувствительные к подобному метаболическому пути, и пациенты смогли бы обойтись без химиотерапии, радиотерапии или хирургического вмешательства, - полагает он. - Их бы не тошнило, их волосы не выпадали бы, а анализы крови не ухудшались".
Ответный иммунный огонь
К сожалению, случаи неожиданного избавления от других форм рака изучены хуже — возможно, потому что они так редки. Однако некоторые ориентиры имеются, их появлению способствовала в том числе новаторская деятельность малоизвестного американского врача более ста лет назад.
В конце XIX века Уильям Брэдли Коли пытался спасти пациента, в шее которого нашли большую опухоль. Пять проведенных операций не помогли излечить рак. Затем мужчина заболел неприятной кожной инфекцией, сопровождавшейся высокой температурой. К тому моменту, как он оправился от инфекции, опухоль исчезла. Коли решил проверить этот принцип на небольшой группе других пациентов и обнаружил, что неоперабельные опухоли рассасываются, если больной принимает микробные токсины или его намеренно заразили бактериями.
Может ли инфицирование в общем случае стимулировать спонтанную ремиссию? Анализ недавних данных явно говорит в пользу дальнейшего изучения этого вопроса. Так, исследование Рашиди и Фишера показало, что 90% пациентов, излечившихся от лейкемии, перенесли другое заболевание – например, воспаление легких – незадолго до исчезновения рака. В других работах отмечается, что опухоли отступали после того, как пациент заболевал дифтерией, гонореей, гепатитом, гриппом, малярией, корью, оспой и сифилисом. Вот уж воистину – что не убивает вас, делает вас сильнее.
Причиной излечения становятся не сами микробы; считается, что инфекция вызывает иммунный ответ, неблагоприятный для существования опухоли. Например, высокая температура может сделать опухолевые клетки более уязвимыми и вызвать их "самоубийство". Или же важную роль играет тот факт, что при борьбе нашего организма с бактериями или вирусами в нашей крови содержится много молекул воспаления, которые активируют клетки-макрофаги, и эти иммунные клетки становятся воинами, уничтожающими и поглощающими микробы – а потенциально и рак.
"Думаю, инфекция способствует тому, чтобы иммунные клетки организма переставали способствовать развитию опухолевых клеток и начинали их уничтожать", - считает Хенрик Шмидт из больницы Орхусского университета в Дании. Это, в свою очередь, может также стимулировать другие составляющие иммунной системы – например, дендритные клетки и Т-клетки – к тому, чтобы распознавать опухолевые клетки и в случае рецидива рака атаковать их вновь.
По мысли Шмидта, понимание процесса спонтанной ремиссии необходимо для развития новейшей методики иммунотерапии, использующей систему естественной защиты организма для борьбы с раком. Так, один способ лечения предполагает инъекцию воспалительных "цитокинов", благодаря которой начинает работать иммунная система. Побочные эффекты – высокая температура и другие симптомы гриппа – обычно смягчаются лекарствами вроде парацетамола для облегчения состояния пациента.
Однако учитывая, что температура сама по себе может вызвать ремиссию, Шмидт предположил, что парацетамол способен уменьшить действенность методики. И действительно, он обнаружил, что в два раза больше пациентов – 25% против 10% – смогли пережить двухлетний период, если им не сбивали температуру.
Возможны и другие простые, но действенные способы борьбы с раком, основанные на этих данных. Так, у одного человека произошла спонтанная ремиссия после вакцинации от столбняка и дифтерии – возможно, благодаря тому, что прививки также активизируют иммунную систему. Исходя из этого, Рашиди указывает, что стандартная ревакцинация – например, противотуберкулезная прививка БЦЖ – по всей видимости, снижает вероятность рецидива меланомы после химиотерапии.
Переформатировать иммунную систему
Другие исследователи считают нужным применять более радикальные методы воздействия. Так, приверженцы одного из подходов утверждают, что необходимо намеренно заражать раковых больных тропическим заболеванием.
Этот метод, разработанный американским стартапом под названием PrimeVax, предполагает борьбу сразу по двум направлениям. Дендритные клетки из крови пациента, способствующие координации иммунного ответа на угрозу, подвергаются воздействию его опухолевых клеток в лабораторных условиях. Таким образом они программируются на распознавание раковых клеток. Одновременно пациента заражают лихорадкой денге, разносчиком которой обычно являются насекомые, после чего ему делают инъекцию "обученных" дендритных клеток.
Под наблюдением врачей температура пациента поднимается до 40,5 градуса, в то же самое время в его кровь выбрасывается множество молекул воспаления – в результате иммунная система организма начинает работать в авральном режиме. Опухоль, ранее остававшаяся незамеченной, становится мишенью для атаки иммунных клеток, которыми управляют запрограммированные дендритные клетки. "Лихорадка денге вторгается и переформатирует иммунную систему таким образом, что она начинает уничтожать опухолевые клетки", - рассказывает Брюс Лайдей из PrimeVax.
Заразить ослабленных пациентов тропической лихорадкой – казалось бы, рискованный шаг, однако для среднего взрослого человека вероятность умереть от лихорадки денге меньше, чем от обычной простуды, так что это самая безопасная из возможных инфекций. Когда температура спадет, запрограммированные иммунные клетки продолжат сохранять бдительность в отношении опухолевых клеток, если они вновь появятся. "Рак – это движущаяся мишень. В большей части методик его атакуют только с одной стороны, мы же стараемся поставить его раз и навсегда в заведомо проигрышное положение", - говорит Лайдей.
Сложно усомниться в мотивации, движущей разработчиками этого метода лечения. "Наша миссия – воссоздать спонтанную ремиссию максимально стандартным образом", - объясняет коллега Лайдея Тони Чен. Тем не менее, сотрудники PrimeVax подчеркивают, что их идея пока находится на раннем этапе разработки – и, пока не начались клинические испытания, они не знают, как все обернется. Исследователи надеются, что первыми на себе методику опробуют больные меланомой в развитой стадии, это может произойти уже к концу года.
Очевидно, нужно действовать осторожно. Как указывает Ирвайн, "спонтанная ремиссия – лишь крошечная зацепка в огромной сложной головоломке". Но если ученым все-таки удастся одержать победу (что совершенно не факт), то последствия их работы будут колоссальными. Быстрое и относительно безболезненное избавление от рака сейчас считается чудом. Как хотелось бы, чтобы оно стало нормой!
Читайте также:


