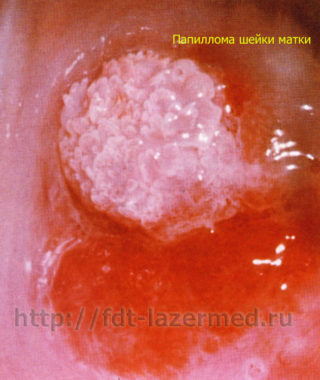
Косвенные признаки вируса папилломы человека при цитологии отзывы

Сейчас часто начали диагностировать у пациентов вирус папилломы человека (ВПЧ) и после этого стал возникать извечный вопрос, что делать?
Для начала, хотелось бы немного рассказать о нем: определение вируса папилломы человека.
Если обобщить, то ВПЧ – инфекция может находиться в следующих формах:
Как проявляется ВПЧ – инфекция?
Основным симптомом инфекции вызванной вирусом папилломы человека является образование так называемых остроконечных кондилом.
Внешне остроконечные кондиломы похожи на обычные бородавки. Они могут иметь небольшие размеры (от нескольких миллиметров до сантиметра), розоватую или телесного цвета окраску, гладкую или слегка бугристую поверхность.
Чаще всего остроконечные кондиломы образуются в области наружных половых органов.
У женщин остроконечные кондиломы могут возникать вблизи клитора, на малых и больших половых губах, во влагалище и на шейке матки. В случае раздражения кондилом, располагающихся близко к входу во влагалище, возможно появление зуда и незначительного кровотечения во время полового акта.
У мужчин остроконечные кондиломы образуются на половом члене и мошонке.
Как правило, остроконечные кондиломы безболезненны. В некоторых случаях в области кондилом ощущается легкий зуд и дискомфорт.
Когда нужно обратиться к врачу?
Обязательно обратитесь к врачу, если вы заметили у себя на коже образования (бородавки, выросты) похожие на остроконечные кондиломы. Врач назначит вам необходимые обследования, которые помогут установить точную причину болезни и исключить другие заболевания, передающиеся половым путем.
Диагностика ВПЧ?
Для подтверждения диагноза папилломавирусной инфекции используется метод ПЦР (полимеразной цепной реакции), который позволяет определить ДНК вируса и точно установить, каким типом вируса заражен человек.
В современных диагностических лабораториях определяется тип вируса, его количество (вирусная нагрузка) и интеграция вируса в геном. В начале статьи приведена информация, которая показывает, что наиболее опасны ВПЧ высокого онкогенного риска (ВОР). Имеет значение кроме типа вируса, определение и его количества. От этого зависит тактика лечения. Интеграция вируса в геном клетки, к сожалению, в наших лабораториях не определяется. Этот анализ важен в ранней диагностике дисплазии эпителия шейки матки и неинвазивной карциномы.
Очень важно, чтобы все поняли, даже если ПЦР анализ выявит у вас онкогенные формы ВПЧ, это не означает, что у вас уже есть рак шейки матки или что вы неминуемо заболеете им в ближайшее время, так как, далеко не во всех случаях ВПЧ приводит к развитию рака. От момента заражения до появления предрака могут пройти годы.
Для того чтобы определить вызвал ли ВПЧ изменение клеток шейки матки и есть ли риск развития рака нужно обязательно пройти тщательное гинекологическое обследование, которое включает в себя обязательно :
- Кольпоскопию (осмотр шейки матки аппаратом, напоминающим микроскоп и позволяющий осматривать под увеличением от 8 до 20 крат).
- Цитологический мазок (ПАП тест), который используется для определения диспластических изменений в клетках шейки матки.
- Бактериоскопическое исследование выделений из влагалища. Часто ВПЧ-инфекция сочетается с другими инфекциями передающимися половым путем (примерно в 20% случаев), поэтому может быть необходимо дополнительное дообследование для определения хламидиоза, микоплазмоза, уреаплазмоза и трихомониаза.
- Прицельная биопсия – взятие кусочка ткани шейки матки в случаи наличия дисплазии или подозрения на злокачественную опухоль шейки матки.
Лечение ВПЧ
Поскольку полного излечения от папилломавирусной инфекции в настоящее время достичь невозможно (наряду с этим часто наблюдается спонтанное, самопроизвольное излечение), лечат проявления ВПЧ, а не присутствие вируса в организме. При этом эффективность различных методов лечения составляет 50-70 %, а в четверти случаев заболевание вновь проявляет себя уже спустя несколько месяцев после окончания лечения. Вопрос о целесообразности лечения каждой пациентки решается врачом индивидуально. При этом необходимо избегать факторов, снижающих иммунитет (переохлаждение, сильные эмоциональные стрессы, хроническое переутомление, авитаминоз). Существуют исследования, которые говорят о профилактическом эффекте ретиноидов (бета-каротин и витамин А), витамина С и микроэлементов, таких как фолаты, в отношении заболеваний, вызванных ВПЧ.
Среди методов лечения проявлений ВПЧ инфекции (остроконечных кондилом и папиллом) чаще всего используются:
- Деструктивные методы - это местное лечение, направленное на удаление кондилом. Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты - подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни.
- Имунологические методы Наиболее часто для лечения ВПЧ-инфекции используются интерфероны (лаферон, лаферобион, альфарекин, реаферон, виферон). Они представляют собой семейство белков, которые вырабатываются клетками иммунной системы в ответ на стимуляцию вирусами. Отдельно стоит препарат Алокин-альфа, который стимулирует выработку собственного интерферона и активирует клеточный иммунитет.
- Специфические противовирусные препараты (цидофовир, панавир, алпиразин). Известный противовирусный препарат ацикловир (зовиракс) не оказывает действие на ВПЧ. Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
Профилактика ВПЧ
Может быть неспецифическая и специфическая.
Неспецифическая включает предотвращение заражения ВПЧ половым путем, здоровый образ жизни с целью укрепления работы иммунной системы и сбалансированное питание включающее в себя бета-каротин, витамин А, витамина С и фолиевую кислоту.
Специфическая профилактика – вакцинация.
Вакцины для профилактики ВПЧ содержат органические вещества, структура которых похожа на структуру живых вирусов ВПЧ. Эти вещества ни в коем случае не могут вызвать болезнь.
После введения вакцины в организме человека начинают вырабатываться клетки иммунной системы, которые препятствуют внедрению ВПЧ в организм.
В настоящее время существует два типа вакцин против ВПЧ: квадривалентная Гардасил (Gardasil) и бивалентная Церварикс (Cervarix).
Церварикс предотвращает заражения ВПЧ 16 и 18, которые вызывают 70% всех случаев рака шейки матки и рака заднего прохода.
Гардасил, кроме защиты от ВПЧ 16 и 18 типов, предоставляет защиту ещё и от ВПЧ 6 и 11 типов, вызывающих 90% случаев бородавок на половых органах.
Гардасил и Церварикс защищают от заражения людей, которые еще не заражены ВПЧ соответствующего типа. Они не могут устранить вирус из организма человека, если он уже проник в него и не могут вылечить болезни (например, остроконечные кондиломы или дисплазию шейки матки) которые вирус уже успел спровоцировать. Именно по этой причине, прививки против ВПЧ рекомендуется делать в детском и подростковом возрасте, до начала половой жизни.
Таким образом, вакцина Гардасил защищает от заражения ВПЧ 6, 11, 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки, рака влагалища и наружных половых органов у женщин, а также для профилактики рака заднего прохода и остроконечных кондилом у мужчин и женщин. Вакцина Церварикс защищает от заражения ВПЧ 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки у женщин и рака заднего прохода у мужчин и женщин.
По состоянию на 2013 год вакцины зарегистрирована более, чем в 125 странах мира, почти в 20 странах входят в национальные календари прививок, в мире распространено 111 миллионов доз препарата.
Основные факты
- Вирус папилломы человека (ВПЧ) — это общее название группы вирусов, чрезвычайно широко распространенных во всем мире.
- Известно более 100 типов ВПЧ, из которых не менее 14 являются онкогенными (так называемые вирусы высокого онкогенного риска).
- ВПЧ передается, главным образом, половым путем, и большинство людей заражаются ВПЧ вскоре после начала половой жизни.
- Рак шейки матки развивается в результате передающейся половым путем ВПЧ-инфекции определенных типов.
- В 70% случаев причиной рака шейки матки оказываются ВПЧ двух типов (16 и 18).
- Имеются также доказательства связи ВПЧ с раком заднего прохода, вульвы, влагалища, полового члена и ротоглотки.
- Рак шейки матки — второй по распространенности вид рака среди женщин, проживающих в развивающихся странах. По оценкам, в 2018 г. число новых случаев в этих странах составило 570 000 (84% от всех новых случаев в мире).
- В 2018 г. от рака шейки матки умерло около 311 000 женщин, причем более 85% этих случаев смерти имели место в странах с низким и средним уровнем дохода.
- В комплекс мероприятий по борьбе с раком шейки матки входят первичная профилактика (вакцинация против ВПЧ), вторичная профилактика (скрининг и лечение предраковых поражений), третичная профилактика (диагностика и лечение инвазивного рака шейки матки) и паллиативная помощь.
- Вакцины, формирующие иммунитет к ВПЧ 16-го и 18-го типов, рекомендованы ВОЗ и одобрены к применению во многих странах.
- Одним из экономически эффективных способов профилактики рака шейки матки считается скрининг и лечение предраковых поражений у женщин в возрасте старше 30 лет.
- При выявлении рака шейки матки на ранней стадии возможно полное его излечение.
Общие сведения о ВПЧ
Вирусы папилломы человека (ВПЧ) — возбудители самой распространенной вирусной инфекции половых путей. Большинство ведущих половую жизнь женщин и мужчин рано или поздно приобретают эту инфекцию, а некоторые могут заражаться несколько раз в течение жизни.
Большинство женщин и мужчин заражаются ВПЧ вскоре после начала половой жизни. Инфекция ВПЧ относится к заболеваниям, передающимся половым путем, хотя заражение возможно и при половых контактах без проникновения. Известно, что передача вируса происходит и при простом соприкосновении половых органов.
Среди множества типов ВПЧ многие не представляют опасности для здоровья. ВПЧ-инфекции обычно исчезают за несколько месяцев без какого бы то ни было лечения, и примерно в 90% случаев элиминация инфекции из организма достигается в течение 2 лет. В небольшой доле случаев инфекции ВПЧ определенных типов могут принимать хронический характер и со временем приводить к развитию рака шейки матки.
Рак шейки матки вне всяких сомнений является самым распространенным из заболеваний, связанных с ВПЧ. Почти все случаи рака шейки матки вызваны ВПЧ-инфекцией.
Инфекциями ВПЧ некоторых типов также обусловлена определенная доля случаев рака заднего прохода, вульвы, влагалища, полового члена и ротоглотки, — заболеваний, которые можно предотвратить с помощью тех же методов первичной профилактики, что и рак шейки матки.
Некоторые не онкогенные вирусы папилломы человека, особенно ВПЧ 6-го и 11-го типов, могут приводить к образованию остроконечных кондилом и развитию респираторного папилломатоза (заболевания, при котором опухоли образуются в дыхательных путях, ведущих от носа и полости рта в легкие). Хотя эти патологические состояния очень редко приводят к смерти, распространенность заболевания может быть значительной. Остроконечные кондиломы очень широко распространены, отличаются высокой контагиозностью и отрицательно влияют на половую жизнь.
Каким образом инфекция ВПЧ приводит к развитию рака шейки матки
Несмотря на то, что большинство ВПЧ-инфекций исчезают сами по себе, а предраковые поражения в большинстве случаев самопроизвольно излечиваются, все женщины подвержены риску перехода инфекции в хроническую форму и прогрессирования предраковых поражений в инвазивный рак шейки матки.
У женщин с нормальным иммунитетом рак шейки матки может развиваться в течение 15-20 лет. Однако при нарушениях иммунной системы, например у женщин с нелеченой ВИЧ-инфекцией, этот процесс может занять всего 5–10 лет.
Факторы риска хронической ВПЧ-инфекции и рака шейки матки
- степень онкогенности ВПЧ (способности вируса вызывать рак);
- нарушения иммунитета: люди с ослабленным иммунитетом, в частности, лица, живущие с ВИЧ, подвержены более высокому риску хронической ВПЧ-инфекции и ускоренного развития предраковых поражений и рака;
- наличие сопутствующих инфекций, передающихся половым путем, таких как генитальный герпес, хламидиоз и гонорея;
- количество родов в анамнезе и роды в раннем возрасте;
- курение табака.
Бремя рака шейки матки в мире
Рак шейки матки — четвертый в мире по распространенности вид рака у женщин. Так, в 2018 г. было зарегистрировано около 570 000 новых случаев этого заболевания. Оно является причиной 7,5% всех случаев смерти от онкологических заболеваний среди женщин. Ежегодно от рака шейки матки умирает более 311 000 женщин, причем более 85% этих случаев приходится на развивающиеся страны.
В развитых странах реализуются программы по вакцинации девочек против ВПЧ и ведется регулярный скрининг женщин на ВПЧ-инфекцию. Скрининг позволяет выявлять предраковые поражения на стадиях, на которых они легко поддаются лечению. В этих странах раннее начало лечения позволяет предотвратить развитие рака шейки матки почти в 80% случаев.
В развивающихся странах из-за ограниченного доступа к профилактике рак шейки матки часто остается не выявленным до поздних стадий заболевания и появления клинических симптомов. Кроме того, в этих странах может быть крайне ограничен доступ к лечению поздних стадий рака (например, доступ к онкохирургии, лучевой и химиотерапии), в связи с чем смертность от рака шейки матки там намного выше.
Проведение эффективных лечебно-профилактических мероприятий могло бы позволить снизить высокий показатель смертности от этого заболевания в мире (стандартизированный по возрасту коэффициент смертности в 2018 г.: 6,9 на 100 000).
Комплексный подход к борьбе с раком шейки матки
ВОЗ рекомендует комплексный подход к профилактике и лечению рака шейки матки. В рекомендуемый набор действий входят мероприятия, относящиеся ко всем этапам жизненного цикла. В эту многопрофильную программу должны входить такие компоненты, как просветительская работа в сообществах, мобилизация социальных ресурсов, вакцинация, скрининг, лечение и паллиативная помощь.
Первичная профилактика начинается с вакцинации девочек в возрасте 9–14 лет до начала половой жизни.
В перечень других рекомендуемых профилактических мероприятий для девочек или мальчиков, в зависимости от ситуации, входят:
- информирование о практиках безопасного секса, в том числе о нежелательности раннего начала половой жизни;
- пропаганда использования презервативов и предоставление их тем, кто уже начал половую жизнь;
- предупреждение о вреде употребления табака, к которому многие приобщаются в подростковом возрасте и которое является серьезным фактором риска развития рака шейки матки и других онкологических заболеваний;
- мужское обрезание.
Начиная с 30 лет все женщины, ведущие активную половую жизнь, должны проходить скрининг на атипичные клетки шейки матки и наличие предраковых поражений.
Если для лечения предраковых поражений шейки матки необходимо иссечение участков с атипичными клетками или измененными тканями, рекомендуется применять метод криотерапии, основанный на разрушении патологических тканей путем их замораживания.
При обнаружении признаков рака шейки матки необходимо начинать лечение, вариантами которого могут быть хирургическое вмешательство, лучевая терапия и химиотерапия.
Вакцинация против ВПЧ
В настоящее время существуют три вакцины, которые защищают одновременно от ВПЧ 16-го и 18-го типов, вызывающих не менее 70% случаев рака шейки матки. Одна из этих вакцин обеспечивает дополнительную защиту от трех других онкогенных ВПЧ, ответственных еще за 20% случаев этого заболевания. С учетом того, что вакцины только от ВПЧ 16-го и 18-го типов, обеспечивают также определенный уровень перекрестной защиты от других менее распространенных онкогенных типов ВПЧ, ВОЗ считает, что эти три вакцины являются равноценными средствами профилактики рака шейки матки. Две из этих вакцин защищают также от ВПЧ 6-го и 11-го типов, вызывающих аногенитальные остроконечные кондиломы.
Клинические и пострегистрационные исследования показывают, что вакцины против ВПЧ отличаются высокой безопасностью и высокой эффективностью в предотвращении ВПЧ-инфекций.
Вакцины против ВПЧ дают максимальный эффект, если их вводят до контакта организма с этими вирусами. В связи с этим ВОЗ рекомендует вакцинировать девочек в возрасте от 9 до 14 лет, когда большинство из них еще не начали вести половую жизнь.
Вакцины не лечат ВПЧ-инфекцию и связанные с ВПЧ заболевания, в частности, рак.
В некоторых странах начали вакцинировать и мальчиков, так как вакцинация предотвращает развитие рака половых органов не только у женщин, но и у мужчин, а две из существующих вакцин способны также препятствовать развитию остроконечных кондилом у представителей обоих полов. Рекомендуемая ВОЗ вакцинация девочек в возрасте от 9 до 14 лет представляет собой наиболее эффективное с точки зрения затрат медицинское мероприятие по борьбе с раком шейки матки.
Вакцинация против ВПЧ не отменяет необходимости скрининга на рак шейки матки. В странах, где вакцинация против ВПЧ внедрена в медицинскую практику, может сохраняться необходимость в разработке или усилении программ по скринингу.
Выявление и лечение предраковых поражений
Скрининг на рак шейки матки предусматривает проверку на наличие предраковых и раковых образований у женщин, которые зачастую могут чувствовать себя совершенно здоровыми и у не иметь никаких симптомов заболевания. Если при скрининге обнаруживаются предраковые поражения, их лечение не представляет трудностей и позволяет избежать развития рака. Кроме того, скрининг позволяет обнаруживать рак на ранней стадии, когда высока вероятность полного излечения.
Поскольку предраковые поражения развиваются на протяжении многих лет, скрининг рекомендуется регулярно проходить всем женщинам, начиная с возраста 30 лет (периодичность скрининга зависит от используемого для этого метода). Регулярный скрининг у женщин с ВИЧ-инфекцией, ведущих активную половую жизнь, должен начинаться раньше — с момента, когда они узнают о своем ВИЧ-статусе.
При проведении скрининга необходимо обеспечить возможность последующего лечения и предусмотреть необходимые действия в случае получения положительных результатов теста. Без надлежащей организации таких мероприятий проведение скрининга неэтично.
Существуют три различных типа скрининговых тестов, рекомендуемых ВОЗ в настоящее время:
- тесты на ВПЧ, относящиеся к группе высокого риска;
- визуальная проверка с применением уксусной кислоты;
- традиционный ПАП-тест и метод жидкостной цитологии (ЖЦ).
Для лечения предраковых поражений ВОЗ рекомендует применять методы криотерапии и электрохирургической петлевой эксцизии. При обнаружении более глубоких поражений следует направлять пациенток на дополнительные обследования для принятия обоснованных решений о дальнейших действиях.
Лечение инвазивного рака шейки матки
При наличии у женщины симптомов, позволяющих заподозрить рак шейки матки, ее необходимо направить в специализированное лечебное учреждение для проведения дополнительных исследований, постановки диагноза и лечения.
На ранних стадиях рака шейки матки могут появляться следующие симптомы:
- нерегулярные мажущие кровянистые выделения или слабое кровотечение в период между месячными у женщин детородного возраста;
- мажущие выделения или кровотечение у женщин в постменопаузе;
- кровотечение после полового акта;
- более обильные выделения из влагалища, иногда с неприятным запахом.
По мере прогрессирования рака могут появляться более тяжелые симптомы, в том числе:
- постоянная боль в спине, ногах и (или) в области таза;
- потеря веса, утомляемость, снижение аппетита;
- неприятно пахнущие выделения и дискомфорт во влагалище;
- отек одной или обеих нижних конечностей.
При далеко зашедших формах рака могут развиться и другие тяжелые симптомы, в зависимости от того, на какие органы распространился рак.
Диагноз рака шейки матки должен быть подтвержден результатами гистологического исследования. Стадию заболевания устанавливают на основании размеров опухоли и распространения процесса на область таза и отдаленные органы. Выбор метода лечения зависит от стадии рака, при этом в перечень возможных вариантов входят хирургическая операция, лучевая терапия и химиотерапия. Кроме того, важную роль в ведении пациентов с онкологическими заболеваниями играет паллиативная помощь, позволяющая облегчать боль и страдания, причиняемые болезнью.
Действия ВОЗ
ВОЗ разработала руководство по профилактике рака шейки матки и борьбе с этим заболеванием путем вакцинации, скрининга и лечения инвазивной формы рака. Совместно со странами и партнерами ВОЗ занимается разработкой и осуществлением комплексных программ.
В мае 2018 г. Генеральный директор ВОЗ выступил с призывом к действиям, направленным на ликвидацию рака шейки матки, и предложил странам и партнерам объединить усилия для расширения доступа к мерам профилактики рака шейки матки и увеличения охвата населения. В качестве трех основных мер были названы вакцинация против ВПЧ, скрининг и лечение предраковых поражений, а также ведение пациенток с раком шейки матки.
Папилломы (кондиломы, аногенитальные бородавки, половые бородавки) – это доброкачественные образования, вызываемые вирусом папилломы человека (ВПЧ). Помимо косметических неудобств, ВПЧ часто становится причиной развития рака шейки матки, опухолей половых органов и других не менее опасных недугов.
На сегодняшний день ВПЧ является наиболее распространенным из всех заболеваний, передающихся половым путем. Вирусом папилломы человека заражены около 50% всего населения земли. В настоящее время насчитывается около 180 типов ВПЧ, из них 29 типов обладают онкогенным потенциалом.
По степени онкогенного риска выделяют следующие группы ВПЧ:
Папиллома выглядит как небольшой нарост (бородавка) телесного, розоватого или коричневатого цвета, на тонкой ножке. Она может достигать в размере 1-2 см. При обильном разрастании папилломы внешне напоминают структуру цветной капусты и, чаще всего, располагаются на половых органах, но могут появиться и в любом другом месте. У женщин они располагаются в области больших и малых половых губ, реже во влагалище и на шейке матки.
Остроконечные кондиломы локализуются, в основном, в местах трения и травматизации при половом контакте. У женщин поражаются уздечка половых губ, большие и малые половые губы, клитор, уретра, лобок, промежность, перианальная область, преддверие и вход во влагалище, а также девственная плева, непосредственно влагалище и шейка матки. В уретре кондиломы располагаются кольцеобразно, главным образом в области наружного отверстия.
Причины развития папилломатоза шейки матки
Заражение ВПЧ, как правило, происходит половым путем.
Инфицирование может происходить также в бассейнах, банях, спортзалах и других общественных местах и в результате самозаражения при бритье, эпиляции, обкусывании ногтей, расчесах кожи.
Наблюдается также перенос ВПЧ-инфекции от родителей к детям. Новорожденные могут быть инфицированы в родах при прохождении через родовые пути матери, инфицированной ВПЧ.
К группе риска заражения ВПЧ относятся все люди, живущие половой жизнью. Факторами риска развития инфекции являются:
- раннее начало половой жизни;
- большое количество половых партнеров;
- местные раздражители (выделения из влагалища, уретры, прямой кишки при различных патологических состояниях, мацерация, скопление смегмы и т.д.);
- дисбиотические состояния;
- курение, алкоголь;
- авитаминоз и атопический дерматит;
- беременность;
- лечение цитостатиками;
- контакт с женщиной, больной раком шейки матки, или имеющей генитальный папилломатоз;
- сочетание ВПЧ-инфекции с другими ИППП (хламидиоз, урогенитальный микоплазмоз, гонорея, трихомониаз, бактериальный вагиноз, HSV-инфекция, ВИЧ, цитомегаловирусная инфекция, сифилис и т.д.).
Симптомы папилломатоза
Сложность диагностики и лечения папиллом шейки матки заключается в том, что данное заболевание может протекать практически бессимптомно! Тем не менее, некоторые пациенты отмечают косвенные признаки ВПЧ, к которым относятся:
- Болезненность при половом акте;
- Кровянистые выделения после полового акта;
- Резкий, неприятный запах из половых органов.
Диагностика папилломатоза
Обнаруженные при осмотре шейки матки в зеркалах и при расширенной кольпоскопии эктопия и лейкоплакия, являются обязательным показанием для обследования на ВПЧ. Наибольшее диагностическое значение в настоящее время придается методу полимеразной цепной реакции (ПЦР), позволяющий идентифицировать отдельные типы ВПЧ.
Этот метод имеет большую прогностическую значимость, особенно если на фоне папилломавирусной инфекции уже имеется картина дисплазии эпителия шейки матки. Новым способом диагностики ВПЧ-инфекции является определение онкобелка Е7 в цервикальном материале методом иммунофлюоресцентного анализа.
Лечение папилломатоза
Лечение заболеваний, вызванных ВПЧ, включает в себя не только уничтожение образований, но и коррекцию общего и местного иммунодефицита, а также устранение факторов, способствующих развитию болезни. Адекватное лечение сопутствующих ИППП следует проводить перед деструкцией кондилом и обязательно на фоне приема иммунокорригирующих препаратов.
Мы индивидуально подходим к решению проблем каждой пациентки, учитывая при выборе метода лечения ее возраст, иммунный статус, характер и локализацию заболевания, сопутствующие урогенитальные инфекции. Именно такой подход гарантирует нашим пациенткам высокую эффективность лечения и низкий риск возникновения рецидивов болезни.
В настоящее время, самым многообещающим и перспективным направлением борьбы с ВПЧ является, бесспорно, применение профилактической вакцинации против ВПЧ тех типов, которые являются самыми частыми виновниками рака шейки матки, рака вульвы, рака влагалища.
Телефоны:
гор.: +7 (812) 275-42-42
моб.: +7 (921) 966-61-09 


Электронная почта: clms@mail.ru
Часы работы: с 9:00 до 21:00
Вирусы папилломы человека (ВПЧ) – широко распространенная и гетерогенная группа вирусов. В настоящее время идентифицировано 120 генотипов ВПЧ, 40 из которых ассоциированы с аногенитальным трактом человека.
Вирус папилломы относится к семейству паповирусов (Papoviridae). Филогенетически ВПЧ разделяют на роды (a, b, g), роды на виды, которые обозначаются цифрами (1, 2 и т. д.), а каждый вид, в свою очередь, содержит несколько типов вируса. Генитальные серотипы ВПЧ отнесены к роду a, видам a5, a6, a7, a8, a9, a11 (45 серотипов). По степени канцерогенного потенциала ВПЧ подразделяются на генотипы высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 и др.) и генотипы низкого риска (6, 11, 42, 43, 44 и др.).
Вирусы передаются при тесном контакте с пораженными участками кожи и слизистых оболочек. Основной путь передачи ВПЧ аногенитальной группы – половой. Это было неоднократно показано в эпидемиологических исследованиях по выявлению ВПЧ среди девственниц.
Методы выявления вирусов папилломы человека
Наиболее широко используемые методы выявления инфекционных агентов, в т. ч. вирусных, можно разделить на две группы – косвенные и прямые.
К косвенным относятся методы, позволяющие оценить эффект, который оказывает вирус на организм (клетки, ткани), – серологические, цитологические и гистологические методы. Серологические методы, направленные на выявление антител различных классов к антигенами вируса, в силу особенностей течения ВПЧ-инфекции и разнообразия вирусов, для рутинной диагностики не используются. Цитологические и гистологические методы, направленные на выявление клеток, измененных воздействием активного вируса (койлоциты) или трансформированных вирусом (раковые клетки), используются для установления степени изменения клеток, но не способны достоверно показать наличие или отсутствие вируса у обследуемого.
Прямые методы направлены на выявление самого вируса или его компонентов – белков, ДНК, РНК. Поскольку ВПЧ не может быть изолирован в культуре чувствительных клеток, основной подход, который широко применяют в настоящее время для обнаружения и изучения вируса, – выявление его нуклеиновых кислот (ДНК, РНК) методами гибридизации, амплификации, секвенирования.
Выявление ВПЧ подгруппы низкого канцерогенного риска
Низкая степень опасности вируса для его носителей, невысокий процент клинических проявлений инфекции (не более 10% остроконечных кондилом в группе инфицированных вирусом), высокая доля спонтанной элиминации вируса в течение года, отсутствие специфической противовирусной терапии ставят под сомнение необходимость использования скринингового обследования для выявления ВПЧ у этой подгруппы лиц. Основным диагностическим признаком папилломавирусной инфекции низкого риска является выявление остроконечных кондилом при осмотре. Прямые методы лабораторной диагностики (обнаружение ДНК) могут служить вспомогательным инструментом для дифференциальной диагностики, например, от сифилитических перианальных кондилом или от злокачественной опухоли. В этом случае также значение имеет проведение биопсии и гистологического исследования. В случае использования молекулярно-биологических методов достаточно выявлять 6-й и 11-й генотипы ВПЧ, т. к. они ответственны более чем за 95% случаев остроконечных кондилом. Дополнительное выявление других типов (42–44) незначительно повысит чувствительность выявления, но удорожит исследования. Следует заметить, что для этой задачи необходимо брать соскоб эпителия именно с места поражения, иначе велик шанс “пропустить” вирус.
Выявление ВПЧ подгруппы высокого канцерогенного риска
Основная опасность, которую несет инфицирование вирусами данной подруппы, является риск развития рака шейки матки (РШМ). Этиологическая роль ВПЧ в развитии РШМ на сегодняшний день не вызывает сомнений. Эпидемиологические и вирусологические исследования показали, что ВПЧ является причиной РШМ в 100% случаев, рака заднего прохода – в 90%, рака вульвы и влагалища – в 40%, и только в 12% случаев – орофарингеального рака.
РШМ является значимой проблемой для здравоохранения России. В нашей стране ежегодно регистрируют около 12 тыс. новых случаев, а примерно 6 тыс. заболевших умирает. Заболеваемость составляет в среднем по стране 12 случаев на 100 тыс. женщин, что соответствует 5-му ранговому месту в структуре онкологических заболеваний у женщин. При этом прирост заболеваемости в возрастной группе до 29 лет за 10 лет составил более 150%.
Поскольку основной причиной РШМ является ВПЧ, первичная профилактика должна быть направлена на снижение распространения инфекции в популяции. Эффективный метод первичной профилактики – вакцинация. Вторичная профилактика предполагает раннее выявление и лечение лиц, имеющих предраковые изменения. Несмотря на успехи в разработке и внедрении вакцин против наиболее часто встречающихся канцерогенных типов ВПЧ, на сегодняшний день наиболее важным методом профилактики РШМ является скрининговое обследование женского населения на наличие маркера предраковой стадии папилломавирусной инфекции – цервикальной интраэпителиальной неоплазии (ЦИН, SIL). Хорошо известно, что в большинстве экономически развитых стран Европы и Северной Америки внедрение программ скрининга позволило значительно снизить заболеваемость РШМ. Однако в развивающихся странах, на долю которых приходится наибольшее количество случаев заболевания в мире, традиционные программы скрининга оказались неэффективными.
Следует отметить, что основное требование, которому должны отвечать программы скрининга, – высокая эффективность и низкая стоимость. Эффективность выявления женщин группы риска развития РШМ зависит от нескольких параметров: охват женского населения, чувствительность используемого метода и периодичность проведения исследований. При использовании цитологического метода скринингово исследования женщин с возраста 25–30 лет, с 3–5-летним интервалом и не менее чем 75%-ном охвате женского населения удается достичь снижения заболеваемости РШМ на 70–80%, при условии достаточно высокой чувствительности цитологического метода. Однако основным недостатком этого метода как раз является его низкая чувствительность, варьирующая в пределах 40–70%, составляя в среднем 50%. Причины такой низкой чувствительности метода обсуждаются. По одним данным, в 70– 90% случаев причиной ложноотрицательных цитологических ответов является некачественный забор материала для исследования и в 10–30% – ошибочная интерпретация цитологических данных. По другим данным, наоборот, отмечается низкая сопоставимость между лабораториями при тестировании одних и тех же препаратов – от 11 до 80%. Кроме того, высока доля сомнительных результатов (до 15% атипичных плоских клеток неясного значения – ASCUS), требующих повторных и подтверждающих исследований. Таким образом, предсказательная ценность отрицательного результата оказывается низкой, что требует более частого проведения исследований и приводит к удорожанию программы скрининга. В связи с этим в последние годы в скрининге все больше стали использоваться тесты, позволяющие выявлять ДНК ВПЧ (ВПЧ-тесты).
Многочисленные международные исследования продемонстрировали более высокую чувствительность ВПЧ-тестов в выявлении ЦИН в сравнении с цитологическими. Доказано, что получение отрицательного результата ВПЧ- теста позволяет значительно увеличить интервал между повторными тестированиями. На основании данных крупных международных исследований, ведущими специалистами международных организаций (ASCCP, EUROGIN, ESIDOG и др.) предложены алгоритмы диагностики с использованием ВПЧ- тестирования, сформулированы рекомендации по применению ВПЧ-теста в программах скрининга:
- на первом этапе скрининга у женщин старше 30 лет в дополнение к цитологическому исследованию;
- для разрешения сомнительных результатов цитологического исследования (ASCUS)на первом этапе скрининга для стран, где плохо организованы программы цервикального цитологического скрининга;
- для мониторинга терапии цервикальных поражений высокой степени (ЦИН 2/3, рак in situ, инвазивный рак).

Рис. 1. Алгоритм использования ВПЧ-теста на первом этапе скрининга
Во многих странах совместное применение ВПЧ-теста и цитологического ПАП-теста (рис. 1) позволило увеличить чувствительность выявления ЦИН до 99–100%, удлинить интервалы исследований до 5–7 лет, что, несмотря на использование дополнительного метода исследования, в конечном итоге привело к снижению затрат на программу скрининга. Разработан принципиально новый способ забора клеток цервикального эпителия в транспортно-фиксирующую среду для одновременного проведения цитологического исследования (жидкостная цитология) и ВПЧ-теста. Такой подход позволил, с одной стороны, повысить эффективность цитологического метода, а с другой – разрешать сомнительные результаты цитологического анализа без повторного забора клинического образца (рис. 2).

Рис. 2. Алгоритм использования ВПЧ-теста при сомнительных результатах цитологического исследования (ASCUS)
Диагностическая чувствительность рекомендованного для скрининга ВПЧ- теста, в среднем составляющая 88–100%, значительно превышает чувствительность цитологического исследования, а диагностическая специфичность скринингового ВПЧ-теста при использовании его в возрастной группе женщин старше 30 лет лишь немного уступает специфичности цитологического метода (78–99%). Прогностическая значимость отрицательного результата выявления ДНК ВПЧ приближается к 100%. Это является основанием для использования ВПЧ-теста на первом этапе скрининга. Алгоритмы применения ВПЧ-теста, как самостоятельного исследования на первом этапе скрининга были предложены еще в 2003 г. (рис. 3), но широкое применение в программах скрининга они нашли позднее.

Рис. 3. Алгоритм использования ВПЧ-теста как самостоятельного исследования на первом этапе скрининга
Главное условие эффективного цервикального скрининга – оптимальный баланс между диагностической чувствительностью и специфичностью в выявлении предраковых поражений шейки матки (ЦИН 2/3) и рака. На основании многолетнего мирового опыта применения молекулярно-биологических методов для выявления ДНК ВПЧ в скрининговых программах к настоящему времени сформулированы четкие требования к ВПЧ-тестам, которые могут быть использованы в скрининге.
Требования к аналитическим характеристикам теста
Во-первых, ВПЧ-тест должен выявлять только типы вируса, которые относятся к группе высокого канцерогенного риска, т. к. выявление всех типов вируса, включая группу низкого онкогенного риска, которые не вызывают трансформации эпителиальных клеток, будет приводить к значительному снижению специфичности теста. В то же время, ВПЧ-тест должен выявлять широкий спектр типов вируса высокого канцерогенного риска – не менее 10–13 (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 типы), т. к. это обеспечивает не менее чем 90% чувствительность теста. Выявление ВПЧ только 16-го и 18-го типов будет приводить к значительному снижению чувствительности скрининга, поскольку эти два типа ответственны не более чем за 70% случаев предраковых поражений (ЦИН 2/3).
Во-вторых, ВПЧ-тест должен обладать высокой диагностической чувствительностью и специфичностью выявления ЦИН 2/3. Это обеспечивается способностью теста выявлять только клинически значимую концентрацию вируса или дифференцировать клинически значимую концентрацию и клинически незначимую. Исследования голландских ученых показали, что критическое значение вирусной нагрузки, при которой может развиться дисплазия тяжелой степени, находится в интервале 104–105 копий ДНК ВПЧ в 1 мл клинического образца (в соскобе клеток цервикального канала, взятом в 1 мл транспортной среды). Стандартные общепринятые ВПЧ-тесты, используемые для скрининга, откалиброваны на выявление клинически значимой концентрации ВПЧ.
Клиническая валидация теста
Новый ВПЧ-тест должен быть валидирован в клинических испытаниях относительно стандартного ВПЧ-теста, уже прошедшего клиническую валидацию. Таким тестом на сегодняшний день считается Hybrid Capture 2 High Risk HPV DNA Test, разработанный компанией Digene (США). Этот тест был одобрен FDA в 2003 г., а затем, после проведения широких испытаний в разных странах мира, рекомендован для скрининга. В основе теста лежит методика гибридизации ДНК ВПЧ со специфическими РНК-пробами в растворе с последующим захватом ДНК-РНК гибридов с помощью моноклональных антител.
Новый ВПЧ-тест должен быть валидирован в клинических испытаниях на гистологически верифицированных образцах. Диагностическая чувствительность ВПЧ-теста определяется как способность выявлять образцы с дисплазией тяжелой степени (ЦИН 2/3), а диагностическая специфичность – как способность не выявлять образцы с гистологической нормой.
ВПЧ-тесты в России
Тесты для выявления и генотипирования ВПЧ, основанные на методах гибридизации и/или методах амплификации нуклеиновых кислот, к которым относится полимеразная цепная реакция (ПЦР), начали применять еще более 10 лет назад. В настоящее время в литературе описано достаточно большое число методов выявления и генотипирования ВПЧ. Однако очевидно, что в программах скрининга могут быть использованы только стандартизованные тесты, удовлетворяющие заданным требованиям по чувствительности и специфичности и прошедшие клиническую апробацию. Общепринятый международный стандарт Hybrid Capture 2 High Risk HPV test в настоящее время разрешен для применения в России. Но высокая стоимость теста ограничивает возможность использовать его в российских программах скрининга. Тем не менее, поскольку этот тест удовлетворяет практически всем требованиям ВПЧ-теста, он в обязательном порядке должен использоваться для валидации вновь разработанных отечественных ВПЧ-тестов.
Российскими производителями в настоящее время разработано и выпуска- ется большое количество тестов для выявления ВПЧ как низкого, так и высокого канцерогенного риска. Но, несмотря на то, что многие выпускаемые тесты зарегистрированы и разрешены к применению, большинство из них не удовлетворяют требованиям, предъявляемым к ВПЧ-тестам для скрининга. Спектр выявляемых генотипов вируса, аналитическая чувствительность и специфичность отечественных ВПЧ-тестов сильно варьируют в широком диапазоне. И, несмотря на повсеместное применение российских ПЦР-тестов, используемых для диагностики ВПЧ-инфекции, нельзя признать, что все они стандартизованы и прошли должную клиническую апробацию.
Учитывая, что международный стандартный ВПЧ-тест недоступен многим российским производителям тест-систем для валидации собственных разработок, назрела необходимость создания стандартной панели контрольных образцов как для оценки качества работы самих тестов, так и лабораторий, использующих эти тесты. Согласно международному опыту создания панелей контрольных образцов, необходимо, чтобы разработанные панели удовлетворяли условиям работы всех тест-систем, представленных на рынке, и были валидированы с помощью стандартного международного теста (www.QCMD.org). Поскольку ВПЧ невозможно вырастить в культуре клеток, контрольная панель может состоять из рекомбинантных ДНК, содержащих полные геномы различных типов ВПЧ. Необходимость использования полноразмерных ДНК ВПЧ продиктована тем, что в разных тест-системах используются разные гены вируса в качестве мишени для амплификации. Таким образом, контрольные панели количественно охарактеризованных образцов могут служить для контроля выпускаемых серий тест-систем, а также для проведения контроля качества лабораторных исследований.
Особенности преаналитического этапа
Важным условием эффективного применения ВПЧ-тестов является стандартизация всех этапов исследования, прежде всего – процедуры получения клинического материала и сбора данных. Необходимо четко представлять, кому, как и зачем проводить исследование. Согласно международным рекомендациям по ВПЧ-тестированию, исследование по выявлению ВПЧ высокого канцерогенного риска проводят только у женщин. Материалом для исследования служит соскоб цервикального канала и/или зоны трансформации, выполненный цервикальной цитологической щеточкой. При взятии материала щетку обламывают и сохраняют рабочую часть щетки в транспортной среде до доставки в лабораторию.
ВПЧ-тесты, разработанные на основе ПЦР, позволяют контролировать адекватность клинического образца по наличию в нем ДНК человека.ВПЧ-тестирование мужчин с целью скрининга или выявления носи- тельства не рекомендуется. Инфицированность мужчин ВПЧ сходна с инфицированностью женщин, но при этом рак полового члена – крайне редкое заболевание. Поэтому мужчины являются бессимптомными носителями инфекции. С учетом того, что опасность развития ассоциированной с ВПЧ онкологической патологии у мужчин невелика, а существующие формы рака не имеют 100% ассоциации с ВПЧ, проводить скрининговое выявление папилломавирусной инфекции у мужчин не следует. Исследование возможно лишь по эпидемиологическим показаниям и при проведении дифференциальной диагностики клинической формы папилломавирусной инфекции с другими патологиями.
В заключение следует отметить, что в нашей стране на сегодняшний день созданы все условия для стандартизации и масштабного использования ВПЧ- тестов в лабораторной службе, т. к. доступны тест-системы, удовлетворяющие международным требованиям, создана сеть лабораторий для работы с этими тест-системами, налажена система обучения специалистов и разработаны панели для контроля качества работы лабораторий.
Читайте также: