Какие есть виды вирусов и бактерий
Общее описание
Вирусы находятся в атмосфере, почве, воде. Различают вирусы растений, животных, грибов, бактерий. Вирусы, поражающие бактерии, называются бактериофагами. Существуют сателлиты, которые попадают в клетку только при наличии в ней дополнительного вируса.

Рис. 1. Бактериофаг.
Большинство вирусов вызывает инфекции, некоторые виды не оказывают видимого влияния. Одним из интересных фактов является наличие остатков вирусов в ДНК человека.
Вирусы имеют разнообразную форму (шары, спирали, палочки) и мельчайшие размеры – 20-300 нм (в 1 мм 1 млн. нм). Самые крупные вирусы – мимивирусы, имеющие диаметр в 500 нм. Они имитируют строение и жизнедеятельность бактерий, и некоторые учёные считают мимивирусы переходной формой от вирусов к бактериям.

Рис. 2. Мимивирусы.
Кратко о вирусах и их отличиях от живой и неживой материи представлено в таблице.
Строение
Отличия
от неживой материи
от живых организмов
Молекулы ДНК или РНК, заключённые в плотную белковую оболочку – капсид. Сложноустроенные вирусы могут иметь дополнительную оболочку из жиров или белков
– передача наследственной информации (ДНК или РНК);
– способность к мутациям;
– способность адаптироваться к условиям окружающей среды
– Отсутствие клеточного строения;
– обладают свойствами неживой материи вне клетки;
– отсутствие обмена веществ (дыхания, питания);
– отсутствие роста и развития
Вирусы могут размножаться только внутри клетки (в цитоплазме или ядре), т.е. являются облигатными паразитами. Находясь вне клетки, вирусы кристаллизуются, превращаясь в вирионы, и могут находиться в таком состоянии долгое время.
Классификация
Вирусы выделяются в отдельное царство и классифицируются по пяти таксонам. Большинство вирусов ещё не изучено и не классифицировано.
Современная классификация включает:
- 9 отрядов;
- 127 семейств;
- 44 подсемейств;
- 782 рода;
- 4686 видов.
Биолог Дейвид Балтимор в 1971 году разработал альтернативную классификацию вирусов по особенностям генетической информации. Балтимор разграничил, какие бывают вирусы по содержанию РНК или ДНК.
Его классификацию можно объединить в три крупные группы:
- ДНК-вирусы;
- РНК-вирусы;
- Вирусы, превращающие РНК в ДНК.
Основные виды вирусов в биологии по Балтимору представлены в таблице.
Название
Класс по Балтимору
Особенности
Примеры
Двуцепочечная ДНК. Размножение в ядре клетки
Вирусы оспы, герпеса, папиллом
Одноцепочечная ДНК. Размножение в ядре
ДНК одновременно двуцепочечная и одноцепочечная
Вирус гепатита В
Двуцепочечная РНК. Размножение в цитоплазме
Одноцепочечная информативная РНК (плюс-цепь)
Одноцепочечная РНК, не несущая информацию (минус-цепь)
Одноцепочечная РНК (плюс-цепь) превращается в ДНК
Вирусы – структуры, меняющие ДНК клетки, в результате чего клетка производит новые вирусы. Когда вирусов становится слишком много, они разрывают клеточную мембрану, выходят наружу и поражают новые клетки. Иногда не убивают клетку, а отпочковываются от неё.

Рис. 3. Вирус, внедряющийся в клетку.
Что мы узнали?
Из доклада 5-6 класса узнали о строении, особенностях, классификации вирусов. Их нельзя отнести ни к живой природе, ни к неживой материи. По структуре вирусы – белки, несущие наследственную информацию, которая встраивается в живую клетку. Биолог Балтимор выделил семь классов вирусов в зависимости от особенностей строения генетического материала.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
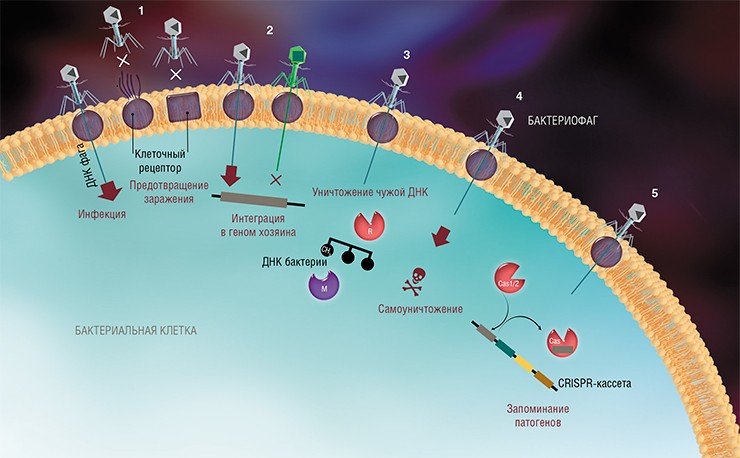
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)

Защита, точнее, вакцины от вирусов появились еще до того, как люди поняли, что такое вирус. Они понимали, что существуют инфекционные заболевания, но не видели никакой разницы между бактериями, вирусами и даже какими-нибудь амебами. По-видимому, первой появилась вакцина против натуральной оспы, которую английский врач Эдвард Дженнер создал в конце XVIII века. Во всяком случае, это первый документированный случай исследования и использования вакцины. Потом, уже в 1870-е годы, случилось другое знаменитое событие — создание Луи Пастером вакцины против бешенства. Это прекрасно работало и выглядело как настоящее чудо: совершенно неизлечимая болезнь, которую можно предотвратить и даже вылечить, если вовремя начать лечение при помощи этих вакцин.
Но при этом вакцины создавались вслепую. Никаких идей о том, что есть некий особый тип агента, который вызывает эти болезни, не было. Такие идеи стали появляться в самом конце XIX века. В 1890-е годы был такой русский ученый, Дмитрий Иосифович Ивановский, молодой тогда еще человек, который готовился защищать диссертацию, ничем особенно не примечательный. Он исследовал болезни табака и был первым, кто уделил внимание тому обстоятельству, что эта болезнь передавалась с соком больных растений. То есть возбудитель этой болезни как-то проходил через фильтры, которые не пропускают бактерии. Ивановский на самом деле не понимал, живой это организм или нет, он скорее думал, что это токсин, хотя и подозревал, что это начало каким-то образом репродуцирует себя. Но, как бы то ни было, первым описал такой объект, привлек внимание научного сообщества и стал, по сути, основателем вирусологии. А дальше довольно за короткое время был сделан еще ряд важных открытий: было показано, что многие болезни вызываются вирусами — ящур, желтая лихорадка, полиомиелит, саркома птиц.

Английский бактериолог Фредерик Туэрт в 1915 году описал в своей статье группу вирусов, инфицирующих бактерии, а французско-канадский микробиолог Феликс Д’Эрелль в 1917 году описал эти вирусы подробно и дал им название бактериофаги, то есть ‘пожиратели бактерий’, поскольку при добавлении к бактериям в питательной среде эти вирусы создают зону с мертвыми бактериями. Таким образом, к концу Первой мировой войны стало понятно, что существуют некие мельчайшие агенты, которые составляют совершенно особый класс паразитов.
Такой иммунитет исключительно эффективен. Однако включается пресловутая гонка: как только вирус меняется в соответствующей части генома, он становится устойчивым против вакцины. И чтобы восстановить иммунитет, хозяин должен заимствовать новые фрагменты измененного вирусного генома. Так что это такая фундаментальная (поскольку основана на центральном принципе в биологии — комплементарности нуклеиновых кислот) форма этой гонки вооружений.
Есть и другие способы борьбы. Многие вирусы разрабатывают специальные, так сказать, противозащитные средства. В частности, у вирусов очень часто есть некие белки, которые адаптируются к системе иммунитета и мешают ей. Очень часто происходит так, что вирус захватывает компонент хозяйской защитной системы и его же использует против нее. Этот компонент меняется и перестает работать, но воспринимается как работающий. И таким образом вирус как бы ставит хозяину палки в колеса. Это очень распространенное явление. Такая гонка вооружений ведет к разнообразию как вирусов, так и хозяйской системы защиты. Это важнейший фактор генерации разнообразия в процессе эволюции.
Очевидно, что какие-то вирусы подстраиваются под иммунную систему и продолжают борьбу, а какие-то оказываются побежденными. Но мы ничего не знаем об этих видах, которые существовали миллионы лет назад, но так и не прошли по пути эволюции. Правда, мы можем реконструировать какие-то предковые формы, которые оставили потомство, дошедшее до наших дней.
В ходе эволюции у вирусов появились и другие способы выживания. Они могут встроить свой геном в клетку хозяина и таким образом жить. Однако когда что-то плохое угрожает его существованию, вирус активируется, выходит из своего полусонного состояния, убивает хозяина и переходит к другому. Вообще говоря, в ходе эволюции победили именно те паразиты, которые умеют сочетать названные две стратегии. Это как умение правильно распределять свои ставки в казино. И очень важно понимать, что гибель хозяина или его тяжелое состояние ни в коем случае не является чем-то выгодным для паразита. Это побочный эффект его деятельности.
Размножение вирусов, как правило, не сулит ничего хорошего индивидуальным организмам. Хотя, с другой стороны, вирусы могут стимулировать иммунитет. Были даже попытки вылечить рак при помощи заражения вирусами. Но в целом в ходе эволюции паразиты и вирусы играют огромную роль, без них не было, нет и не будет никакой жизни. И вся история жизни — это история совместной эволюции взаимодействия паразитов с хозяином. И увеличение сложности защиты хозяев, совершенствование иммунной системы было бы невозможно без постоянного взаимодействия с паразитами. В частности, можно математически показать, что возникновение многоклеточных организмов стимулируется во многом именно защитой от вирусов. Многоклеточность становится выгодной тогда, когда клетки атакуются вирусом: выгодно, когда одна клетка принимает на себя удар и при помощи механизмов программируемой клеточной смерти может себя убить и избавить других от вируса. И многие другие приспособления, которые существуют у клеточных организмов, связаны либо с защитой от вирусов, либо с генетическим материалом, который хозяин получает от вируса.
Можно привести следующий пример. Есть довольно знаменитый фермент под названием теломераза — это тот фермент, который обеспечивает стабилизацию наших хромосом, как бы следит за тем, чтобы они не становились короче. Это совершенно необходимо для выживания организма, и активность этого фермента связана как со старением, так и с раком. И изначально, на заре становления эукариот, эта самая теломераза была не чем иным, как обратной транскриптазой, которая у ранних эукариот входила в состав одного из мобильных генетических элементов. И нужно всегда помнить, что наш собственный геном где-то на две трети или чуть меньше состоит из остатков мобильных генетических элементов. Большинство людей полагают, что это бесполезный мусор, но их так много, что многие из них используются для всяких нужд. Таким образом, эволюция хозяев никогда не свободна от паразитов и очень многое от них берет.
В 1971 году великий американский ученый Дэвид Балтимор предложил классифицировать вирусы в зависимости от типа геномной нуклеиновой кислоты — ДНК или РНК. Тип вируса, согласно этой классификации, определяет цикл его размножения. Но в природе эти классы распределены очень неравномерно. Если мы посмотрим, какие виды вирусов заражают разные организмы, получится интересная картина. У бактерий и архей подавляющее большинство — это вирусы, содержащие двуцепочечную ДНК. А у эукариот существенно преобладают РНК-вирусы, которых существует просто фантастическое разнообразие. Причины этих различий очень интересны, но хорошо понятны только в немногих случаях. Например, большие ДНК-содержащие вирусы не могут распространяться в растениях, они там не выживают и присутствуют только в водорослях. У высших растений их место занимают РНК-содержащие вирусы. Вот это понятие ниши как раз и определяет, по-видимому, различия в распространении вирусов. Но это не всегда можно точно понять.
Российские ученые выделили и охарактеризовали два новых бактериальных вируса, действие которых направлено на уничтожение антибиотикоустойчивых бактерий Acinetobacter baumannii , вызывающих вспышки инфекции в лечебных учреждениях. Результаты работы опубликованы в журнале Viruses .
лизис (растворение) бактериальной клетки, выход новых фаговых частиц.
Проблема внутрибольничных или нозокомиальных инфекций является одной из важнейших для современного здравоохранения. Во многих странах наблюдается рост инфекционной заболеваемости в стационарах лечебных учреждений, что существенным образом связано с распространением штаммов микроорганизмов, устойчивых к различным антибактериальным препаратам.
На сегодняшний день благодаря высокому уровню и широкому спектру природной и приобретенной резистентности к различным антибиотикам представитель бактерий рода ацинетобактер – Acinetobacter baumannii – является одним из наиболее значимых возбудителей во всем мире. В отделениях реанимации и интенсивной терапии, а также в ожоговых отделениях данный микроорганизм может явиться причиной развития разнообразных инфекционных осложнений: от госпитальной пневмонии до абсцессов мозга. Эта бактерия обладает механизмами, обеспечивающими устойчивость к подавляющему большинству антибиотиков, к дезинфицирующим средствам, высушиванию, ультрафиолетовому облучению. Ее патогенность обусловлена суммарным действием целого ряда факторов, одним из которых являются капсулярные полисахариды – поверхностные структуры, формирующие толстый защитный слой (капсулу) вокруг бактериальной клетки.
Естественным природным противником бактерий являются вирусы. Свойство определенных штаммов вирусов заражать и убивать специфичные виды бактерий - причину разнообразных инфекций, исследовали ещё в начале XX века. Бактериофаги были открыты в 1915 г. британским микробиологом Фредериком Твортом и в 1917 г. канадским сотрудником института Пастера в Париже – Феликсом Д’Эррелем. Позже, в 1934 году, Д'Эррель приехал в Советский Союз и принял участие в организации НИИ бактериофагов в Тбилиси. Но появление антибиотиков позволило надолго забыть данное направление исследований. С появлением мультирезистентных, устойчивых ко многим антибиотикам бактериальных штаммов, поиск других способов борьбы с инфекциями стал вновь актуальным. Микробиологи вновь вернулись к исследованию вирусов, называемых бактериофагами или фагами, как к альтернативе в качестве препаратов от бактериальных заболеваний.
Ученые исследовали литические бактериофаги, то есть такие, которые после заражения бактериальной клетки и периода размножения быстро разрушают бактерию, освобождая свое потомство. Использование данных фагов, а также ферментов и белков, закодированных в их генетическом материале, является одним из возможных подходов для решения проблемы распространения антибиотикоустойчивых штаммов A. baumannii и других видов бактерий.
На рисунке “Литический цикл развития вируса”: 1-2 - введение вирусной ДНК в бактериальную клетку, модификация жизнедеятельности бактерии; 3 - репликация фаговой ДНК и синтез вирусных белков; 4 - образование зрелых вирусных частиц; 5 - лизис (растворение) бактериальной клетки, выход новых фаговых частиц.
Литические фаги не влияют на нормальную микрофлору, соответственно, не вызывают развития дисбактериозных процессов; бактериофаги способны увеличивать свою численность до тех пор, пока не будут уничтожены все чувствительные к ним бактериальные клетки. Вирусы можно использовать наряду с другими антибактериальными агентами, в том числе для борьбы с множественно-устойчивыми микроорганизмами.
В исследовании двух новых бактериальных вирусов, cпецифически инфицирующих A. baumannii , участвовали ученые из МФТИ, Института антимикробной химиотерапии Смоленского медуниверситета, Государственного научного центра прикладной микробиологии и биотехнологии, Института молекулярной генетики и биологии гена РАН, Сколтеха, Института биоорганической химии им. Шемякина-Овчинникова, Санкт-Петербургского медуниверситета.
Попова Анастасия , сотрудник лаборатории разработки инновационных лекарственных средств и агробиотехнологий Центра живых систем МФТИ: “ В данной работе были выделены и охарактеризованы два новых бактериофага vB_AbaP_AS11 и vB_AbaP_AS12 (AS11 и AS12), которые были отненсены к роду Fri1virus, подсемейству Autographivirinae семейства Podoviridae. Литическая активность бактериофагов была протестирована на 100 клинических антибиотикоустойчивых изолятах A. baumannii из 53 больниц и 32 городов России и Беларуси. Было отмечено, что для данных бактериальных вирусов характерны быстрая адсорбция к бактериальной клетке-хозяину и высокий выход фагового потомства в расчете на одну инфицированную бактериальную клетку. Была изучена организация генетического материала (геномов) AS11 и AS12 и описана стратегия взаимодействия вирусов с бактериальными клетками”.
Увеличивается во всем мире и число сторонников вирусной теории рака. Исследования сотен лабораторий свидетельствуют, что именно вирусы — наиболее вероятная причина рака, саркомы, лейкемии.
И. Губарев, наш специальный корреспондент, обратился к директору Института вирусологии имени И. Д. Ивановского АМН СССР, академику АМН СССР, профессору Виктору Михайловичу Жданову с просьбой рассказать об истории и сегодняшнем дне Вирусологии, о стратегии борьбы С вирусными болезнями.
Вирусология — наука молодая. 80 лет прошло со времени открытия И. Д. Ивановским первого вируса — возбудителя мозаичной болезни табака. Много позже — в 50-х годах — было получено первое несовершенное изображение этого инфекционного агента. Самые значительные исследования в области вирусологии были выполнены лишь за последние 15—20 лет.
С исследованиями вирусологов сегодня связано уничтожение инфекционных заболеваний на планете, борьба против рака. Вирусологии же, изучающей наиболее простые формы существования, предстоит дать ответ на многие вопросы, связанные с происхождением жизни на Земле.
Итак, что же мы знаем и «его еще не знаем о вирусах?
Пример: до недавнего времени мы почти ничего не знали о специфических обезьяньих вирусах. В 1960-х годах было начато массовое производство вакцины против полиомиелита, изготавливаемой на обезьяньих почках. Необходимо было обеспечить стерильность этой вакцины, то есть полностью исключить проникновение в нее каких-либо микроорганизмов. И вот в ходе исследований, направленных на обеспечение такого рода стерильности, был открыт целый ряд до тех пор неизвестных вирусов, специфичных для обезьян.
К настоящему времени мы располагаем сведениями примерно о тысяче видах вирусов. Безусловно, лучше других нам известны вирусы, поражающие человека. Их выявлено около 500 видов. Весьма обширна группа вирусов, найденных у лабораторных животных — мышей, кроликов, морских свинок.
Сравнительно много мы знаем о вирусах сельскохозяйственных животных и растений, меньше — о вирусах, опасных для птиц и других животных, древесных и кустарниковых пород лесе. И уж вовсе малоизвестны и числом и повадками вирусы папоротников, мхов, лишайников.
Вирусы проявляют себя не всегда одинаково. В одних случаях они нападают лишь на определенные виды живых существ. Скажем, уже выявлены специфические вирусы гриппа свиней, кошек, чаек, поражающие только этих животных и безопасные для других. Подчас специализация становится своеобразно утонченной: мельчайшие вирусы бактерий — фаги Р-17 выбирают в качестве объекта лишь мужские особи только одной разновидности кишечной палочки. А вот в числе объектов онкогенных вирусов — пресмыкающиеся, птицы, млекопитающие. Рекорд побивают, пожалуй, так называемые пулевидные вирусы, названные так благодаря их характерному очертанию на микрофотографии. Внешне вирусы этой разновидности очень схожи. А болезни они вызывают самые разнообразные, поражая при этом весьма далекие друг от друга виды живых существ. Они могут стать причиной бешенства — тяжелейшего поражения нервной системы млекопитающих (в том числе, разумеется, и человека) и таких болезней, как везикулярный стоматит крупного рогатого скота (передаваемый, кстати, через насекомых), желтой карликовости картофеля и полосатой штриховатости пшеницы. Эти же вирусы провоцируют тяжелое заболевание у мухи дрозофилы, приводящее насекомое к гибели в результате повышения чувствительности к углекислому газу.
Человек, животные, насекомые, растения. Болезни общие для многих видов и узко-специфичные. Откуда такой широкий спектр агрессивных возможностей? Под влиянием каких условий сложились эти свойства? Сколько еще существует в природе вирусов специализированных и универсальных?
На все эти вопросы лишь предстоит ответить.
С вирусами связано немало загадочного, неясного, а если быть точным до конца — еще не выясненного.
Признавая существование возбудителей инфекционных болезней, по размерам намного меньших, чем бактерии, ученые долго не могли прийти к единому мнению: какие они? Так, известный голландский микробиолог М. Бейеринк, к примеру, предполагал, что вирусы — необъяснимая загадка. Он дал им название Cоntagium vivum fluidum — живое жидкое заразное начало.
Другие исследователи пытались связать данные о вирусах с привычными для них представлениями о живом организме (клеточное строение, размножение путем деления с последующим ростом до размеров взрослой особи и т. д.). Не будем перечислять здесь другие предположения, высказанные на заре развития вирусологии. Все они — как наивные, так и наделенные долей предвидения — строились на одних лишь догадках, вслепую.
Много неясного и в современных гипотезах о происхождении вирусов. Так, одни исследователи считают, что вирусы — это потомки древних доклеточных форм жизни, застывшие, остановившиеся в своем развитии на определенном этапе. Разнообразие генетического вещества, говорят сторонники гипотезы, отражает ход эволюции этих существ. Природа как бы опробовала на вирусах все возможные варианты наследственного вещества, прежде чем остановиться окончательно на двухспиральной ДНК.
Вирусы — потомки бактерий или других одноклеточных организмов, по неизвестным причинам двинувшиеся в своем развитии вспять, деградировавшие, говорят другие ученые. Возможно, некогда их устройство было сложней, но со временем они многое утратили, и их нынешнее состояние, в том числе и разнообразие носителей генетической информации, лишь отражает разные уровни деградации, которых достигли различные их виды.
Наконец, существует гипотеза, согласно которой вирусы представляют собой составные части клеток живых существ, по неизвестной причине ставшие автономными системами. Процесс возникновения вирусов, согласно этой гипотезе, относится не только к глубокой древности, когда они уже, безусловно, существовали, но и к нашему времени. Иными словами, эта гипотеза признает возможность повсеместного, происходящего непрерывно образования вирусов клеточными элементами. Возможно ли такое, способны ли составные части клеток стать автономными, да еще и саморепродуцирующимися (способными к воспроизведению) системами?
Логика и парадоксы микромира
Устройство вирусов поражает своей чисто математической завершенностью, логикой симметрии. Возьмем, к примеру, наиболее просто организованный вирион (зрелый вирус) табачной мозаики.
Сотни белковых кристаллообразных структур уложены в виде тугой спирали. Сердцевина нити, образующей спираль, представляет собой своеобразную капсулу, где находится молекула нуклеиновой кислоты. В результате общий вид вириона — предельно лаконичный цилиндр, полая трубка.
А вот другая форма: двадцатигранник, икосаэдр, грани которого образованы треугольниками. Основной материал, из которого сложен икосаэдр, — те же белковые структуры. Внутри — полость, где покоится молекула нуклеиновой кислоты. Это вирион полиомиелита.
— Позвольте, — возражали многие ученые еще в недавнем прошлом, — да можно ли вообще после этого называть вирусы живыми существами? Может быть, это кристаллообразные вещества, наделенные болезнетворными свойствами?
— Либо, — говорили другие, — это пограничные формы между живым и неживым мирами.
Кто же прав? Скорей всего наиболее многочисленная группа исследователей, которая считает, что вирусы — представители живой природы, го есть не вещества, а существа. Правда, существа крайне своеобразные, ведущие сугубо паразитический образ жизни.
Вирус проникает в клетку
Вирусы, имеющие иное строение, проникают в клетку не столь затейливым путем. Притянутые к оболочке клетки и воздействующие на нее ферментами, они провоцируют втягивание внутрь того участка мембраны, на котором осели. Образуется своего рода капсула-вакуоль с вирусной частицей внутри. Вакуоль эта затем отрывается, и в ней, путешествующей внутри клетки, продолжают идти одновременно два процесса — вирусная частица с помощью своих ферментов разрушает окутывающие ее стенки капсулы, а ферменты клетки разрушают внешние оболочки вируса, освобождая, как это было и в случае с фагом Т2, нуклеиновую кислоту.
Итак, нуклеиновая кислота покинула белковую оболочку и исчезла, бесследно растворилась в клеточной среде. Что же дальше?
Мы еще не имеем возможности получить полный ответ на этот вопрос. До сих пор удалось установить характер лишь некоторых изменений, происходящих на этом этапе в различных частях клетки. И по этим отдельным штрихам мы воссоздаем, пытаемся представить себе полностью происходящее.
Формирование вирусов начинается, по-видимому, с подавления нормальных процессов обмена веществ в клетке. Установлено, в частности, что рибонуклеиновая кислота (РНК) вируса гриппа способна синтезировать на клеточных элементах — рибосомах, ведающих выработкой белка,— особое вещество, также белковой природы,— гистон, который, в свою очередь, связывается с ДНК клетки и прекращает синтез клеточной РНК. Некоторые другие вирусы, например, вирусы полиомиелита, не нуждаются в окольном пути, так как сами способны вмешаться в деятельность рибосом и прекратить синтез клеточных белков. Выявлены и другие механизмы подавления вирусами клеточного обмена, их вмешательства в жизнедеятельность клетки, но в конечном счете все сводится к одному: клеточные ресурсы перестают расходоваться на нужды самих клеток и поступают в распоряжение вирусной нуклеиновой кислоты.
Беззащитна ли клетка!
Цикл превращений, связанных с размножением вирусов, как правило, краток. В одних случаях проникновение вирусной нуклеиновой кислоты в клетку отделяет от появления вирионов 13—15 минут, в других — 40 минут. Вирусы одной из наиболее распространенных инфекций, гриппа, проходят этот путь примерно за 6—8 часов. И каждый раз около погибшей клетки оказываются десятки, а порой и сотни вирионов. Причем каждый из них, в свою очередь, готов к продолжению процесса размножения. Количество вирусной инфекции нарастает буквально лавинообразно.
Но так как главное действующее лицо — вирус остается за кадром (в обычный микроскоп он не виден), на экране только последствия его агрессии. Картина перед наблюдателем разворачивается впечатляющая. Вначале крайние клетки, первыми подвергшиеся нападению, начинают терять свойственные им округлые очертания. Постепенно истончаются их мембраны, клеточные элементы, клетка как бы взрывается. В этот момент, как мы знаем (но не видим этого), опустошенную оболочку покидают полчища вирионов, направляющихся к очередным своим жертвам. И через самое непродолжительное время точно так же изменяются, а затем лопаются соседние клетки, за ними другие, еще и еще.
. Колония клеточной культуры как бы охвачена пламенем. Вот она рассечена обезжизненными структурами на островки. Вот сжимаются и эти островки, уменьшаются в размерах, и. все кончено. Колония разрушена дотла.
Обладай вирусы такими же возможностями в естественных условиях, и человеку и любому другому живому существу пришлось бы плохо. Однако этого не происходит, ибо на страже — отработанные за миллионы лет защитные приспособления организма, ограничивающие могущество вирусов.
Безграничному расширению вирусной агрессии препятствуют прежде всего сами вирусы. Еще в 30-х годах ученые заметили, что размножение в клетке одного вируса нередко препятствует размножению в этой же клетке другого вируса.
Кстати, если говорить серьезно, одна из многочисленных гипотез, пытавшихся объяснить это явление, так и гласила: всему причиной конкуренция вирусов, борющихся за клеточные компоненты. Без малого три десятилетия понадобилось, чтобы раскрыть существо этого явления, получившего название интерференции. И, как оказалось, в данном случае инициатива принадлежала не вирусам, а самой клетке. На проникновение вируса (чему воспрепятствовать клетка, увы, не может) она отвечает немедленной выработкой особого белкового вещества — интерферона. Правда, интерферон не спасает уже пораженную клетку, но препятствует продвижению вирусной инфекции к другим клеткам организма. Иными словами, за первыми же вирионами, прорвавшимися в организм, возникает барьер интерфероновой защиты.
Антитела, появляющиеся позже, существуют несравненно дольше. Именно они и становятся основой стойкого иммунитета, благодаря которому многие инфекционные болезни не повторяются дважды в жизни одного индивидуума.
Медицина — в наступлении
Среди инфекционных заболеваний 80 процентов вирусных. Эта цифра — свидетельство победы человека над бактериальными инфекциями. Чума, холера, тиф, некогда безоговорочно первенствовавшие в медицинских статистических сводках, с приходом антибиотиков и сульфопрепаратов навсегда сдали свои позиции. Их место заняли болезни, вызываемые вирусами.
Как известно, и с этими недугами ведется успешная борьба. Побежден полиомиелит. Тягостным воспоминанием ушла в прошлое оспа. Широким фронтом идет наступление на корь: лишь за последнее пятилетие число перенесших заболевание корью снизилось в 5 раз; на повестке дня — полное искоренение этой инфекции на территории нашей страны.
Значительные усилия направляются на борьбу с гепатитом, гриппом, паротитом, вирусными респираторными заболеваниями, однако здесь решающие достижения еще впереди.
Наряду с этим ученые работают над созданием других эффективных лекарственных веществ, способных подавить вирусную инфекцию.
Работа эта начата. Во все концы нашей страны и за рубеж отправляются специальные экспедиции вирусологов. Уже получены чрезвычайно ценные данные о перемещениях вирусной гриппозной инфекции из Всемирного противогриппового центра, в деятельность которого вносит существенный вклад региональный противогриппозный центр СССР.
Читайте также:


