Интерлейкин-28в и лечение гепатита с
Роль полиморфизмов гена интерлейкина 28В в прогнозах лечения вирусного гепатита С
Вирусный гепатит С был объявлен европейской ассоциацией по изучению печени излечимым заболеванием. Это означает, что ограниченный по времени курс лечения противовирусными препаратами назначается пациенту один раз. В результате лечения достигается элиминация вируса из крови (устойчивый вирусологический ответ – УВО), нормализация биохимических показателей крови, улучшение состояния печени по данным УЗИ и эластометрии (снижение показателей фиброза вплоть до нормальных значений).
Однако, УВО достигается не всегда. Кроме того, среди пациентов, прошедших курс стандартной противовирусной терапии, возможны рецидивы заболевания. В этих случаях назначаются повторные курсы лечения, которые часто приводят к достижению УВО.
Отсутствие адэкватного анализа, позволяющего подтвердить выздоровление, а именно удаление вируса не только из крови, но и из печеночных клеток, заставляет гепатологов искать те факторы, которые влияют на прогноз эффективности лечения. К ним относятся факторы вируса – его генотип, и факторы хозяина. Среди этих факторов есть те, на которые нельзя влиять (пол, возраст, длительность заболевания, состояние печени на момент начала лечения), а также факторы, которые можно изменить (например, масса тела и особенности метаболизма).
Как показали исследования последних лет, особое влияние на результат лечения, а также возможность самостоятельного выздоровления при заражении вирусом гепатита С, оказывают генетические факторы, особенно полиморфизмы гена интерлейкина 28В.
Интерлейкин 28В является представителем интерферонов-лямбда, или интерферонов 3 типа, обладающих сильным противовирусным действием и подавляющих репликацию вируса гепатита С. Были изучены полиморфизмы гена интерлейкина 28В, связанные с устойчивым вирусологическим ответом. При определенных генотипах достижение устойчивого вирусологического ответа достигается в 2 раза чаще.
Для оценки прогноза гепатита С чаще всего используются два основных полиморфизма: rs12979860 и rs8099917. В зависимости от нуклеотидов в этих локусах, выделены аллели C (цитозин), T (тимин), G (гуанин) и соответствующие генотипы: для аллели rs12979860 — СС, СТ, ТТ, а также ТТ, ТG, GG для аллелей rs8099917. Получены данные, что генотип интерлейкина 28В является независимым и наиболее достоверным фактором, влияющим на частоту раннего и устойчивого вирусологического ответа на ПВТ среди других факторов прогноза. При этом полиморфизмы rs12979860 отвечают за получение ответа, а полиморфизмы rs8099917 тесно связаны с отсутствием ответа на ПВТ.
Более успешные результаты ПВТ получены у больных с генотипами СС rs1297960 и ТТ rs8099917 – более 70 %, по сравнению с генотипами rs1297960 СТ и ТТ и генотипами rs8099917 GT и GG – около 30 %. Определение полиморфизмов интерлейкина 28В позволяют прогнозировать вероятность достижения УВО с чувствительностью более 60 % и специфичностью около 80 %. Благоприятными аллелями являются rs1297960 CC и rs8099917 ТТ. Все другие генотипы определяют отрицательный прогноз.
Благоприятные генотипы часто ассоциируются с большей воспалительной активностью и стадией фиброза. Кроме того, отмечена связь полиморфизма rs12979860 Т с возникновением гепатоцеллюлярной карциномы. Носительство этого аллеля расценивается как независимый фактор риска в сочетании с другими известными факторами риска.
Определение генотипа интерлейкина 28В и учет других неблагоприятных факторов прогноза противовирусной терапии позволяет искать пути повышения эффективности лечения сразу при назначении терапии. Было показано, что увеличение дозы интерферона в 2 раза у пациентов с неблагоприятным генотипом интерлейкина 28В увеличивало эффективность лечения и снижало количество рецидивов значительно в меньшей степени, чем увеличение длительности лечения до 72 недель. Более того, у больных с благоприятным генотипом и быстрым вирусологическим ответом возможно укорочение сроков лечения до 24 недель.
Таким образом, связь генотипов интерлейкина 28В с достижением устойчивого вирусологического ответа достоверна. Изучение полиморфизма гена интрлейкина 28В наряду с другими факторами прогноза дает возможность более четко определить прогноз течения инфекции и эффективности лечения. Это важный шаг к индивидуализированной противовирусной терапии, позволяющий индивидуально определять сроки лечения и дозы препаратов, и не только увеличивая их, но и уменьшая. (Лечение гепатита С)

Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности, с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы исследования
Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3 ± 10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3 ± 7,9 лет, не имеющих заболеваний печени.
В настоящем исследовании мы проанализировали однонуклеотидную замену (SNP) в гене IL-28В (rs12979860) у 190 человек (90 доноров без хронических заболеваний печени и 100 пациентов с ХГС).
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2 = 0,61; р = 0,44) и составили соответственно 42 и 36 % (рисунок). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 и 8 % (χ2 = 0,35; р = 0,55). В обеих группах преобладали гетерозиготы СТ (χ2 = 0,79; р = 0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2 = 0,64; р = 0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2 = 4,55; р = 0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
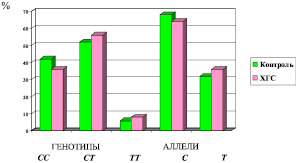
Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
Воронежская государственная медицинская академия им. Н.Н. Бурденко
Хронический вирусный гепатит С продолжает оставаться актуальной проблемой современной инфектологии. По данным Всемирной организации здравоохранения (ВОЗ), около 3% населения планеты, или около 300 миллионов человек, инфицировано гепатитом С.
Уровень инфицированности в различных регионах мира колеблется от 0,6–1,4% в США, до 4–5% в африканских странах. В России регистрируется до трех миллионов инфицированных (около 2% населения) [2]. По частоте вирусный гепатит С (ВГС) стоит на одном из первых мест среди всех инфекций, передающихся парентеральным путем [2, 3, 11]. Хронический гепатит С (ХГС) является одной из причин формирования цирроза печени и гепатоцеллюлярной карциномы [11, 12]. В последние годы в России регистрируют более 6,5 тысяч случаев первичного рака печени, причиной которого, является гепатит С [2, 7]. По этой причине ХГС - ведущая причина трансплантации печени в России и в мире [1, 11]. Проблема усугубляется тем, что в течение длительного времени для большинства инфицированных типично длительное бессимптомное течение, вплоть до цирроза печени [9].
Цель работы: изучить влияние полиморфизма гена IL-28В (rs12979860 и rs8099917) на эффективность проводимой комбинированной ПВТ у больных ХГС.
Материалы и методы. За период с 2010 по 2011 г. на базе БУЗ Областной клинической инфекционной больницы г. Воронежа обследовались и лечились 36 пациентов (19 мужчин и 17 женщин) с диагнозом ХГС. Все пациенты обследовались согласно общепринятым стандартам. Этиологическая верификация диагноза проводилась на основании обнаружения в сыворотке крови РНК вируса гепатита С с помощью полимеразной цепной реакции (ПЦР). ПЦР-диагностика проводилась в режиме real-time, чувствительность использованных тест-систем (РНК HCV Амплисенс) составляла 50 копий/мл. Всем больным проводилось определение генотипа НСV. Из числа обследованных больных генотип 1в обнаруживался у 25 пациентов, 3а был зафиксирован у 11 человек. При необходимости у больных проводилось количественное определение РНК HCV в крови. Количество вируса в сыворотке крови наблюдалось в широких пределах от 2,9х103 до 3,7х106.Также определялись серологические маркеры (а-HCV-IgG, а-HCV-IgM) с использованием иммуноферментного анализа (ИФА).
Средний возраст больных составил 54,1±18,7 лет. Продолжительность болезни, по данным эпидемиологического анамнеза, составил от 1 до 13 лет.
В биохимическом исследовании крови у всех больных ХГС показатели сывороточных аминотрансфераз были выше нормы. Большинство пациентов (72,2%) имели уровень аланинаминотрансферазы (АЛТ) до 3 норм. Показатели АЛТ до 5 норм выявлены у 22,2% пациентов. Высокая активность АЛТ (более 5 норм) была обнаружена только у 5,5% пациентов. У всех исследуемых больных регистрировались различные сопутствующие соматические заболевания. Чаще всего отмечалась патология желудочно-кишечного тракта (хронический панкреатит, дуоденит, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки). Эта группа заболеваний выявлена у 83,3% больных ХГС. Патология желчевыводящих путей, такие как, дискинезия желчевыводящих путей и хронический холецистит наблюдались у 75% пациентов. Болезни сердечно-сосудистой и эндокринной систем встречалась у 58,3% и 11,1% соответственно. При ультразвуковом исследовании у всех больных наблюдались гепатомегалия и диффузные изменения печени.
Всем больным была выполнена пункционная биопсия печени (ПБП) по Mengini дважды (до и после лечения противовирусными препаратами). Проводился морфологический анализ полученных гистологических препаратов, оценивая параметры активности гепатита по R.G. Knodell с соавторами (1981) [10] и фиброза по V. Desmet (1995) [6] с использованием систем METAVIR. Минимальная степень активности (1–3 балла) была зарегистрирована у 66,7% пациентов, низкая степень активности (4–8 баллов) наблюдалась у 27,8% больных, умеренная степень активности (9–12 баллов) выявлялась реже – в 5,5% случаев. Гистологическая активность более 13 баллов выявлено не было. У большинства больных фиброз отсутствовал или был слабо выражен. С фиброзом 0 баллов наблюдалось 52,8% пациентов. Слабый фиброз был выявлен у 22,2%, умеренный и тяжелый фиброз наблюдался в 8,3% случаев. Цирроз печени выявлен у 16,6% исследуемых больных. Помимо этого, у 30,6% (11 пациентов) дополнительно была проведена фиброэластометрия ткани печени на аппарате Fibroscan FS-502 (Echosens, Франция) с выявлением стадии фиброза по шкале Metavir. Из них степень фиброза F0 была выявлена у 63% пациентов, F2 – у 27,3%, F4 – у 9% больных.
Помимо общеклинических методов обследования, у всех больных проводилось полное серологическое обследование на маркеры вирусных гепатитов В, D, HIV с использованием методов ИФА, проводилось определение содержания α-фетопротеина, концентрации железа и меди в сыворотке крови. У всех больных в анамнезе была проведена комбинированная ПВТ (20 пациентов получали лечение с использованием препаратов интерферона короткого действия и 16 человек – пегилированные интерфероны). Обе схемы лечения включали в комплексную терапию рибавирин. Длительность терапии составила 24 и 48 недель в зависимости от генотипа HCV. Достижение устойчивого вирусологического ответа (УВО) оценивалось как показатель эффективности терапии. УВО – неопределяемый уровень РНК HCV в сыворотке крови через 24 недели после прекращения терапии [5]. Всем пациентам было проведено определение полиморфизма гена IL-28В (rs12979860 – генотипы CC, CT, TT и rs8099917 – генотипы TT, TG, GG) с помощью ПЦР в режиме реального времени. Все больные исследуемых групп были рандомизированы по основным клинико-лабораторным показателям.
При статистической обработке результатов исследования, имеющих нормальное распределение, количественные признаки выражались как М±s (среднее ± стандартное отклонение). Во всех выборках проверяли гипотезу нормальности распределения по критерию Колмогорова-Смирного. Для оценки достоверности различий выборок использовали непараметрический критерий Манна-Уитни. Все различия считались достоверными при значении р
Список использованных источников:
1. Влияние полиморфизма интерлейкина 28В на раннюю кинетику HCV у больных, получающих противовирусную терапию после ортотопической трансплантации печени/ В.Е. Сюткин и др.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2011. - №6. – С. 49–55.
2. Дерябин П.Г. Распространение гепатита С в России становится социальной проблемой// СанЭпидемКонтроль. – 2009. - №4. – С. 34-38.
3. Исаков В.А. Современная терапия хронического вирусного гепатита С: какая длительность комбинированной терапии оптимальна и почему?// Клиническая гастроэнтерология и гепатология. – 2009. - №2. – С. 9-12.
4. Роль полиморфизма гена интерлейкина 28В в оценке эффективности противовирусной терапии хронического гепатита С / Т.Н. Лопаткина, И.С. Кудлинский// Клиническая гепатология. – 2011. - №2. – С. 28-38.
5. Современные схемы лечения больных хроническим гепатитом С/ В.Т.Ивашкин и др. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2012. - №1. – С. 36–44.
6. Классификация хронического гепатита: диагностика, определение степени тяжести и стадии течениям V. Desmet, M. Gerber, J.H. Hoofnagle / Российский журнал гастроэнтерологии, гепатологии, колопротологии. – 1995. № 2. - Р. 38-45.
7. Deuffic–Burban S. Impact of pegylated interferon and ribavirin on morbidity and mortality in patients with chronic hepatitis C and normal aminotransferases in France// Hepatology. – 2009. - №50. – P. 1351-1359.
8. Development of novel treatment for hepatitis C D.P. Webster et al. / Lancet. – 2010. - №45. – P. 349-355.
9. Empirically calibrated model of hepatitis C virus infection in the United States J. Salomon et al.// Am J Epidemiol. – 2002. - №156. – P. 761-773.
10. Formulation and application of numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis/ R.G. Knodell, K.G. Ishak// Hepatology. – 1981. - №1. - Р. 431-435.
11. Global epidemiology of hepatitis C virus infection/ C. Shepard, L. Finelli, M. Alter// Lancet. – 2005. №5. – P. 558-567.
12. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide/ J. Perz, G. Armstrong, L. Farrington// Hepatology. – 2006. - №45. – P. 529-538.
Синонимы: ДНК-диагностика прогноза эффективности терапии гепатита С (IL-28B); определение полиморфизмов, ассоциированных с функциями интерлейкина 28В.
Связанные тесты: определение РНК ВГС, генотипирование ВГС.
Известно, что особое влияние на результат лечения препаратами интерферона, а также возможность самостоятельного выздоровления при заражении вирусом гепатита С, оказывают генетические факторы, в частности полиморфизм гена интерлейкина 28В.
Исследование позволит вашему врачу:
- определить вероятное течение и исходы ВГС – инфекции;
- в совокупности с результатами других исследований определить тактику лечения пациента;
- прогнозировать эффективность проводимой терапии.
Исследование рекомендуется проводить:
- при выборе терапии ВГС – инфекции.
Метод:
Полимеразная цепная реакция (ПЦР) в режиме реального времени с анализом кривых плавления.
Материал для исследования:
Подготовка к исследованию
Исследование рекомендуется проводить натощак; между последним приёмом пищи и взятием крови должно пройти не менее 6 часов.
Особые условия:
Предварительная запись не требуется.
Формат выдачи результата:
Комментарий:
| Полиморфизм | Генотип | Возможные проявления генотипа |
|---|---|---|
| IL28B C > T [rs12979860] | С/С |
|
| С/Т | 20-40% пациентов с ХГС отвечают на лечение | |
| Т/Т | 20-25% пациентов с ХГС отвечают на лечение | |
| IL28B T > G [rs8099917] | Т/Т | Возможно спонтанное разрешение инфекции |
| G/T | Сниженный ответ на терапию интерфероном и рибавирином | |
| G/G | Низкий ответ на терапию интерфероном и рибавирином |
Изучение полиморфизма гена интерлейкина 28В наряду с другими факторами прогноза дает возможность более четко определить прогноз течения инфекции и эффективность лечения вирусного гепатита С.
Цены на определение маркеров риска развития состояний/заболеваний
| Исследования | Стоимость, руб. | Срок выполнения | |
|---|---|---|---|
| Маркеры, ассоциированные с риском развития гипертонии (ADD1, AGT, AGTR1, AGTR2, CYP11B2, GNB, NOS3) | 39.45 | До 14 дней |  |
| Маркеры, ассоциированные с риском развития тромбофилии (F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI – 1) | 43.41 | До 14 дней |  |
| Маркеры, ассоциированные с нарушением фолатного цикла (MTHFR, MTR, MTRR) | 31.94 | До 14 дней |  |
| HLA-типирование II класса DRB1 | 68.06 | До 14 дней |  |
| HLA-типирование II класса DQA1 | 57.92 | До 14 дней |  |
| HLA-типирование II класса DQB1 | 69.09 | До 14 дней |  |
| Делеции AZF региона | 35.94 | До 14 дней |  |
| Маркеры, ассоциированные с риском развития рака молочной железы (BRCA 1,2) | 51.60 | До 14 дней |  |
| Маркеры, ассоциированные с эффективностью терапии гепатита С (интерлейкин 28В) | 19.62 | До 14 дней |  |
| Маркеры, ассоциированные с метаболизмом варфарина | 26.63 | До 14 дней |  |
220068, Республика Беларусь,
г. Минск, ул. Червякова 64
E-mail: mail@biomedica.by
Лицензия №02040/6344 от 26 марта 2010г
Время работы центра:
Понедельник - пятница:
08:00 - 20:00
Суббота: 08:00 - 16:00
Воскресенье: выходной
Аннотация научной статьи по клинической медицине, автор научной работы — Фазылов Вильдан Хайруллаевич, Ткачева Светлана Васильевна, Манапова Эльвира Равилевна, Созинова Юлия Михайловна
Похожие темы научных работ по клинической медицине , автор научной работы — Фазылов Вильдан Хайруллаевич, Ткачева Светлана Васильевна, Манапова Эльвира Равилевна, Созинова Юлия Михайловна
The identification of options interleukin 28b gene polymorphism as a predictor of effective antiviral therapy for chronic hepatitis C
определение варианта полиморфизма гена интерлейкина 28в как предиктора эффективности противовирусной терапии хронического гепатита с
ЭльвирА рАВилЕВнА МАнАпоВА, канд. мед. наук, ассистент кафедры инфекционных болезней
Ключевые слова: гепатит С, ген ИЛ-28В, противовирусная терапия, интерферон-а, рибавирин.
THE iDENTiFicATioN oF opTioNs iNTERLEuKiN 28B GENE polymorphism as a predictor of effective antiviral therapy for chronic hepatitis c
VILDAN кн. FAzuloV, SVETLANA V. TKACHEVA, ELVIRA г. MANApoVA, JuLIA M. SoHNoVA
Key words: hepatitis C, the gene IL-28B, antiviral therapy, interferon-а, ribavirin.
Комбинированная противовирусная терапия (ПВТ) хронического гепатита С (ХГС) пегилиро-ванными интерферонами-а (ПегИФН-а) и рибавирином (РИБ) остается стандартом лечения моноинфициро-ванных наивных пациентов, но является дорогостоящей и малодоступной [1, 2]. Индукционное введение стандартных ИФН-а, хотя и не относится к современным международным стандартам, но часто и не без успеха используется в практической медицине [3, 4]. В ежедневной схеме лечения стандартными ИФН-а сохраняется оптимальный баланс между противовирусной активностью и длительностью периода их по-лувыведения. Проведенные исследования показывают удовлетворительную переносимость приема индукционных доз стандартных ИФН-а, а при возникновении побочных реакций — возможность модификации доз, а также сопоставимость результатов по достижению стойкого вирусологического ответа (СВО) при использовании ПегИФН-а [3]. В последние годы ведется поиск предикторов эффективности ПВТ. Наряду с вирусной нагрузкой, генотипом вируса, стадией фиброза все большее внимание клиницистов привлекает возможность персонифицированного подхода к лечению заболевания, основанного на проведении генотипиро-вания самого хозяина и, таким образом, определения предрасположенности к исходу терапии. Полиморфизм ге12979860 и ге8099917 генов интерлейкина 28В (ИЛ-28В) оказывает существенное влияние на частоту достижения устойчивого вирусологического ответа. У пациентов белой расы — носителей генотипа СС (т.е. гомозиготы по аллели С) регистрируется 2-кратная разница (95%, ДИ 1,8-2,3) в частоте достижения СВО по сравнению с носителями генотипов СТ и ТТ полиморфизма М2979860 гена ИЛ-28В [5]. Данные пилотного ретроспективного исследования в группе больных ХГС в России [6] также продемонстрировали предварительные результаты, свидетельствующие о существенном значении вариантов полиморфизма гена ИЛ-28В как ^12979860, так и ге8099917 в достижении СВО в результате ПВТ.
Цель исследования — оценить эффективность индукционного метода введения стандартных интер-феронов при проведении комбинированной противовирусной терапии ХГС с учетом генотипирования пациента по ИЛ-28В.
Материал и методы. Под наблюдением находилось 89 больных (53% женщин и 47% мужчин) ХГС в возрасте (30,4±1, 1) года, ранее не получавшие ПВТ, с длительностью инфицирования (4,7±0,49) года; средний ИМТ составил (24,12±0,12) кг/м2. Исходные показатели активности НС^инфекции определялись высокой вирусной нагрузкой (РНК Н^>400 000 МЕ/ мл) у 55 (62%) больных, 1-м генотипом (НС^1) у 50 (56,1%) пациентов и уровнем аланинаминотрасферазы (АлАТ), который составил (68,6±7,90) Ед/л [у мужчин — (81,85±13,07) Ед/л; у женщин — (51,32±7,99) Ед/л при N=(22,6^1,26) и (19,23±1,27) Ед/л соответственно].
Пациенты получали ПВТ отечественными препаратами: а-ИФН2Ь индукционным методом по 5 млн ЕД/сут в течение 12 нед, затем по 3 млн ЕД/сут до окончания лечения в сочетании с рибавирином (дозы зависели от массы тела: 800—1200 мг/сут). Длительность ПВТ составляла 24—48 нед в зависимости от генотипа НСУ В случае отсутствия вирусологического ответа на 24-й нед лечения у больных НС^1 терапия отменялась.
В исследование не включались лица с аутоиммунными и другими хроническими декомпенсированными системными заболеваниями; пациенты с микст-гепатитами; с циррозом печени, а также имеющие степень фиброза больше F3 (по результатам пункционной биопсии печени или фиброэластометрии по шкале METAVIR); больные с алкогольной болезнью или принимающие алкоголь, психоактивные вещества (ПАВ); с нейтропенией Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ВО, 48-я нед., n=11 6 (100%) — 5 (55,6%) — 9 (81,8%) — 2 (66,7%) —
СВО, n=20 5 (83,3%) 3 (75%) 4 (44,4%) 8 (80%) 6 (54,5%) 6 (75%) 2 (66,7%) 6 (85,7%)
1-м генотипом — 7 (77,8%). При анализе распределения больных по генотипам ИЛ-28 оказалось, что благоприятные варианты генотипов СС полиморфизма rs12979860 и ТТ полиморфизма rs8099917 в 1-й группе зарегистрированы у 8 (40%) и 12 (60%) пациентов, а во
Частота достижения БВО, РВО, ВО на 24-й и 48-й нед ПВТ, СВО в зависимости от полиморфизма генотипов rs12979860 и rs8099917 гена ИЛ-28В и генотипов HCV представлена в таблице. Максимальная частота вирусологического ответа получена у пациентов с HCV-1, имеющих генотипы СС rs12979860 и ТТ rs8099917 ИЛ-28В (БВО — 66,7 и 54,5%; РВО — 100 и 100%; СВО — 83,3 и 54,5% соответственно).
Заключение. На основании вышеизложенного, индукционный метод применения стандартных с(-ИФН2Ь в сочетании с рибавирином для противовирусной терапии ХГС является эффективным: СВО получен у 70,8% пациентов (у 52,9% больных с 1-м генотипом и 95,8% с 2-м и 3-м генотипами) c достижением биохимического ответа у 100% больных, ответивших на лечение, к 24-й нед диспансерного наблюдения. Наиболее эффективной терапия была у пациентов с HCV-1 при благоприятных генотипах СС rs12979860 и ТТ rs8099917 по ИЛ-28В. Необходимо подчеркнуть, что данные о ПЕН rs12979860 и rs8099917 не могут быть инструментом решения вопроса о назначении ПВТ или отказе от ее проведения, они позволяют лишь более точно определить шанс больного на излечение от ХГС при использовании конкретной схемы терапии. Результаты исследований генотипов по ИЛ-28 в сочетании с финансовой доступностью отечественных препаратов при индукционном методе ПВТ снижают экономические затраты на лечение больных ХГС.
1. Абдурахманов, Д.Т. Противовирусная терапия хронического гепатита С: этапы развития / Д.Т. Абдурахманов // Клиническая гепатология. — 2009. — № 2. — С. 26—33.
2. Моисеев, С.В. Лечение хронического гепатита С: результаты рандомизированных контролируемых исследований / С.В. Моисеев // Инфекционные болезни. — 2010. — Т. 8, № 3. — С.52—57.
3. Еналеева, Д.Ш. Хронические вирусные гепатиты В, С и D / Д.Ш. Еналеева, В.Х. Фазылов, А.С. Созинов. — М.: Медпресс-информ. — 2011. — 463 с.
4. Никитин, И.Г. Человеческий лейкоцитарный альфа-интерферон в комбинированной терапии больных хроническим гепатитом С, инфицированных не 1-м генотипом вируса/ И.Г. Никитин, Л.М. Гогова, И.Е. Байкова [и др.] // Клинические перспективы гастроэнтерологии и гепатоло-гии. — 2009. — № 1. — С.33—37.
5. Genetic factors and hepatitis C virus infection/ A.J. Thompson // Gastroenterology. — 2012. — Vol. 142. — P.1335—1339.
6. Козина, А.Н. Возможности персонифицированного подхода к лечению гепатита С на основании разработанных генетических тестов определения варианта полиморфизма гена ИЛ-28 / А.Н. Козина, Д.Д. Абрамов, Е.А. Климова [и др.] // Лечащий врач. — 2011. — №10. —
Читайте также:


