Ингибиторы вируса что это

Для лечения гриппа и других ОРВИ АМИКСИН ® может применяться у взрослых и детей с 7 лет.
Узнать подробнее про АМИКСИН ® …

Противовирусный препарат АМИКСИН ® направлен на борьбу с большинством распространенных респираторных вирусов, включая вирусы гриппа.
Узнать больше…

Современные противовирусные препараты, такие как АМИКСИН ® , могут способствовать снижению риска развития осложнений на фоне гриппа и других ОРВИ.
Подробнее…


Для лечения гриппа и других ОРВИ у детей старше 7 лет АМИКСИН ® выпускается в дозировке 60 мг.
Узнать подробнее о детском "Амиксине"…

АМИКСИН ® обладает не только иммуностимулирующим, но и противовирусным действием за счет подавления трансляции вирус-специфических белков.
Узнать подробнее…

Вирусы гриппа и других ОРВИ способны формировать устойчивость к некоторым противовирусным препаратам. АМИКСИН ® способствует стимулированию собственных ресурсов организма на борьбу с инфекцией…
Читать подробнее…

Механизм действия противовирусных средств
Иммунная система умеет распознавать зараженные клетки, поэтому многие противовирусные лекарственные средства направлены на стимулирование собственного иммунитета. Они называются иммуностимуляторами (иммуномодуляторами).
Вообще, создание эффективного противовирусного средства — задача нетривиальная, поскольку вирусы паразитируют внутри клеток, и как в этом случае уничтожить пришельца, не нанеся вреда организму хозяина?
На сегодня в России чаще всего применяется клинико-фармакологическая классификация, означающая, что разделение препаратов на группы производится в зависимости от того, на какие именно виды вирусов они воздействуют [2] . Внутри каждой узкоспециализированной группы препаратов обычно приводится классификация противовирусных средств по механизмам их действия. Давайте изучим вопрос на конкретном примере:
Как можно убедиться, спектр противовирусных лекарственных средств весьма широк. Большую его часть составляют препараты прямого противовирусного действия (ПППД), что означает их специфичность, направленность на конкретные виды вирусов. Однако эти лекарства зачастую оказывают разрушающее воздействие не только на геном вируса и его способность к репликации (размножению), но и на здоровые клетки хозяина. В общем случае можно констатировать, что чем мощнее противовирусный препарат, тем больше у него побочных эффектов. Это обязательно следует учитывать.
В то же время существует категория противовирусных средств неспецифичного (широкого) спектра действия. Преимущественно, это иммуностимуляторы (иммуномодуляторы), призванные активизировать резервные силы организма для борьбы с самыми разнообразными вирусами и другими микроорганизмами.
Итак, вот пример некоторых противовирусных препаратов, разрешенных детям:
Ограничения по возрасту могут быть вызваны не только составом средства, но и его формой выпуска. Например, таблетки не рекомендуются для приема детям до 3 лет, а капсулы — до 7 лет.
- прикрепление вирусов к клеткам;
- проникновение их в клетки;
- размножение;
- выход из клеток.

Рис. 1. Сравнение взаимодействия ранее изученного антитела человека FI6v3 и разработанного пептида с частицами вирусов гриппа. Совмещение молекул демонстрирует сходство и различия в том, как антитело (лиловое) и синтезированный пептид (желтый) связываются с гемагглютининовым рецептором вирусов H1 (А) и H3 (B). Оба типа рецепторов, характерные для различных штаммов вируса, связываются с антителом и синтетическим пептидом за счет остатка аминокислоты триптофана (Trp 21 ), положение которого в первичной структуре геммагглютининов Н1 и Н3 одинаково. Рисунок из обсуждаемой статьи в Science
Международная группа исследователей из США, Бельгии и Нидерландов разработала искусственные пептиды, способные нейтрализовать широкий спектр вирусов гриппа, включая штамм H1N1, вызвавший пандемию 2009 года, и штамм высокопатогенного птичьего гриппа H5N1. Эти пептиды могут стать новым оружием в борьбе человечества с гриппом, только сезонные эпидемии которого, по оценкам Всемирной организации здравоохранения, ежегодно приводят к 3–5 миллионам случаев тяжелой болезни и госпитализации и 250 000–500 000 случаев смерти во всем мире.
Существующие в настоящее время способы лекарственной терапии гриппа основаны на воздействии на два белка вируса — канал M2 и нейраминидазу (NA). Оба эти белка важны для нормальной организации жизненного цикла вируса. Белковый канал M2 бывает задействован на ранней и поздней стадиях репликации вируса, а нейраминидаза участвует в высвобождении дочернего поколения вирионов. Но мутации вирусов гриппа приводят (и уже привели) к появлению резистентных штаммов, против которых существующие противовирусные препараты (даже самый эффективный из существующих на настоящий момент — осельтамивир) оказываются малоэффективными. Эти обстоятельства приводят к необходимости разработки новых способов борьбы с вирусами гриппа. Предполагается, что более эффективными могут оказаться стратегии, опирающиеся на применение препаратов, молекулярной мишенью которых будут белки-гемагглютинины (НА) вируса гриппа.
Гемагглютинины — поверхностные белки вируса гриппа, обеспечивающие способность вируса присоединяться к инфицируемой клетке. Возможно, неспособность вируса внедриться в клетку-хозяина снизит вероятность образования устойчивых к противовирусным препаратам мутирующих вирусов: вирусы способны размножаться, только паразитируя в клетках, и не попавший в живую клетку вирус будет лишен возможности воспроизводить себя.
Инфицирование вирусом гриппа начинается с того, что гемагглютинины вируса связываются с поверхностью клетки-хозяина. Вирусный гемагглютинин представляет собой гликопротеид (сложный белок, в котором с цепью, состоящей из аминокислотных остатков, связан углеводный фрагмент). После контакта с клеткой гемагглютинин изменяет свое пространственное строение, фактически внедряясь в клеточную мембрану, что, в свою очередь, обеспечивает проникновение вируса внутрь клетки, где он и начинает свой цикл размножения

Рис. 2. Общий мотив строения синтезированных циклических пептидов. Цепь пептида состоит из протеиногенных аминокислот — лейцин (L), глутаминовая кислота (Е), тирозин (Y), фенилаланин (F), триптофан (W), серин (S), а также аминокислоты, не входящие в состав белковых молекул: орнитин (диаминовалениановая кислота, Orn) и β-аланин (XD), R — алкильный остаток. Черным цветом обозначена цепь, состоящая из протеиногенных аминокислот, зеленым и красным — участки цепи синтезированного циклического пептида, не характерные для обычных пептидных цепей. С гемагглютинином вируса гриппа циклический пептид связывается преимущественно за счет остатка фенилаланина. Рисунок из обсуждаемой статьи в Science
Ряд спроектированных структур был синтезирован, и после определения их пространственного строения и испытаний на предмет связывания с вирусами исследователи остановились на четырех циклических (обладающих замкнутой цепью, рис. 2) пептидах, каждый из которых обладает свойствами, которые позволяют говорить о его потенциальном применении в качестве блокаторов функций вирусов. Выбранная четверка пептидов демонстрирует прочное связывание с гемагглютининами широкого набора штаммов вирусов гриппа типа А. Синтетические пептиды, как и антитела человека, по образу и подобию которых они были созданы, связываются с остатком аминокислоты триптофана в структуре гемагглютинина вируса. Примечательно, что структура участка, на котором расположен этот триптофановый фрагмент практически не различается для разных штаммов гриппа, поскольку именно этот участок играет ключевую роль в проникновении вируса через оболочку клетки-хозяина.
Основное преимущество разработанных в ходе исследования пептидов по сравнению со ставшими для них образом и подобием антителами заключается в гораздо меньших размерах. Это обеспечивает и дешевизну их получения по сравнению с антителами, и сделает более эффективной усвояемость лекарства при пероральном и инъекционном приеме. Чтобы синтезированные пептиды были устойчивы к действию ферментов, способных ускорять гидролитическое расщепление веществ с аналогичной структурой в крови, в них были введены остатки β-аланина и диаминовалериановой кислоты (орнитина) — аминокислот, не кодируемых в ходе синтеза белковых цепей на рибосоме. Циклическая структура синтезированных пептидов, отсутствие у них характерных для линейных и разветвленных белковых молекул C- и N-конца также способствует устойчивости к гидролизу.
Осельтамивир и занамивир были складированы во многих странах для лечения и профилактики сезонного и пандемического гриппа, [чтобы использовать] до того как вакцина против гриппа, соответствующая циркулирующему вирусу, станет доступной. Осельтамивир классифицируется Всемирной организацией здравоохранения как основное (жизненно-важное) лекарственное средство.
Какие подходы к этому обзору использовались
Мы обновили и объединили наши обзоры по противовирусным средствам занамивир и осельтамивир при гриппе у взрослых и детей на основании отчетов производителей в регуляторные органы (отчеты о клинических исследованиях) и комментариев регуляторов. Мы назвали эти комментарии и отчеты "регуляторная информация'. Отчеты о клинических исследованиях не опубликованы, это обширные документы с очень подробными деталями испытаний, которые сформировали базу для маркетингового одобрения. Они включают в себя протоколы, методы и результаты. Отчеты о клинических исследованиях до сих пор были конфиденциальными, их видели только производители и регуляторы.
Почему мы предприняли этот подход
В предыдущих версиях этого обзора мы выявили неразрешенные несоответствия в данных, представленных в опубликованных отчетах по клиническим испытаниям, и существенную предвзятость публикаций (публикационное смещение). Исходя из этого, мы решили не использовать данные из журнальных статей, а включили документы, созданные во время процессов лицензирования (маркетингового одобрения). Мы получили доступ к таким данным из Великобритании, США, Европейского лекарственного агентства (EMA), от японских регуляторов и к отчетам по клиническим исследованиям от производителей (после затяжной кампании в средствах массовой информации). Это позволило нам проверить информацию из рандомизированных плацебо-контролируемых клинических испытаний на взрослых и детях с подтвержденным или предполагаемым контактом с естественно встречающимся гриппом.
Исходя из наших оценок регуляторных документов (более 160 000 страниц), мы пришли к выводу, что были существенные проблемы с дизайном, проведением, отчетностью и доступностью информации во многих из этих клинических испытаний.
Мы использовали в этом обзоре данные из 46 клинических испытаний (20 по осельтамивиру и 26 исследований по занамивиру). Мы определили проблемы в дизайне многих исследований, которые мы включили, и которые отразились на нашей уверенности в их результатах. Мы обнаружили, что оба лекарства сокращали продолжительность симптомов гриппоподобного заболевания (неподтвержденный грипп или "грипп") менее, чем на один день. Осельтамивир, на основании данных от всех людей, включенных в клинические испытания по лечению осельтамивиром, не влиял на число госпитализаций. Клинические испытания по занамивиру этот исход не регистрировали. Сообщения о влиянии на пневмонии и другие осложнения гриппа, такие как бронхит, инфекции среднего уха (средний отит) и синуситы, были не надёжны, как показали истории болезни по документам клинического испытания. Некоторые формы показали ограничения (проблемы) диагностических критериев пневмонии. Регуляторные комментарии отметили проблемы с недостающими дневниками наблюдения у участников. У детей с астмой не было ясного влияния на время до первого облегчения симптомов.
Клинические испытания по профилактике (заболевания) показали, что осельтамивир и занамивир снижали риск симптоматического гриппа у отдельных лиц и в семье. Не было доказательств влияния на бессимптомный грипп или на не грипп, на гриппоподобные заболевания, но проблемы в проведении испытаний препятствуют любому определённому заключению.
Применение осельтамивира было связано с тошнотой, рвотой, головными болями, почечными и психиатрическими событиями; последние три случались, когда его [осельтамивир] применяли для профилактики гриппа. Его [осельтамивира] действие на сердце остается неясным: он может уменьшать симптомы со стороны сердца, но может и вызывать серьезные проблемы сердечного ритма. В клинических испытаниях занамивира у взрослых не было повышенного риска по сообщённым неблагоприятным событиям. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные.
Соответствие другим результатам
Отсутствие качественных доказательств, демонстрирующих влияние на осложнения [гриппа], согласуется с осторожными выводами по обоим лекарствам, сделанными Администрацией по контролю за лекарствами и пищевыми продуктами США (FDA). FDA разрешила заявления только по эффективности обоих лекарств в профилактике и лечении симптомов гриппа, но не по другим эффектам (в том числе прерывание распространения вируса от человека к человеку или профилактика пневмонии). FDA описала эффективность обоих препаратов в целом, как "скромную".
Механизм развития благоприятных эффектов
Эти результаты позволяют предположить, что низкий иммунный ответ с низким уровнем прововоспалительных цитокинов, вызванный действием осельтамивира карбоксилата, может уменьшать симптомы гриппа, не связанные с подавлением размножения (репликации) вируса гриппа. Потенциальный гипотермический или жаропонижающий эффект осельтамивира как депрессанта центральной нервной систем, также может вносить вклад в очевидное сокращение симптомов пораженного организма. Заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими данными, к которым мы имели доступ.
Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.
В структуре острых респираторных вирусных инфекций (ОРВИ) грипп занимает ведущее место по показателям тяжелых форм клинического течения, госпитализации, развития осложнений и летальности в период как эпидемий, так и пандемий [1–3].
С появлением и быстрым распространением в 2009 г. нового вируса гриппа A(H1N1)pdm09 изменилась структура циркулирующих штаммов, а также их долевое участие в последующих эпидемических сезонах [4, 5]. В странах Северного полушария в сезонах 2009–2010, 2010–2011, 2012–2013 и 2015–2016 гг. доминировал вирус гриппа A(H1N1)pdm09. Следует отметить, что вирус гриппа A(H1N1)pdm09 низкочувствителен к препаратам адамантанового ряда (римантадину и амантадину). Вирус гриппа A(H3N2) не циркулировал только в сезоне 2009–2010 гг. и проявлял максимальную активность в сезонах 2011–2012 и 2014–2015 гг. Вирус гриппа B наблюдался в период всех семи сезонов и значительную долю в структуре циркулирующих вирусов гриппа занимал в сезонах 2014–2015 и 2015–2016 гг.
Деятельность экспертов Всемирной организации здравоохранения (ВОЗ) предполагает, в частности, мониторинг чувствительности циркулирующих штаммов к применяемым на практике препаратам, оценку их эффективности в лечении и профилактике, а также разработку и внедрение новых форм. Названные направления имеют значение для диверсификации запасов антивирусных препаратов во избежание появления резистентных к ним штаммов и закрепления последних в популяции циркулирующих вирусов гриппа.
В настоящее время ингибиторы нейраминидазы являются референтными и рекомендованы ВОЗ для лечения и профилактики гриппозной инфекции, обусловленной сезонными вирусами гриппа и новым вирусом гриппа с пандемическим потенциалом. Ингибиторы нейраминидазы эффективны также в отношении высокопатогенных вирусов гриппа птиц A(H5N1), A(H7N9) и A(H5N6), случаи инфицирования которыми в последнее время зарегистрированы среди людей [6, 7].
Разработка данной группы препаратов относится к целевым достижениям ученых, которые использовали современные данные о структуре и свойствах одного из поверхностных белков вируса гриппа – нейраминидазы, выполняющей роль и антигена, и фермента [8]. Препараты с антинейраминидазной активностью имитируют структуру натуральных субстратов каталитического сайта нейраминидазы, привлекая вирус к большему взаимодействию. Это не позволяет нейраминидазе действовать в роли фермента для высвобождения из конгломерата на поверхности клетки-хозяина новых поколений вируса, в результате чего предотвращается их распространение на восприимчивые клетки.
Первые официальные сообщения о новых препаратах с антинейраминидазной активностью появились в 1993 г. (занамивир) и 1997 г. (осельтамивир). Практическое применение препаратов началось в 1999 г. При этом осельтамивир быстро завоевал позиции препарата выбора в лечении гриппозной инфекции в период эпидемий и создании резерва на случай пандемии [6]. Причиной тому в определенной степени послужила высокая частота резистентных к римантадину и амантадину штаммов высокопатогенного вируса гриппа птиц A(H5N1), инфицировавших людей в период 2003–2004 гг. С появлением в 2007 г. резистентных к осельтамивиру штаммов вируса гриппа A(H1N1) эксперты ВОЗ изменили рекомендации в отношении подготовки к пандемии, дополнив перечень используемых препаратов занамивиром.
В России с 2001 г. осельтамивир (Тамифлю®) разрешен для лечения детей с одного года, для профилактики гриппа – с 12 лет. В 2005 г. показания к применению были расширены и препарат рекомендовали для лечения и профилактики детей с одного года. В 2007 г. разрешили применение занамивира (Реленза®) у детей с пяти лет и взрослых без ограничения возраста.
К настоящему моменту накоплен огромный практический опыт использования осельтамивира и занамивира в лечении и профилактике гриппозной инфекции как в России, так и за рубежом. Кроме того, в ряде клинических исследований подтверждена высокая эффективность данных препаратов [9, 10]. В частности, C.J. Heneghan и соавт. опубликовали систематический обзор и метаанализ данных об эффективности антинейраминидазных препаратов, в том числе в отношении показателей смертности и риска развития побочных реакций [11].
Показано, что осельтамивир сокращает длительность клинических симптомов у взрослых на 16,8 часа (95%-ный доверительный интервал (ДИ) 8,4–25,1), занамивир – на 14,4 часа (ДИ 9,6–19,2). Оба препарата продемонстрировали эффективность при лечении пневмонии (разность рисков (РР) 1,0%; ДИ 0,2–1,5 и РР 0,3%; ДИ 0,1–0,4 соответственно). Профилактическое применение препаратов повышало риск возникновения тошноты у 3,7% взрослых, рвоты – у 4,6% взрослых и 5,3% детей. Профилактика осельтамивиром и занамивиром снижала риск развития клинических симптомов гриппозной инфекции у отдельных лиц (РР 3,1%; ДИ 1,8–3,9 и РР 1,98%; ДИ 1,0–2,5 соответственно) и в семьях (РР 13,6%; ДИ 9,5–15,5 и РР 14,8%; ДИ 12,2–16,6 соответственно). Во время и после лечения осельтамивиром имели место психические расстройства (РР 1,06%; ДИ 0,07–2,8) и во время лечения головные боли (РР 3,2%; ДИ 0,9–5,8). Результаты 30 исследований показали зависимость частоты летальных исходов от времени начала приема препарата и снижение риска летальных исходов у пациентов, инфицированных пандемическим вирусом гриппа A(H1N1)pdm09. Авторы также указали, что, решая вопрос об использовании осельтамивира и занамивира, следует обосновывать необходимость их назначения и учитывать потенциальный риск развития побочных эффектов.
S.G. Muthuri и соавт. провели метаанализ исследований эффективности ингибиторов нейраминидазы у пациентов с пневмониями, этиологически связанными с вирусом гриппа A(H1N1)pdm09 [12]. Авторы проанализировали индивидуальные данные 20 634 пациентов, у которых был диагностирован грипп, вызванный вирусом A(H1N1)pdm09 (лабораторно подтвержден у 20 021 пациента, клинически – у 613). Рентгенологическое подтверждение пневмонии было также обязательным критерием включения пациентов в анализ. Исследователи установили, что раннее назначение антинейраминидазных препаратов не снижало риск развития вирусной пневмонии, но достоверно сокращало частоту случаев подключения больных к искусственной вентиляции легких и летальных исходов.
Препараты с антинейраминидазной активностью являются препаратами выбора при лечении гриппозной инфекции у беременных. A.B. Beau и соавт. оценивали безопасность осельтамивира у 337 беременных и 674 небеременных женщин с гриппозной инфекцией. Достоверных различий по таким показателям, как самопроизвольный аборт (относительный риск (ОР) 1,52; 95% ДИ 0,80–2,91), преждевременные роды (ОР 0,64; 95% ДИ 0,31–1,27) и патология плода (ОР 0,62; 95% ДИ 0,23–1,54), не выявлено [17].
Одним из направлений в разработке новых противогриппозных препаратов является изучение эффективности инъекционных форм, в частности занамивира и перамивира. Такие формы имеют особое значение для пациентов, испытывающих затруднения (желудочный стаз, мальабсорбция, наличие рвоты, бронхоспазм) при использовании пероральных или ингаляционных форм.
Перамивир – противогриппозный препарат, избирательно ингибирующий нейраминидазу вирусов гриппа человека, а также потенциально активный в отношении нейраминидазы высокопатогенного вируса гриппа птиц A(H5N1). Химическая структура перамивира позволяет взаимодействовать с нейраминидазой вируса гриппа с большим сродством, чем осельтамивир. В лабораторных исследованиях у перамивира регистрировались меньшие значения ингибирующих концентраций по сравнению с другими ингибиторами нейраминидазы [18–20].
Результаты изучения эффективности перамивира в плацебоконтролируемых исследованиях у взрослых, как входящих, так и не входящих в группы риска, продемонстрировали, что введение препарата в дозах 300/600 мг/сут в течение одного – пяти дней значительно сокращает длительность клинических симптомов по сравнению с группой контроля. Средняя продолжительность клинических симптомов составила 68,6 часа (90% ДИ 30,0–82,7), у принимавших 300 мг/сут – 114,4 часа (90% ДИ 40,2–253,3), у получавших 600 мг/сут – 42,3 часа (90% ДИ 30,0–82,7). Побочные реакции зарегистрированы у 33,3% пациентов. Какие-либо серьезные клинические симптомы отсутствовали. При измерении концентрации препарата в крови не выявлено признаков его накопления и задержки выведения.
T. Hikita и соавт. изучали эффективность перамивира у 223 детей в возрасте до 18 лет. Средняя продолжительность лихорадки составила один день. Этот показатель существенно отличался от аналогичного показателя в группе сравнения – два дня на фоне применения занамивира (p = 0,02420). Побочных реакций не зарегистрировано, что позволило рекомендовать перамивир для использования в педиатрической практике [21]. Убедительные данные о безопасности препарата, в том числе у беременных и госпитализированных пациентов с тяжелыми формами гриппа, получавших постоянную заместительную почечную терапию и экстракорпоральную мембранную оксигенацию, позволили начать его практическое применение в Японии в 2010 г. (Rapicta), а затем в США и Южной Корее [22].
Ланинамивир (R-125489, или CS-8958) – одна из последних удачных разработок японских ученых, занимающихся поиском новых препаратов с антинейраминидазной активностью. Ланинамивир в отличие от представленных в настоящем обзоре препаратов обладает продолжительным действием: его однократное интраназальное введение на курс лечения подтверждено результатами клинических исследований в 2008–2009 гг. [23–25]. Эффективность ланинамивира сравнима с таковой других препаратов с антинейраминидазной активностью. Однако одним из его преимуществ является снижение риска инфицирования контактирующих лиц при прерывании или недостаточности курса других препаратов на фоне длительно протекающей инфекции, особенно вызванной вирусом гриппа A(H1N1)pdm09. Ланинамивир (инавир), в настоящее время производимый компанией Daiichi Sankyo Co., Ltd (Tokyo), в Японии разрешен для лечения с 2010 г., для профилактики – с 2012 г.
В 2014–2015 гг. частота штаммов вирусов гриппа с пониженной чувствительностью к препаратам с антинейраминидазной активностью была низкой – 1,9%, в 2015–2016 гг. – около 1,0%. Большинство штаммов были выделены у больных, получавших курс лечения осельтамивиром, или пациентов с иммунодепрессивными состояниями [28, 29].
Таким образом, учитывая низкую частоту штаммов с пониженной чувствительностью к препаратам с антинейраминидазной активностью, можно утверждать, что они остаются препаратами выбора в лечении и профилактике гриппозной инфекции. К практическому применению рекомендованы новые препараты, а также их формы. В 2016 г. в России зарегистрирован отечественный препарат с антинейраминидазной активностью – Номидес, активным веществом которого является осельтамивир.
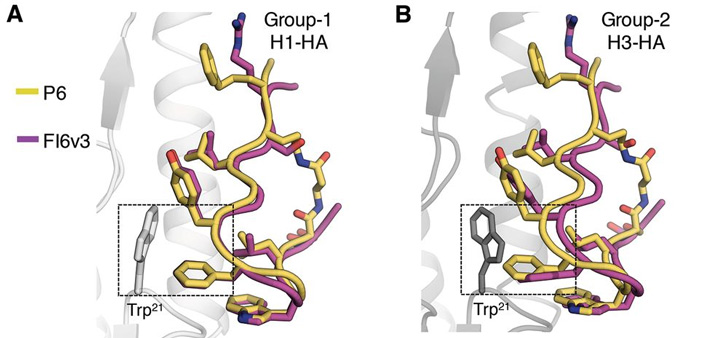
Рис. 1. Сравнение взаимодействия ранее изученного антитела человека FI6v3 и разработанного пептида с частицами вирусов гриппа. Совмещение молекул демонстрирует сходство и различия в том, как антитело (лиловое) и синтезированный пептид (желтый) связываются с гемагглютининовым рецептором вирусов H1 (А) и H3 (B). Оба типа рецепторов, характерные для различных штаммов вируса, связываются с антителом и синтетическим пептидом за счет остатка аминокислоты триптофана (Trp 21 ), положение которого в первичной структуре геммагглютининов Н1 и Н3 одинаково. Рисунок из обсуждаемой статьи в Science
Международная группа исследователей из США, Бельгии и Нидерландов разработала искусственные пептиды, способные нейтрализовать широкий спектр вирусов гриппа, включая штамм H1N1, вызвавший пандемию 2009 года, и штамм высокопатогенного птичьего гриппа H5N1. Эти пептиды могут стать новым оружием в борьбе человечества с гриппом, только сезонные эпидемии которого, по оценкам Всемирной организации здравоохранения, ежегодно приводят к 3–5 миллионам случаев тяжелой болезни и госпитализации и 250 000–500 000 случаев смерти во всем мире.
Существующие в настоящее время способы лекарственной терапии гриппа основаны на воздействии на два белка вируса — канал M2 и нейраминидазу (NA). Оба эти белка важны для нормальной организации жизненного цикла вируса. Белковый канал M2 бывает задействован на ранней и поздней стадиях репликации вируса, а нейраминидаза участвует в высвобождении дочернего поколения вирионов. Но мутации вирусов гриппа приводят (и уже привели) к появлению резистентных штаммов, против которых существующие противовирусные препараты (даже самый эффективный из существующих на настоящий момент — осельтамивир) оказываются малоэффективными. Эти обстоятельства приводят к необходимости разработки новых способов борьбы с вирусами гриппа. Предполагается, что более эффективными могут оказаться стратегии, опирающиеся на применение препаратов, молекулярной мишенью которых будут белки-гемагглютинины (НА) вируса гриппа.
Гемагглютинины — поверхностные белки вируса гриппа, обеспечивающие способность вируса присоединяться к инфицируемой клетке. Возможно, неспособность вируса внедриться в клетку-хозяина снизит вероятность образования устойчивых к противовирусным препаратам мутирующих вирусов: вирусы способны размножаться, только паразитируя в клетках, и не попавший в живую клетку вирус будет лишен возможности воспроизводить себя.
Инфицирование вирусом гриппа начинается с того, что гемагглютинины вируса связываются с поверхностью клетки-хозяина. Вирусный гемагглютинин представляет собой гликопротеид (сложный белок, в котором с цепью, состоящей из аминокислотных остатков, связан углеводный фрагмент). После контакта с клеткой гемагглютинин изменяет свое пространственное строение, фактически внедряясь в клеточную мембрану, что, в свою очередь, обеспечивает проникновение вируса внутрь клетки, где он и начинает свой цикл размножения
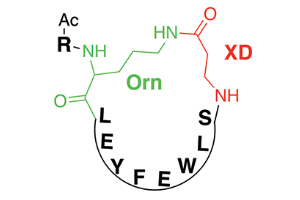
Рис. 2. Общий мотив строения синтезированных циклических пептидов. Цепь пептида состоит из протеиногенных аминокислот — лейцин (L), глутаминовая кислота (Е), тирозин (Y), фенилаланин (F), триптофан (W), серин (S), а также аминокислоты, не входящие в состав белковых молекул: орнитин (диаминовалениановая кислота, Orn) и β-аланин (XD), R — алкильный остаток. Черным цветом обозначена цепь, состоящая из протеиногенных аминокислот, зеленым и красным — участки цепи синтезированного циклического пептида, не характерные для обычных пептидных цепей. С гемагглютинином вируса гриппа циклический пептид связывается преимущественно за счет остатка фенилаланина. Рисунок из обсуждаемой статьи в Science
Ряд спроектированных структур был синтезирован, и после определения их пространственного строения и испытаний на предмет связывания с вирусами исследователи остановились на четырех циклических (обладающих замкнутой цепью, рис. 2) пептидах, каждый из которых обладает свойствами, которые позволяют говорить о его потенциальном применении в качестве блокаторов функций вирусов. Выбранная четверка пептидов демонстрирует прочное связывание с гемагглютининами широкого набора штаммов вирусов гриппа типа А. Синтетические пептиды, как и антитела человека, по образу и подобию которых они были созданы, связываются с остатком аминокислоты триптофана в структуре гемагглютинина вируса. Примечательно, что структура участка, на котором расположен этот триптофановый фрагмент практически не различается для разных штаммов гриппа, поскольку именно этот участок играет ключевую роль в проникновении вируса через оболочку клетки-хозяина.
Основное преимущество разработанных в ходе исследования пептидов по сравнению со ставшими для них образом и подобием антителами заключается в гораздо меньших размерах. Это обеспечивает и дешевизну их получения по сравнению с антителами, и сделает более эффективной усвояемость лекарства при пероральном и инъекционном приеме. Чтобы синтезированные пептиды были устойчивы к действию ферментов, способных ускорять гидролитическое расщепление веществ с аналогичной структурой в крови, в них были введены остатки β-аланина и диаминовалериановой кислоты (орнитина) — аминокислот, не кодируемых в ходе синтеза белковых цепей на рибосоме. Циклическая структура синтезированных пептидов, отсутствие у них характерных для линейных и разветвленных белковых молекул C- и N-конца также способствует устойчивости к гидролизу.
Читайте также:


