Иммуноглобулин специфический против вируса
Действующее вещество:
Содержание
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Состав
| Раствор для инфузий | 1 мл |
| активные вещества: | |
| белки плазмы человека | 50 мг |
| из них: | |
| иммуноглобулин G (IgG) | не менее 96% |
| иммуноглобулин А (IgA) | не более 2 мг |
| содержание антител против вируса гепатита B | 50 МЕ |
| распределение подклассов иммуноглобулина G: | |
| IgG1 — 59%; IgG2 — 35%; IgG3 — 3%; IgG4 — 3% | |
| вспомогательные вещества: глицин — 300 мкмоль; вода для инъекций — до 1 мл |
Описание лекарственной формы
Бесцветная или светло-желтая, прозрачная или слабо опалесцирующая жидкость.
Фармакологическое действие
Фармакодинамика
Неогепатект является препаратом Ig , который изготовлен из плазмы доноров, с высоким титром антител против гепатита В.
Распределение подклассов IgG соответствует распределению в плазме здоровых доноров.
Фармакокинетика
Биодоступность Ig человека против гепатита В при инфузии составляет 100%. Распределение между плазмой и внесосудистой жидкостью происходит достаточно быстро, причем через 3–5 дней достигается равновесие между внутрисосудистым и внесосудистым пространством. T1/2 Неогепатекта составляет в среднем 24 дня. IgG и комплексы IgG утилизируются клетками ретикулоэндотелиальной системы.
Показания препарата Неогепатект
профилактика гепатита В у новорожденных, родившихся от матерей — носительниц поверхностного антигена вируса гепатита В;
использование у лиц с повышенным риском заражения вирусом гепатита В до или одновременно с вакцинацией против гепатита В ( в т.ч. перед операциями, повторной гемотрансфузией, гемодиализом);
профилактика инфицирования трансплантата печени у пациентов, имеющих поверхностный антиген вируса гепатита В;
профилактика гепатита В:
- взрослые и дети старше двух лет, не вакцинированные против гепатита В или не имеющие документального подтверждения о проведенных прививках и подвергшихся опасности заражения гепатитом В из-за контакта с материалом, в отношении которого имелись подозрения на его инфицирование (например, в случае нарушения целостности кожного покрова при уколе инъекционной иглой или непосредственного контакта со слизистой оболочкой).
Введение Неогепатекта рекомендуется осуществлять одновременно с вакцинацией против гепатита В (одновременная активная и пассивная иммунизация). Начатую таким образом первичную вакцинацию следует продолжать в течение последующих месяцев в соответствии с инструкцией по применению вакцины.
Введение Неогепатекта не показано, если подвергшийся опасности заражения гепатитом пациент был вакцинирован по полной схеме и у него образовалось достаточное количество антител (минимум 10 МЕ/л сыворотки). Если количество антител к HBs-антигену не может быть определено в течение 24 ч после контакта с контаминированным материалом, то в любом случае необходима сочетанная профилактика (вакцина и Ig);
- у лиц, содержание антител в сыворотке которых по истечении 6 мес после вакцинации составляет менее 10 ME/л. Таким пациентам одновременно с введением Неогепатекта следует назначать дополнительные дозы вакцины против гепатита В.
Применение Неогепатекта показано лицам, которым требуется немедленная профилактика гепатита В и у которых одновременно имеется склонность к кровоточивости, поскольку в/м введение препаратов может вести к местным кровоизлияниям.
Противопоказания
повышенная чувствительность к Ig человека и другим препаратам крови, особенно в редко встречающихся случаях дефицита в крови IgA и наличия антител против IgA;
повышенная чувствительность к другим компонентам препарата.
Применение при беременности и кормлении грудью
Отсутствие риска применения данного препарата во время беременности не исследовалось в контролируемых клинических исследованиях. Поэтому в период беременности и лактации его следует использовать с осторожностью, хотя длительный опыт медицинского применения Ig не позволяет ожидать никакого вредного влияния на течение беременности, а также на плод и новорожденного.
Введенные Ig выделяются с материнским молоком и могут способствовать передаче защитных антител новорожденным.
Побочные действия
Возможны такие побочные действия, как озноб, головная боль, повышение температуры, тошнота, рвота, аллергические реакции, ломота в суставах и легкая боль в спине.
В редких случаях возможно неожиданное понижение АД и в единичных случаях — анафилактический шок, даже если пациент при предыдущем введении не проявлял чрезмерной чувствительности.
При введении Ig человека наблюдались случаи появления признаков асептического менингита и в редких случаях — гемолитическая анемия/гемолиз, транзиторная кожная реакция (сыпь или гиперемия), которые полностью исчезали после прекращения терапии.
Помимо этого наблюдалось повышение содержания сывороточного креатинина и/или острая почечная недостаточность.
Отмечены единичные случаи тромбоэмболических реакций у пациентов пожилого возраста, с признаками церебральной или кардиологической ишемии, а также у пациентов с избыточной массой тела или тяжелой гиповолемией.
В случае появления реакций, свидетельствующих о непереносимости препарата, необходимо либо уменьшить скорость введения, либо приостановить инфузию до исчезновения симптомов. Выбор соответствующих мероприятий по предотвращению возникших побочных явлений зависит от вида и тяжести побочного действия.
В случае отрицательного воздействия на функцию почек терапию Ig необходимо прекратить.
В случае возникновения шока необходимо следовать современным рекомендациям по проведению противошоковой терапии.
Взаимодействие
Нельзя добавлять никаких других препаратов в раствор Неогепатекта, т.к. изменение концентрации электролита или значения уровня рН может привести к выпадению в осадок или денатурации белка.
Аттенуированные (ослабленные) живые вакцины: введение Ig может отрицательно влиять в период от 6 нед и до 3 мес на эффективность живых вакцин против таких вирусных заболеваний, как корь, краснуха, эпидемический паротит и ветряная оспа.
Вакцинацию с помощью ослабленной живой вакцины следует проводить не ранее чем по прошествии 3 мес после введения этого препарата. В случае прививки против кори влияние Ig может продолжаться до 1 года. Пациентов, которым нужно сделать прививку против кори, необходимо вначале обследовать на наличие специфических антител.
Лабораторные исследования. После введения Ig возможно временное повышение титра различных пассивно введенных антител, что может привести к ложноположительным данным анализа при серологическом исследовании.
Пассивно введенные антитела против антигенов эритроцитов (например А, В, D) могут влиять на такие серологические параметры, как аллоантитела к эритроцитам (например реакция Кумбса), количество ретикулоцитов и гаптоглобин.
Способ применения и дозы
В/в, путем инфузии. Начальная скорость инфузии должна составлять 0,1 мл/кг массы тела/час. При хорошей переносимости препарата через 10 мин после начала введения скорость можно постепенно увеличить до 1 мл/кг массы тела/час.
Пациентам, принадлежащим к группе риска, особенно людям пожилого возраста, пациентам с нарушением функции почек Неогепатект следует вводить с минимальной скоростью.
Клинический опыт применения Неогепатекта у новорожденных, родившихся от матерей — носителей HBs-антигена показал, что препарат в дозе 2 мл, введенный в течение 5–15 мин, хорошо переносится.
Не допускается смешивать Неогепатект с другими ЛС .
Перед введением Неогепатекта необходимо визуально проверить содержимое флакона. Раствор должен быть прозрачным или слегка опалесцировать. Непрозрачный или содержащий осадок раствор применять запрещается.
Перед введением препарат следует подогреть до комнатной температуры или температуры тела.
Препарат не подлежит предварительному разведению.
Нельзя добавлять никакие другие препараты в раствор Неогепатекта.
Вскрытый флакон следует сразу же использовать. Из-за риска бактериального загрязнения неиспользованный остаток препарата хранению не подлежит.
Рекомендуемые дозировки препарата
Если не назначено ничего иного, то рекомендуется следующее.
Для профилактики гепатита В у новорожденных, матери которых инфицированы вирусом гепатита В, — непосредственно после рождения однократно вводят Неогепатект в дозе 20–50 МЕ/кг массы тела, но не менее 100 МЕ (2 мл). Рекомендована срочная вакцинация против гепатита В. Первое введение вакцины может быть осуществлено в тот же день, что и введение Неогепатекта, только в разные участки тела.
После контакта с материалом, подозрительным на содержание вируса гепатита В, — безотлагательно, не позднее чем через 72 ч однократно вводят Неогепатект в дозе 8–10 МЕ/кг массы тела (от 0,16 до 0,20 мл).
Для профилактики при высоком риске заражения гепатитом В (например в отделениях гемодиализа) — однократно вводят Неогепатект в дозе 7 МЕ/кг массы тела (0,14 мл), но не менее 10 мл, после определения HBsAg и антител к HBs.
Если через месяц ( в т.ч. и для контроля проводимой одновременно активной иммунизации) титр антител к HBsAg будет более 10 МЕ/л, то немедленное введение Неогепатекта не требуется, и его проводят через 2 мес.
Введение Ig при существующей опасности заражения повторяют в случае необходимости с интервалом в 1 мес при ежемесячном контроле титра антител к HBsAg. После активного образования антител к HBsAg пассивное введение антител больше не является необходимым.
Для профилактики инфицирования трансплантата печени у HBsAg-положительного реципиента — в/в вводят во время операции после удаления печени и до трансплантации новой печени 10000 МЕ (200 мл) Неогепатекта. После операции препарат вводят не менее 7 дней ежедневно в дозе 2000 МЕ (40 мл). При длительной терапии в сыворотке крови должен поддерживаться уровень минимум 100 МЕ/л (ежемесячный контроль). Длительность терапии должна составлять минимально 6 мес.
Рекомендуемые дозировки основаны на результатах клинических исследований.
Передозировка
Передозировка препарата у пациентов, принадлежащих к группе риска, особенно у людей пожилого возраста, а также у пациентов с нарушением функции почек, может привести к гиперволемии (увеличение ОЦК) и повышению вязкости крови.
Меры предосторожности
Пациент в течение всей инфузии и после ее окончания в течение минимум 20 мин должен находиться под врачебным контролем с целью наблюдения за возможным появлением симптомов побочного действия.
Определенные побочные явления могут встречаться чаще всего:
- при высокой скорости введения;
- у пациентов с полным и частичным иммунодефицитом как при наличии, так и при отсутствии IgA-дефицита;
- у пациентов, получающих Ig человека впервые, или (в редких случаях) при переходе на другой препарат Ig , или если лечение Ig проводилось давно.
Реакции гиперчувствительности в чистом виде встречаются в крайне редких случаях, при которых в крови отсутствует IgA и образуются антитела к IgA.
В большинстве случаев можно избежать возможных осложнений:
- если удостовериться, что пациент не проявляет аллергических реакций в отношении Ig человека, вводя сначала Неогепатект очень медленно (0,1 мл/кг/ч);
- если внимательно наблюдать во время введения препарата за пациентом и следить за появлением признаков нежелательного действия. С особой тщательностью следует контролировать возможное появление симптомов побочного действия у пациентов, никогда ранее не получавших Ig человека, или получавших до настоящего времени другие Ig , или если Ig вводились очень давно. За состоянием таких пациентов необходимо наблюдать в течение всей инфузии и по крайней мере 1 ч после ее окончания. Все остальные пациенты должны находиться под наблюдением по крайней мере в течение 20 мин после введения.
У пациентов при введении Ig очень редко могут наблюдаться случаи острой почечной недостаточности. В большинстве случаев это побочное явление возникало у пациентов, имеющих дополнительные факторы риска: нарушение функции почек, сахарный диабет, пониженный ОЦК , избыточную массу тела, прием лекарств, оказывающих нефротоксическое действие, а также возраст старше 65 лет.
При лечении Ig для всех групп пациентов необходимо:
- потреблять достаточное количество жидкости перед инфузией Ig;
- контролировать содержание креатинина сыворотки (индикатор функции почек);
- исключить одновременный прием диуретиков.
В случае отрицательного влияния на функцию почек следует рассмотреть вопрос о прекращении введения Ig .
Наиболее часто нарушение функции почек и острую почечную недостаточность связывают с применением препаратов Ig , содержащих в качестве стабилизатора сахарозу. Поэтому пациентам с каким-либо фактором риска рекомендуется использовать Ig , которые не содержат сахарозу (например Неогепатект). Кроме этого, препарат следует вводить с наиболее низкой скоростью введения.
Влияние на способность управлять автомобилем или выполнять работы, требующие повышенной скорости физических и психических реакций. Нет никаких указаний на то, то иммуноглобулины могут влиять на способность управлять автомобилем или обслуживать механизмы.
При применении лекарственных препаратов из крови или плазмы человека вследствие передачи возбудителей инфекционных заболеваний заражение последними нельзя полностью исключить. Это касается также возбудителей до сих пор неизвестной природы. Чтобы снизить риск передачи возбудителей болезней, по строгим критериям проводится отбор доноров, тестируется и отбирается донорская плазма и контролируется пул плазмы.
В производственный процесс включены стадии элиминации и/или инактивации возбудителей.
Для изготовления Неогепатекта используется исключительно плазма здоровых доноров, в которой не были обнаружены антитела к ВИЧ типа 1 и 2, вирусу гепатита С и поверхностный антиген вируса гепатита В.
Дополнительно к индивидуальному тестированию плазмы отдельных доноров контролю подвергаются сначала минипулы (тестирование методом полимеразной цепной реакции (ПЦР) на ВИЧ , вирусы гепатита А, В и С, парвовирус В19), а затем производственный пул плазмы, перерабатываемый на Неогепатект (повторное тестирование на антитела к ВИЧ типа 1 и 2, гепатиту В и С, а также методом ПЦР на ВИЧ , вирусы гепатита В и С). В производстве используется пул плазмы только при отрицательных результатах тестирования.
Неогепатект изготавливают фракционированием этанолом на холоду. Для инактивации и элиминации возможных вирусов проводят обработку три-н-бутил-фосфатом/твином 80 и осаждение октановой кислотой.
Предусмотренные методы вирусинактивации, валидированные с использованием модельных вирусов, являются эффективными в отношении возбудителей СПИДа и гепатита В и С.
Форма выпуска
По 2, 10, 40 мл во флаконах бесцветного стекла, укупоренных пробкой с алюминиевым колпачком.
По 1 фл. в картонной пачке с инструкцией по применению.
о применении препарата
прозрачная или с незначительной опалесценцией, бесцветная или желтоватая жидкость. При хранении допускается появление незначительного осадка, который исчезает при встряхивании. Препарат является иммунологически активной белковой фракцией плазмы крови доноров, проверенной на отсутствие антител к ВИЧ-1, ВИЧ-2. к вирусу гепатита С и поверхностного антигена вируса гепатита В, очищенной и концентрированной методом фракционирования, спиртоводними растворами для осаждения, прошедшей стадию вирусной инактивации сольвент-детергентним методом. Содержание белка в 1,0 мл препарата от 0,09 г до 0,11 г. Препарат не содержит консервантов и антибиотиков.
действующие вещества — специфические антитела к вирусу герпеса обычного 1 типа — титр антител составляет не менее, чем 1:25 000;
вспомогательные вещества — глицин (глікокол, кислота амінооцтова), натрия хлора д.
Раствор для инъекций.
Код АТС. Ј06ВВ. Специфические иммуноглобулины.
Действующей основой препарата являются иммуноглобулины, в частности иммуноглобулин G, специфический к вирусу герпеса обычного 1 типа. Специфическая активность препарата обусловлена віруснейтралізуючою действием антител. Кроме того, иммуноглобулин G вызывает иммуномодулирующий эффект, влияя на разные звенья иммунной системы человека, и повышает неспецифическую резистентность организма.
Препарат применяют с целью лечения заболеваний, вызванных вирусом герпеса обычного 1 типа, в том числе: энцефалитов, урогенитальных, мєнінгоенцефалітів, арахноенцефалітів, арахноїдитів, енцефалополірадикулїтів и др.
Иммуноглобулины вводят внутримышечно. Для лечения заболеваний взрослых, вызванных вирусом герпеса обычного 1 типа, в том числе поражений нервной системы, иммуноглобулин вводят 5 раз с дводобовим интервалом в дозе 4,5 мл (3 ампулы по 1,5 мл) на введение.
Реакции на введение иммуноглобулина, как правило, отсутствуют. Возможны:
реакции в месте ін'екціі — отек, боль, эритема, уплотнение, покраснение, высыпания, зуд;
общие расстройства и реакции — лихорадка, недомогание, озноб;
расстройства со стороны иммунной системы — реакции гіперчугливості, а в исключительно редких случаях анафілактични и шок;
расстройства со стороны нервной системы — головная боль;
расстройства со стороны сердечно-сосудистой системы — тахикардия, гипотония;
расстройства со стороны ЖКТ — тошнота, рвота;
расстройства со стороны кожи и подкожных тканей — эритема, зуд;
расстройства со стороны костно-м визовой и соединительной ткани — артларгія.
Препарат противопоказан: при селективном дефиците Ig А при условии наличия антител против Ig А, лицам, которые имеют тяжелые аллергические реакции на введение белковых препаратов крови человека в анамнезе, а также реакции гиперчувствительности к донорских иммуноглобулинов человека.
Препарат не следует вводить в случаях тяжелой тромбоцитопении и других нарушений гемостаза.
Введение препарата внутривенно запрещено!
Пациенты, получившие препарат, должны находиться под медицинским наблюдением в течение 30 минут.
Пациентам, страдающим аллергическими болезнями или имеющим их в анамнезе, в день введения иммуноглобулина и в последующие 3 сут рекомендуется назначать антигистаминные препараты. В случае возникновения анафилактического шока проводится стандартная противошоковая терапия. Лицам, страдающим иммунопатологическими системными заболеваниями (болезни крови, соединительной ткани, нефрит и др.), иммуноглобулин следует вводить на фоне соответствующей терапии.
Применение при беременности и кормлении грудью. Долговременный клинический опыт применения иммуноглобулина не подтверждает отрицательного влияния на протекание беременности, а также на плод и новорожденного.
Иммуноглобулин выделяется с грудным молоком и поэтому может способствовать переносу защитных антител от матери к ребенку, что следует рассматривать как положительный эффект.
Возможна комбинация с другими протитерпетичними препаратами непосредственно перед применением иммуноглобулина или одновременно.
При введении несовместим в одном шприце с другими лекарственными средствами. Передозировка. Не изучалось.
Влияние на способность управления автотранспортом
В сухом, защищенном от света месте при температуре от 2 до 8 °С.
Состав
действующие вещества - специфические антитела к вирусу герпеса простого 2 типа, титр
антител не менее 1:640.
вспомогательные вещества - натрия хлорид;
стабилизатор - глицин (гликокол, кислота аминоуксусная).
Описание
Прозрачная или слегка опалесцирующая, бесцветная или желтоватая жидкость. В процессе хранения возможно появление незначительного осадка, исчезающего при встряхивании. Препарат содержт антитела к вирусу герпеса простого 2 типа. Препарат не содержит консерванта и антибиотиков, в сырье отсутствуют антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита С и поверхностному антигену вируса гепатита В (HBsAg).
Фармакологическое действие
Иммунологические и биологические свойства. Действующей основой препарата являются антитела, специфические к вирусу герпеса простого 2 типа, в частности, иммуноглобулин G. Специфическая активность препарата обусловлена вируснейтрализующим действием антител. Кроме того, иммуноглобулин G, вызывает иммуномодулирующий эффект, влияя на разные звенья иммунной системы человека, и повышает неспецифическую резистентность организма.
Показания к применению
Препарат применяют в комплексной терапии при лечении заболеваний, вызванных вирусом герпеса простого 2 типа:
- первичной и рецидивирующей урогенитальной инфекции у мужчин и женщин;
- генитальной герпетической инфекции у беременных женщин и связанной с нею акушерской патологией.
Противопоказания
Введение иммуноглобулина противопоказано лицам, имеющим в анамнезе тяжелые аллергические реакции на введение белковых препаратов крови человека. Больным, страдающим аллергическими заболеваниями или имеющим в анамнезе тяжелые аллергические заболевания, в день введения иммуноглобулина и в последующие 3 суток рекомендуются антигистаминные препараты. Лицам, страдающим иммунопатологическими системными заболеваниями (болезни крови, соединительной ткани, нефрит и др.), иммуноглобулин следует вводить на фоне соответствующей терапии.
Беременность и период лактации
Долговременный клинический опыт применения иммуноглобулина указывает на то, что не следует ожидать какого-либо вредного воздействия на мать и плод при беременности или на новорожденного.
Иммуноглобулин выделяется с грудным молоком и поэтому может способствовать переносу защитных антител от матери к ребенку.
Способ применения и дозы
. Иммуноглобулин вводят внутримышечно.
Первичная и рецидивирующая генитальная герпетическая инфекция - внутримышечно 1,5 мл (1 доза) один раз в три дня. Курс лечения - 7 инъекций, а также местно - обработка пузырчатых герпетических высыпаний.
Герпетическая генитальная инфекция у беременных женщин. Первый курс лечения начинают после 12 недель беременности. Препарат вводят внутримышечно 1,5 мл (1 доза) 1 раз в три дня, 6
инъекций. Второй курс начинают после 36 недель беременности. Препарат вводят внутримышечно 1,5 мл (1 доза) 1 раз в три дня, 6 инъекций, после чего иммуноглобулин вводят интравагинально шприцем без иглы по 1,5 мл (1 доза) 1 раз в день в течение 5 дней после предварительного промывания влагалища физиологическим раствором.
Побочное действие
Реакции на введение иммуноглобулина, как правило, отсутствуют. В единичных случаях могут развиться местные реакции в форме гиперемии и повышения температуры до 37,5 °С в течение первых суток. У отдельных людей с изменённой реактивностью могут развиться аллергические реакции разного типа, а в исключительно редких случаях - анафилактический шок. В связи с этим лица, получившие препарат, должны находиться под медицинским наблюдением в течение 30 минут.
Передозировка
Взаимодействие с другими лекарственными средствами
Возможна комбинация с другими противогерпетическими препаратами непосредственно перед применением иммуноглобулина или одновременно. Снижает активность ослабленных живых вакцин против кори, краснухи, эпидемического паротита, ветряной оспы (при введении в первые две недели после вакцинации против кори, паротита и краснухи прививку указанными вакцинами следует повторить не раньше, чем через 3 месяца). Для кори этот период может длиться до 1 года, поэтому не обходимо проверить антительный статус к иммунизации. При необходимости использование иммуноглобулина раньше этого срока, вакцинацию против кори или эпидемического паротита не обходимо повторить. Вакцинации против других инфекций могут быть проведены в любые сроки до или после введения иммуноглобулина. Временное повышение содержания антител в крови
Особенности применения
Введение препарата внутривенно запрещено!
Результаты ДНК и серологических тестов и целесообразность назначения специфических иммуноглобулинов:

Современные ВВИГ получают фракционированием плазмы крови человека. Они представляют собой препараты поликлональных антител класса IgG, синтезированных В-лимфоцитами в ответ на антигенные стимулы, имевшие место на протяжении жизни человека-донора. IgG – гликопротеин с молекулярной массой около 150 кДа, содержащийся в плазме человека в количестве от 7 до 12 г⁄л [12]. Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип IgG определяется последовательностью аминокислот константной области тяжелой цепи [2].
Современные препараты ВВИГ подразделяются на три группы [3]:
I. Стандартные препараты – содержат в основном IgG (иммуноглобулин человека нормальный для внутривенного введения).
II. Стандартные специфические (гипериммунные) препараты – содержат в основном IgG, но имеют более высокое содержание противовирусных антител.
III. Обогащенные препараты ВВИГ – содержат антитела классов IgG, IgM, IgA против патогенных вирусов и бактерий.
Эффективность и безопасность медицинского применения ВВИГ определяются дуализмом функции IgG: они могут специ фически взаимодействовать с чужеродными антигенами и одновременно способны вызывать неспецифические эффекты. Такая функциональная дихотомия является следствием особенностей структуры молекулы IgG. Ее вариабельный регион (два Fab-фрагмента) состоит из легкой и частично из тяжелой цепей и специфически взаимодействует с антигенами, что обусловлено меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы. Константный регион (Fc- или кристаллизующийся фрагмент) связывает компонент комплемента 1 (С1) и взаимодействует с Fc-рецепторами макрофагов или нейтрофилов. Активация эффекторной функции Fc-фрагмента антитела происходит после агрегации IgG на поверхности антигена, структура молекулы меняется, что служит сигналом для запуска системы комплемента или индукции опсонизации через фагоцитоз (рис. 1) [2].
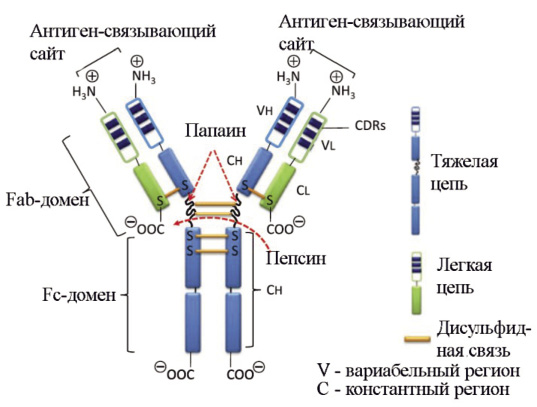
Рис. 1. Схематическое строение иммуноглобулина G. Обработка пепсином приводит к расщеплению в участке молекулы на С-концевой стороне, за дисульфидной связью, соединяющей две тяжелые цепи вариабельного участка IgG. В результате образуются один сдвоенный F(аb’)-фрагмент [F(аb’)2] и один Fc-фрагмент. Расщепление IgG папаином происходит в N-концевом участке, непосредственно перед дисульфидной связью, в результате образуются два одинаковых Fab-фрагмента и один Fc-фрагмент [12]
Обобщение опыта клинического применения ВВИГ позволило Е.К. Донюш [3] утверждать, что они обеспечивают:
– увеличение бактерицидной активности сыворотки, стимуляцию фагоцитоза, нейтрализацию некоторых бактериальных токсинов;
– блокаду дифференцировки В-лимфоцитов, продуцирующих антитела;
– предотвращение или блокаду взаимодействия аллергена с IgE, фиксированного на тучной клетке, за счет IgG4 блокирующих антител;
– подавление продукции аллерген-специфических и ауто-антител за счет воздействия антиидиотипических антител;
– снижение продукции и активности провоспалительных цитокинов;
– предупреждение комплемент-зависимого повреждения тканей за счет связывания C3b и C4b компонентов комплемента;
– предохранение от дополнительных вирусных инфекций, обладающих триггерным эффектом при аутоиммунных заболеваниях.
Первыми неспецифическими иммуноглобулинами, использованными в клинической практике, были иммуноглобулины для внутримышечного применения (intramuscular immunoglobulin, IMIG). В России разрешены иммуноглобулин человека нормальный, противоаллергический и 6 специфических иммуноглобулинов, получаемых из плазмы крови иммунизированных людей (противооспенный, антирабический, антистафилококковый, противостолбнячный, против гепатита В и клещевого энцефалита) [1].
Технология приготовления таких иммуноглобулинов разработана в 1940-х гг. Включает этапы получения плазмы крови человека и осаждения из нее IgG этанолом при температуре ниже 0 °С и определенном значении рН [1, 2]. Дополнительной очистки IgG не проводится. Получаемый препарат содержит 70–80 % мономерных IgG и значительные количества IgA и IgM. Вводимые в его составе в организм человека антитела имеют обычный период полураспада, активируют комплемент в присутствии антигена и обладают опсонизирующими свойствами. Применение нормальных иммуноглобулинов оказалось эффективным для профилактики и лечения кори, гепатита А и для предупреждения бактериальных инфекций у детей с наследственной агаммаглобулинемией [3, 12].
Непреодолимыми в рамках данной технологии получения IgG недостатками данных препаратов, стали болезненность в месте введения, низкая скорость поступления антител в системный кровоток и невозможность быстро создавать высокие концентрации антител в ургентных ситуациях. При попытках внутривенного введения у пациентов развивались опасные анафилактоидные реакции и гипотония, что связано с неспецифической активацией комплемента в результате спонтанного образования агрегатов иммуноглобулинов и наличием в препарате следовых количеств протеаз [7]. Поэтому применение препаратов, полученных по данной технологии, ограничено внутримышечным введением.
Низкая терапевтическая эффективность энзиматических и химических производных IgG вынудила разработчиков ВВИГ в начале 1970-х гг. вернуться к получению интактного IgG. Особую значимость для потребителей препаратов крови в те годы приобрела их вирусная безопасность. Проблемы качества и безопасности ВВИГ на основе интактного IgG решались строгой государственной регламентацией процессов сбора и фракционирования плазмы доноров, контроля производства. Были разработаны национальные и международные документы, регулирующие производство ВВИГ. Система таких мер приведена в табл. 1.
Меры безопасности и контроля качества при производстве ВВИГ [12]
Требования к этапу, критические для обеспечения качества/безопасности ВВИГ
Учреждение по заготовке крови (лицензирование и проверяются национальным регулирующим органом; контроль оборудования, фракционирующего плазму)
Скрининг донор крови и плазмы
Эпидемиологический надзор за населением, идентификация доноров, конфиденциальное анкетирование кандидатов в доноры на наличие факторов риска, анализ их медицинских документов и анкеты
Процедура сбора крови/плазмы
Контроль длительности процедуры забора крови у доноров, смешивания с растворами, предотвращающими коагуляцию, температуры от момента забора крови до ее направления в блок переработки и др. параметров процесса, определенных нормативным документом
Тестирование донора на вирусоносительство перед забором крови
Выявление антител к ВИЧ 1 и 2, вирусам гепатитов А, В и С, HBsAg, парвовируса В19. Исследование должно проводится индивидуально или минипулами, использованные методы должны быть валидированы
Другие тесты у доноров
Тестирование на изоагглютинины к антигенам А, В, D, не использование крови доноров с высокими титрами антител к этим антигенам
Должна использоваться плазма, замороженная в течение 24–72 ч после забора
Замораживание и хранение плазмы
Должен использоваться быстрый способ замораживания плазмы, в процессе ее хранения температура не должна меняться
Во время транспортировки должен вестись постоянный мониторинг температуры ее хранения с записью соответствующим оборудованием. Температура хранения при транспортировке должна быть минус 20 °С или менее
Предприятия по фракционированию плазмы крови (лицензирование и инспекция национальным регулирующим органом)
Используются технологии амплификации нуклеиновых кислот. Определяется нуклеиновая кислота ВИЧ 1 и 2, вирусов гепатитов А, В и С, парвовируса В19
Тестирование производственного пула
Антитела на ВИЧ 1 и 2, вирус гепатита С, HBsAg (обязательно); РНК вируса гепатита С (обязательно в Европе). Исследование нуклеиновых кислот других вирусов – в соответствии с регулирующими документами
Предприятие по фракционированию плазмы
Должно быть разработано, построено и функционировать в соответствии с GMP
Этапы очистки белков и инактивация вирусов
Все процессы должны быть валидированы, все операции должны выполняться в соответствии с утвержденной СОП
Стерилизующая фильтрация и асептическое заполнение упаковок
Лиофильное высушивание (когда необходимо)
Проверка конечного продукта
Все операции должны выполняться в соответствии с утвержденной СОП
Устранение недостатков, характерных для ВВИГ на основе интактного IgG, проводилось путем более тщательной очистки препарата от агрегатов иммуноглобулинов, протеаз, плазмина, плазминогена, активатора прекалликреина, примесей IgA и IgM. Е.К. Донюш [3] выделяет 4 поколения ВВИГ.
Препараты первого поколения – начало 1970-х гг., это энзиматически и химически модифицированные IgG, не имевшие функционального Fc-фрагмента.


Рис. 2. Основные технологии, используемые для получения коммерческого ВВИГ и других компонентов крови из плазмы человека [12]. А, Б, В и Г – технологии, описанные в работах Bertolini J. [8], Teschner W. et al. [17], Terpstra F.G. et al. [16] и Stucki M. еt al. [15] соответственно
Препараты второго поколения – конец 1970-х гг., включали полностью интактную молекулу IgG с активной Fc-функцией и могли применяться не только с целью заместительной, но и иммуномодулирующей терапии. Однако степень их очистки оставалась низкой, они содержали IgA в количествах, вызывающих анафилактические реакции при внутривенном введении, показатель Fc-функции не превышал 70–75 %.
Препараты третьего поколения создавались в середине-конце 1980-х гг., характеризовались высокой чистотой и полной активностью Fc-фрагмента, высокой степенью вирусной безопасности, достигаемой многоступенчатым процессом производства. Выпускались в жидком виде и могли храниться при температуре 2–8 °С.
Препараты четвертого поколения – препараты, удовлетворяющие более жестким требованиям вирусной безопасности и физиологического распределения IgG по подклассам. Разработаны в 1990-х гг. и широко используются в настоящее время. Имеют высокую чистоту IgG с нормальным распределением по подклассам, содержание мономеров и димеров более 95 %. Активность Fc-фрагмента молекулы IgG приближается к 100 %. Препараты получают, используя многоступенчатую схему инактивации вирусов, включающую не менее двух самостоятельных методов (сольвент-детергентная обработка + инкубация при низких значениях рН или пастеризация в сочетании с обработкой полиэтиленгликолем). Препараты выпускают в жидком виде, допускается хранение при комнатной температуре.
В качестве стабилизаторов ВВИГ четвертого поколения используются вещества, безопасные для пациентов с нарушением углеводного обмена и дисфункцией почек, 10 %-е растворы ВВИГ позволяют снизить объемную нагрузку на пациента. Учитывая, что степень очистки IgG в препаратах четвертого поколения приближается к 100 %, их можно считать пределом развития всего направления получения ВВИГ из плазмы крови доноров. Отдельные усовершенствования будут касаться повышения эффективности технологий получения и клинического применения ВВИГ (препарат для подкожного применения, комбинации различных иммуноглобулинов в препарате и др.), их вирусной безопасности, способов очистки от примесей компонентов, которые раньше не считали способными влиять на результат клинического применения (растворимые молекулы CD4, CD8, HLA, следовые количества факторов свертывания крови VIII, IX, X, XI, XII и др.). Основные технологии, используемые в настоящее время для получения ВВИГ и других компонентов крови, показаны на рис. 2.
Стандартная технология производства позволяет из 1 литра плазмы получить до 2,5 упаковок альбумина 10 %, до 3,5 упаковок иммуноглобулина для внутривенного введения 5 % и около 200–250 МЕ фактора VIII [4].
Основной тенденцией в стабилизации препаратов ВВИГ в настоящее время считается использование высокой концентрации IgG (100 мг/ мл по белку); слабокислой среды (рН 4,5–5,5); включение в лекарственную форму стабилизаторов, таких как полиолы (сорбит), сахара (мальтоза, глюкоза), или аминокислоты (глицин, пролин, изолейцин); отсутствие в препаратах хлорида натрия и сахарозы; осмолярность, близкая к физиологической; отсутствие консервантов и антибиотиков [1, 10].
Требования к свойствам ВВИГ следующие [3]:
– они должны иметь оптимальный спектр антител в соответствии с инфицированностью населения (более 1000 доноров);
– обладать доказанной эффективностью (с помощью контролируемых клинических исследований);
– распределения IgG по подклассам должно соответствовать их содержанию в плазме крови;
– для каждой партии препарата должен быть задекларирован титр антител;
– макроагрегаты должны составлять менее 1 % общего содержания IgG;
– антикомплементарная активность не должна превышать 1,0 СН50/1 мг белка протеина;
– гемолизины не должны содержаться в препарате, титр АВ-антител должен быть менее 1:8;
– активаторы прекалликреина, консерванты, активированные ферменты, токсические вещества не должны присутствовать в препарате;
– если предусмотрено применение у пациентов с врожденным дефицитом IgA; содержание IgA должно быть минимальным;
– высокая противовирусная очистка.
Возможность получения IgG с высокой степенью очистки позволила в последнее десятилетие вернуться к практике их подкожного введения, оказавшейся неудачной в 1940–1950-е гг. из-за большого количества реакций на балластные компоненты иммуноглобулинов, получаемых по технологиям того времени. Иммуноглобулины для подкожного введения (subcutaneous immunoglobulin, SCIG) в основном используются для лечения пациентов с врожденными нарушениями антителообразования (низкий уровень IgA), с повышенным содержанием в сыворотке крови воспалительных маркеров, флебитами, заболеваниями почек и другой патологией, создающей условия для осложнения при введении ВВИГ [6]. В настоящее время за рубежом в клинической практике используется не менее 6 SCIG. Сравнение свойств SCIG с аналогичными свойствами ВВИГ приведено в табл. 2.
Для улучшения проницаемости внеклеточного матрикса для IgG в SCIG добавляется рекомбинантная человеческая гиалуронидаза (rHuPH20), что позволяет сократить расход препарата на курс лечения пациента и добиться более высоких уровней антител в плазме крови [9]. По совокупности свойств и благодаря более простому применению в клинике, SCIG, особенно препараты с rHuPH20, способны вытеснить ВВИГ с рынка фармацевтических препаратов.
Существует серьезное противоречие между требованиями к качеству и эффективности ВВИГ, и его безопасностью. Прежде всего, оно имеет отношение к вирусной безопасности ВВИГ и других препаратов крови. Чтобы ВВИГ был эффективным и соответствовал критериям качества, плазма должна быть получена от как можно большего количества доноров, более 1000. Но чем больше донаций использовано для получения плазмы, тем больше риск того, что она будет инфицирована опасными для человека вирусами. Когда ВВИГ начали применять в клинической практике, считалось, что если IgG фракционируют холодным этанолом, то это обеспечивает вирусную безопасность полученных препаратов. Но эти надежды не оправдались, вирусы, особенно возбудитель гепатита С, продолжали находить в крупных партиях ВВИГ [19].
Читайте также:


