Иммуногенность новой гриппозной вакцины
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Изучение частоты местных и общих реакций, а также соматической и инфекционной заболеваемости во всех группах наблюдения, проведенное в рамках данного исследования, показало, что препараты хорошо переносятся и обладают низкой реактогенностью. Целью данной публикации является анализ результатов иммуногенности вакцины Гриппол ® Нео в сравнении с коммерческим препаратом — вакциной Гриппол ® .
Материалы и методы
Вакцины
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
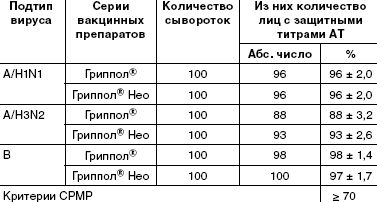
Наиболее иммуногенными оказались компоненты вакцин H1N1 и B. У привитых вакциной Гриппол ® Нео по 5 мкг уровень серопротекций составил 96% и 97% соответственно, у привитых вакциной Гриппол ® — 96% и 98%. Число людей с защитным титром антител (сероконверсий) против штамма A/H3N2 было несколько ниже — 93% для Гриппола® Нео и 88% для Гриппола ® . Достоверных различий по данному показателю между исследуемыми вакцинами и препаратом сравнения вакциной Гриппол ® (p > 0,05) не выявлено. Кратность нарастания антител и доля лиц с 4-кратным и более приростом титра антител являются важными характеристиками иммунного ответа на вакцинацию, особенно у людей, ранее не встречавшихся с данными разновидностями вируса гриппа. В табл. 2 показаны результаты вакцинации серонегативных добровольцев — людей с низким ( ® Нео и Гриппол ® число сероконверсий к подтипу А/H1N1 составило 89,4% и 92,6%; для подтипа А/H3N2 — 77,8% и 77,4%; для типа В — 91,2% и 76,0% соответственно. Кратность прироста титра антител у серонегативных лиц составила от 7,5 до 18,5 для Гриппола ® Нео и от 8,5 до 13,9 — для препарата сравнения.
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
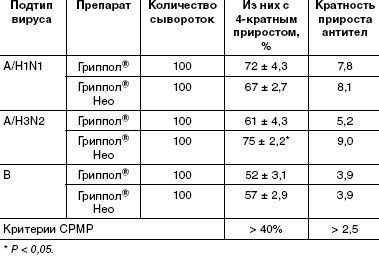
Уровень сероконверсий в целом по группам привитых для штаммов типа А составил 67–75% для вакцины Гриппол ® Нео и 61–72% для вакцины сравнения. Уровень сероконверсий для штамма В составил 57% для вакцины Гриппол ® Нео и 52% для Гриппола ® . Отметим, что в препарате сравнения содержание антигена типа В вдвое выше (11 мкг), чем в тестируемой вакцине — Гриппол ® Нео (5 мкг), однако статистически достоверных различий по иммуногенности к этому компоненту не выявлено.
Выводы и заключение
В настоящее время вакцина Гриппол ® Нео зарегистрирована (РУ № ЛСР-006029/09 от 23.07.2009 г.). Таким образом, семейство вакцин Гриппол ® пополнилось новым полноправным членом, а профилактическая медицина обрела новый инструмент для контроля такого заболевания, как грипп. Гриппол ® Нео стал первой в мире субъединичной адъювантной вакциной с клеточной технологией получения антигенов. При этом впервые вакцинация против гриппа разрешена людям с аллергией на белок куриного яйца. Исследования по расширению показаний к применению вакцины продолжаются.
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура
Полный текст:
Александр Викторович Караулов – академик РАН, д.м.н., профессор, заведующий кафедрой клинической иммунологии и аллергологии
Анатолий Сергеевич Быков – д.м.н., профессор кафедры микробиологии, вирусологии и иммунологии
103009, Москва, ул. Моховая, 11–10. +7 916 494-35-43
Наталья Владимировна Волкова – к.б.н., руководитель научно-исследовательского отдела
123112, г. Москва, Пресненская наб., д. 12, этаж 38
+7(495) 926-21-07 доб. 706
1. Gross C.P., Sepkowitz K.A. The myth of the medical breakthrough: Smallpox, vaccination, and Jenner reconsidered // Int. J. Infection Diseases. 1998. N3. P. 54–60.
2. Zepp F. Principles of vaccine design–lessons from nature // Vaccine. 2010. Vol. 28. Suppl. 3. P. 14–24.
3. Platt L.R., Estívariz C.F., Sutter R.W. Vaccine–Associated Paralytic Poliomyelitis: A Review of the Epidemiology and Estimation of the Global Burden // J. Infect. Dis. 2014. Vol. 210. Suppl 1. P. 380–389.
5. Halsey N.A., Talaat K.R., Greenbaum A., et al. The safety of influenza vaccines in children: An Institute for Vaccine Safety white paper // Vaccine. 2015. Vol. 33. Suppl 5. P. F1–F67.
6. Roux É., Yersin M.A. Contribution a l’étude de la diphthérie (2e mémoire) // Ann. Inst. Pasteur. 1889. N. 3. P. 273–288.
7. Decker W.K., Safdar A. Bioimmunoadjuvants for the treatment of neoplastic and infectious disease: Coley’s legacy revisited // Cytokine and Growth Factor Reviews. 2009. Vol. 20. P. 271–281.
9. Ramon G. Sur la toxine et sur I’anatoxine diphtheriques // Ann. Inst. Pasteur. 1924. Vol. 38. P. 1–10.
10. Glenny A., Pope C., Waddington H., et al. The antigenic value of toxoid precipitated by potassium alum // J. Pathol. Bacterial. 1926. Vol. 29. P. 31–40.
11. Glenny A.T., Pope C.G., Waddington H., et al. Immunological notes. XVII–XXIV // J. Pathol. Bacteriol. 1929. Vol. 29. P 31–40.
12. Ramon G. Sur l’augmentation anormale de l’antitoxine chez les chevaux producteurs de serum antidiphterique // Bull. Soc. Centr. Med. Vet. 1925. Vol. 101. P. 227– 234.
13. Freund, J. Some Aspects of Active Immunizatiion // Annu. Rev. Microbiol. 1947. Vol. 1. P. 291–308.
14. Freund, J. & Hosmer, E.P. Sensitization and antibody formation after injection of tubercle bacilli and paraffi n oil // Proc. Soc. Exp. Biol. Med. 1937. Vol. 37. P. 509–513.
15. Bovier P.A. Epaxal: A virosomal vaccine to prevent hepatitis A infection // Expert Rev. Vaccines. 2008. Vol. 7. P. 1141–1150.
16. Bovie P.A., Farinelli T., Loutan L. Interchangeability and tolerability of a virosomal and analuminum– adsorbed hepatitis A vaccine // Vaccine. 2005. 23. 2424–2429.
17. Saksawad R., Likitnukul S., Warachit B., et al. Immunogenicity and safety of a pediatric dose virosomal hepatitis A vaccine in Thai HIV–infected children // Vaccine. 2011. 29. 4735–4738.
18. Vacher G., Gremion C., Moser C., et al. Virosomal C. albicans vaccine for vaginal application:formulation development and toxicity/immunogenicity studies // J. Drug Del. Sci. Tech. 2012. 22(5). 447–452.
19. Herzog Ch., Hartmann K., Kunzi Valerie, et al. Eleven years of Inflexal® V– a virosomal adjuvanted influenza vaccine // Vaccine. 2009. 27.4381–4387.
20. Preis, I., Langer, R.S. A single–step immunization by sustained antigen release // J Immunol Methods. 1979. 28 (1–2). 193–197.
21. Heller, J. Polymers for controlled parenteral delivery of peptides and proteins //Adv Drug Deliv Res. 1993. 10. 163–204.
22. Lemaitre B, Nicolas E, Michaut L., et al //The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults //Cell. 1996. 86. 973–983.
23. Medzhitov R., Preston–Hurlburt P, Janeway CA Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity //Nature. 1997. 388(6640). 394–397.
24. Poltorak A., He X, Smirnova I., et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene // Science 1998. 282: 2085–2088.
25. Tomai MA, Solem LE, Johnson AG, Ribi E. The adjuvant properties of a non–toxic monophosphoryl lipid A in hyporesponsive and aging mice // J. Biol. Response Med., 1987. 6(2): 99–107.
26. Martinon F., Tschopp J. NLRs join TLRs as innate sensors of pathogens //Trends Immunol. 2005. 26: 447–454.
27. Palsson–McDermott EM, O’Neil LA Building an immune system from nine domains //Biochem. Soc. Trans. 2007. 35(Pt6: 1437–1444).
28. Didierlaurent AM, Morel S., Lockman L. et al. ASO4, an aluminum salt– and TLR4 agonist–based adijuvant system, induces a transient localized innate immune response leading to enhanced adaptive immunity // J. Immunol. 2009. 183: 6186–197.
29. Nuhn L., Hoecke L.V., Deswarte K., et al. Potent anti–viral vaccine adjuvant based on pH–degradable nanogels with covalently linked small molecule imidazoquinoline TLR7/8 agonist // Biomaterials 2018. 178: 643–651.
30. Sun H.X, Xie Y., Ye Y.P., Advances in saponin–based adjuvants // Vaccine 2009. 27(12):1787–1796.
31. Gribble E.J., Sivakumar P.V., Ponce R.A., et al. Toxicity as a result of immunostimulation by biologics// Expert Opin. Drug Metab. Toxicol. 2007. 3(2): 209–234.
32. Maubec E., Pinquier L., Viguier M., et al. Vaccination–induced cutaneous pseudolymphoma // J. Am. Acad. Dermatol. 2005. 52 (4): 623–629.
33. Tomljenovic L., Shaw CA. Mechanisms of aluminum adjuvant toxicity and autoimmunity in pediatric populations// Lupus (2012) 21, 223–230.
34. Некрасов А.В., Пучкова Н.Г., Иванова А.С. и др. Производные поли–1,4–этиленпиперазина, обладающие иммуномодулирующей, противовирусной, антибактериальной активностями. Дата подачи заявки: 06.08.1990. Дата публикации: 10.02.1997 Патент РФ № 2073031.
35. Puchkova N.G., Nekrasov A.V., Razvodovskii Ye.F. et al.. The synthesis and properties of aliphatic poly–N–oxides. Polymer Science U.S.S.R., 1980, Vol. 22, no. 6, pp. 1407–1412.
36. Некрасов А.В., Пучкова Н.Г. Полиоксидоний: основы синтеза и свойства // Иммунология. 2002. Т. 23. № 6. С. 329–333.
37. Пинегин Б.В., Ильина Н.И., Латышева Т.В. и др. Полиоксидоний в клинической практике // Под ред. Караулова А.В. – М.: ГЭОТАР–Медиа, 2008. 136 с.
38. Петров Р.В., Хаитов Р.М., Норимов А.Ш. и др. Влияние синтетических полиэлектролитов на взаимодействие Т– и В–клеток после иммунизации мышей разного генотипа искусственными антигенами (T,G)–A–L) // Бюллетень экспериментальной биологии и медицины. 1981. Т. 91. № 5. С. 590–592.
39. Хаитов Р.М. Итоги и перспективы исследований по созданию искусственных вакцин // Иммунология. 1982. № 6. С. 35–40.
40. Виноградов И.В., Кабанов В.А., Мустафаев М.И. и др. Комплексы белков с неприродными поликатионами: тимус–независимые антигены // Доклады Академии Наук СССР. 1982. Т. 263. № 1. С. 228–230.
41. Кабанов В.А., Мустафаев М.И., Некрасов А.В. и др. Критическая природа влияния степени полимеризации полиэлектролитов на их иммуностимулирующие свойства // Доклады Академии Наук СССР. 1984. Т. 274. № 4. С. 998–1001.
42. Норимов А.Ш., Некрасов А.В., Сивук Н.Е. и др. Иммуноадъювантная активность модифицированного сополимера акриловой кислоты и N–винилпирролидона // Иммунология. 1983. № 4. С. 43–45.
43. Петров Р.В., Хаитов Р.М., Некрасов А.В. и др. Вакцина против вируса гриппа и способ ее получения. Патент № 2164148. № 2000120902/14. заявл. 09.08.2000. опубл. 20.03.2001, Бюл. № 8.
44. Петров Р.М., Хаитов Р.В., Некрасов А.В. и др. Искусственные вакцины. В: Семенов Б.Ф. (ред.). Вакцины третьего поколения. М., ВИНИТИ МЗ РФ, 1987, С. 56–61.
46. Москаленко Е.П., Хаитов Р.М., Ильина С.И. и др. Разработка и оценка бесклеточной коклюшной вакцины на основе полиоксидония // Аллергия, Астма и Клиническая иммунология. 2001. № 1. С. 16–19.
48. Калюкина А.С. Изучение возможности применения рекомбинантного белка HSP70 туберкулезной микобактерии в профилактике туберкулеза. Автореферат на соискание ученой степени кандидата биологических наук. Москва, 2007.
49. Ельшина Г.А., Масалин Ю.М., Шерварли В.И. и др. Изучение гриппозной тривалентной полимер–субъединичной вакцины Гриппол в условиях контролируемого эпидемиологического опыта // Военно–медицинский журнал. 1996. СССXVII(8): 57–60.
50. Ельшина Г.А., Горбунов М.А., Шерварли В.И. др. Профилактическая эффективность тривалентной полимер–субъединичной вакцины Гриппол // Военно–медицинский журнал. 1997. СССXVII(2). 47–49.
51. Ельшина Г.А., Горбунов М.А., Бектимиров Т.А. и др. Оценка реактогенности, безвредности и профилактической эффективности гриппозной тривалентной полимер–субъединичной вакцины Гриппол при введении детям школьного возраста // Журнал микробиологии 2000. № 2. С. 50–54.
53. Слепушкин А.Н., Бурцева Е.И., Шамшева О.В. и др. Реактогенность и иммуногенность вакцины Гриппол у детей младшего школьного возраста (6–11 лет) // Аллергия, Астма и Клиническая иммунология. Новости науки и техники. 1999. 5. 3–7.
54. Панфилова Л.В., Лусс Л.В., Иванова А.С. и др. Результаты вакцинации лиц пожилого и старческого возраста гриппозной трехвалентной полимер–субъединичной жидкой вакциной Гриппол // Аллергология. 1999. № . 4. С. 19–21.
56. Хаитов Р. М., Некрасов А. В., Горбунов М. А. и др. Вакцинация Грипполом детей // Вакцинация. 2001. Т. 5. № 17. С. 56–59.
57. Хаитов Р.М., Некрасов А.В., Бектимиров Т.А. и др. Изучение безопасности и иммунопрофилактической эффективности гриппозной полимер–субъединичной тривалентной вакцины Гриппол у детей разных возрастов и взрослых, относящихся к группе риска. Новости науки и техники: Аллергия, Астма и клиническая иммунология. В: Вакцины нового поколения // Конъюгированные полимер–субъединичные иммуногены и вакцины. 2001. № 1. С. 5–7.
58. Панфилова Л.В., Лусс Л.В., Бурцева Е.И. и др. Особенности вакцинации вакциной Гриппол лиц с измененной иммунореактивностью // Современные проблемы аллергологии, иммунологии и иммунофармакологии. 2001. т.2. С. 39–42.
59. Лусс, Л.В. Панфилова Л.В. Особенности вакцинации вакциной Гриппол лиц с измененной иммунореактивностью // Современные проблемы аллергологии, иммунологии и иммунофармакологии. М. 2000. С. 39–42.
60. Булгакова В.А., Балаболкин И.И., Сенцова Т.Б. Клинико–иммунологическая эффективность субъединичных гриппозных вакцин при иммунизации детей с аллергическими болезнями // Иммунология. 2006. Т. 27. № 5. С. 298–303.
61. Кучко И.В., Семенов М.В. Клинико–иммунологические аспекты применения инактивированных гриппозных вакцин у больных туберкулезом легких // Иммунопатология, аллергология, инфектология. 2007. № 1. С. 66–72.
62. Азова Е.А., Скочилова Т.В., Воробьева В.А. Опыт вакцинации детей с сахарным диабетом 1-го типа против пневмококковой инфекции и гриппа // Педиатрическая фармакология. 2009. Т. 6. № 1. С. 96–97.
63. Костинов М.П., Тарасова А.А. Вакцинопрофилактика пневмококковой инфекции и гриппа у пациентов с аутоиммунными заболеваниями. – Москва. МВД. 2009. 252 с.
64. Матвеичев А.В., Талаева М.В., Талаев В.Ю. и др. Оценка аутоиммунного гомеостаза у лиц, вакцинированных против бактериальных и вирусных респираторных инфекций // Иммунология. 2016. Т. 37. № 5. С. 256–261.
65. WHO Weekly epidemiological record, 2007, Vol. 82. Nos. 28/29, pp. 245–260.
66. Лусс Л.В., Костинов М.П. Проблемы терапии и профилактики гриппа: мифы об опасностях поствакцинальных реакций, результаты анализа поствакцинальных осложнений после прививки против гриппа у детей Пермского края // Иммунология. 2009. № 1. С. 13–21.
67. Лусс Л.В., Костинов М.П. Результаты анализа реакций, отмеченных после вакцинации против гриппа у детей Пермского края // Consilium Medicum. 2007.– № 9 (10). С. 92–98.
70. Некрасов А.В., Пучкова Н.Г., Харит С.М. и др. Вакцина Гриппол® Нео: Результаты клинических исследований безопасности и реактогенности (фаза II) // Эпидемиология и вакцинопрофилактика. 2009. № 5(48). С. 54–60.
71. Романенко В.В., Анкудинова А.В., Аверьянов О.Ю. и др. Результаты клинического исследования профиля безопасности и эффективности гриппозной тривалентной инактивированной полимер–субъединичной вакцины Гриппол® плюс для детей от 6 месяцев до 3 лет // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2012. № 5. 75–78.
72. Харит С.М., Ерофеева М.К., Никаноров Н.Ю. и др. Безопасность вакцинации детей субъединичной адъювантной гриппозной вакциной, полученной с применением клеточной технологии: результаты двойного слепого рандомизированного исследования // Вопросы современной педиатрии. 2010. Т.9. № 4. С.44–49.
73. Романенко В.В., Осипова И.В., Лиознов Д.А. и др. Результаты клинического исследования по оценке безопасности и эффективности полимер–субъединичной адъювантной гриппозной вакцины при сочетанном применении иммуномодулятора у лиц 60 лет и старше // Эпидемиология и вакцинопрофилактика 2016. Т. 15. № 5. С.63–71.
74. Ерофеева М.К., Никоноров И.Ю., Максакова В.Л. и др. Оценка эффективности применения гриппозной вакцины Гриппол® плюс у детей школьного возраста в период эпидемии гриппа 2008–2009 годов // Эпидемиология и Вакцинопрофилактика. 2010. № 4 (53). С. 80–86.
75. Ильина Т.Н. Оценка эпидемиологической эффективности гриппозной инактивированной полимер–субъединичной вакцины при иммунизации школьников // Вопросы современной педиатрии. 2009. Т. 8. № 5. С. 48–52.
76. Шмелева Н.П., Шиманович В.П., Сивец Н.В. и др. Оценка профилактической эффективности вакцины Гриппол® плюс при массовой вакцинации организованных взрослых и детских коллективов в Республике Беларусь // Эпидемиология и Вакцинопрофилактика. 2017. Т. 16. № 5. 33–42.
78. Салтыкова Т.С., Романенко В.В., Минаева О.В. Эпидемиологическая и экономическая эффективность иммунизации взрослого работоспособного населения коммерческой гриппозной вакциной Гриппол® плюс // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2015. № 5. 65–71.
79. Костинов М.П., Черданцев А.П., Сависько А.А. и др. Истинные и ложные реакции у беременных на введение вакцины против гриппа // Вопросы гинекологии, акушерства и перинатологии. 2011. Т. 10, № 6. С. 44–48.
80. Черданцев А.П., Костинов М.П., Кусельман А.И. и др. Вакцинация беременных против гриппа А(H1N1) // Журнал микробиологии, эпидемиологии и иммунобиологии, 2011, № 4, С. 46–50.
81. Костинов М.П., Черданцев А.П., Шмитько А.Д. и др. Иммуногенность иммуноадъювантной вакцины против гриппа у беременных // Инфекция и иммунитет. 2017. Т. 7, № 2, С. 193–202. doi: 10.15789/2220–7619–2017–2–193–202.
82. Костинов М.П., Черданцев А.П., Семенова С.С. и др. Акушерские и перинатальные исходы после вакцинации против гриппа или перенесенной респираторной инфекции // Гинекология. 2015. Т. 17. № 4. С. 43–46.
83. Костинов М.П., Черданцев А.П. Состояния здоровья грудных детей, рожденных от вакцинированных против гриппа беременных // Педиатрия, 2016. № 1. С. 67–71.
84. Бойцов С.А., Лукьянов М.М., Платонова Е.В. и др. Исследование эффективности и безопасности вакцинопрофилактики гриппа у пациентов с болезнями системы кровообращения // Профилактическая медицина. 2014. № 6. С. 13–20.
85. Бойцов С.А., Лукьянов М.М., Платонова Е.В. и др. Оценка эффективности вакцинопрофилактики гриппа по данным проспективного контроля у лиц, находящихся под диспансерным наблюдением по поводу болезней системы кровообращения // Рациональная фармакотерапия в кардиологии 2016. Т. 12. № 6. С. 703–710.
86. Чебыкина А.В., Костинов М.П., Магаршак О.О. Оценка безопасности и эффективности вакцинации против гриппа пациентов с бронхообструктивным синдромом // Эпидемиология и вакцинопрофилактика. 2010. Т. 55. № 6. С. 50–53.
87. Костинов М.П., Чучалин А.Г. Чебыкина А.В. Особенности формирования поствакцинального иммунитета к гриппу у пациентов с хронической бронхо–легочной патологией // Инфекционные болезни. 2011. Т. 9. № 3. С. 1–6.
88. Андреева Н.П., Петрова Т.И., Костинов М.П. Влияние активной иммунизации против гриппа и пневмококковой инфекции у детей с бронхиальной астмой на течение заболевания и микробный спектр мокроты // Российский аллергологический журнал. 2006. № 5. С. 31–35.
89. Тарасова А.А., Колбасина Е.В., Лукушкина Е.Ф. и др. Иммуногенность и безопасность трехвалентной иммуноадъювантной субъединичной противогриппозной вакцины у детей с сахарным диабетом 1–го типа: результаты проспективного сравнительного исследования // Вопросы современной педиатрии. 2016. Т. 15. № 5. С. 489–496.
90. Протасов А.Д., Жестков А.В., Лаврентьева Н.Е. и др. Эффект комплексной вакцинации против пневмококковой, гемофильной типа b инфекции и гриппа у пациентов с хронической обструктивной болезнью легких // Журнал микробиологии, эпидемиологии и иммунобиологии, 2011, № 4, C. 80–84.
91. Коновалов И.В., Шамшева О.В., Ельшина Г.А. Безопасность и иммунологическая эффективность сочетанной иммунизации детей в возрасте 6—7 лет вакцинами Национального календаря профилактических прививок // Детские инфекции. 2013. Т. 11. № 1. C. 14–17.
92. Галицкая М.Г., Бокучава Е.Г. Оценка безопасности двух субъединичн.ых противогриппозных вакцин у детей с отягощенным аллергоанамнезом // Детские инфекции, 2013, Т. 12, № 4, C. 35–38.
93. Харит С.М., Рулева А.А., Голева О.В. и др. Результаты сочетанного введения вакцины против гриппа и вакцин Национального календаря прививок у детей с соматической патологией и иммунодефицитными состояниями // Вопросы современной педиатрии. 2014. Т. 13. № 1. С. 76–82.
94. Рулева А.А., Харит С.М., Фридман И.В. и др. Результаты исследования по сравнительной оценке реактогенности и иммуногенности гриппозных инактивированных вакцин // Медицинский совет. 2016. № 5. С. 47–51.
96. Костинов М.П., Ахматова Н.К., Хромова Е.А. и др. Влияние адъювантной и неадъювантной вакцин против гриппа на эффекторы врожденного и адаптивного иммунитета. Под ред. Шайлендра К. Саксена, 2018.
97. Лиознов Д.А., Харит С.М., Ерофеева М.К. и др. Оценка реактогенности и иммуногенности вакцины гриппозной четырехвалентной инактивированной субъединичной // Эпидемиология и вакцинопрофилактика. 2018. Т. 17. № 3. С. 57–62.
98. Михайлова Н.А., Биткова Е.Е., Хватов В.Б. и др. Опыт применения вакцины Пиопол для иммунизации доноров–добровольцев // Иммунология 2006. Т. 27. № 2. С. 80–83.
100. Пономарева Т.С., Дерябин П.Н., Каральник Б.В. и др. Влияние полиоксидония на иммуногенную и протективную активность живой чумной вакцины // Иммунология, 2014, № 5, С. 286–290.
102. Кравцов А.Л., Курылина А.Ф., Клюева С.Н. и др. Модулирующий эффект Полиоксидония на реактивность клеток иммунной системы при формировании противочумного иммунитета // Иммунология. 2016. Т. 37. № 6. С. 320–325.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

Ростех к 2022 году планирует войти в пятерку крупнейших в мире производителей основного компонента вакцин от гриппа – гемагглютинина.
Красивый и с шипами: как устроен вирус гриппа
Когда мы видим названия штаммов гриппа, вроде A(H1N1) или A(H3N2), то H и N – это обозначения гемагглютинина и нейраминидазы. Именно эти два белка обусловливают такие свойства вируса гриппа, как иммуногенность и изменчивость.
Простыми словами описать работу этих белков можно так – гемагглютинин обеспечивает прикрепление вируса к клетке, а нейраминидаза отвечает за способность вирусной частицы проникать в клетку хозяина и выходить из нее после размножения. Некоторые противовирусные препараты как раз подавляют работу нейраминидазы, чтобы вирусные частицы не могли мигрировать в новые клетки.
Гемагглютинин является основным компонентом гриппозных вакцин, так как именно он индуцирует в организме человека образование защитных антител. На сложной трехмерной структуре этого белка располагаются такие участки, которые очень важны с точки зрения профилактики гриппа, – это так называемые антигенные домены. Когда антитела образуются, они блокируются именно с этими участками и лишают вирус возможности входить в клетку. Но вирус гриппа пытается любыми путями обмануть иммунную систему человека. В структуре его поверхностных белков происходят различного рода мутации, которые приводят к изменению свойств вируса, или его дрейфу.
Нейраминидаза также меняется. Возможно изменение одного или двух антигенов одновременно. В настоящее время известны 18 подтипов гемагглютининов (Н1 – Н18) и 11 подтипов нейраминидаз (N1 – N11).
Вариантов вируса гриппа очень много, они подразделяются на типы: А, B, С. Вирусы гриппа А являются самыми опасными,так как именно они ответственны за пандемии и тяжелые эпидемии. Эти возбудители более патогенны и заразны, чем вирусы гриппа В и С. Дело в том, что вирус А содержит два типа нейраминидазы (N1, N2) и четыре типа гемагглютинина (Н0, H1, H2, НЗ), благодаря чему он более изменчив, а вирусы В не подразделяются на подтипы (только на две линии). Вирус гриппа С содержит только гемагглютинин и не содержит нейраминидазу. Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, только лишь приводят к заболеваниям в легкой и бессимптомной форме у детей и пожилых пациентов.
В эпидемическом 2019-2020 гг. в Северном полушарии, по данным ВОЗ, будут доминировать следующие штаммы: A/Brisbane/02/2018 (H1N1)pdm09; A/Kansas/14/2017 (H3N2); B/Colorado/06/2017 (линия B/Victoria-подобных); B/Phuket/3073/2013 (линия B/Yamagata-подобных). Первые три предназначены для трехвалентных вакцин от гриппа, четвертый – дополнительный штамм для включения в четырехвалентные вакцины.
О том, какие виды гриппа будут угрожать в текущем году, ВОЗ объявляет заранее, до начала эпидсезона. Для этой цели Организация имеет сеть лабораторий – 149 Национальных лабораторий по гриппу в 121 стране, которые во время эпидемий выделяют от больных штаммы, изучают антигенные и генетические свойства, определяют наиболее актуальные из них. Специалисты ВОЗ анализируют также многие другие факторы – перемещение людей, миграция птиц. На основе всей этой информации и прогнозируется перечень опасных штаммов. В этом году ВОЗ предоставила производителям вакцин актуальные штаммы в конце марта, на месяц позже обычного, – эксперты долго не могли определить, какой штамм вируса A/H3N2 нужно включать в вакцины.
Во многих развитых странах сегодня переходят на четырехвалентную вакцину от гриппа, то есть содержащую два актуальных штамма А и два актуальных штамма гриппа B. Отечественная четырехвалентная вакцина прошла регистрацию в Минздраве в июле 2019 года. В этом сезоне ею будут прививать тех, кто в группе риска – работников социальной сферы, транспорта и здравоохранения. Полностью на прививки с четырьмя штаммами Россия перейдет к 2023 году. Кстати, наша страна является седьмой в мире, где по полному циклу производится четырехвалентная вакцина.
Новая защита: белок вместо целого вируса
Позже ученые поняли, что целый вирус для вакцины не нужен, можно использовать только белок, на который, собственно, и формируется иммунный ответ. То есть теперь для защиты от гриппа человек получает лишь порцию белка гемагглютинина – 15 мкг на каждый штамм гриппа.

Завершающая стадия производства выполняется в стерильных асептических зонах, в которых гемагглютинин от четырех вирусов объединяется в одном реакторе. После чего следует автоматический розлив вакцины в шприцы. Готовые шприцы с вакциной попадают в зону инспектирования и этикетирования препарата. Там они проверяются на отсутствие повреждений и соответствие дозе с помощью автоматических оптических камер, а затем на них наклеивается этикетка.
Сейчас вакцинация от гриппа в самом разгаре. Традиционно пик распространения гриппа приходится на конец января – начало февраля, но начаться волна может уже в ноябре. Организму требуется 2–4 недели, чтобы выработать иммунитет после прививки. Поэтому сейчас самое время задуматься о прививке. Напоминаем, что у вакцинации есть противопоказания, поэтому не забудьте проконсультироваться с врачом.
И напоследок немного статистики:
– около 35 млн больных гриппом каждый год фиксируется в России;
– грипп ежегодно становится причиной 250-500 тыс. смертей и 3-5 млн случаев серьезных заболеваний;
– своевременная вакцинация на 60-80% предотвращает заболеваемость гриппом и осложнений после болезни у людей среднего возраста.
Кардиостимулятор: сердце в правильном ритме
Читайте также:


