Хронический гепатит в частота цирроза печени
При хроническом вирусном гепатите С в сочетании с циррозом печени высокие дозы пегинтерферона a- 2а способствуют поддержанию ремиссии, оцениваемой по вирусологическим и биохимическим показателям
Translated, with permission of the ACP—ASIM, from "High-dose peginterferon a- 2а sustained virologic and biochemical response in chronic hepatitis C infection with cirrhosis". ACP J Club 2001;135:52. Abstract of: Heathcote E.J., Shiffman M.L., Cooksley W.G., et al. Peginterferon alfa-2a in patients with chronic hepatitis C and cirrhosis. N Engl J Med 2000;343:1673—80, and from the accompanying Commentary by T. Shehab and P. Schoenfeld.
Сравнить эффективность и безопасность пегинтерферона a- 2а и немодифицированного интерферона a- 2а при вирусном гепатите С в сочетании с циррозом или мостовидным фиброзом печени.
Рандомизированное (со скрытым отнесением участников к той или иной группе) слепое (для исследователей, оценивавших клинические исходы) контролируемое испытание, продолжительность наблюдения — 72 нед.
30 клинических центров в США, Канаде, Австралии и Великобритании.
271 больной (средний возраст 47 лет, 72% мужчины) с хроническим вирусным гепатитом С и подтвержденным при биопсии циррозом или мостовидным фиброзом печени. Критерии включения: повышение активности аминотрансфераз, выявленное дважды за последние 6 мес, биопсия печени в течение предшествующего года. Критерии исключения: другие болезни печени, декомпенсированный цирроз печени, ВИЧ-инфекция, психические расстройства, судорожные припадки, тяжелое заболевание сердца, ретинопатия, злокачественные новообразования, нейтропения или тромбоцитопения, концентрация a- фетопротеина >100 нг/мл. Анализ данных проводили исходя из допущения, что все больные получали назначенное лечение; в анализ были включены данные о всех больных.
96 больных получали пегинтерферон a- 2а в дозе 90 мкг 1 раз в неделю, 87 больных — пегинтерферон a- 2а в дозе 180 мг 1 раз в неделю, 88 больных— немодифицированный интерферон a- 2а в дозе 3 млн ед 3 раза в неделю. Все препараты вводили п/к в течение 48 нед. При возникновении побочных эффектов дозу уменьшали.
Стойкая ремиссия, оцениваемая по вирусологическим (отрицательный результат определения вируса гепатита С) и биохимическим (нормали зация активности аминотрансфераз через 72 нед) показателям.
В обеих группах пегинтерферона через 48 нед отмечено больше случаев стойкой ремиссии, оцениваемой по вирусологическим и биохимическим показателям (р Ј 0,004), чем в группе немодифицированного интерферона. В группе высоких доз пегинтерферона через 72 нед стойкая ремиссия наблюдалась чаще, чем в группах низких доз пегинтерферона и немодифицированного интерферона (р a- 2а в дозе 180 мкг/нед — более эффективное средство достижения стойкой ремиссии (оцениваемой по вирусологическим и биохимическим показателям), чем пегинтерферон a- 2а в дозе 90 мкг/нед или немодифицированный интерферон a- 2а в дозе 3 млн ед 3 раза в неделю.
Источник финансирования: F. Hoffmann-LaRoche.
Адрес для корреспонденции: Dr. E.J. Heathcote, University Health Network, Toronto Western Hospital, 399 Bathurst Street, Toronto, Ontario M5T 2S8, Canada. FAX 416-603-9195.

Приблизительно 3 млн американцев заражены вирусом гепатита С, причем у 10—20% из них в течение 20 лет после инфицирования развивается цирроз печени. Комбинированная терапия немодифицированным интерфероном и рибавирином позволяет добиться ремиссии (по вирусологическим показателям) примерно у 40% больных без цирроза печени и, таким образом, отсрочить развитие этого осложнения. Поскольку добиться ремиссии при циррозе печени значительно труднее, таким больным часто не назначают противовирусную терапию. Эффективность лечения больных с циррозом не установлена. Клиническую значимость противовирусной терапии у этих больных можно оценить по замедлению развития декомпенсированного цирроза или рака печени.
E.J. Heathcote et al. провели самое крупное на сегодняшний день испытание противовирусной терапии у больных с циррозом и вирусным гепатитом С и получили впечатляющие результаты. В этом тщательно организованном испытании авторы сравнивали новый препарат интерферона — пегинтерферон a- 2а, в разных дозах и немодифицированный интерферон. Среди больных, получавших высокие дозы пегинтерферона a- 2а, отмечено больше случаев улучшения гистологических показателей, нормализации уровня аминотрансфераз и уничтожения вируса гепатита С. Частота развития побочных эффектов во всех группах была одинаковой.
Таким образом, у больных с вирусным гепатитом С и циррозом печени пегинтерферон более эффективен, чем немодифицированный интерферон, и столь же безопасен. Однако в этом, как и во многих других испытаниях терапии вирусного гепатита C, использовались только косвенные критерии оценки. В дальнейшем необходимо провести исследования, в которых оценивались бы клинически значимые исходы, такие как отсрочка развития декомпенсированного цирроза или рака печени. Кроме того, немодифицированный интерферон обычно применяют вместе с рибавирином. В настоящее время проводятся исследования, в которых сравниваются пегинтерферон и немодифи цированный интерферон у больных, получающих одновременно рибавирин. Учитывая все это, дать однозначные рекомендации по лечению больных с вирусным гепатитом С и циррозом печени пока нельзя. Решение о назначении лечения таким больным должно приниматься индивидуально.
Thomas Shehab, MD
Philip Schoenfeld, MD, MSEd, MSc (Epi)

Вирусы гепатитов В, С, D являются основными причинами формирования цирроза печени. Следствием развития цирроза печени является ее неспособность выполнять свои основные функции, что приводит к нарушению деятельности всего организма и, нередко, к летальному исходу. Цирроз печени имеет необратимый характер, что является важным прогностическим показателем с необходимостью своевременного назначения лечения и профилактических мер. Вирусные гепатиты В и С приводят к развитию цирроза в 15–26 % от всех случаев случаев хронической инфекции. По данным динамического клинического наблюдения, цирроз печени у хронических носителей HBsAg наблюдается в 10 % случаев, по данным же морфологического контроля – в 20–60 % [1]. А в государствах Центральной Азии частота цирроза печени, из числа носителей HBsAg, достигает примерно 2 % в год.
Согласно нашим наблюдением, при хроническом гепатите С, цирроз печени развивается преимущественно у лиц старше 50 лет, где он обнаруживается примерно, в 50 % случаев от общего числа лиц этого контингента. При этом наиболее высока частота формирования цирроза в случае HCV – генотипом 1b [2]. По другим источникам, частота формирования цирроза печени различными генотипами HCV почти одинакова [3]. Следовательно, этиологический диагноз требует неотъемлемой индикации специфических маркеров HCV (HCV-РНК, анти-HCV).
При хроническом ГD заболевание протекает с высокой степенью циррозогенности. При этом в сравнении с хроническими сывороточными гепатитами иной этиологии, цирроз печени развивается гораздо чаще и в гораздо ранние сроки. Так, уже в ранние сроки выявляются отечно-асцитический синдром. При хронических гепатитах наблюдается ряд и других осложнений, таких как портальная гипертензия, спленомегалия и кровотечения из варикозных вен пищевода [4, 5].
В данное время в мире частота цирроза печени составляет около 20–40 случаев на 100 тыс. населения. Однако этот показатель все же неуклонно возрастает. Ежегодно от цирроза печени умирает около 2 млн человек. Совместно цирроз и рак печени оказываются причиной 90–95 % от всех случаев летальных исходов при хронических заболеваниях печени. Цирроз печени входит в список основных причин смерти. Смертность населения от цирроза печени в возрасте от 35 до 60 лет доходит до 14–30 случаев на 100 тыс. населения. Частота развития цирроза печени у мужчин выше, чем у женщин, примерно в 1,5–3 раза [6]. Однако у 10–20 % больных истинную причину цирроза печени установить все же не удается.
Большое количество больных циррозом печени, наблюдавшихся в Кыргызской Республике (38,8 на 100 тыс. нас. 2017 г.), обусловило и высокую летальность. Показатели смертности от цирроза печени в Республике колеблются в пределах 37,7–25,5 на 100 тыс. нас. на протяжении 10 лет наблюдения. Остаются, однако, на высоком уровне высокие показатели смертности среди трудоспособного населения. В связи с этим данная проблема показывает особую актуальность в Кыргызской Республике, и для ее решения требуется этиологическая верификация хронических вирусных гепатитов, особенно в цирротической стадии. Это необходимо в целях уточнения диагноза и организации адекватных лечебно-профилактических мероприятий.
Цель исследования: изучение этиологической верификации цирроза печени.
Материалы и методы исследования
В целях этиологической верификации возбудителя цирроза печени нами были отобраны 260 пациентов амбулаторно-поликлинической сети и стационарных учреждений, имевших диагноз цирроз печени. У них производились биохимические анализы крови, включающие определение активности ферментов АСТ и АЛТ, тимоловой пробы, уровней билирубина, содержание общего белка и его фракций, выявление специфических маркеров вирусов гепатитов.
Этиологически документированный диагноз хронических вирусных гепатитов устанавливали на основании выявления в крови маркеров инфицирования вирусами ВГВ (HbsAg, HBc-IgM IgG, HBeAg), ВГD (HDV-IgG), ВГС (HCVIg(total). Тесты на наличие ДНК – ВГВ и РНК – ВГС проводили с помощью полимеразно-цепной реакции (ПЦР). При неверифицированных случаях нами проводились АNА, AМА исследования в целях исключения аутоиммунного цирроза.
Для диагностики цирроза печени дополнительно использовали следующие инструментальные методы: ультразвуковое исследование, компьютерная томография и фиброскан исследования.
Результаты исследования и их обсуждение
Группа обследованных больных состояла из лиц мужского пола – (58 %) и женщин (42 %). Среди больных с циррозом печени преобладали взрослые люди (рис. 1).
Приведенные на рис. 1 данные показывают, что заболеванию циррозом печени в наибольшей степени подвержены люди 55–59-летнего возраста. Среди детей отмечен лишь один случай.
Рис. 2 показывает, что основной причиной цирроза печени является инфицирование вирусами гепатитов. У обследуемых пациентов был диагностирован хронический гепатит дельта (ХГD) – 48 %, хронический гепатит С – 24 %, хронический вирусный гепатит В – 18 %, алкогольный гепатит – 2,6 %, а аутоиммунный гепатит – 1,6 % пациентов, 0,8 % – составил токсический гепатит. В 5 % случаев причину цирроза печени выявить не удалось.
Существенную роль в развитии прогрессирующего цирроза печени, на наш взгляд, сыграло превалирование репликативной фазы хронических вирусных гепатитов В и С (35/74 %, и 54/87 %) соответственно. Маркеры гепатитов В и С определялиcь методом ПЦР, констатирующим виремию (таблица).
Результаты исследования, представленные в табл. 1, показали, что у 125 больных с хроническим вирусным гепатитом D осложнившимся циррозом печени, на момент исследования методом ПЦР была выявлена повышенная репликация вируса HDV-инфекции (91/73 %). Эти данные свидетельствует о том, что HDV приводит к подавлению вируса гепатита В, что согласуется с мнением других авторов. У 18 % пациентов отмечена одновременная репликация ДНК HBV и РНК HDV – инфекций.
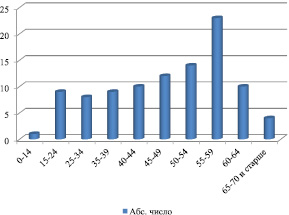
Рис. 1. Возрастная структура больных с циррозом печени (n = 260)
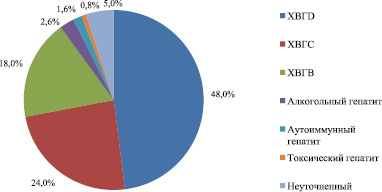
Рис. 2. Этиологическая структура циррозов печени (n = 260)
Наибольшее число хронических вирусных гепатитов представлено вариантом РНК-НСV. Учитывая клиническую диагностику генотипов HCV, было проведено изучение определяющих этих генотипов тяжесть заболевания и исход, во взаимосвязи с циррозом печени. Нами была обследована группа больных из 54 человек, которые имели в сыворотках крови РНК-HCV согласно сведениям ПЦР (рис. 3).
Впоследствии определения типа генотипов HCV получены следующие итоги: тип 1а выявлен у 5 человек (9 %), 1b – у 36 человек (67 %), 2 – у 4 (7 %) человек. 3а выявлен у 7 пациентов (13 %), у 2 человек (4 %) генотип РНК HCV не типировался (рис. 3).
Таким образом, из всех форм генотипов хронического вирусного гепатита С, наибольшее количество приходится на HCV генотипа 1b. У всех больных клинически был ярко выражен астеновегетативный синдром, проявлявшийся слабостью и повышенной утомляемостью. Диспепсический синдром (тошнота, рвота) наблюдался у 92 % больных. У 8 больных в клинической картине болезни имела место желтуха. Более чем у половины больных течение заболевания осложнялось геморрагическим синдромом, проявлениями которого были носовое кровотечение, кровоточивость из десен, кровотечение из варикозных вен пищевода, петехиальная сыпь. У всех пациентов наблюдался также синдром портальной гипертензии. Большинство пациентов 67 % имели клинически выраженные асцит и отеки нижних конечностей. У 87 % больных отмечены спленомегалия и внепеченочные знаки (телеангиэктезия и пальмарная эритема).
Далее приведено описание клинической картины и вирусологические, биохимические сведения пациента хроническим гепатитом С, у которого был отмечен цирроз печени.
Результаты детекции ДНК HBV, РНК HDV и РНК HCV, в сыворотке крови больных с циррозом печени (n = 234)
По этиологии и патогенезу выделяют следующие формы хронического гепатита:
- хронический вирусный гепатит В,
- хронический вирусный гепатит С,
- хронический вирусный гепатит D,
- аутоиммунный гепатит,
- лекарственный гепатит,
- криптогенный хронический гепатит.
Кроме того, ряд других заболеваний печени может иметь клинико-лабораторные и гистологические признаки хронического гепатита - это болезнь Вильсона-Коновалова, альфа 1-антитрипсиновая недостаточность, начальные стадии первичного билиарного цирроза, первичного склерозирующего холангита.
Хронический вирусный гепатит В, С - воспалительное заболевание печени, обусловленное инфекцией вируса гепатита В (HBV) или С (HCV), способное прогрессировать до цирроза печени. Хронический гепатит В развивается приблизительно у 5% больных с желтушной формой острого гепатита. НСV -инфекция является причиной 70% случаев хронического вирусного гепатита, 40% - цирроза печени и 60% - гепатоцеллюлярной карциномы в мире. Основные пути передачи HBV и HCV-инфекций - парентеральный (контакт с кровью или инфицированным медицинским инструментарием), половой, перинатальный.
Хронический вирусный гепатит В и С характеризуется клиническими проявлениями, складывающимися из поражения печени и/или признаков внепеченочных поражений. Первые клинические симптомы часто проявляются спустя годы или десятилетия после инфицирования. Выделяют астенический, диспепсический, желтушный синдромы, увеличение печени и селезенки. Среди внепеченочных проявлений определяется кожная пурпура, артриты, миалгии, нефротический и мочевой синдромы и другие.
Аутоиммунный гепатит - хронический процесс в печени неизвестной этиологии, механизм развития которого связан с агрессией собственной иммунной системы против компонентов ткани печени.
Аутоиммунный гепатит характеризуется пери-портальным или более обширным воспалительным процессом, наличием гипер- g -глобулинемии и тканевых аутоантител, который в большинстве случаев отвечает на иммунносупрессивную терапию. В качестве основного фактора патогенеза аутоиммунного гепатита рассматривается генетическая предрасположенность. Для реализации процесса необходимы запускающие агенты - вирусы, лекарственные препараты и другие факторы окружающей среды. Выделяют аутоиммунный гепатит 3 типов соответственно профилям выявляемых аутоантител. Аутоиммунный гепатит характеризуется широким спектром клинических проявлений - от бессимптомного до тяжелого, иногда фульминантного гепатита с наличием или отсутствием внепеченочных признаков. При первичном обследовании клинические признаки цирроза печени обнаруживают у 25% больных. Внепеченочные проявления аутоиммунного гепатита - лихорадка, кожные васкулиты, артралгии и артриты, миалгии, полимиозит, лимфоаденопатия, плеврит, перикардит, миокардит, тиреодит Хашимото, гломерулонефрит, язвенный колит, сахарный диабет, гемолитическая анемия и др.
Дефицит α1-антитрипсина является первым по частоте врожденным метаболическим дефектом с аутосомно-кодоминантным типом наследования, вызывающим поражение печени с холестазом и цирроз печени у детей.
Дефицит ингибитора трипсина α1-антитрипсина приводит к повышению активности протеаз, что вызывает повреждение тканей легких, поджелудочной железы, почек. Механизм хронического поражения печени при дефиците α1 -антитрипсина до конца не изучен, его связывают с накоплением α1 -антитрипсина в ткани печени.
Дефицит α1 -антитрипсина клинически характеризуется следующими симптомами - гепатомегалия, реже спленомегалия, желтуха в раннем возрасте. В ряде случаев выявляется патология со стороны легких, поджелудочной железы, почек.
Дефицит α1 -антитрипсина - диагностика:
- исследование функциональных проб печени;
- определение 1-антитрипсина, α1 -глобулинов в сыворотке крови;
- ультразвуковое исследование органов брюшной полости;
- гистологические исследование биоптата печени;
- выявление мутаций гена, ответственного за дефицит α1 -антитрипсина в гомозиготном состоянии при приведении генетического исследования.
Цирроз печени - хроническое диффузное прогрессирующее заболевание печени. Анатомически характеризуется фиброзом, образованием узлов-регенератов, нарушающих дольковую архитектонику органа, и перестройкой внутрипеченочного сосудистого русла.
Этиологические факторы цирроза печени следующие:
- вирусы гепатита В,С, D;
- генетически обусловленные метаболические нарушения - гемохроматоз, болезнь Вильсона-Коновалова, дефицит α1 -антитрипсина, гликогеноз IV типа, галактоземия, наследственная тирозинемия;
- длительный внутри- и внепеченочный холестаз;
- нарушение венозного оттока из печени - синдром Бада-Киари, вено-окклюзионная болезнь и др.;
- токсины и лекарства;
- шунтирующие операции на кишечнике с выключением значительной части тонкой кишки.
Первичный билиарный цирроз представляет собой хроническое воспалительное холестатическое заболевание печени неизвестной (предположительно иммунной) этиологии, ведущее к прогрессирующей необратимой деструкции мелких внутридольковых и септальных желчных протоков. Как и другие аутоиммунные заболевания, первичный билиарный цирроз ассоциируется с внепеченочными аутоиммунными синдромами - тиреоидитом, коллагеновыми болезнями, гломерулонефритом, язвенным колитом. Клинически первичный билиарный цирроз проявляется гепатос-пленомегалей, астеническим синдромом, кожным зудом, позднее желтухой, гиперпигментацией кожных покровов с ксантелазмами и ксантомами.
Первичный склерозирующий холангит - хроническое холестатическое заболевание печени предположительно аутоиммунной природы, характеризующееся воспалением и фиброзом внутри- и внепеченочных желчных протоков. Поражение желчных протоков является необратимым и приводит к выраженному холестазу, формированию цирроза печени и развитию печеночной недостаточности. Первичный склерозирующий холангит может осложняться бактериальным холангитом, стриктурами желчных ходов, желчно-каменной болезнью, высок риск развития холангиокарциномы. Клинически первичный склерозирующий холангит характеризуется астено-вегетативными проявлениями, кожный зудом, желтухой. Первичный склерозирующий холангит более чем у 75% больных сочетается с воспалительными заболеваниями кишечника: язвенным колитом или болезнью Крона.
Особенности структуры и репликации вируса гепатита В описаны в главе 3.
Эпидемиология. Примерно 5% населения Земли – это хронические носители HBV. Распространенность этого вируса широко варьирует в различных отделах земного шара и составляет от 8% до 15% на Дальнем, Среднем Востоке и в Африке и только 0,2% - 1% - в Западной Европе и США (рис.4.1). Россия относится к странам со средней степенью распространенности HBV инфекции (
7%). Заболеваемость гепатитом В в России растет: в 1991 г. она составляла 17.9 на 100 тыс. населения, а к 1999 г. увеличилась до 43.5 на 100 тыс. населения. Параллельно увеличивается частота носительства HBV инфекции: с 2.1. на 100 тыс. в 1992 г. до 82.0 на 100 тыс. в 1999г. В эпидемический процесс интенсивно вовлекаются люди молодого возраста (15 - 30 лет), на долю которых приходится около 90% от общего количества заболевших этой инфекцией. Объяснить такой возрастной состав могут доминирующие пути передачи HBV инфекции в настоящее время: внутривенная наркомания и половой путь. В 1999 г. половым путем заразилось 51.5%, при внутривенном введении наркотиков – 30.1% лиц. Молодые люди в возрасте до 30 лет по данным формы Госстатучета №2 составляют 80% умерших от гепатита В. 42% летальных исходов обусловлено одновременным инфицированием HBV, HCV и HDV. Следует отметить, что удельный вес внутрибольничной заболеваемости HBV-инфекцией в структуре общей заболеваемости населения ежегодно снижается: от 34.1% в 1993г. до 3.3% в 1999г.

Рис. 4.1. Географическое распределение хронических носителей HBC-инфекции
Пути передачи HBV и группы риска инфицирования описаны в главе 3.
Риск хронизации острого гепатита В напрямую связан с возрастом пациента в момент инфицирования. У взрослых с нормальной иммунной системой ХГВ развивается менее, чем в 5% случаев. Среди детей, инфицированных в возрасте от 1 до 5 лет, хронический процесс возникает в 30% случаев, для новорожденных эта цифра возрастает до 90%. Приблизительно у 0,1 – 0,5% больных с острым гепатитом В развивается фульминантная печеночная недостаточность, смертность от которой без трансплантации печени составляет 80%.
Течение HBV инфекции. Естественное течение HBV-инфекции определяется взаимоотношениями вируса и иммунного ответа организма. Дополнительное значение имеет возраст пациента в момент его инфицирования. Прогрессированию заболевания могут способствовать пол (см. ниже), употребление алкоголя и сочетание HBV с другими вирусами гепатитов.
В целом, хроническая HBV инфекция разделяется на две фазы: ранняя репликативная фаза с острым процессом в печени и поздняя нерепликативная фаза с ремиссией заболевания (рис. 4.2).

Рис. 4.2. Естественное течение хронической HBV-инфекции
Для детей, инфицированных внутриутробно, выделяют дополнительную фазу - иммунной толерантности, при которой репликация вируса не сопровождается какими-либо симптомами заболевания.
У внутриутробно инфицированных больных первая фаза инфекции характеризуется высоким уровнем репликации HBV (наличие HBeAg и HBV DNA в сыворотке крови) без клинических признаков болезни, с нормальным уровнем АЛТ и минимальными изменениями при биопсии печени. Это объясняется иммунной толерантностью организма к HBV, причины которой окончательно не известны.
Переход ко второй фазе (иммунного клиренса) у этих больных происходит в возрасте от 15 до 35 лет. Данный процесс сопровождается спонтанным клиренсом HBeAg, средняя частота которого составляет 10% -20% в год (рис. 4.2, б). Иммунный клиренс может протекать бессимптомно, или сопровождаться клиническими признаками ОГВ. Иногда в этот период появляются антитела класса IgM к HBcAg, что может быть причиной неправильной диагностики ОГВ у ранее нераспознанных носителей инфекции. Такие обострения заболевания приблизительно в 2,5% случаев приводят к его декомпенсации или фульминантной печеночной недостаточности. Предполагается, что пусковым фактором иммунного клиренса инфекции является увеличение вирусной нагрузки или изменения в презентации вирусных антигенов иммунокомпетентным клеткам.
Клинические обострения не всегда сопровождаются сероконверсией HBeAg и исчезновением HBV DNA. Недостаточный иммунный ответ в некоторых случаях приводит к прекращению иммунного клиренса инфекции, в результате чего формируется хроническое рецидивирующее заболевание. Повторные эпизоды некровоспалительной активности могут приводить к формированию цирроза печени и повышать риск развития гепатоцеллюлярной карциномы (ГЦК). Рецидивирующее течение заболевания чаще встречается у мужчин, чем у женщин. Причина этого факта не ясна.
Инфицированные во взрослом возрасте пациенты чаще имеют следующий тип течения хронической инфекции (рис. 4.2, а): во время первой репликативной фазы имеются клинические признаки заболевания, повышение уровня АЛТ и наличие HBeAg и HBV DNA в сыворотке крови; при гистологическом исследовании ткани печени - картина хронического гепатита. Частота спонтанной сероконверсии HBeAg также составляет в среднем 10 – 20% в год. Однако, рецидивы обострений значительно реже сопровождаются сероконвесией HBeAg в anti-HBe.
Во время третьей фазы заболевания у перинатально инфицированных и второй фазы у инфицированных взрослых происходит сероконверсия, т.е. пациенты становятся HBeAg-негативными и у них появляются anti-HBe. В этот период заболевание входит в фазу ремиссии, хотя в сыворотке крови может сохраняться и циркулировать HBsAg. Частота отсроченного клиренса HBsAg в среднем составляет 0,5 – 2% в год.
В целом, при заражении HBV последовательность событий такова: из числа всех инфицированных лиц приблизительно 70% - 80% становятся бессимптомными носителями, у 10 – 30% формируется хронический гепатит; самостоятельное разрешение хронической HBV инфекции также возможно. За 10 – 50 лет существования хронического гепатита у пациента может сформироваться цирроз печени, что служит фоном для развития ГЦК. Риск развития ГЦК составляет, в среднем, 4% в год у больных с ЦП (рис. 4.3).

Рис. 4.3. Течение гепатита B
Клиническая картина. В странах с низкой и средней частотой распространенности HBV инфекции приблизительно 1/3 –1/2 больных ХГВ в прошлом переносят клинически манифестный ОГВ, который постепенно прогрессирует в хроническую форму. Оставшиеся пациенты, а также лица с ХГВ, проживающие в эндемичных для этой инфекции зонах, часто не имеют анамнестических указаний на острую фазу инфекции.
В эндемичных районах основной путь заражения HBV – вертикальный: от инфицированной матери к ребенку. В результате в таких регионах у 9 человек из 10 от всех инфицированных к моменту достижения ими взрослого состояния уже имеется хроническая инфекция.
Специфических симптомов хронической HBV инфекции не существует (табл. 4.1). У большинства больных вообще отсутствуют какие-либо клинические признаки заболевания.
Таблица 4.1. Симптомы HBV инфекции (большинство пациентов с ХГВ не имеют никаких клинических симптомов заболевания)
| Острый гепатит В | Хронический гепатит В |
|---|---|
| Утомляемость или гриппоподобный синдром | Симптомы, аналогичные ОГВ |
| Тошнота, эпигастральная боль | Мышечные и суставные боли |
| Диарея | Слабость |
| Кожная сыпь | Симптомы и стигмы цирроза печени |
| Желтуха | Симптомы и стигмы рака печени |
| Темная моча, светлый кал |
Основной симптом хронического гепатита – немотивированная слабость или недомогание. Иногда пациенты ощущают боль или дискомфорт в правом верхнем отделе живота или эпигастральной области. ХГВ в фазе репликации HBV по своему течению может походить на острый гепатит В. В таких случаях больные ощущают утомляемость, отсутствие аппетита, тошноту, появляется желтуха. Иногда развивается печеночная декомпенсация.
При физикальном осмотре можно не обнаружить никаких специфических признаков или выявить стигмы хронического заболевания печени, например, пальмарную эритему, сосудистые звездочки или умеренную гепатомегалию. Для больных с циррозом печени характерна спленомегалия. Прогрессирование заболевания приводит к появлению осложнений цирроза печени в виде варикозного расширения вен пищевода и желудка с возможностью кровотечений из них, асцита, периферических отеков, энцефалопатии.
Внепеченочные проявления хронической HBV инфекции. Приблизительно у 10-20% больных встречаются внепеченочные проявления хронической HBV инфекции. Считается, что они вызываются циркулирующими иммунными комплексами, хотя их истинное происхождение окончательно не известно.
Сывороточная болезнь. Иногда начало острого гепатита В подобно сывороточной болезни с лихорадкой, артралгиями, артритами и кожной сыпью. При кожной и суставной манифестации болезни быстро присоединяется желтуха.
Нодозный периартериит. У 10 – 50% больных с нодозным периартериитом обнаруживается HBsAg. Иммунные комплексы, содержащие антигены и антитела к HBV рассматриваются в качестве триггера поражения сосудов. В патологический процесс могут вовлекаться крупные, средние и мелкие артерии с поражением сердечно-сосудистой системы (перикардит, артериальная гипертензия, сердечная недостаточность), почек (гематурия, протеинурия), гастроинтестинального тракта (васкулит мезентериальных сосудов с болями в животе), костно-мышечной системы (артралгии и артриты), нервной системы (мононевриты или поражения ЦНС), кожи (сыпь).
Гломерулонефрит. HBV-опосредованный гломерулонефрит чаще встречается у детей. Морфологически это мембранозная, мембранознопролиферативная формы или IgA-опосредованная нефропатия. При манифестации заболевания поражением почек изменения в печени редко бывают тяжелыми. Приблизительно у 30 – 60% детей с HBV опосредованным мембранозным гломерулонефритом развиваются спонтанные ремиссии. Лечение кортикостероидами, как правило, неэффективно и способствуют репликации HBV. Положительные результаты лечения интерфероном показаны в нескольких клинических исследованиях, но они значительно ниже у взрослых, чем у детей. Приблизительно у 30% больных заболевание может прогрессировать с развитием почечной недостаточности, в среднем,10% их них будут требовать постоянного гемодиализа.
Эссенциальная смешанная криоглобулинемия. Смешанная крио-
глобулинемия – системное заболевание с вовлечением в патологический процесс преимущественно мелких сосудов, проявляющееся гломерулонефритом, артритом и пурпурой. В криоглобулинах обнаруживают HBsAg, HBsAb и HBV -подобные частицы. Однако, последние исследования ставят под сомнение связь эссенциальной смешанной криоглобулинемии с HBV и указывают на строгую ассоциацию между этим состоянием и хронической HCV инфекцией.
Болезнь Джанотти (папулезный акродерматит). Клинически проявляется симметричной макулопапулезной эритематозной сыпью на ногах, ягодицах, предплечьях, сохраняющейся от 15 до 20 дней, иногда сопровождающейся лимфоаденопатией. В патогенезе патологического процесса играют роль циркулирующие иммунные комплексы, содержащие HBsAg и антитела к нему. У детей эта форма заболевания всегда строго ассоциируется с выявлением HBsAg в сыворотке крови.
Апластическая анемия. В литературе описаны тяжелые случаи апластической анемии в ранней фазе ОГВ. Однако, результаты недавних исследований показали, что ассоциированная с гепатитом апластическая анемия развивается по иммунопатологическому механизму и патогенетически напрямую не связана с вирусом.
Читайте также:


