Гепатит с может быть лекарственным при лечении туберкулеза

Сологуб Т. В., Романцов М. Г., Кетлинская О. С., Петров А. Ю., Комиссаров С. Н., Кремень Н. В., Александрова Л. Н., Суханов Д. С., Ледванов М. Ю., Стукова Н. Ю., Козько В. М., Бондарь А. Е.,
Лекарственные поражения печени (ЛПП) являются одной из серьезных проблем в гепатологии. В настоящее время насчитывается более 800 лекарственных средств, способных вызывать поражения печени, а четверть фульминантных гепатитов связывают с острым токсическим лекарственным поражением.
Поражения печени (15-20%) у больных туберкулезом свидетельствуют о высокой частоте патологии печени при туберкулезе, обусловленной различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков наличием сопутствующих заболеваний, в том числе и вирусных гепатитов).
Печень представляет собой центральную лабораторию химического гомеостаза организма, где создается единый обменный и энергетический комплекс для метаболизма белков, жиров и углеводов. Особенно важна детоксикационная и клиренсная функции печени, так как 80% токсических веществ из организма выводится именно ею.
В целом, согласно МКБ X пересмотра, гепатопатии классифицируются на 2 большие группы:
1-я - поражения печени инфекционного и неинфекционного генеза (поражения специфическими гепатотропными вирусами; поражения неспецифическими инфекционными агентами (герпес, энтеровирус, цитомегаловирус);
2-я группа - токсические поражения печени (алкогольная болезнь; хронический гепатит, включая аутоиммунный).
Гепатопатии являются одной из ведущих видов патологии, не только в России, но и в мире. При этом, разные категории больных имеют различную частоту и причины поражения печени. Одной из таких групп больных, для которых поражения печени являются весьма актуальными, считаются больные туберкулезом.
В зависимости от структуры и состава лекарственных веществ может наблюдаться избыточное образование свободных радикалов, активизация перекисного окисления липидов (ПОЛ), денатурация белков, истощение запасов АТФ, нарушение функции митохондрий, образование гаптенов, связывание с ядерными и цитоплазматическими молекулами, мембранными рецепторами, блокада транспортной РНК, разрушение клеточного цитоскелета, обуславливая различные подходы к терапии этих состояний.
ЛПП принято подразделять на 3 группы: гепатоцеллюлярные, холестатические и смешанные. Мишенью токсического действия являются гепатоциты (некроз), желчные протоки и канальцы (холестаз) или синусоидальные клетки (эндотелий, жиросодержащие клетки). ЛПП повреждают паренхиму, приводят к некрозу или апоптозу, стеатозу, холестазу, образованию гранулем, сосудистым расстройствам, злокачественному перерождению и др. [Farwell G.S., (1994)].
Важную роль в подобных повреждениях играет генетический полиморфизм ферментов детоксикации ксенобиотиков(CYP450, NAT2). Риск развития гепатита при лечении противотуберкулезными препаратами в значительней степени определяется генным полиморфизмом изофермента СУР2Е1. У пациентов с гомозиготным диким генотипом CYP2E1 cl/cl риск гепатотоксичности высок (20%), чем у лиц с мутантным аллелем с2 (СYP2E1 с1/с2 или с2/с2; (9,0%) [Huang YS, (2003)]. Восприимчивость к гепатотоксическому действию противотуберкулезных препаратов продолжает увеличиваться [Nagayama N et al, (2003)]. Так, в период 1980-2000 гг. прошлого столетия частота развития гепатитов (при комбинированном применении изониазида и рифампицина) составляла от 9,0% до 27,4%, что связано с повышением частоты гепатотоксических реакций и неблагоприятным воздействием на печень факторов окружающей среды.
Лекарственные поражения при применении пиразинамида развиваются по тому же типу, что и при использовании изониазида. Осложнения редки при дозе менее 30 мг/кг, а в высоких дозах пиразинамид тормозит окислительное фосфорилирование, перекисное окисление липидов (ПОЛ), истощая антиоксидантные резервы, повреждая клеточные структуры, потенцируя гепатотоксическое действие рифампицина.
Аминогликозиды вызывают субклинические неспецифические реактивные гепатиты с умеренной гипераминотрансфераземией [Логинов А.С. и соавт., (1987)], в единичных случаях развивается острый цитолитический гепатит с гепатоцеллюлярным некрозом. В основе цитолитического гепатита лежат некрозы или стеатоз печени. Под действием лекарственного препарата наблюдается диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах ОВГ. Развитие распространенного массивного некроза печени описано при применении противотуберкулезных средств (изониазида, рифампицина, аминогликозидов). Лекарственные препараты вызывают диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах острого вирусного гепатита.
К развитию цирроза печени может вести длительное применение противотуберкулезных препаратов, вызывающих острый или хронический гепатит. По мнению В.Т.Ивашкина (2006) цирроз - это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов, являясь конечной стадией хронического поражения печени. Его тяжесть и прогноз зависит от объема сохранившейся функциональной паренхимы печени, выраженности портальной гипертензии и активности основного заболевания, приведшего к нарушению ее функций. Нарушение архитектоники печени даже при отсутствии цирроза ведет к развитию портальной гипертензии.
Поражение печени может стабилизироваться или регрессировать при прекращении приема противотуберкулезных препаратов, улучшая функциональное состояние печени, но эволюция гистологических изменений в печени происходит значительно медленнее. Продолжение приема лекарств приводит к прогрессированию ХГ с исходом в цирроз печени, формируя печеночную недостаточность.
Побочные явления непереносимости антибактериальных препаратов наблюдаются в клинике туберкулеза в 7,9-32% случаев. Их частота и характер в значительной мере обусловлены давностью и формой процесса, а так же наличием сопутствующих заболеваний, в частности ВГ. Токсическое действие наступает через 2 месяца после начала приема препаратов, в 19,7% связано с поражением печени. У половины пациентов с биохимическими нарушениями отсутствуют клинические признаки патологии печени.
Ассортимент лекарственных средств патогенетической терапии, применяемых при заболеваниях печени, насчитывает более 1000 наименований, но среди такого многообразия препаратов, выделяют сравнительно небольшую группу лекарственных средств [гепатопротекторов], оказывающих избирательное действие на печень. Их действие направлено на восстановление гомеостаза в печени, повышение устойчивости органа к действию патогенов, нормализацию функциональной активности и стимуляцию репаративно-регенеративных процессов в печени.
Современным подходом для улучшения эффективности патогенетической терапии является применение препаратов, восстанавливающих не только митохондриальную мембрану клеток, не только липидный слой мембран, но нормализующих окислительное фосфорилирование и модифицирующих клеточный обмен.
Это возможно за счет применения гепатопротекторов (реамберин, цитофлавин, ремаксол), обладающих антигипоксическим/антиоксидантным эффектом поскольку, печень является основным местом метаболизма и мишенью токсического действия с первичным нарушением функции мембран.
Указанные препараты являются метаболическими протекторами, в составе которых несколько активных компонентов, одним из основных является янтарная кислота. В основе нарушений функций организма лежат структурные изменения, обусловленные метаболическими расстройствами. Сложная динамика развития гипоксии в организме, вовлеченность в нее широкого спектра функционально-метаболических систем объясняет сложность решения вопросов, связанных с антигипоксической защитой организма. Повышение устойчивости к гипоксии обеспечивают интермедиаты цикла Кребса - фумаровая, лимонная и янтарная кислота, включаясь в энергетический обмен как субстраты, направляя процесс окисления по наиболее экономичному пути. При гипоксии происходит функционально-метаболическое нарушение, в котором ведущую роль играет снижение уровня макроэргов. Высокая биологическая активность янтарной кислоты послужила предпосылкой создания на ее основе эффективных лекарственных препаратов (реамберин, цитофлавин). Разработанная новая метаболическая композиция ремаксол (препарат завершает клинические исследования), ориентирована на патологические состояния, сопровождающиеся нарушением метаболизма и энергетического обмена, обладает выраженным гепатопротекторным эффектом за счет стимуляции распада жировых включений в паренхиматозных органах до ацетил-КоА, поступающего в цикл трикарбоновых кислот. В экспериментальных исследованиях установлен антитоксический и гепатопротекторный эффект ремаксола на моделях экспериментального токсического и аденовирусного гепатитов с активацией тканевого дыхания, уменьшением недоокисленных метаболитов, снижением уровня цитолитических ферментов, нормализацией перекисного окисления липидов. За счет купирования изменений в системе глутатиона установлена выраженная антиоксидантная активность препарата.

Дата публикации: 19.01.2018 2018-01-19
Статья просмотрена: 1576 раз
Среди ПР при туберкулезе легких особое место занимает поражение печени [5, с.357; 7, с.17; 2, c.68], Туберкулезная инфекция создает предпосылки для поражения печени, угнетая ферментативную активность и гликогенобразование [3, с.5; 9, с.280], вызывая различного вида морфологические изменения [8,40]. Побочные реакции со стороны печени наблюдаются у 11–46,5 % больных туберкулезом. [9, с.15; 10, с.16],
Клинико-лабораторная характеристика состояния печени до химиотерапии трудна, так как изменения в печени, вызванные самим туберкулезным процессом, наслаиваются на изменения, обусловленные возможными последствиями перенесенного вирусного гепатита [6, с.19; 4, с.12].
С целью изучения состояния печени у больных с туберкулезом легких при побочных реакциях проведено наблюдение и комплексное обследование 226 больных туберкулезом легких, находившихся на лечении в терапевтических отделениях клиники РСНПМЦФиП 2001–2011 гг. Для оценки функционального состояния печени определяли в крови активность ферментов: аспартатаминотрансферазы — АсТ (N — 0,43±0,05 ммоль/ч.л.) и аланинаминотрансферазы — АлТ (N — 0,20±0,03 ммоль/ч.л.) методом S.Rautman — S.Frenkel (1957); холинэстеразы методом В. Г. Колба (1972; N — 74,98±10,15мкм/ч.л.), содержание общего билирубина и его фракций методом Йендрашека (1972; N — 7,4±0,25 мкмоль/л). [1 ,с.180],
Из общего числа обследованных мужчин было 111 (49,1 %), женщин — 115 (50,9 %) в возрасте от 17 до 65 лет. Инфильтративный туберкулез легких установлен у 134 (59,2 %) больных, фиброзно-кавернозный туберкулез легких у 30 (13,3 %), кавернозный и диссеминированный туберкулез легких 18 (8 %). Впервые выявленных больных было 194 (85,8), т. е. абсолютное большинство, ранее леченых — 32 (14,1 %).
Сопутствующие заболевания выявлены у 177 (77,8) больных: ХОБЛ — у 31 %, анемии — у 33,8±3,1 %, заболевания ЖКТ и печени — у 11,3 %, сахарный диабет — у 19,7 %.
В процессе химиотерапии побочные реакции отмечены у 145 больных (64,5 %). В своей работе мы применяли по синдромную классификацию побочных реакций от противотуберкулезных препаратов [9, с.31]. Частота и характер ПР представлены на рис. 1.
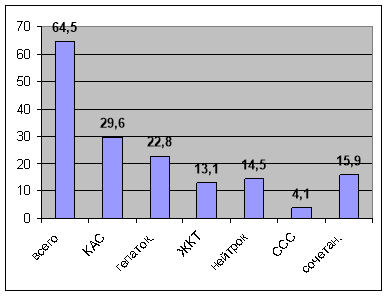
Рис. 1. Частота и характер побочных реакций от противотуберкулезных препаратов у больных туберкулезом легких
Как видно из рис 1, побочные реакции со стороны печени отмечены у 33 (22,8±3,4 %) больных.
Анализ характера клинических симптомов поражения печени при гепатоксических реакциях (рис.2) показывает преобладание диспепсического синдрома.
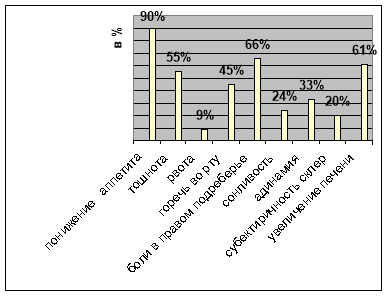
Рис 2. Клинические симптомы гепатотоксических реакций у больных туберкулезом легких
С целью установления взаимосвязи частоты и характера отдельных синдромов ПР с поражением печени и почек было изучено динамика нарушений функции печени на основе определения индикаторных ферментов в крови и моче.
Характеризуя функциональное состояние печени у больных нужно, прежде всего, отметить, что сама туберкулезная интоксикация сопровождается интоксикационным синдромом. Печень при этом обеспечивает удаление из крови продуктов микробных и поврежденных клеток, а также обезвреживание эндогенных метаболитов.
Кроме того, необходимо учитывать локализацию ферментов АсТ и АлТ в субклеточных структурах. Известно, что АсТ значительно в большей степени связана с митохондриями и ядерными структурами, чем АлТ, которая сосредоточена в гиоплазме. Поэтому АлТ легче попадает в кровь, и повышение ее активности при повреждении клеток печени определяется раньше.
Коэффициент Де Ритиса у всех больных особенно с гепатоксическими реакциями, был меньше 1,0, билирубиновый показатель также не превышал 50 %, что указывает на наличие нарушения на уровне мембраны гепатоцитов.
Функциональное состояние печени убольных туберкулезом при развитии побочных реакций от противотуберкулезных препаратов
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.
Стеатоз печени - это жировая перестройка ткани печени (т.н. жировая дистрофия печени), когда клетки печени страдают от избыточного накопления жира. Это патологическое состояние, при котором в гепатоцитах накапливается жир в виде капель. Жира может образоваться так много, что гепатоцит разрывается, а жир скапливается в межклеточном пространстве в виде жировых кист, нарушающих структуру печени.
Жировая болезнь печени – это заболевание, связанное с накоплением и отложением в тканях внутри печени избыточного количества жиров.
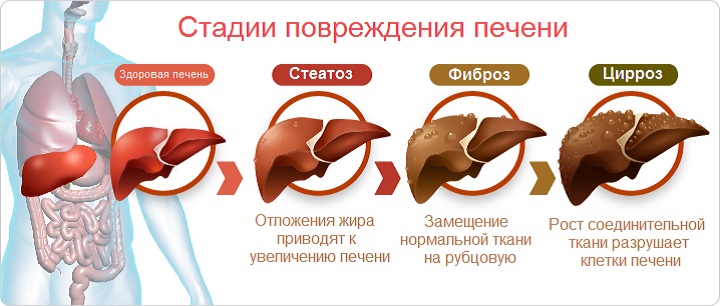
Поражение печени происходит по определённому континууму: первая стадия заболевания печени называется Гепатоз или Стеатоз, затем присоединяются воспалительные заболевания, и развивается Гепатит/стеатогепатит
Стеатоз печени (жировой гепатоз) - это жировая перестройка ткани печени (т.н. жировая дистрофия печени), когда клетки печени страдают от избыточного накопления жира. Это патологическое состояние, при котором в гепатоцитах накапливается жир в виде капель. Жира может образоваться так много, что гепатоцит разрывается, а жир скапливается в межклеточном пространстве в виде жировых кист, нарушающих структуру печени. В дальнейшем разрушения печени затрагивают все большие участки, что в итоге, приводит к циррозу печени.
Среди причин развития стеатоза печени выделяют следующие:
- Воздействие токсических веществ: алкоголь или лекарственные препараты;
- Нарушение обмена веществ: сахарный диабет, заболевания щитовидной железы;
- Несбалансированное питание: дефицит белков, избыток жиров и углеводов;
- Наличие легочных заболеваний и патологий сердечно-сосудистой системы и др.
Основными причинами гепатозов являются воздействие на печень токсичых веществ, эндокринные нарушения, неправильное питание. Среди токсичых агентов особое место занимает алкоголь. Однако у лиц, злоупотребляющих алкоголем, развитие заболевания связано как непосредственно с действием алкоголя на клетки печени, так и с неправильным питанием. Быстрота развития и выраженность изменений тем выше, чем больше количество употребляемого алкоголя. Роль других ядовитых факторов (инсектицидов, фосфорорганических соединений и др.) менее существенна.
Возможно развитие лекарственного стеатоза печени, например, при лечении туберкулеза, приеме антибиотиков, главным образом тетрациклинового ряда, гормональных препаратов. В группе эндокринных заболеваний ведущее место среди причин гепатозов занимает сахарный диабет, особенно у лиц пожилого возраста. Возможно развитие "жировой дистрофии печени" при заболеваниях щитовидной железы. Стеатоз также сопутствует общему ожирению. Определяющим в дисбалансе пищевых факторов является несоответствие между общей калорийностью пищи и содержанием в ней животных белков, а также дефицит витаминов и других веществ. Нарушение питания служит основной причиной развития стеатоза при хронических заболеваниях пищеварительной системы (хроническом панкреатите). При хроническом панкреатите он встречается в 25—30% случаев. Нехватка кислорода является основной причиной развития стеатоза печени у лиц, страдающих легочными заболеваниями и сердечно-сосудистой недостаточностью. При обнаружении первых симптомов следует незамедлительно начать лечение стеатогепатита.
Цены на прием врача и лечение стеатогепатита печени в Москве
Стеатоз достаточно коварное заболевание, так как на первоначальном этапе, когда жировые отложения в печени только начинают формироваться, болезнь никак себя не проявляет. Лишь когда вкрапления жира увеличатся в размерах и начнут сливаться друг с другом, образуя кисты, могут появиться следующие симптомы:
- Слабость, усталость, вялость;
- Болезненные ощущения в области правого подреберья;
- Тошнота;
- Вздутие живота;

Стеатоз может протекать скрыто, проявляясь лишь незначительным увеличением печени, или с выраженными проявлениями. При этом наиболее постоянным признаком является увеличенная печень. При пальпации выявляется болезненность печени. У большинства больных отмечаются также самостоятельные боли в области правого подреберья, может быть тошнота. Стеатоз может протекать длительно, на протяжении многих лет. Периоды ухудшения сменяются относительными улучшениями самочувствия. Обострения чаще связаны с психическим или физическим перенапряжением, приемом алкоголя, инфекцией.
К осложнениям стеатоза, которые наблюдаются в основном при его тяжелых формах, относится формирование цирроза печени. Из-за нарушений иммунитета у больных со стеатозом часто наблюдаются пневмонии, может развиться туберкулез легких.
Лечение стеатозов представляет собой довольно сложную, но разрешимую для профессионалов задачу и состоит из нескольких направлений. Среди них правильно подобранная диета, модификация поведенческого паттерна (изменение пищевых привычек, изменение количества и состава потребляемого алкоголя, увеличение физической активности), комплекс мероприятий, направленных на нормализацию энергетического обмена печени, медикаментозная терапия современными лекарственными средствами, действие которых направлено на стабилизацию и защиту мембран клеток печени, нормализацию печеночного обмена. Прогноз, как правило, благоприятный и при адекватном лечении стеатогепатита довольно быстро подвергается обратному развитию. Однако, поддерживающие мероприятия могут быть необходимы в течение довольно длительного времени.
- Правильно подобранная сбалансированная диета,
- Комплекс мероприятий, направленных на нормализацию энергетического обмена печени,
- Медикаментозная терапия современными лекарственными препаратами, действие которых направлено на стабилизацию и защиту клеток печени, нормализацию печеночного обмена.
Тем не менее, поддерживающая терапия может быть необходима в течение достаточно длительного времени.
Профилактика стеатоза заключается в устранении влияния токсичных факторов, адекватном лечении сахарного диабета, полноценном сбалансированном питании, эффективном лечении хронических заболеваний пищеварительной системы. Больным, длительно принимающим гормоны, с профилактической целью следует назначать препараты, улучшающие функцию печени.
Любите себя, относитесь бережно к собственному здоровью! Чувствуйте себя уверенно с нашими специалистами. Мы поможем!
Запишитесь на прием ежедневно с 9 до 21: 8 495 646-07-47
Или оставьте ваш номер телефона, мы вам перезвоним в удобное для вас время
Успешное лечение больного, достижение прекращения бактериовыделения у него – это одно из важнейших эпидемиологических звеньев в деле снижения заболеваемости туберкулезом среди населения.
При подтверждении диагноза “туберкулез”, больного нужно незамедлительно поместить в диспансер, где ему необходимо пройти полный курс лечения, не пропуская ни одной процедуры, даже если жалобы и недомогание исчезают через несколько недель после начала лечения. В случае несвоевременного прекращения лечения туберкулез может перейти в устойчивую к антибиотикам форму, которую будет очень трудно вылечить.
Основой комплексного лечения больных туберкулезом является в настоящее время лечение противотуберкулезными препаратами – лекарствами, губительно воздействующими на микобактерии, находящиеся в организме больного. На сегодня это единственная возможность справиться с туберкулезом.
КАКИЕ ОСНОВНЫЕ УСЛОВИЯ УСПЕШНОЙ ТЕРАПИИ?
Непременным условием успешной химиотерапии является одновременное назначение нескольких препаратов (комбинированная терапия). Лечение одним препаратом (монотерапия) неэффективно, более того оно приводит к развитию устойчивости микобактерий туберкулеза к примененному лекарству.
Вторым непременным условием успешного лечения является непрерывный длительный прием препаратов контролируемым методом в присутствии медицинского работника! Эти условия лечения определяются врачом индивидуально в зависимости от особенностей больного и его болезни.
КАК ПРОХОДИТ ЛЕЧЕНИЕ?
Лечение туберкулеза в зависимости от особенностей случая проводится в условиях стационара, санатория, дневного стационара или амбулаторно - строго контролируемым методом. У части больных возникает необходимость использования дополнительных лечебных воздействий – коллапсотерапии и хирургических вмешательств. Как правило, это происходит при недостаточной эффективности консервативного лечения при выявлении запущенных случаев.
ЧТО ТАКОЕ ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ?
У значительной части хронически больных формируется лекарственная устойчивость к микобактериям туберкулеза. Лекарственная устойчивость – ситуация, когда противотуберкулезные препараты не действуют на микобактерии туберкулеза. Лечение такого контингента в значительной части требует применения резервных препаратов и стоимость лечения значительно возрастает. Излечение этой категории больных представляет уже значительные трудности.
ГЛАВНАЯ ЗАДАЧА РОДСТВЕННИКОВ
Главное – убедить больных неукоснительно следовать предписываемому режиму лечения. Регулярно, беспрерывно, в течение рекомендованного срока принимать противотуберкулезные препараты. При возникновении явлений непереносимости лекарств и симптомов побочного их действия, совместно с лечащим врачом следует стремиться преодолеть их, пытаясь, насколько это возможно, не прекращать курс лечения.
От этого в значительной степени будет зависеть скорейшее выздоровление больного, исключение заражения его родных и близких. Кроме того, принимая препараты в должном объеме в течение надлежащего периода времени, больной способствует тому, что у него не появятся лекарственно устойчивые штаммы возбудителя, которые могут быть переданы здоровым лицам, и вызвать новое заболевание с наличием лекарственной устойчивости. Это будет способствовать улучшению эпидемиологической ситуации по туберкулезу в районе, городе, области, регионе, а в целом будет значительным вкладом в дело снижения бремени туберкулеза в России.
Успех или поражение в битве с туберкулезом более чем на половину зависит от самого пациента. Его воля, желание выздороветь несмотря ни на что – способны творить чудеса.
По любым вопросам – от питания до способов снижения токсического воздействия противотуберкулезных препаратов больной должен получить консультацию у лечащего врача, либо в ближайшем противотуберкулезном диспансере.
ЗАПОМНИТЕ!
ПРОХОДИТЬ ФЛЮОРОГРАФИЧЕСКОЕ ОБСЛЕДОВАНИЕ НЕОБХОДИМО НЕ РЕЖЕ, ЧЕМ ОДИН РАЗ В ГОД (с учетом состояния здоровья, профессии и принадлежности к группам риска).
Читайте также:


