Факторы патогенности вируса гриппа
В отличие от эпидемий гриппа, практически ежегодно поражающих население, пандемии случаются гораздо реже, но имеют более тяжелые медицинские и социальные последствия. Изучение характера течения всех современных эпидемий и пандемий в настоящее время приобретает особую актуальность. Пандемия гриппа A(H1N1) 2009 г. была вызвана вирусом смешанного (тройного) происхождения. В России первые три случая заболеваний были выявлены в Москве с 21 по 10 июня 2009 г. На Дальнем Востоке - на 2-2,5 мес позже по сравнению с европейской частью России. Однако эпидемия гриппа в России, вызванная вирусом гриппа A(H1N1) pdm09, началась и более стремительно развивалась именно на Дальнем Востоке. Наиболее высокая заболеваемость (10,2-10,3 на 100 человек) была зарегистрирована в городах Дальневосточного и Сибирского регионов. Филогенетический анализ позволил установить происхождение тройного реассортанта вируса A(H1N1)pdm09 из вирусов H1N1, H1N2, H3N2 птиц, свиней и человека. Проведенный анализ функциональных доменов белков вируса гриппа A(H1N1)pdm09 показал, что современные пандемические вирусы гриппа имеют ряд принципиальных генетических дефектов, совокупность которых позволяет отнести их к умеренно патогенным вирусам. Высокий риск тяжелого течения гриппа и возникновения осложнений отмечен в трех группах больных: беременные женщины, особенно в III триместре беременности; дети до 2 лет и пациенты, имеющие сопутствующие хронические заболевания дыхательной и сердечно-сосудистой системы, а также пациенты с эндокринными нарушениями и ожирением.
Garten R.J., Davis C.T., Russell C.A. et al. Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans. Science. 2009; 325 (5937): 197-201.
Покровский В.И., Киселев О.И. Пандемический грипп H1N1. СПб.: Росток; 2010.
Conenello G.M., Zamarin D., Perrone L.A., Tumpey T., Palese P. A single mutation in the PB1-F2 of H5N1 (HK/97) and 1918 influenza a viruses contributes to increased virulence. PloS Pathogens. 2007; 3 (10): 141.
Tran G.M.K., Gerbaud L.,Caprani A.C. Scorpion model of influenza A(H1N1). Jn: ISHEID Conf. Toulon; 2010: 168.
Sun X., Tse L.V., Ferguson A.D., Whittaker G.R. Modification to the hemagglutinin cleavage site control the virulence of a neurotropic H1N1 influenza virus. J. Virol. 2010; 84 (17): 8683-90.
Arias C.F., Escalera-Zamudio M., Soto-del Rio M. et al. Molecular anatomy of 2009 influenza virus A(H1N1). Arch. Med. Res. 2009; 40: 643-54.
Gannage M., Dormann D., Albrecht R. et al. Matrix protein 2 of influenza A virus blocks autophagosome fusion with lysosomes. Cell. Host. Microbe. 2009; 6: 367-80.
Fernandez-Sesma A., Marukian S., Ebersole B.J. et al. Influenza virus evades innate and adaptive immunity via the NS1 protein. J. Virol. 2006; 80: 6295-304.
Min J.-Y., Krug R.M. The primary function of RNA binding by the influenza A virus NS1 protein in infected cells: Inhibiting the 2’,5’-oligo(A)synthetase/RNase L pathway. Proc. Natl. Acad. Sci. USA. 2006, 103 (18): 7100-5.
Twu R.Y., Noah D.L., Rao P. et al. The CPSF30 binding site on the NS1A protein of influenza a virus Is a potential antiviral target. J. Virol. 2006; 80: 3957-65.
Львов Д.К., Бурцева Е.И., Прилипов А.Г. и др. Изоляция 24.05.2009 года и депонирование в Государственную коллекцию вирусов первого штамма A/Moscow/01/2009(H1N1)swl, подобного свиному вирусу A(H1N1) от первого выявленного 21.05.2009 года больного в г. Москве. Вопросы вирусологии. 2009; 5: 10-4.
Denholm J.T., Gordon C.L., Johnson P.D. et al. Hospitalised adult patients with pandemic (H1N1) 2009 influenza in Melbourne, Australia. Med. J. Austral. 2010; 192 (2): 84-6.
Soundararajan V. et al. Extrapolating from sequence - the 2009 H1N1 “swine” influenza virus. Nat. Biotechnol. 2009; 27: 510-13.
Shinya K. et al. Avian flu: influenza virus receptors in the human airway. Nature. 2006; 440: 435-6.
Tse H. et al. Structural basis and sequence co-evolution analysis of the hemagglutinin protein of pandemic influenza A/H1N1 (2009) virus. Exp. Biol. Med. 2011; 236: 915-25.
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
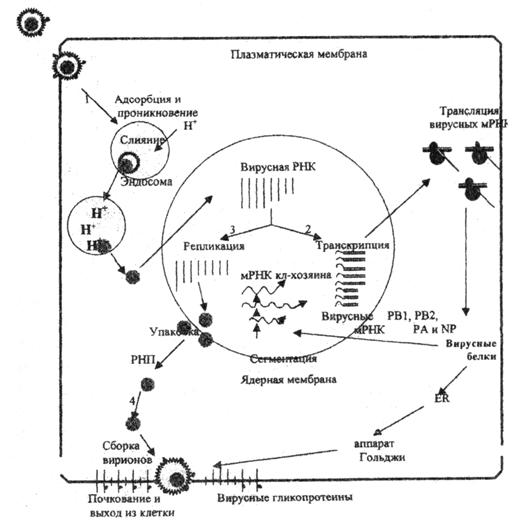
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
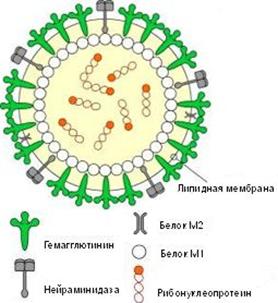
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
doi: 10.18527/2500-2236-2017-4-1-10-20
Получена: 2017-10-18 Принята к печати: 2017-11-02 Опубликована: 2017-12-06
Р. Н. Гейдаров 1 , Н. Ф. Ломакина 2 , Е. Ю. Боравлева 2 , И.С. Холодилов 2 , А. С. Гамбарян 2# , В. М. Михайлович 1 , Е. Е. Фесенко 3
# Для корреспонденции: Александра Гамбарян: al.gambaryan@gmail.com
Среди изолятов от диких птиц идентифицированы вирусы гриппа субтипов H3N1, H3N6, H3N8, H4N6, H1N1, H5N3 и H11N9. Все они содержали последовательность ESEV на С-конце белка NS1, полноразмерную рамку считывания для белка PB1-F2. Замена N66S в PB1-F2 обнаружена у шести штаммов. Однако такие маркеры патогенности, как последовательность ESEV (лиганд PDZ-домена) в вирусном белке NS1 и замена N66S PB1-F2 в контексте генома вирусов гриппа диких уток, не делали вирус патогенным для мышей. Все изоляты были высокоурожайны в куриных эмбрионах, инфекционны и иммуногенны для мышей, но не вызывали у этих животных клинических симптомов заболевания.
Forty-two strains of avian influenza viruses were isolated from the wild waterfowl’s feces in the city of Moscow. These viruses as well as reference strains and some experimental reassortants were analyzed by microarrays. The used microarrays contained 176 probes to the different segments of influenza virus genome. The microarray allows to determine 1) the hemagglutinin and neuraminidase proteins subtype; 2) the primary structure of the C-terminal sequence of the viral NS1 protein, which serves as a ligand for the PDZ domain; 3) the presence of stop codons and substitution N66S in the reading frame of the viral protein PB1-F2; 4) the presence of the polybasic site for hemagglutinin cleavage. The viruses of H3N1, H3N6, H3N8, H4N6, H1N1, H5N3 and H11N9 subtypes were identified from the group of wild bird’s isolates. All isolates contained the ESEV sequence at the C-terminus of the NS1 protein and the full-length reading frame for the PB1-F2 protein. The replacement of N66S in PB1-F2 was found in six strains. However, the presence of ESEV sequence (ligand of PDZ domain) in the NS1 virus protein and the N66S substitution in PB1-F2 did not lead to the pathogenicity of these viruses for mice. All isolates demonstrated high yield growth in chicken embryos, were infectious and immunogenic for mice, but did not induce any clinical symptoms.
Низкопатогенные вирусы гриппа диких птиц (low pathogenic avian influenza viruses, LPAIV) расположены в основаниях эволюционных ветвей всех субтипов вирусов гриппа А. Они эволюционируют медленно и сохраняют ряд характерных признаков. К таким признакам относятся: консервативное строение рецепторсвязывающего участка в верхушечной части гемагглютинина (НА); строение сайта нарезания, который расщепляется только трипсиноподобными протеазами, секретируемыми в клетках респираторного и желудочно-кишечного тракта, что ограничивает распространение вируса в организме; низкий рН конформационного перехода молекулы НА, обеспечивающий ее высокую устойчивость к кислой среде пищеварительного тракта птиц.
Повышенная патогенность вируса – многофакторная характеристика, которая определяется множественными изменениями в различных генах вируса. Так, в молекуле HA высокопатогенных штаммов присутствует полиосновная последовательность в сайте нарезания [3]. В белке нейраминидазе (NA) появляется делеция в стеблевом участке [4]. Мутация E627K в белке PB2 способствует повышению активности вирусной полимеразы и улучшению репродукции вируса [5–7]. Замена N66S в рамке считывания PB1-F2 ускоряет ядерный транспорт [8–10]. В неструктурном белке NS1 появляются замены, приводящие к эффективному подавлению синтеза интерферона в хозяйской клетке [7, 11–13].
1) устойчивость к основным противогриппозным лекарственным средствам: препаратам группы адамантанов (амантадин, ремантадин) и ингибиторам NA (озельтамивир и его аналоги);
2) наличие и структуру участка связывания PDZ-домена в белке NS1: характерные для HPAIV последовательности ESEV, EPEV, ESKV и KSEV либо характерные для LPAIV – RSKV и RSEV;
3) наличие стоп-кодонов в позициях 12 и 58 и мутацию N66S в рамке считывания белка PB1-F2;
4) наличие в НА подтипов H5 и H7 полиосновного сайта протеолитического расщепления, характерного для HPAIV.
Вирусы
Вирусы из фекалий чаек и уток выделены в 2006–2014 гг. на берегу пруда в Тропаревском парке города Москвы и хранятся в коллекции Федерального научного центра исследований и разработки иммунобиологических препаратов им. М. П. Чумакова (Москва, Россия).
Реассортантный вирус VNH5N1-PR8/CDC-RG (VN‑PR) (H5N1) сконструирован в Центрах по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, Atlanta, USA) и содержит гены, кодирующие белки НА и NA от вируса A/Vietnam/1203/2004 (H5N1), а остальные – от штамма A/Puerto Rico/8/34 (H1N1) (PR8). Вирус любезно предоставлен д-ром R. Donis. В гене НА методом обратной генетики модифицирован участок, кодирующий полиосновный сайт нарезания. Холодоадаптированный вирус A/Leningrad/134/17/57 (H2N2) (Len) любезно предоставлен проф. Л. Г. Руденко (Институт экспериментальной медицины, Санкт-Петербург, Россия). Вирус A/Hamburg/5/2009 любезно предоставлен д-ром М. Н. Матросовичем (Institute of Virology, Philipps University, Marburg, Germany), Вирус A/mallard/Sweden/91/2002 (H7N9) любезно предоставлен д-ром R. A. Fouchier (Department of Virology, Erasmus Medical Centre, Rotterdam, The Netherlands). Вирус А/duck/Buryatia/664/1988 (H3N1) получен из коллекции Национального исследовательского центра эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи (Москва, Россия). Полные названия и обозначения вирусов приведены в Табл. 1.
Вирус
Обозначение
Субтип
Номер в GenBank (ген)
PB1-F2 66 a
Линия NS1 б
A/Vietnam/1203/2004 ×A/Puerto Rico/8/34
VN-PR × Len (клон 3697)
VN-PR × Len (клон 4760)
Hamb × Len (клон 4885)
Hamb × Len (клон 4886)
Hamb × Len (клон 4888)
а Аминокислота в позиции 66 белка PB1-F2.
б Линия гена NS1 согласно [15].
Таблица 1. Исследованные вирусы
Выделение вирусов
Выделение вирусов проводили из свежих фекалий, которые суспендировали в двойном объеме фосфатно-солевого буфера (PBS) с добавлением антибиотиков: 0.4 мг/мл гентамицина, 0.1 мг/мл канамицина, 0.01 мг/мл нистатина и 2% раствора MycoKill AB (PAA Laboratories GmbH). Суспензию центрифугировали 10 мин при 4 000 об/мин и полученным супернатантом (200 мкл) заражали 10-дневные куриные эмбрионы (КЭ). Аллантоисную жидкость собирали через 48 ч и для дальнейшего пассирования отбирали пробы, положительные в реакции гемагглютинации (РГА).
Секвенирование
Анализ на микрочипе
Биочип представляет собой подложку с упорядоченно расположенными микроячейками, содержащими ковалентно иммобилизованные олигонуклеотидные зонды. На подложках закреплены пластиковые гибридизационные камеры вместимостью 30 мкл, куда вносят исследуемые флуоресцентно меченные фрагменты генома вирусов гриппа. При гибридизации флуоресцентно меченный ПЦР-продукт образует комплекс с комплементарным иммобилизованным зондом. Анализ результатов гибридизации проводили с помощью универсального аппаратно-программного комплекса ТУ 9443-004-02699501-2006 (Институт молекулярной биологии им. В. А. Энгельгардта, Россия). Сигнал флуоресценции в каждой ячейке регистрировали камерой с ПЗС-матрицей и подвергали оцифровке.
Анализ патогенности вирусов для мышей
Мышам линии BALB/c весом 8–12 г вводили интраназально под легким эфирным наркозом по 50 мкл цельной или разведенной вируссодержащей аллантоисной жидкости (ВАЖ). Проводили ежедневное наблюдение за состоянием подопытных особей и изменением их веса в сравнении с животными контрольной группы. На 14-е сутки после заражения отбирали кровь для определения уровня антител методом ИФА. Инфекционность вирусов определяли титрованием на КЭ и выражали в lg эмбриональных инфекционных доз (lg ЭИД50).
Получение реассортантов
Для получения холодоадаптированных реассортантов с донором аттенуации Len 10-дневные КЭ заражали одновременно вирусами Len и донором поверхностных белков – по 7,0 lg ЭИД50 каждого вируса. КЭ инкубировали 18 ч при 32°С, после чего проводили еще один пассаж длительностью 18 ч при 32°С. Аликвоту полученного вирусного урожая инкубировали в течение ночи с мышиной иммунной сывороткой против вируса Len; затем клонировали методом предельных разведений при 26°С и отбирали пробы, положительные в реакции торможения гемагглютинации с сывороткой против донора поверхностных белков и отрицательные с сывороткой к вирусу Len. После этого трижды клонировали вирус методом предельных разведений, выращивая в течение 96 ч при 26°С.
В качестве референсных штаммов использованы вирусы: A/duck/Buryatia/664/1988 (H3N1), A/duck/Primorie/3628/2002 (H9N2), A/mallard/Sweden/91/2002 (H7N9), штамм А/chicken/Kurgan/3654at/2005 (H5N1) [19], аттенуированный в лабораторных условиях, а также циркулировавшие в человеческой популяции вирусы гриппа подтипов H1N1, H2N2 и H1N1pdm. Основные характеристики и краткие обозначения исследованных вирусов приведены в Табл. 1.
В результате анализа определены субтипы HA и NA всех изолятов. Для вирусов, у которых гены, кодирующие белки HA и NA, были секвенированы ранее, результаты субтипирования на биочипе соответствовали результатам секвенирования.
Факторы патогенности в природных изолятах
Полиосновной сайт нарезания HA был идентифицирован в НА вируса ch/Ku (H5N1), что соответствует данным секвенирования (GenBank HQ724523.1).
Устойчивость к лекарственным препаратам адамантанового ряда, обусловленная заменами в белке М2, обнаружена только у вирусов гриппа человека: PR8 (A27 и N31) и Hamb (N31).
Во всех изолятах от диких птиц белок NS1 терминирован последовательностью ESEV, а в штаммах ch/Ku, PR8 и Len – последовательностями ESKV, RSEV и RSKV соответственно, что подтверждается данными секвенирования, опубликованными в GenBank.
Стоп-кодон в рамке считывания белка PB1-F2 обнаружен в вирусе Hamb, что также соответствует данным секвенирования. Все природные изоляты содержали полноразмерную рамку считывания белка PB1-F2. У восьми штаммов выявлена замена N66S в белке PB1-F2, которая считается фактором, повышающим патогенность вируса (Табл. 1). Для 15 штаммов, вошедших в исследование, была определена первичная структура гена PB1, и результаты секвенирования подтвердили данные анализа на биочипе.
Для выяснения вопроса, как влияет замена N66S в белке PB1-F2 на патогенность природных изолятов, мы исследовали близкородственные вирусы, отличающиеся по этой позиции, на вирулентность для мышей. На Рис. 1 приведены данные изменения веса мышей для вирусов гриппа подтипов H3N8 и H3N1. Динамика изменения веса мышей, зараженных утиными вирусами 2008–2014 гг. с N66 и S66 в белке PB1-F2, не отличалась достоверно от динамики контрольных мышей. Аналогичные результаты получены и для вирусов подтипов H4N6 и H6N2 (Табл. 2). Важно подчеркнуть, что у всех зараженных мышей наблюдался мощный вирусспецифический иммунный ответ, проявляющийся в высоких титрах антител (по данным ИФА). Это свидетельствовало о том, что заражение прошло успешно. Единственный утиный штамм вируса гриппа, который вызывал болезнь и гибель мышей, – изолят 1988 года d/664.
РОМАНОВСКАЯ-РОМАНЬКО Екатерина Андреевна
БЕЗОПАСНОСТЬ, ИММУНОГЕПНОСТЬ И ПРОФИЛАКТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ВАКЦИННЫХ ШТАММОВ ВИРУСА ГРИППА A/II5N1 С УДАЛЕННЫМИ ФАКТОРАМИ ПАТОГЕНПОСТИ: БЕЛКАМИ NS1 И PB1-F2
Специальность 03.02.02 - Вирусология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата биологических наук
Научный руководитель: доктор биологических наук
Егоров Андрей Юрьевич
Официальные оппоненты: доктор медицинских наук
Бичурина Майна Александровна
доктор биологических наук Ипанова Валерия Тимофеевна
Ведущая организация: Учреждение Российской академии медицинских
наук Научно-исследовательский институт экспериментальной медицины Северо-Западного отделения РАМН
Ученый секретарь ' ^ кандидат медицинских наук
Диссертационного совета /У/ Суховецкая Вера Федотовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы
Основной задачей, поставленной ВОЗ в глобальном плане подготовки к борьбе с гриппом и защиты от пандемий, является создание коллекции вакцинных штаммов, которые, в случае наступления пандемической ситуации, могут быть немедленно востребованы для производства вакцины (ВОЗ, 2005). Вирус гриппа птиц H5N1 сохраняет высокий пандемический потенциал, так как продолжает активно циркулировать в популяциях домашних птиц, вызывая вспышки заболевания с высоким уровнем смертности среди людей. >
При подготовке к пандемии живые аттенуированные вакцины имеют ряд преимуществ, связанных с возможностью их интраназального введения, способностью формировать местный иммунный ответ и обеспечивать широкий спектр защиты против дрейфовых вариантов вируса гриппа (Rudenko et al., 1996; Belshe et al., 2007).
Новым направлением в создании эффективных и безопасных живых гриппозных вакцин является использование рекомбинантных вирусов с укороченным или удаленным NS1 белком (delNSl) - антагонистом системы интерферонов первого типа (Egorov A. et al., 1998; Garcia- Sastre et al., 1998). Вследствие отсутствия экспрессии белка NS1, такие штаммы теряют способность к полноценной репликации в ИЛФ-компстснтпых организмах, но могут накапливаться до высоких титров в ИФН-дефицитных системах таких, как клеточная линия Vero, разрешенная для производства вакцин (Talon et al., 2000; Romanova J et al., 2009). Неспособность delNSl вирусов к репродукции в клетках респираторного тракта обеспечивает высокий уровень безопасности вакцины, полученной на основе штаммов с удаленной генетической последовательностью, кодирующей белок NS1. В то же время, delNSl вакцинные вирусы являются достаточно иммуногенными из-за повышенной продукции цитокинов в месте аппликации вакцины. Высвобождение цитокинов таких, как интерфероны первого типа, стимулирует местный иммунитет слизистых оболочек носа, опосредованный секреторными антителами класса IgA, цитотоксический, а также системный В- и Т- клеточный иммунный ответ, обеспечивая перекрестную защиту без использования адъювантов (Ferko et al., 2004; Stasakova J. et al., 2005).
Результаты доклинических исследований delNSl вакцинных кандидатов против эпидемических вирусов гриппа A. (H1N1, H3N2) и В продемонстрировали их безопасность и профилактическую эффективность на экспериментальных моделях мышей, хорьков и приматов (Wressnigg et al., 2009; Nakowitsch et al., 2011). Перспективность использования delNSl гриппозных вакцин у людей была показана в ходе I фазы клинического исследования моновакцины на основе штамма вируса гриппа А/Новая Каледония/20/99 (H1N1) (Wacheck et al., 2010).
Разработка H5N1 вакцинных кандидатов с укороченным NS1 сегментом генома является новым подходом к созданию живых аттенуированных пандемических гриппозных вакцин.
Цель исследования. Разработка вакцинных кандидатов против высокопатогенного вируса гриппа A/H5N1 на основе вирусных штаммов с удаленной геномной последовательностью, кодирующей белок NS1. Задачи исследования
2. Охарактеризовать рекомбинантные H5N1 delNSl вакцинные штаммы in vitro по следующим параметрам: репродуктивность на культуре клеток Vero, генетическая стабильность и антигенные свойства.
3. Оценить безопасность H5N1 delNSl вакцинных штаммов на моделях мышей и приматов при интраназальном введении.
4. Оценить иммуногенные и протективные свойства H5N1 delNSl вакцинных штаммов при экспериментальной гриппозной инфекции у мышей и приматов.
5. Изучить влияние удаления фактора патогенности - белка PB1-F2 на безопасность, иммуногенную активность и протективные свойства delNSl вакцинных штаммов.
Научная новизна работы
Практическая значимость работы
В результате проведенных исследований было показано, что использование штаммов вируса гриппа A/H5N1, имеющих делецию последовательности, кодирующей белок NSI (delNSl), в качестве интраназальной вакцины может служить перспективным подходом в решении задач разработки нового поколения пандемических противогриппозных вакцин. Результаты, полученные в ходе проведенных доклинических исследований, были использованы для проведения клинического исследования I фазы вакцинного кандидата VN1203 delNSl на основе штамма А/Вьетнам/1203/04 (H5N1).
Основные положения, выносимые на защиту
1. Рекомбинантные штаммы вируса гриппа A/H5N1, имеющие делецию геномной последовательности, кодирующей . - белок NS1, являются генетически стабильными при длительном пассировании на культуре клеток Vero и обладают высоким уровнем репродуктивной активности.
2. H5NldelNSl вакцинные штаммы обладают аттенуированным фенотипом и являются безопасными при интраназальном применении у мышей и приматов.
3. Интраназальная иммунизация животных (мышей и приматов) H5N1 delNSl вакцинными штаммами приводит к формированию кросс-реактивного иммунного ответа и обеспечивает защиту от инфекции, вызванной вирусами гриппа A/H5N1 различных клайдов.
4. Отсутствие экспрессии белка PB1-F2 - антагониста системы интерферонов -не снижает ростовых характеристик и приводит к увеличению безопасности и иммуногенной активности H5N1 delNSl вакцинного штамма.
Публикации. По теме диссертации опубликовано 15 печатных работ, в том числе 3 статьи в журналах, рекомендованных ВАК, 1 патент и 10 тезисов докладов. Принята к печати 1 статья в журнале, входящем в список ВАК. Объем и структура диссертации. Диссертация. изложена на 128 страницах машинописного текста, включая 13 таблиц и 28 рисунков. Работа состоит из введения, обзора литературы, описания использованных материалов и методов, 4-х глав собственных исследований, обсуждения полученных результатов,
выводов и списка цитируемой литературы. Список литературы содержит 195 источников на русском и английском языках.
Иммунизация и экспериментальное заражение животных. Мышам под легкой эфирной анестезией вводили интраназально 50 мкл культуральной или аллантоисной жидкости с известным содержанием вакцинных (Ю2'0-106'3ТИД5о) или заражающих вирусов (102О-105'3 ТИД50). Иммунизацию и заражение приматов проводили под наркозом (кетамин-ксилозин), вводя интраназально 500мкл культуральной или аллантоисной жидкости с известным содержанием вакцинного или заражающего • вируса. Животные контрольных групп при иммунизации получали эквивалентный объем культуральной жидкости или фосфатного буферного раствора, не содержащих вируса.
Иммунологические методы. Наличие антигемагглютинирующих антител определяли в сыворотках- иммунизированных и контрольных животных в реакции торможения гсмагглютинации (РТГА) с использованием 0,5%
куриных или 1% лошадиных эритроцитов. Наличие нейтрализующих антител определяли в сыворотках иммунизированных и контрольных, животных в реакции микронейтрализации (РМН) вируса гриппа на культуре клеток Vero с использованием в качестве первых антител моноклинальных антител к белку NP вируса гриппа А (0.125 мкг/мл; Chcmicon, США). В качестве вторых антител использовали поликлональные анти-мышиные IgG антитела козы (0.25 мкг/мл; KPL, США), конъюгированные с пероксидазой хрена. Иммуиоферментный анализ (ИФА) для выявления вирус-специфических антител классов IgG и IgA определяли в образцах сывороток и носовых смывов опытных животных. Использовали рекомбинантный гемагглютинин, соответствующий вирусу А/Вьетнам/1203/04 II5N1 (0.5 мкг/мл). HS-специфические IgG или IgA в зависимости от эксперимента выявляли с помощью анти-мышиных антител козы IgG, IgGl, IgG2a или IgA (Rockland, Германия), конъюгированных с пероксидазой хрена. Молекулярпо-гепетические методы.
CGAGAAAGTTCTTATCTCTTGCTC-3'. Для скрининга вирусов, имеющих полноразмерных NS сегмент генома, была использована пара праймеров: 5'NS-l 5'-AGCAAAAGCAGGGTGACAAAG-3' и 3'NS-205 5'-CACGTGTGGCTGTCTCGATGT С-3'. Данная пара праймеров выявляла только полноразмерные NS сегменты генома, поскольку область отжига праймера 3'NS-205 у delNSl штаммов была делетирована в результате удаления геномной последовательности белка NS1. Для секвенирования участка НА, включающего нуклеотидную последовательность основного сайта расщепления, были использованы универсальные Н5 праймеры: H5uniF -5 ' А АС АСС AACTGTC А ААСТСС и H5uniR - 5'TTGACCTTATTGGTGACTCC.
Детекцию продукта ПЦР проводили в 2% агарозном геле с последующим окрашиванием бромистым этидием.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ Получение H5N1 delNSl вакцинных штаммов
Вакцинные вирусные штаммы были получены путем трансфекции клеток Vero набором из 8 плазмид, в каждую из которых была клонирована кДНК одного из восьми вирусных геномных сегментов (Hoffmann et al., 2000). Полноразмерные последовательности генетических сегментов были синтезированы на основе последовательностей, полученных из базы данных GeneBank, и клонированы в двунаправленную экспрессионную плазмиду pHW_2006 в компании Geneart AG (Регенсбург, Германия). Вирусные штаммы были сконструированы на основе вакцинного штамма IVR-116, рекомендованного ВОЗ для производства вакцин, и содержали гены НА, NA и M (5:3 реассортанты) или только НА и NA (6:2 реассортанты) от штаммов вируса гриппа A/H5N1.
В процессе клонирования в геномном сегменте NS delNSl вакцинных штаммов была делетирована генетическая последовательность, кодирующая белок NS1, что, однако, не отражалось на способности данных вирусов образовывать мРНК белка NS2 (NEP).
Полиосновный сайт расщепления НА RERRRKKR/GLF, характерный для высокопатогенных вирусов гриппа птиц H5N1, во всех штаммах был заменен на трипсинозависимую последовательность TETR/GLF, типичную для непатогенных Н5 вирусов (Horimoto et al., 2006).
Для иммунизации животных были получены следующие штаммы: [VN1203delNSl] - 5:3 реассортант вируса гриппа А/Вьетнам/1203/2004 (H5N1, клайд 1), рекомендованного ВОЗ для создания пандемических вакцин; [Kurg delNSl] - 6:2 реассортант вируса гриппа А/курица/Курган/05/2005 (H5N1, клайд 2.2). Также был получен штамм delNSl [Kurg full], имеющий все геномные сегменты от вируса гриппа. А/Курган/05/2005 (H5N1, клайд 2.2).
Для того, чтобы проанализировать влияние такого фактора патогенности, как белок PB1-F2, на свойства delNSl штаммов, были получены два 6:2 реассортанта вируса А/курица/Курган/5/05 на основе вируса 1VR-116 [Kurg delNSl] и [Kurg wtNSdelF2], Благодаря введению трех стоп-кодонов в нуклеотидную последовательность PB1-F2 (T153G, Т222А, G291A) и замене первого метионина на треонин эти вирусы не были способны экспрессировать функциональный белок PB1-F2 (knockout мутанты). При этом один из
реассортантов [Kurg delNSdelF2] обладал удаленной генетической последовательностью белка NS1 и был использован в качестве вакцинного кандидата, а второй [Kurg wtNSdelF2] — имел полноразмерный сегмент генома NS и, соответственно, сохранял такой фактор патогенности, как белок NS1.
Для экспериментального заражения животных использовали 6:2 реассортанты на основе вируса IVR.-116 с полноразмерным NS1 геном, содержащие НА и NA от вирусов гриппа A/H5N1 А/Вьетнам/1203/04 (клайд1) [VN1203 wtNS], А/Гонконг/213/03 (клайд 1) [НК213 wtNS], А/Индонезия/5/05 (клайд 2.1) [IND05 wtNS] и А/курица/Курган/5/05 (клайд 2.2) [Kurg wtNS], Наличие полноразмерного белка NS 1 позволяло этим вирусам реплицироваться в респираторном тракте животных. Характеристика использованных в исследовании штаммов представлена в таблице 1.
Характеристика реассортантных штаммов вируса гриппа A/H5N1,
использованных в исследовании
Название штамма Реассортация с IVR-116 Удаление последовательности NSI Экспрессия РВ1-Р2
VNJ203delNSl 5:3 есть нет
Kurg delNSl 6:2 есть нет
Kurg delNSdelF2 6:2 есть есть
Kurg full - есть нет
Kurg wtNSdeIF2 6:2 нет есть
Kurg wtNS 6:2 нет нет
VN1203 wtNS 6:2 нет нет
HK213 wtNS 6:2 нет нет
IND05 wtNS 6:2 нет нет
Все вирусные штаммы были получены и культивировались исключительно на сертифицированной клеточной линии Vero, разрешенной для производства вакцин.
Ростовые характеристики и генетическая стабильность II5N1 delNSl вакцинных кандидатов
В ходе исследования было показано, что delNSl штаммы вируса гриппа A/H5N1 могут успешно продуцироваться на ИНФ-дефектной культуре клеток Vero до высоких титров. Вакцинный вирус VN1203delNSl был способен расти до 108'5 ТИД5()/мл, при этом ростовые показатели не снижались ростовых показателей при длительном пассировании на культуре клеток Vero (12 пассажей).
Для вакцинного штамма VN1203delNSl была продемонстрирована высокая генетическая стабильность при длительном пассировании на культуре клеток Vero. Секвенирование генов НА, NA и М вакцинного штамма VN1203delNSl после 8 пассажей на культуре клеток показало отсутствие мутаций в данных генах. Кроме этого, для штамма VN1203delNSl было
продемонстрировано сохранение при пассировании (12 пассажей) на культуре Vero всех генетических (удаление генетической последовательности белка NS1, модификация сайта расщепления НА, 6:2 реассортация со штаммом IVR-116) и фенотипических (неспособность штамма delNSl образовывать бляшки на культуре клеток в отсутствии трипсина) маркеров аттенуации.
Также было показано, что в процессе пассирования и накопления (8 пассажей) вирусного штамма VN1203delNSl сохраняются антигенные свойства, характерные для исходного штамма вируса гриппа А/Вьетнам/1203/04 (H5N1, клайд 1).
Безопасность H5N1 delNSl вакцинных штаммов на моделях мышей и приматов
Безопасность и безвредность применения H5N1 delNSl вакцинных штаммов в качестве вакцинных кандидатов была продемонстрирована на различных моделях животных: беспородных мышах, мышах линии С57Ы/6 и яванских макаках.
Однократная и двукратная интраназальная иммунизация мышей delNSl вакцинными штаммами VN1203delNSl (в дозе Ю5'7ТИД50 на животное), Kurg delNSl(Ю6,0 ТИД50 на животное), Kurg delNSdelF2 (1060 ТИД50 на животное) и Kurg full (105 ТИД50 на животное) не приводила к снижению массы тела и развитию каких-либо клинических симптомов у животных. Для 6:2 рекомбинантных вакцинных штаммов (VN1203delNSl, Kurg delNSl и Kurg delNSdelF2) было показано отсутствие репликации в респираторном тракте мышей. Для вакцинного кандидата Kurg full, обладающего всеми сегментами генома от вируса А/Курган/5/05 (delNSl), на 2 день после иммунизации у 3-х животных из 6-и вакцинный вирус был выявлен в низком титре ( t ч ii
Читайте также:


