Дибикор при гепатите с
Специалистам в области медицины приходится сталкиваться с задачей выбора препаратов при любом заболевании, особенно при наличии сопутствующих патологий. При этом следует учитывать возможное токсическое действие лекарственных средств, их сочетание и совместимость. Не всегда удается уйти от полипрагмазии, последствия которой сказываются на печени. На наш взгляд, значимым решением этой проблемы может явиться применение такого препарата как Дибикор. Именно об этом мы беседовали с доктором медицинских наук профессором Ларисой Арсентьевной ЗВЕНИГОРОДСКОЙ
— Лариса Арсентьевна, скажите, пожалуйста, с какими проблемами желудочно- кишечного тракта приходится сталкиваться вашим пациентам и чем они обусловлены?
— К нам приходят больные с самым широким спектром заболеваний желудочно- кишечного тракта, печени и желчевыводящих путей — это хронический гепатит, цирроз печени, печеночная недостаточность, холестаз, жировой гепатоз, хронический гастрит, лекарственные гепатиты, язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, заболевания толстой кишки, дивертикулярная болезнь толстой кишки и т.д. Причины могут быть разнообразные — от стрессов до лекарственной интоксикации и инфекции.
— Удовлетворены ли вы арсеналом лекарственных препаратов, которые назначаются при заболеваниях печени, и что вас не устраи вает?
— Пациенты приходят к нам не с одним, а с целым букетом заболеваний. Они вынуж дены принимать сразу несколько препаратов. Многие из них противопоказаны при забо леваниях печени, а их применение приводит к метаболическим нарушениям клеток вну тренних органов, в том числе и гепатоцитов, например, диклофенак натрия, салицилаты, тетрациклины, парацетамол. Лекарственные стеатозы, холестазы не всегда можно устра нить только отменой препарата. Необходи мо средство, не имеющее противопоказаний и обладающее свойством убирать побочное действие других лекарств.
Наше внимание было привлечено к пре парату Дибикор. Его показания: хроническая сердечная недостаточность и сахарный диабет типа 1 и 2. Опыт применения препарата при этих заболеваниях показал, что он благопри ятно действует на обмен липидов и функцию печени. Этот факт не удивителен, т.к. дей ствующим веществом препарата является сульфокислота — таурин. Из классической биохимии известно, что таурин, соединяясь с холевыми кислотами, непосредственно связан с функцией печени и обменом жиров, холе стерина и жирорастворимых витаминов. При хронических заболеваниях печени, особенно при циррозах, часто наблюдается также нару шение гомеостаза глюкозы. Нарушение гомеостаза глюкозы у больных с циррозом печени выявляется часто при проведении тестов на толерантность к инсулину. В научной лите ратуре были опубликованы результаты иссле дований действия Дибикора при сахарном диабете. Я имею в виду работы профессоров А.C. Аметова, М.В. Шестковой, А.М. Мкрту мяна. В них было показано, что Дибикор благоприятно действует на все показатели метаболизма углеводов (постпрандиальную и тощаковую глюкозу, гликозилированный гемоглобин). Он также уменьшает инсулинре зистентность, защищая при этом бета-клетки поджелудочной железы. В этих работах про демонстрировано уменьшение ферментатив ной гиперактивности трансаминаз, что само по себе уже говорит о влиянии Дибикора на клеточную мембрану гепатоцитов.
— А что можно ожидать от этого пре парата и есть ли какие-то данные о непо средственном его влиянии на печень при раз личной печеночной патологии?
— Есть много экспериментальных и кли нических работ, которые свидетельствуют о гепатопротекторных свойствах таурина. Например, у больных взрослых и детей, находящихся на парентеральном питании, могут развиться такие осложнения, как стеатоз, холестаз и застойные процессы с образованием камней. Специалисты в этой области считают, что в данной ситуации следует принимать соответствующие меры: исключить препараты, обладающие гепато токсическими свойствами, приостановить лечение травами, сократить калорийность пищи, в том числе и жирных эмульсий, добавить в терапию таурин (Kumpf V.J. 2006).
Miyata K. с соавт. провели исследование на пациентах с колоректальным раком II—III стадии. На фоне постоперационной адъю вантной химиотерапии тегафурурацилом у некоторых больных развивалась гипербилиру бинемия. В связи с этим к химиотерапии был добавлен таурин. Таурин повысил способ ность к экскреции желчи, увеличил кровоток печени и улучшил активность гепатоцитов. Комбинация успешно устранила гипербили рубинемию у этих больных.
Известно, что попадание в организм живот ных таких веществ, как четыреххлористый углерод, белый фосфор, приводит к деграда ции гепатоцитов и других клеток печени. Эти вещества вызывают активацию липогенеза, повышенную пролиферацию, а в строме — клеточную инфильтрацию. Matsuoka T. обна ружил, что таурин (0,5 г/кг) как при остром, так и при хроническом отравлении устранял эффекты ядов и восстанавливал нормальный обмен веществ и физиологическую функцию печени. Оральное введение таурина также предотвращает фиброз печени и гепатоцел люлярный некроз, вызванный четыреххлори стым углеродом и этанолом.
Сотрудники Волгоградской медицинской академии МЗ РФ изучали действие Дибикора при лечении хронических гепатитов. Приведу один клинический пример:
Больная А., 18 лет. Диагноз: хронический активный гепатит. Страдает хроническим персистирующим гепатитом около 8 лет. Настоящее обострение около 3-х месяцев. Предшествующая гормональная терапия к клинико-лабораторному улучшению не при вела: сохранялась высокая активность фер ментов и снижение печеночного кровотока. После курса терапии Дибикором длительно стью 21 день в дозе 1 г в сут отмечалось значи тельное клиническое улучшение: у пациент ки увеличился кровоток более чем на 200%, активность всех изучаемых ферментов, в том числе и уроканиназы.
Также об опыте применения Дибико ра в гастроэнтерологии сообщали в 2006 г. на XII Российской гастроэнтерологической неделе в Москве. Авторы исследовали влияние Дибикора на антигеликобактерную терапию у больных язвенной болезнью двенадцатиперст ной кишки и обнаружили, что заживление язв за две недели при применении Дибикора отмечалось у 88%; без включения Дибикора — у 65% больных; за четыре недели— у 98% и 89% соответственно. Эрадикация Helicobacter pylori с включением Дибикора достигалась у 92,8%, без включения Дибикора — в 67%.
— А какие-то ваши собственные наблюде ния при лечении Дибикором уже есть?
— Говорить о статистике еще рано, но мы наблюдаем у наших больных на терапии Дибикором улучшение качества жизни: уве личение работоспособности, снятие стресса, устранение побочных эффектов при липи доснижающей терапии, улучшение метаболи ческих нарушений в печени (по уменьшению ферментативной активности трансаминаз). Было обнаружено, что препарат хорошо сни мает синдром “компьютерного зрения”.
— А с чем можно связать подобный эффект Дибикора?
— О том, что обмен жиров непосредствен но связан с таурохолевыми кислотами, мы уже говорили. На самом деле существует таурин, который находится в свободном состоянии. И именно этот таурин представлен в клет ках не только печени, но и в других органах и тканях. Можно сказать, свойства таурина определяют эффекты Дибикора как мембран ного стабилизатора, регулятора осмотиче ского давления, внутриклеточного кальция и противовоспалительного средства, действую щего через так называемый нуклеарный фак тор. Нам представляется, что препарат займет достойное место для лечения метаболических нарушений со стороны печени.
Н.В. ЛОСЕВА, заведующая гастроэнтерологическим отделением ГКБ №7 г. Новосибирск

В последние годы ожирение среди населения многих стран, в том числе и России, приобрело характер неинфекционной пандемии. Являясь одним из главных модифицируемых факторов риска развития сердечно-сосудистых заболеваний, избыточная масса тела обуславливает и заболевания органов пищеварения, прежде всего печени.
Жировая инфильтрация печеночных клеток лежит в основе самостоятельного заболевания, или синдрома, называемого стеатозом печени (синонимы: жировой гепатоз, метаболический стеатоз). Морфологическим критерием жирового гепатоза является содержание триглицеридов (ТГ) в печени свыше 10% сухой массы. При развитии воспалительного процесса на фоне стеатоза печени говорят о наличии стеатогепатита (СГ). В первых сообщениях о СГ указывалось, что до 80—85% случаев составляют алкогольные и лишь 15—20% — неалкогольные стеатогепатиты (НАСГ). В последние годы доля НАСГ увеличилась до 30—40%. В США 62,5% взрослого населения имеют избыточный вес (индекс массы тела, ИМТ > 30 кг/м2), а в исследовании Dionysos study (1994) отмечалось наличие гистологически подтвержденного стеатоза у 46% пациентов с ожирением, не злоупотребляющих алкоголем, и у 95% — с ожирением и употребляющих более 60 г чистого этанола в день.
Таким образом, существует четкая корреляция между ИМТ и частотой жировой инфильтрации печени, не связанной с приемом алкоголя. По данным нашего отделения, за 5 лет, с 2005 по 2009 г., из 8359 пациентов у 1739 (21%) был выявлен ИМТ более 30, а у 965 из них (56%) при обследовании диагностирована неалкогольная жировая болезнь печени (НАЖБП). При этом в 10% (95 случаев) — НАСГ, а в 90% (870 человек) — стеатоз.
НАЖБП — нозологическая единица, при которой морфологические изменения в ткани печени подобны таковым при алкогольном гепатите, но пациенты не употребляют алкоголь в токсических количествах (мужчины до 30 г/сут, а женщины до 20 г/сут). Степень дистрофических, воспалительных и фиброзных изменений может варьировать вплоть до стадии цирроза печени.
Выделяют первичную, ассоциированную с метаболическим синдромом, и вторичную НАЖБП, вызванную лекарственными препаратами, синдромом мальабсорбции, быстрым уменьшением массы тела, длительным парентеральным питанием, болезнью Вильсона и др.
Для больных с СГ и НАСГ характерно преобладание женщин (до 80%) с ИМТ более 30, старше 50 лет; инсулинонезависимый сахарный диабет у 25—70%; у 50% отсутствуют симптомы заболеваний печени; иногда имеется неопределенный абдоминальный дискомфорт, тяжесть в правом подреберье, астенический синдром; у 70% обнаруживается гепатомегалия; при инструментальном исследовании — повышенная эхогенность печени, сглаженность сосудистого рисунка, снижение плотности паренхимы печени; при морфологическом исследовании — жировая дистрофия гепатоцитов, некрозы, внутридольковое воспаление, периваскулярный фиброз, чаще слабый или умеренно выраженный.
Терапия НАСГ включает комплекс мероприятий, направленных в первую очередь на уменьшение активности воспаления и, следовательно, гибели гепатоцитов, предотвращение накопления жирных кислот в печени (коррекцию массы тела и дислипидемии, компенсацию углеводного обмена, борьбу с инсулинорезистентностью). Модификация образа жизни, гипохолестериновая диета и медикаментозная терапия — основных три направления лечения пациентов с жировой болезнью печени.
При всем многообразии медикаментозных средств продолжается поиск новых препаратов с хорошей эффективностью и минимумом побочных эффектов.
В нашем исследовании мы применяли препарат Дибикор® (таурин), разработанный сотрудниками РКНПК, Института биофизики МЗ РФ и Волгоградского государственного медицинского университета. Действующим началом является таурин, жизненно необходимая сульфоаминокислота — конечный продукт обмена серосодержащих аминокислот (метионина, цистеина, цистамина). Таурин — естественный метаболит, присутствующий в организме животных и человека. У него выявлены свойства антиоксиданта, осморегулятора, мембранопротектора, детоксиканта, природного антагониста кальция, он нормализует обмен холестерина. В норме во многих клетках — лейкоцитах, эритроцитах, клетках печени, миокарде, в некоторых отделах мозга и сетчатке глаз — обнаруживаются очень высокие внутриклеточные концентрации таурина. Снижение содержания таурина на фоне патологических изменений приводит к нарушению функций этих органов.
В связи с вышеизложенным интересно было оценить гепатопротекторные свойства таурина при различных нарушениях функции печени и сравнить с уже известными гепатопротекторами.
В исследовании, проведенном на базе гастроэнтерологического отделения МКБ №7 г. Новосибирска, приняли участие 36 пациентов с НАСГ обоего пола от 18 до 65 лет, с длительностью заболевания не менее 1 года. Критерии исключения: вирусные гепатиты В и С, алкогольный анамнез, сопутствующая патология в стадии субкомпенсации или декомпенсации, прием препаратов, потенциально способных приводить к нарушению функции печени, отсутствие у врача уверенности в комплаенсе больного. Продолжительность наблюдения составляла 1 месяц для каждого пациента. Пациенты были разделены на 2 группы. Все из них получали терапию, включающую эссенциальные фосфолипиды, силимарины, метформин, витамины, а пациенты второй группы (n=20) дополнительно принимали Дибикор по 0,5 г 2 раза в день за 20 минут до еды. До исследования и через месяц всем пациентам проводились электрокардиограмма, биохимический анализ крови, липидный профиль, гликемический профиль, оценивались общее состояние и динамика жалоб, измерялись вес, параметры ИМТ и отношение обхвата талии к обхвату бедер (ОТ/ОБ). При лечении никаких побочных эффектов препарата Дибикор выявлено не было.
В обеих группах на фоне стандартной терапии НАСГ произошло улучшение общего состояния пациентов: уменьшилась слабость, повысилась работоспособность, были купированы диспепсия и болевой синдром. При анализе динамики биохимии в обеих группах также отмечалась нормализация показателей активности (цитолиза) трансаминаз, но при этом лишь в группе Дибикора были выявлены положительные сдвиги липидного спектра. Эти изменения заключались в снижении уровня холестерина (5,48±0,31 до лечения и 5,11±0,25 после лечения), ТГ (1,97±0,63 исходно и 1,56±0,46 через 1 месяц) и коэффициента атерогенности на 0,67 (р
Аннотация научной статьи по клинической медицине, автор научной работы — Звенигородская Л. А., Нилова Т. В.
Похожие темы научных работ по клинической медицине , автор научной работы — Звенигородская Л. А., Нилова Т. В.
TAURINE IN TREATMENT OF NON-ALCOHOLIC FATTY LIVER DISEASE
The clinical study in which was evaluated efficacy of taurine ( Dibicor , "PIKPharma") in patients with non-alcoholic fatty liver disease and type 2 diabetes mellitus (T2DM type) in compare to placebo. Clinical research led to the conclusion that use of the drug dibicor has hypoglycemic effect, removes cholesterol in the taurocholic bile acid complex, anti-inflammatory, antioxidant, detoxifying and membrane stabilizing effect. Dibicor pharmacotherapy was estimated by clinical and biochemical parameters of blood and markers of inflammation in liver at the early stages of transition from steatosis to steatohepatitis indicators of nitrogen oxide metabolites and bacterial polysaccharide ( endotoxin )
ТАУРИН В ЛЕЧЕНИИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Звенигородская Л. А., Нилова Т. В.
ГБУЗ Центральный научно-исследовательский институт гастроэнтерологии ДЗ г. Москвы
Звенигородская Лариса Арсентьевна
Ключевые слова: неалкогольная жировая болезнь печени; оксид азота; эндотоксин; дибикор. SUMMARY
The clinical study in which was evaluated efficacy of taurine (Dibicor, "PIK- Pharma") in patients with non-alcoholic fatty liver disease and type 2 diabetes mellitus (T2DM type) in compare to placebo. Clinical research led to the conclusion that use of the drug dibicor has hypoglycemic effect, removes cholesterol in the taurocholic bile acid complex, anti-inflammatory, antioxidant, detoxifying and membrane stabilizing effect. Dibicor pharmacotherapy was estimated by clinical and biochemical parameters of blood and markers of inflammation in liver at the early stages of transition from steatosis to steatohepatitis - indicators of nitrogen oxide metabolites and bacterial polysaccharide (endotoxin) Keywords: non-alcoholic fatty liver disease, nitric oxide, endotoxin, dibicor.
Неалкогольная жировая болезнь печени (НАЖБП) в настоящее время признана самым распространенным в популяции заболеванием и представляет собой поражение печени, включающее жировую дистрофию с воспалением и повреждением гепатоцитов — неалкогольным стеатогепа-титом (НАСГ) и фиброзом с возможностью перехода в цирроз. НАЖБП в 75% случаев протекает на фоне ожирения, дислипидемии, артериальной гипертонии, сахарного диабета 2-го типа или нарушением толерантности к глюкозе 3. Указанные патологические процессы являются факторами риска сердечно-сосудистых заболеваний и атеросклероза. В патогенезе немаловажную роль играет нарушение микрофлоры толстой кишки и, как следствие, повышение содержания продуктов жизнедеятельности микроорганизмов (короткоцепочечные жирные
кислоты, эндотоксин, оксид азота) 4. Биопсия печени является наиболее специфичным и чувствительным диагностическим методом выявления заболевания, когда нет возможности провести пункционную биопсию печени, для раннего выявления воспаления при НАЖБП можно использовать определение маркеров воспаления — оксида азота и эндотоксина [7].
В настоящее время для лечения больных НАЖБП используют препараты, сочетающие в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительную терапию [8].
1. Гепатопротекторы (эссенциальные фосфо-липиды, урсодезоксихолевая кислота, препараты липоевой кислоты, орнитин-гепамерц, таурин-дибикор).
2. Антиоксиданты (аевит, эйканол, липостабил и др.).
3. Антибактериальные препараты (санация толстой кишки рифаксимин-альфанормикс, ме-тронидазол, макролиды и др.).
4. Пребиотики и пробиотики (бифидумбакте-рин, лактумбактерин, споробактерин бифиформ-комплекс.
Таурин — жизненно необходимая сульфоа-минокислота, являющаяся конечным продуктом обмена серосодержащих аминокислот (метионин, цистеин, цистеамин) [9; 10]. Дефицит таурина в любом органе приводит к осложнениям, дефицит в печени ведет к нарушению желчевыделения и образованию камней. Таурин, соединяясь с холевой кислотой, участвует во всасывании жиров и жирорастворимых витаминов. Препарат дибикор имеет в молекуле сульфгидрильные группы, которые обуславливают фармакодинамическую активность соединения.
ДИБИКОР — ЕСТЕСТВЕННЫЙ ПРОДУКТ ОБМЕНА СЕРОСОДЕРЖАЩИХ АМИНОКИСЛОТ (метионина, цистеина, цистеамина)
• является тормозным нейромедиатором;
• регулирует выработку пролактина, адреналина,
• улучшает метаболизм в печени.
Образование смешанных дисульфидов тиолов белка с глутатионом является ключевым событием в регуляции клеточного ответа на окислительный стресс. Детоксицируются не только продукты перекисного окисления липидов за счет конъюгации с глутатионом, а также ксенобиотики и их метаболиты в защите от токсических, мутагенных, и канцерогенных соединений. Наличие в молекуле тиоловых групп придает свойства антиоксидантов. Образование SH-групп обуславливает относительно высокую детоксицирующую активность соединения, которое может выступать в роли эффек-торного вещества в реакциях гидроксилирования, стимулировать процессы образования глюкурони-дов. Благодаря сульфгидрильным группам соединение может взаимодействовать с токсическими веществами и предохранять SH-группы жизненно важных ферментов организма. Тиолдисульфидная система играет существенную роль в поддержании редокс-потенциала клеток, является ингибитором активных форм кислорода и стабилизатором мембран [11; 12].
Дибикор проявляет свойства антиоксиданта, способствуя удалению СР, улучшает метаболические
процессы в сердце печени и других органах и тканях. Обмен липидов в организме человека тесно связан с участием желчных кислот. Таурин в составе таурохолевых желчных кислот принимает активное участие в выведении холестерина.
При диффузных заболеваниях печени увеличивает кровоток, улучшает микроциркуляцию и уменьшает выраженность цитолиза.
Показана его эффективность в отношении влияния на углеводный и липидный обмен. Антиоксидантное, гипогликемиру-ющее, детоксицирующее действие дибико-ра и его способность в выведении холестерина дает возможность применять его для лечения НАЖБП. В организме животных концентрация таурина падает при ишемии, радиационном облучении и других воздействиях. На фоне приема дибикора исчезала одышка у больных, они чувствовали прилив сил, увеличение трудоспособности, улучшение общего состояния. У больных с артериальной гипертонией препарат умеренно снижает АД, нормализует обмен ионов кальция и калия в клетках.
Цель исследования — изучить фармакодинами-ческие показатели метаболитов оксида азота и бактериального эндотоксина в результате 3-месячного курса фармакотерапии дибикором у больных НАЖБП и СД 2-го типа; сопоставить содержание оксида азота и эндотоксина у больных НАЖБП с СД 2-го типа с биохимическими показателями крови.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 40 больных НАЖБП и СД 2-го типа до и после фармакотерапии дибикором.
Средний возраст больных составил 56,35 ± 8,75 года, из них 30 женщин и 10 мужчин. Проведено плацебо-контролируемое исследование препарата дибикор в дозе 0,5 г 2 раза в день за 20 минут до еды в течение 3 месяцев. Индекс массы тела больных увеличен на 30-35% в среднем до 40. Верификацию диагноза проводили по данным клинических, биохимических, инструментальных методов исследования.
У больных НАЖБП отмечено достоверное повышение аминотрансфераз АЛТ и АСТ, а также ГГТП у 35 больных. По показателям липидного спектра у обследованных больных также наблюдалось повышенное общее содержание липидов и ЛПНП. По данным УЗИ выявлена жировая дистрофия печени у всех больных. Уровень метаболитов оксида азота в сыворотке крови определяли экспресс-методом для биологических жидкостей с использованием ванадия хлорида (Германия) [13]. Уровень эндотоксина определяли ЛАЛ-тестом (США).
Волгоградский государственный медицинский университет
Актуальность проблемы. Экзогенно-токсические гепатиты представляют собой поражение печени, вызванное токсическими агентами: алкоголем и его суррогатами, лекарственными препаратами, продуктами бытовой химии, пестицидами, профессиональными вредностями. В последние годы как в России, так и за рубежом наблюдается рост распространенности токсических гепатитов [1]. Используемые в настоящее время гепатопротекторы часто недостаточно эффективны, могут способствовать нарастанию холестаза и ферментативной гиперактивности клеток печени [2,3].
Учитывая, что, на решающих этапах патогенеза повреждения печени возникают неспецифические изменения, обусловленные общностью механизмов развития клеточных повреждений [4,5], можно предположить, что применение антиоксидантов в качестве гепатопротективных средств окажется достаточно эффективным и безопасным. Одним из антиоксидантов является таурин (2-аминоэтансульфоновая кислота) [6]. В последнее время установлено, что таурин способствует улучшению энергетических и обменных процессов, нормализации функции клеточных мембран, стимулирует репаративные процессы при различных заболеваниях 10.
При изучении побочных эффектов противотуберкулезной терапии указывается на снижение уровня таурина в организме больных [11].
Таким образом, есть основания считать, что достаточное потребление таурина и устранение его дефицита позволят эффективнее бороться с нарушением обменных процессов у больных туберкулезом.
Цель исследования. Оценить экономическую эффективность применения оригинального отечественного препарата таурина – Дибикорадля лечения и профилактики лекарственно-индуцированного поражения печени как осложнения противотуберкулезной химиотерапии.
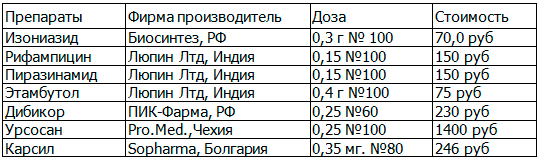
Материалы и методы. В сравнительном проспективном открытом рандомизированном исследовании в параллельных группах участвовали 80 больных с впервые выявленным туберкулезом и 80 больных туберкулезом с лекарственно-индуцированным поражением печени. Все больные получали противотуберкулезные препараты по 1-му стандартному режиму химиотерапии (в соответствии с приказом МЗ РФ №109): изониазид – 0,6 г/сут; рифампицин – 0,45 г/сут; этамбутол – 1,2 г/сут и пиразинамид – 1,5 г/сут. Пациенты были рандомизированы на группы по 20 человек, получавшие в течение 3-х месяцев таурин (Дибикор) 1000 мг/сут, урсодеоксихолевую кислоту (УДХК) (Урсосан) 500 мг/сут, или их комбинацию, а также экстракт плодов расторопши (Карсил) в до 420 мг/сут.
Диагноз туберкулеза легких устанавливался на основании данных ретгенографии органов грудной клетки, клинической картины заболевания, бактериологического и микроскопического анализа мокроты.
Диагноз лекарственного поражения печени устанавливали в соответствии с критериями Guidelines in the Recognition and Prevention of Hepatotoxicity in Clinical Practic, 2001, при повышении сывороточной АлАТ в два раза выше нормы в условиях отсутствия альтернативных клинических диагнозов. Для оценки вероятности связи поражения печени с приемом противотуберкулезных препаратов использовали критерий Roussel Uclaf Causality Assessment Method (RUCAM).
Контрольную группу исследования составили 20 пациентов гастроэнтерологического отделения Городской клинической больницы скорой медицинской помощи №25 г. Волгограда с синдромом раздраженной кишки. Среди них 8 (40,0%) женщины и 12 (60,0%) мужчин в возрасте от 18 до 59 лет, средний возраст которых составил 37,19±16,46 лет (M±s). Обследованные соматически были практически здоровы, не включались в исследование пациенты с заболеваниями почек и печени, сахарным диабетом, злокачественными новообразованиями, инфекционными заболеваниями и алкоголизмом.
Исследование проводили в соответствии с принципами Хельсинкской декларации Международной медицинской ассоциации, принятой в 1996 г., и рекомендациями по этике биомедицинских исследований. Соблюдение требований биоэтики подтверждено результатами экспертизы Регионального этического комитета. Результаты клинического обследования заносились в разработанную индивидуальную регистрационную карту пациента. Все протоколы исследования проходили экспертизу и были утверждены в этическом комитете.
Результаты. На первом этапе исследования обследовано 80 больных с впервые выявленным туберкулезом пациентов Волгоградского областного клинического противотуберкулезного диспансера. Среди них было 52 мужчины (65,0%) и 28 женщин (35,0%) в возрасте от 18 до 62 лет. Средний возраст больных (M±s) составил 38,7±20,3 лет и был сопоставим с группой сравнения (t=0,14, p>0,05).
В ходе исследования выявлена достоверная взаимосвязь развития лекарственного поражения печени как осложнения противотуберкулезной терапии с эффективностью лечения туберкулеза, которую оценивали по степени абациллирования и закрытию полостей распада. Данные представлены в табл.. 1.
Таблица 1. Эффективность лечения туберкулеза легких в зависимости от наличия поражения печени
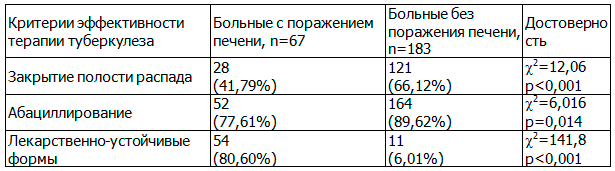
Проведенное исследование показало, что развитие ЛИПП весьма неблагоприятно для больных туберкулезом. Эффективность лечения туберкулеза статистически значимо ниже при развитии лекарственно-индуцированного поражения печени. Из-за выраженных клинико-лабораторных проявлений поражения печени была изменена схема лечения, что привело к замедленной рентгенологической динамике туберкулёзных изменений и повышению частоты развития лекарственно-устойчивых форм микобактерий. Кроме того, необходимо отметить, что у пациентов, которым потребовалась коррекция схемы противотуберкулезной терапии, отмечалось статистически значимое увеличение сроков пребывания в стационаре почти на два месяца по сравнению с больными туберкулезом без ЛИПП (261,7±19,8 дней и 203,1±17,3, соответственно (t=2,23, р 2 =88,54, р 2 =79,303, р 0,05).
Среди пациентов второго этапа исследования лекарственно-индуцированное поражение печени наблюдалось как у больных с впервые выявленным туберкулезом легких, ранее не получавших противотуберкулезные препараты (72 - 90,0%), так и у повторно поступивших (8 пациентов - 10,0%). До начала лечения группы не имели статистически значимых отличий по возрастно-половому составу и характеристике туберкулезного процесса в легких. Кроме того, не было и существенных различий в клинической картине лекарственного поражения печени и уровне цитолиза (p>0,05). Таким образом, анализируемые параметры и группы в целом были сопоставимы.
Наиболее эффективной оказалась комбинация Дибикора и УДХК: у 75% пациентов IIб группы к концу третьего месяца полости деструкции перестали определяться, в то время как в IVб группе сравнения лишь у 45%, соответственно (c 2 =3,75, р=0,05). Кроме того, на фоне комплексной терапии с использованием Дибикора и УДХК наблюдалась более ранняя негативация мокроты. К концу первого месяца – у 20% и 25% пациентов I и II групп, второго – у 35% и 45%, к концу третьего месяца - у 70,0% и 80,0% больных перестали определяться микобактерии; в группе сравнения – у 15%, 25% и 55%, соответственно (c 2 =3,956, р=0,0467). Итак, назначение Дибикора и УДХК позволяло достоверно снизить частоту отмены противотуберкулезной терапии (р 0,05) и приводило к вынужденной отмене противотуберкулезных препаратов у 75% пациентов этой группы (c 2 =24,0, р=0,0001). В то же время во IIб группе, получающей одновременно со специфической терапией комбинацию Дибикора и УДХК, удалось добиться нормализации состояния печени и достоверного снижения уровня трансаминаз до нормальных значений (р 2 =1,026, р=0,311). В Iб группе на фоне терапии Дибикором наблюдалось достоверное снижение уровня трансаминаз (р 2 =3,243, р=0,0717). В IIIб группе применение УДХК достоверно снизило уровень трансаминаз (р 2 =3,75, р=0,05).
Таблица 2. Применявшиеся лекарственные средства
В качестве критерия эффективности использовали процент больных, у которых противотуберкулезная терапии не отменялась и сохранялась ее интенсивность, с учетом длительности стационарного лечения. Более приемлемой с экономической точки зрения считалась схема терапии, которая характеризовалась меньшими затратами на единицу эффективности. Стоимость койко/дня стационарного лечения больных туберкулезом легких составляла 532,86 руб/сут, противотуберкулезной терапии - 12,65 руб/сут. Длительность терапии у больных без поражения печени без гепатопротекции составляла 203,1±17,3 суток, при развитии поражения печени 261,7±19,8 суток. Данные представлены в табл. 3.
Таблица 3. Фармакоэкономический анализ стоимости терапии туберкулеза легких без поражения печени и с лекарственно-индуцированным поражением печени
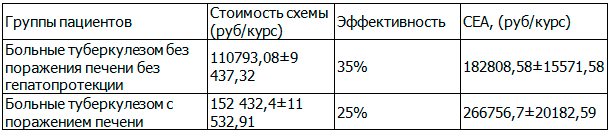
Результаты анализа, представленные в таблице, показывают, что проведение длительных курсов терапии потенциально гепатотоксичными препаратами без гепатопротекции, часто приводит к развитию поражения печени. В результате чего противотуберкулезная терапия вынужденно прерывается у 65-75% пациентов, что значительно удлиняет сроки стационарного лечения больных туберкулезом, снижает эффективность терапии, повышает стоимость курсовой терапии и затраты, приходящиеся на единицу эффективности.
Был проведен фармакоэкономический анализ схем профилактики и для лечения ЛИПП. Данные представлены в табл. 4 и 5.
Таблица 4. Анализ эффективности профилактики лекарственно-индуцированного поражения печени у больных туберкулезом
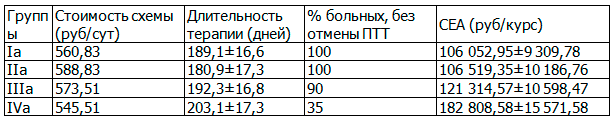
Таблица 5. Анализ эффективности схем терапии лекарственно-индуцированного поражения печени у больных туберкулезом
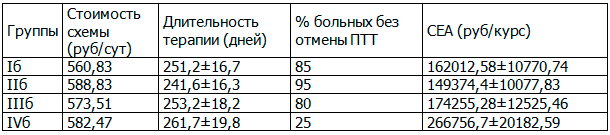
Таким образом, фармакоэкономический анализ доказывает, что применение антиоксиданта для профилактики и лечения лекарственно-индуцированного поражения печени у больных туберкулезом обеспечивает снижение расходов и позволяет значительно сократить частоту развития поражения печени. Назначение Дибикора и его комбинации с УДХК обеспечивает уменьшение затрат при профилактике на 160703 руб/курс (60%), при лечении лекарственно-индуцированного поражения печени на 117382 руб/курс (44%).
Список использованных источников:
1. Carrion J.А. Evaluaciоn de la fibrosis asociada a la enfermedad hepatica, XXXVII congreso anual de la asociacion espanola para el estudio del higado // Gastroenterol. Hepatol. - 2012. - Vol. 35. - P.38-45.
2. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States / G. Ostapowicz, R.J. Fontana, F.V. Schiodt // Ann. Intern. Med. 2002. – №137. – P.947–954.
3. Побочное действие противотуберкулёзных препаратов при стандартных и индивидуализированных режимах химиотерапии / В.Ю. Мишин, В.И. Чуканов, Ю.Г. Григорьев – М.: Компьютербург, 2004. – 208 с.
4. Лукьянова Л.Д. Молекулярные механизмы гипоксии и современные подходы фармакологической коррекции гипоксических нарушений // Фармакотерапия гипоксии и ее последствий при критических состояниях. – СПб. – 2004. – С.36-37.
5. Клинико-патогенетическое значение дислипидемии / Е.С. Симакова, Л.Е. Сивордова, А.И. Романов, Ю.В. Полякова // Кремлевская медицина. Клинический вестник. – 2013. – № 474–478.
6. Taurine in health and diseases: consistent evidence from experimental and epidemiological studies / Y. Yamori, T. Taguchi, A. Hamada, K. Kunimasa, H. Mori, M. Mori // From 17th Int. Meeting of Taurine Fort Lauderdale. – J. Biomed. Sci. – 2010. – Vol.17. – №1. – P.6–9.
7. Мановицкая А.В. Клинические эффекты применения таурина у больных с метаболическим синдромом // Вопросы питания. – 2011. – Т. 80. – №3. – С. 57-61.
8. Применение таурина при нейроэндокринно-обменном синдроме / Р.А. Манушарова, Э.И. Черкезова // Медицинский совет. – 2011. – №7–8. – С. 17-20.
9. Ultrastructural changes in hepatocytes after taurine treatment in CCl4 induced liver injury / I. Tasci, N. Mas, M.R. Mas, M. Tuncer // World J. Gastroenterol. – 2008. – Vol.14. – №31. – P.4897-4902.
10. Taurine attenuates liver injury by down regulating phosphorylated p38 MAPK of Kupffer cells in rats with severe acute pancreatitis / S. Wei, Q. Huang, J. Li, Z. Liu, H. You, Y. Chen, J. Gong // Inflammation. – 2012 Apr. – Vol.35. – №2. – P.690-701.
11. Integrated metabolomic analysis of the nano-sized copper particle-induced hepatotoxicity and nephrotoxicity in rats: a rapid in vivo screening method for nanotoxicity / R. Lei, C. Wu, B. Yang, H. Ma, C. Shi, Q.Wang, Q. Wang, Y. Yuan, M. Liao // Toxicol. Appl. Pharmacol. – 2008. – Vol.232. – №2. – P.292-301.
12. Статистические методы в медико-биологическом эксперименте (типовые случаи) / Д.А. Новиков, В.В. Новочадов. - Волгоград: Издательство ВолГМУ. – 2005. – 84 с.
Читайте также:


