Что такое транскрипция вируса





Общие принципы вирусологии
Цель дисциплины – познакомить студентов с вирусами и субвирусными агентами.
Задача дисциплины - сформировать у студентов представление о:
· месте вирусов и субвирусных агентов в природе
· строении вирусных частиц,
· разнообразии вирусных геномов,
· особенностях взаимодействия вирусов с клеткой и механизмами их репликации,
· природе субвирусных агентов – вироидов, сателлитных РНК и прионах,
IV. Место дисциплины в структуре ООП
Информация об образовательном стандарте и учебном плане:
· тип образовательного стандарта и вид учебного плана – специалитет
· направление подготовки – фармация и лечебное дело
Информация о месте дисциплины в образовательном стандарте и учебном плане:
Для освоения дисциплины необходимо освоение следующих дисциплин: цитологии, органической химии, биохимии, молекулярной биологии, иммунологии
Общая трудоемкость курса – 36 ак. часа
Форма промежуточной аттестации – зачет
V. Форма проведения дисциплины –
Форма проведения дисциплины – лекции
Форма текущего контроля – коллоквиум.
VI. Распределение трудоемкости по разделам и темам, а также формам проведения занятий с указанием форм текущего контроля и промежуточной аттестации:
Трудоемкость (в ак. часах) по формам занятий (для дисциплин) и видам работ (для практик)
Аудиторная работа (с разбивкой по формам и видам)
Наименование разделов и тем дисциплины/наименование разделов (этапов практики)
Раздел I. Общие сведения о вирусах
Тема 1. Краткие сведения о вирусах.
Тема 2. Вирусная инфекция
Тема 3. Структура генетического материала вирусов.
Тема 4. Структура вирусных частиц.
Раздел II. Взаимодействие вируса и клетки.
Тема 1. Проникновение вируса в клетку
Тема 2. РНК-содержащие вирусы.
Тема 3. ДНК-содержащие вирусы.
Коллоквиум по разделам 1 и 2
Раздел III. Синтез компонентов вируса.
Тема 2. Обратная транскрипция.
Тема 3. Синтез вирусных белков
Тема 4. Формирование вирусных частиц
Раздел IV. Онкогенные вирусы и медленные инфекции
Тема 1. РНК-содержащие онкогенные вирусы.
Тема 2. ДНК-содержащие онкогенные вирусы.
Тема 3. Медленные вирусные инфекции.
Тема 4. Прионные болезни
Коллоквиум по разделам 3 и 4
VII. Содержание дисциплины
Раздел I. Общие сведения о вирусах
Тема 1. Краткие сведения о вирусах.
Тема 2. Вирусная инфекция.
Стадии инфекционного цикла. Терминология. История изучения инфекционного цикла. Культивирование клеточных линий. Цитопатический эффект. Синцитиеобразование. Оценка инфекционности вирусов. Методы определения инфекционности. Метод бляшек. Метод конечного разведения. Отношение количества вирусных частиц к количеству бляшкообразующих единиц.
Оценка количества вирусных частиц: гемагглютинация, электронная микроскопия, определение активности вирусных ферментов, иммуноблоттинг, ИФА. Современные методы: использование флуоресцентных белков, ПЦР, секвенирование. Работы Эллис и Дельбрюк. Одиночный цикл размножения фага. Множественность инфекции.
Тема 3. Структура генетического материала вирусов
Классификация вирусов по Балтимору (в зависимости от типа генетического материала). ДНК-содержащие вирусы. Различные типы ДНК-геномов: непрерывный дцДНК, сегментированный дцДНК, оцДНК.
РНК-содержащие вирусы. Различные типы РНК-геномов: дцРНК, оцРНК (+), оцРНК (-). Реассортация сегментированных геномов. Двусмыленная РНК.
Генетика вирусов. Трансформация, трансфекция, мутагенез. Эксперимент Херши-Чейз. Генная терапия.
Тема 4. Структура вирусных частиц.
Общие принципы структуры вирусов. Терминология. Функции вирусных белков. Молекулярная организация вирионов.
Методы изучения структуры вирусных частиц: электронная микроскопия, рентгеноструктурный анализ, криоэлектронная микроскопия, ЯМР-спектроскопия.
Общие принципы структуры вирусов, симметрия. Спиральные вирионы (принципы спиральной симметрии, вирус табачной мозаики). Принципы симметрии сферических вирусов. Икосаэдрические вирусы. Строение оболочечных вирусов. Функции гликопротеинов. Сложные вирусы (аденовирусы, реовирусы, герпесвирусы). Бактриофаги.
Раздел II. Взаимодействие вируса и клетки.
Тема 1. Проникновение вируса в клетку.
Этапы взаимодействия вирусной частицы и клетки. Клеточные рецепторы, необходимые для вирусных частиц. Механизмы проникновения вируса в клетку. Влияние рН на процесс проникновения на примере вируса гриппа. Механизмы регуляции. Молекулярные механизмы проникновения филовирусов в клетку. Взаимодействие простых вирусов с клеточной мембраной. Роль корецепторов в инициации вирусной инфекции. Механизмы проникновения в клеточное ядро.
Тема 2. РНК-содержащие вирусы.
История изучения РНК. Терминология. Типы РНК-геномов. Общие принципы синтеза РНК в клетке. Особенности транскрипции и трансляции (+) РНК-содержащих вирусов. Созревание и выход вирионов из клетки. Репликация и транскрипция (-) РНК-содержащих вирусов с непрерывным геномом. Репликация и транскрипция (-) РНК-содержащие вирусы с сегментированным геномом. РНК-содержащие вирусы с двуцепочечной РНК. Синтез и трансляция вирусных мРНК. Репликация двуцепочечных РНК и созревание вирионов. Синтез РНК как источник генетической изменчивости.
Тема 3. ДНК-содержащие вирусы.
Общие принципы синтеза ДНК в клетке. Особенности репликации вирусных ДНК-геномов. Роль клеточных и вирус-специфических белков в репликации ДНК. Два механизма репликации дцДНК. Обезьяний вирус-40 (SV-40): механизм репликации, роль клеточных и вирусных белков. Парвовирусы: самозатравочный механизм инициации синтеза ДНК. Репликативная форма, надрез (nick) вирусной эндонуклеазой. Инверсия концевых повторов.
Аденовирусы: роль белков в инициации синтеза ДНК. Точка начала репликации (ori) вирусов.
Крупные ДНК-содержание вирусы: механизм репликации вируса простого герпеса и вируса оспы.
Регуляция синтеза вирусных ДНК
Раздел III. Синтез компонентов вируса.
Тема 1. Вирусная транскрипция.
Типы клеточных РНК-полимераз. Понятие о транскрипции вирусных ДНК. Этапы транскрипции. Механизмы инициации транскрипции. Регуляция белкового синтеза на уровне транскрипции. Кэпирование и поладенилирование. Сплайсинг пре-мРНК. Контроль процессинга мРНК при ретровирусной инфекции. Полиаденилирование и сплайсинг при аденовирусной инфекции. Регуляция альтернативного сплайсинга вирусными белками.
Тема 2. Обратная транскрипция.
История открытия и изучения процесса обратной транскрипции. Ретровирусы. Функции вирусной обратной транскриптазы. Механизмы интеграции. Провирус. Ретроэлементы в геноме эукариот. Вирус гепатита В. Строение частиц вируса гепатита В. Структура генома, продукты генов и их функции. Транскрипция ДНК, синтез прегеномной РНК. Механизм репликации вирусного генома, транслокация белковой и РНК-затравок. Общая схема жизненного цикла вируса гепатита В. Эпидемиология гепатита В и его роль в возникновении гепатокарцином.
Тема 3. Синтез вирусных белков.
Тема 4. Формирование вирусных частиц.
Общие принципы сборки вирусных частиц. Механизмы формирования зрелых вирусных частиц. Локализация белков в месте отпочковывания. Механизмы почкования вирусных частиц. Процессы отпочковывания на примере вируса гриппа и ВИЧ. Упаковка вирусной нуклеиновой кислоты. Сигналы упаковки ДНК-содержащих и РНК-содержащих вирусов, вирусов с сегментированным геномом.
Раздел IV. Онкогенные вирусы и медленные инфекции.
Тема 1. РНК-содержащие онкогенные вирусы.
Онкоген, протонкоген, анти-онкоген (супрессор опухоли) – определение понятий.
Онкогенные РНК-содержащие вирусы. Типы структурной организации геномов ретровирусов. Онкогенез в результате вставки промотора, энхансера, трансактивации клеточного генома (вирус Т-клеточного лейкоза человека).
Тема 2. ДНК-содержащие онкогенные вирусы.
Онкогенные ДНК-содержащие вирусы. Истинные вирусные онкогены (механизм действия). ДНК-содержащие онкогенные вирусы как модельная система для исследования молекулярной биологии эукариотической клетки.
Паповавирусы. Общая характеристика. Папилломавирусы. Полиомавирусы. Обезьяний вирус-40 (SV-40): структура, продуктивная и непродуктивная формы инфекции, литическая инфекция. Ранняя транскрипция генов SV-40. Т-антиген - мультифункциональный белок. Репликация ДНК SV-40. Поздняя транскрипция генов. Сборка вириона.
Тема 3. Медленные вирусные инфекции.
Характеристика медленных вирусных инфекций. Факультативные возбудители: вирус кори (подострый склерозирующий панэнцефалит), вирус краснухи (прогрессирующая врожденная краснуха, прогрессирующий краснушный панэнцефалит), вирус клещевого энцефалита (прогредиентная форма клещевого энцефалита), вирус простого герпеса (подострый герептический энцефалит), вирус бешенства (медленная рабическая инфекция). Облигатные возбудители: вирусы JC, ВК, ВИЧ, HTLV 1,2.
Тема 4. Прионные болезни.
Губчатые (спонгиформные) энцефалопатии, свойства, отличающие прионные болезни от других инфекционных заболеваний; история открытия. Роль белка РrРC в организме; Структура и свойства клеточного белка PrPc. Изменение характера укладки полипептидной цепи при превращении белка PrPC в прион PrPSc; механизм копирования конформации. Прионные заболевания человека: наследственные, инфекционные, спорадические; межвидовой барьер, диагностика. Сателлиты. Классификация сателлитов. Сателлитные вирусы. Сателлитные нуклеиновые кислоты (вирусоиды). Вирус гепатита дельта.
VIII. Перечень компетенций, формируемых в результате освоения дисциплины
В результате освоения дисциплины студент должен
· представлять себе место вирусов и субвирусных агентов в системе живой природы
· знать принципы строения вирусов и субвирусных агентов, устройство вирусных геномов вирусов различных групп и способы их экспрессии, способы взаимодействия вирусов и субвирусных агентов с другими организмами.
· уметь использовать полученные знания для применения в области фармации, медицины, медицинской, молекулярной, ветеринарной вирусологии, молекулярной и клеточной биологии, а также смежных областях.
IX. Используемые образовательные, научно-исследовательские и научно-производственные технологии:
В преподавании дисциплины используются демонстрационные компьютерные технологии.
Х. Учебно-методическое обеспечение самостоятельной работы студентов, оценочные средства контроля успеваемости и промежуточной аттестации:
Примеры тем для семинаров:
1. История открытия вирусов
2. Гипотезы происхождения вирусов
3. Гигантские вирусы (мимивирус, мегавирус, пандоравирус)
5. Онколитическая виротерапия
6. Вирус Зика: эпидемиология, пути передачи, лечение
7. Вирус Эбола: эпидемиология, профилактика, лечение
8. Современные препараты для профилактики и лечения ВИЧ-инфекции/СПИДа. Микробициды
9. Вирусные препараты для лечения, профилактики и диагностики инфекционных заболеваний
10. Возбудители медленных вирусных инфекций. Прионы. Вироиды
XI. Учебно-методическое и информационное обеспечение дисциплины
КАРТОЧКА ПРОЕКТА,
ПОДДЕРЖАННОГО РОССИЙСКИМ НАУЧНЫМ ФОНДОМ
Информация подготовлена на основании данных из Информационно-аналитической системы РНФ, содержательная часть представлена в авторской редакции. Все права принадлежат авторам, использование или перепечатка материалов допустима только с предварительного согласия авторов.
Название Исследование регуляции транскрипции ВИЧ-1 белком человека Ku и поиск клеточных факторов, участвующих в Ku-опосредованной регуляции транскрипции, с использованием методов секвенирования РНК нового поколения
Руководитель Готтих Марина Борисовна, Доктор химических наук
Организация финансирования, регион федеральное государственное бюджетное образовательное учреждение высшего образования "Московский государственный университет имени M.В.Ломоносова", г Москва
Года выполнения при поддержке РНФ 2017 - 2019
Область знания, основной код классификатора 04 - Биология и науки о жизни, 04-208 - Молекулярная биология
Ключевые слова гетеродимерный белок Ku70/Ku80, вирус иммунодефицита человека, активация транскрипции, латентность, CRISPR-Cas9, нокаут, РНК-секвенирование нового поколения
Код ГРНТИ 34.15.00
Статус Успешно завершен
ИНФОРМАЦИЯ ИЗ ЗАЯВКИ
Аннотация
Существующая в настоящий момент антиретровирусная терапия (АРТ) достаточно эффективно позволяет продлевать жизнь и улучшать качество жизни ВИЧ-инфицированных людей. Однако она не позволяет полностью удалить вирус из организма человека. Причиной этого является наличие семейств клеток, содержащих интегрированный провирус в транскрипционно-неактивном состоянии, на который не действуют компоненты АРТ. Исследование молекулярных механизмов поддержания вируса в неактивном латентном состоянии и механизмов выхода из него важно с точки зрения создания новых подходов к терапии ВИЧ, которые позволили бы полностью удалить вирус из организма. Латентная стадия вирусной инфекции характеризуется отсутствием полноценной транскрипции с вирусного промотора. Однако в определенных условиях транскрипция может активироваться, что при отсутствии терапии вызывает развитие СПИДа. Изучение клеточных белков, участвующих в активации транскрипции с промотора ВИЧ-1 при переходе вируса из латентной фазы в активную, крайне актуально, поскольку в перспективе поможет понять механизм этого процесса и найти подходы к его регуляции. Одним из клеточных белков, изменение уровня которого в клетке влияет на эффективность транскрипции с промотора ВИЧ-1, является гетеродимерный белок Ku. В ядре клетки белок Ku колокализуется c сайтами элонгации транскрипции РНК полимеразы II и взаимодействует с ее элонгационной формой. Показано также, что Ku-ассоциированная киназа DNA-PK может in vitro фосфорилировать РНК полимеразу II. Однако достоверный механизм воздействия гетеродимера Ku на транскрипцию с интегрированного провируса и возможность участия этого белка в активации транскрипции при переходе из латентной в активную фазу инфекции не известен. Исследование этого механизма позволит предложить новые стратегии лечения ВИЧ-инфекции, которые, возможно, помогут полностью ликвидировать вирус в организме больного. Гетеродимер Ku, состоящий из субъединиц Ku70 и Ku80, является многофукциональным клеточным белком. Достаточно детально изучено его участие в репарации двуцепочечных разрывов в ДНК путем негомологичного соединения концов (NHEJ), где Ku выступает в качестве ДНК-связывающего компонента ДНК-зависимой протеин-киназы (DNA-PK). Тем не менее, учитывая, что Ku участвует во многих клеточных процессах, можно предположить, что его участие в транскрипции ВИЧ-1 является опосредованным и связано с эффектами, которые Ku имеет на транскрипцию клеточных генов, или осуществляется через взаимодействие Ku с транскрипционными факторами. Возможно, что имеет место совокупность этих условий. Необходимо также учитывать, что белок Ku является гетеродимером, и возможно, что каждая из его субъединиц может оказывать свое действие на транскрипцию. Тем не менее, в большинстве работ вывод о влиянии всего гетеродимера Ku на транскрипцию делается на основании данных по нокдауну/нокауту только одной из его субъединиц. Вместе с тем, появляется все больше данных о том, что отдельные субъединицы белка Ku имеют свои собственные функции в клетке, и нокаут одной из них не подавляет полностью функционирование другой. В настоящем проекте впервые будет проведено систематическое исследование влияния каждой из субъединиц Ku на уровень транскрипции с промотора ВИЧ-1 в репортерной системе и в клетках линии J-Lat, содержащих латентно-интегрированный провирус. Помимо этого, впервые будет исследовано изменение клеточного транскриптома в ответ на изменение внутриклеточной концентрации отдельных субъединиц Ku и каталитической субъединицы DNA-PK путем нокаутирования их генов и последующего глубокого секвенирования РНК. В результате этой работы мы планируем отобрать ряд клеточных белков, эффективность транскрипции которых зависит от уровня Ku70 и/или Ku80, и которые, вместе с тем, могут участвовать в транскрипции провируса. Таким образом, в результате проведенной работы мы впервые сможем точно ответить на вопрос, каково влияние каждой из субъединиц Ku на транскрипцию с промотора ВИЧ-1, и выяснить механизм этого влияния (прямой или опосредованный). Мы также сможем выяснить, может ли изменение уровня экспрессии каждой из субъединиц Ku вызвать активацию транскрипции латентно-интегрированного провируса, т.е. в системе, имитирующей выход вируса из латентной фазы. Необходимо также отметить, DNA-PK в целом и Ku в частности участвуют в большом количестве клеточных процессов, поэтому наше исследование изменений клеточного транскриптома в ответ на изменение внутриклеточной концентрации отдельных субъединиц DNA-PK имеет самостоятельную значимость, поскольку позволит получить дополнительную информацию о функциональной роли этого мультибелкового комплекса.
Ожидаемые результаты
1. Будут получены данные об участии индивидуальных субъединиц белка Ku и каталитической субъединицы DNA-PK в регуляции транскрипции с промотора ВИЧ-1 в безвирусной репортерной системе, а также клетках линии J-Lat, содержащих латентно-интегрированный провирус. Эти данные позволят выяснить, может ли изменение уровня экспрессии каждой из субъединиц Ku вызвать активацию транскрипции латентно-интегрированного провируса, т.е. в системе, имитирующей выход вируса из латентной фазы. 2. Разработка конкретных протоколов получения стабильных нокаутов по генам белков комплекса DNA-PK как в клетках линий НЕК 293Т, так и Jurkat и получение линий со стабильно накаутированными генами белков Ku70, Ku80 и DNA-PKcs. Получение профилей тотальной экспрессии генов (RNAseq) в этих клетках. 3. На основании результатов глубокого секверирования мРНК будут выявлены потенциальные гены-мишени транскрипция которых регулируется белком Ku и/или его отдельными субъединицами, и будет проверена роль Ku в регуляции экспрессии этих генов-мишеней. Анализ профилей тотальной экспрессии генов в линиях со стабильно нокаутированными генами белков Ku70, Ku80, DNA-PKcs в дальнейшем позволит более детально охарактеризовать участие каждого их этих белков в функционировании клетки. 4. Подавление экспрессии каждого из белков, транскрипция которых регулируется белком Ku и его отдельными субъединицами, с помощью миРНК и проверка влияния, которое изменение их экспрессии оказывает на транскрипционную регуляцию ВИЧ-1, с использованием как клеточной линии J-Lat, так и репортерной системы. 5. Оценка влияния, которое выбранные нами белки-мишени оказывают на инфицирование клеток HEK 293T или Jurkat VSV-псевдотипированным репликативно-некомпетентным вирусным вектором на основе ВИЧ-1. В результате проведенного исследования мы сможем достоверно определить клеточные белки, транскрипция которых регулируется белком Ku и которые, со своей стороны, оказывают влияние на регуляцию транскрипции с промотора ВИЧ-1.
Аннотация результатов, полученных в 2017 году
Антиретровирусная терапия (АРТ) достаточно эффективно позволяет продлевать жизнь и улучшать качество жизни ВИЧ-инфицированных людей. Однако она не позволяет полностью удалить вирус из организма человека, поскольку не действует на клетки, содержащие интегрированный провирус в транскрипционно-неактивном состоянии. Исследование молекулярных механизмов поддержания вируса в неактивном латентном состоянии и механизмов выхода из него важно с точки зрения создания новых подходов к терапии ВИЧ, которые позволили бы полностью удалить вирус из организма. Латентная стадия вирусной инфекции характеризуется отсутствием полноценной транскрипции с вирусного промотора. Однако в определенных условиях транскрипция может активироваться, что при отсутствии терапии вызывает развитие СПИДа. Изучение клеточных белков, участвующих в активации транскрипции с промотора ВИЧ-1 при переходе вируса из латентной фазы в активную, крайне актуально, поскольку в перспективе поможет понять механизм этого процесса и найти подходы к его регуляции. В настоящем проекте впервые проводится систематическое исследование влияния клеточного белка Ku на уровень транскрипции с промотора ВИЧ-1. Белок Ku является гетеродимером, состоит из субъединиц Ku70 и Ku80 и участвует в большом числе клеточных процессов. Достаточно детально изучено его участие в репарации двуцепочечных разрывов в ДНК путем негомологичного соединения концов (NHEJ), где Ku выступает в качестве ДНК-связывающего компонента ДНК-зависимой протеин-киназы (DNA-PK). Показано также его участие в транскрипции ряда клеточных генов. В ряде работ обнаружено его влияние на транскрипцию ВИЧ-1, однако механизм этого влияния мало исследован. В большинстве работ вывод о влиянии всего гетеродимера Ku на транскрипцию с промотора ВИЧ-1 делается на основании данных по снижению внутриклеточного уровня только одной из его субъединиц. Вместе с тем, появляется все больше данных о том, что отдельные субъединицы белка Ku имеют свои собственные функции в клетке, и нокаут одной из них не подавляет полностью функционирование другой. Соответственно, возможно, что каждая из субъединиц белка Ku может оказывать свое действие на транскрипцию. Именно по этой причине в настоящей работе проводится исследование влияния каждой из субъединиц Ku на уровень транскрипции с промотора ВИЧ-1. Для повышения внутриклеточной концентрации субъединиц Ku70 и Ku80 используются соответствующие вектора для эукариотической экспрессии этих белков, которые были сконструированы нами ранее в ходе выполнения проекта РНФ № 14-14-00489, а для понижения их концентрации используется система РНК-интерференции с помощью малых интерферирующих РНК, а также нокаут генов белков Ku70 и Ku80 с использованием технологии CRISPR/Cas9. Работа проводится с использованием клеток линии НЕК 293Т, а также линии лимфоидного происхождения Jurkat, которая является более адекватной моделью для изучения репликации ВИЧ. За отчетный период получены генетические конструкции, позволяющие изучать влияние различных факторов на транскрипцию с промотора ВИЧ-1, находящегося в так называемом длинном концевом повторе (long terminal repeat - LTR). Для этого была использована система на основе вектора pGL3, который кодирует ген люциферазы светлячка и сконструирован таким образом, что позволяет встроить в него любую промоторную последовательность для контроля экспрессии люциферазы. Соответственно, был получен вектор, в котором ген люциферазы контролируется промотором ВИЧ-1 (pGL3_LTR_HIV). Для нормировки данных, полученных для промотора LTR ВИЧ-1, получена конструкция pGL3_hPGK, с встроенным промотором фосфоглицерат-киназы 1 человека, поскольку для этого промотора ранее была показано, что Ku не влияет на его активность, и конструкция pGL3_CMV, с промотором цитомегаловируса, так как для этого промотора описано подавляющее влияние DNA-PK на его активность. Также был получен вектор pRL_hPGK, кодирующем люциферазу Renilla под промотором hPGK. Учитывая, что люциферазу Renilla можно детектировать в одном растворе с люциферазой светлячка, этот вектор является контролем эффективности трансфекции клеток и подготовки препаратов для анализа. Использование системы с двумя векторами, кодирующими две разные люциферазы, значительно упрощает работу и повышает достоверность полученных данных. Все полученные конструкции эффективно поддерживали экспрессию люциферазы при тестировании их активности на культуре клеток HEK 293T и Jurkat. При исследовании влияния внутриклеточного уровня белков Ku70 и Ku80 на транскрипцию с разных промоторов в клетках линии НЕК 293Т обнаружено, что снижение концентрации обеих субъединиц Ku приводит к значительному и независимому от промотора уменьшению уровня экспрессии люциферазы. Очевидно, это связано со стрессом, который испытывают клетки из-за большого недостатка Ku70/Ku80, который препятствует своевременной репарации генома и, вероятно, стимулирует ограничение всей клеточной транскрипции. По этой причине влияние одновременного нокдауна обеих субъединиц Ku путем РНК-интерференции в дальнейшем не рассматривалось. Учитывая, что Ku участвует в репарации разрывов в ДНК в составе ДНК-зависимой протеин-киназы, мы проверили, как влияет подавление ферментативной активности ее каталитической субъединицы DNA-PKcs коммерчески-доступным ингибитором. Оказалось, что оно приводит к незначительному повышению уровня экспрессии люциферазы со всех промоторов в равной степени, что говорит о неспецифическом влиянии ингибирования DNA-PKcs на транскрипцию. В связи с этим дальнейших экспериментов с DNA-PKcs также не проводилось. Вместе с тем, нами было обнаружено и специфичное по отношению к промотору ВИЧ-1 влияние Ku на транскрипцию. Так для промотора LTR ВИЧ-1 наблюдается значительно более сильная, чем для других промоторов, активация экспрессии люциферазы при суперэкспрессии отдельной субъединицы Ku80 и всего гетеродимера в клетках НЕК 293Т. Ответ на суперэкспрессию субъединицы Ku70 при этом незначительный. Нокаут отдельных субъединиц Ku в этих клетках снижает уровень транскрипции со всех промоторов, но негативный эффект от отсутствия Ku значительно более выражен для промотора LTR, причем нокаут гена ku80 приводит к более сильному падению уровня транскрипции. Таким образом, для промотора LTR показан специфический эффект от изменения внутриклеточного уровня Ku, более сильно выраженный, чем для других промоторов. Результаты о характере влияния пониженной/повышенной внутриклеточной концентрации белков Ku70 и Ku80 на транскрипционную активность промотора LTR ВИЧ-1 в клеточной линии Jurkat в целом коррелируют с результатами, полученными на клетках НЕК 293Т. Снижение уровня Ku70 с помощью малых интерферирующих РНК (миРНК) приводит к снижению экспрессии люциферазы с промотора LTR примерно на 30%. Добавление миРНК к Ku80 также снижает эффективность транскрипции c промотора LTR, хотя эффект менее выражен. Суперэкспрессия субъединиц Ku70 и Ku80 как по отдельности, так вместе приводит к тому, что уровень транскрипции с промотора LTR возрастает примерно в два раза по сравнению с исходным (базальным) уровнем. Эффективность транскрипции с промотора LTR ВИЧ-1 может увеличиваться как при активации инициации транскрипции, так и при активации элонгации транскрипции. В этой связи мы исследовали, как изменяется активность транскрипции с промотора LTR под действием индукторов обоих процессов. Белок TNF-α является классическим активатором инициации транскрипции генов ВИЧ-1. Мы показали, что под действием TNF-α транскрипция активируется независимо от уровня Ku в клетках, но негативный эффект нокаута Ku на транскрипцию при этом сохраняется. Следовательно, эффект Ku на транскрипцию с LTR промотора не связан со стадией инициации транскрипции. Активатором элонгации транскрипции ВИЧ-1 является вирусный белок Tat. Связываясь с РНК-шпилькой TAR, формирующейся на 5’-конце вирусной мРНК при транскрипции, Tat привлекает транскрипционный фактор P-TEFb, обеспечивающий фосфорилирование РНК-полимеразы II и активирующий элонгацию. По нашим предварительным данным, при суперэкспрессии белка Tat активация транскрипции в клетках НЕК 293Т дикого типа происходит несколько слабее, чем в клетках, нокаутных по ku70 и ku80, в результате эффективность транскрипции с LTR промотора во всех клетках выравнивается. Суперэкспрессия Tat в клетках Jurkat приводит к 20-кратному повышению уровня экспрессии люциферазы. Однако, суперэкспрессия Tat параллельно с суперэкспрессией Ku80 или гетеродимера Ku приводит к значительно меньшей активации экспрессии люциферазы, чем при нормальном уровне Ku. На основании этих результатов высказана гиротеза, что в отсутствии Tat белок Ku является активатором элонгации транскрипции с промотора LTR, хотя его активирующий эффект значительно слабее, чем эффект Tat. В присутствии Tat наблюдается конкуренция между двумя активаторами.
1. Е. Княжанская, А. Анисенко, М. Готтих The differential role of Ku in the HIV-1 replication: influence on integration and transcription FEBS Journal, 284 (Suppl. 1), 139-140 (год публикации - 2017).
2. М.Б. Готтих, А.Н. Анисенко, Е.С. Княжанская, С.П. Королев, О.А. Шадрина Роль клеточного белка Ku в репликации ВИЧ-1 Acta Naturae, Спецвыпуск, с.47 (год публикации - 2017).
1. Анисенко А.Н., Княжанская Е.С., Зацепин Т.С., Готтих М.Б. The interaction between HIV-1 integrase and Ku70 facilitates postintegrational DNA repair FEBS Open Bio, V. 8 (Suppl. S1) PP. 202-203 (год публикации - 2018).
2. Анисенко А.Н., Княжанская Е.С., Исагулянц М.Г., Готтих М.Б. A qPCR assay for measuring the post-integrational DNA repair in HIV-1 replication Journal of Virological Methods, V.262, PP. 12-19 (год публикации - 2018).
| Обратные транскриптазы (РНК-зависимая ДНК - полимераза) | |
|---|---|
 |
| Доступные белковые структуры: | |
|---|---|
| Pfam | сооружения |
| PDB | RCSB PDB ; PDBe ; PDBj |
| PDBsum | краткое описание структуры |
| РНК-ДНК-полимеразы направлены | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| номер ЕС | 2.7.7.49 | ||||||||
| Количество CAS | 9068-38-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | вид IntEnz | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | вид NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Джин Онтология | Amigo / QuickGO | ||||||||
| |||||||||
Обратной транскриптазы (RT) представляет собой фермент , используемый для создания комплементарной ДНК (кДНК) из РНК матрицы, процесс называется обратной транскрипции . Обратные транскриптазы используются ретровирусов , чтобы повторить их геномы, с помощью ретротранспозонов мобильных генетических элементов , которые пролиферируют в геном хозяина, с помощью эукариотических клеток , чтобы продлить теломеры на концах своих линейных хромосом , а некоторые не ретровирусов , таких как вирус гепатита В , член Hepadnaviridae , которые являются вирусами дц-RT .
Ретровирусное RT имеет три последовательные биохимическую деятельность: РНК-зависимая ДНК - полимераза активность, рибонуклеазы H и ДНК - полимеразную активность ДНК-зависимая. В совокупности эти мероприятия позволяют фермент конвертировать одноцепочечной РНК в кДНК двуспиральных. В ретровирусов и ретротранспозонов, эта кДНК может затем интегрировать в геном хозяина, из которого новые копии РНК может быть сделано с помощью хост-клеточной транскрипции . Же последовательность реакций , широко используется в лаборатории , чтобы преобразовать РНК в ДНК для использования в молекулярного клонирования , РНК - последовательности , полимеразной цепной реакции (ПЦР), или анализ генома .
содержание
история
Ревертазами обнаружены Темин в Университете Висконсин-Мэдисон в РСВ вирионов и независимо друг от друга изолированы от Дэвида Балтимора в 1970 году в MIT от двух вирусов опухолевых РНК: R-MLV и снова RSV . Для их достижения, как общие , так в 1975 году Нобелевскую премию по физиологии и медицине (с Дульбекко ).
Хорошо изучены обратные транскриптазы включают в себя:
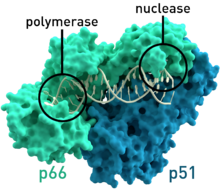
- ВИЧ-1 обратную транскриптазу из вируса иммунодефицита человека типа 1 ( PDB : 1HMV ) имеет две субъединицы, которые имеют соответствующие молекулярные массы 66 и 51 кД .
- М-MLV обратной транскриптазы из вируса мышиного лейкоза Молони является единственным 75 кДа мономера.
- AMV обратной транскриптазы от вируса птичьего миелобластоза также имеет две субъединицы, 63 кДа субъединицу и субъединицу 95 кДа.
- Теломеразы обратной транскриптазы , которая поддерживает теломеры из эукариотическиххромосом .
Функция в вирусах

Эти ферменты кодируются и используются вирусами , которые используют обратную транскрипцию в качестве шага в процессе репликации. Реверс-транскрибировать РНК вирусов , таких как ретровирусы , используют фермент обратной транскрипции РНК их геномов в ДНК, которая затем интегрирована в геном хозяина и реплицируется вместе с ним. Реверс-расшифровку ДНК - вирусы , такие как hepadnaviruses , может позволить РНК служить в качестве матрицы для сборки и изготовления нитей ДНК. ВИЧ заражает людей с использованием этого фермента. Без обратной транскриптазы, вирусный геном не был бы в состоянии включить в клетку - хозяина, что приводит к невозможности репликации.
Обратный транскриптазы создает двухцепочечной ДНК из матрицы РНК.
В вирусных видах с обратной транскриптазой отсутствует ДНК-зависимая ДНК - полимеразная активность, создание двухцепочечной ДНК , возможно , может быть сделано с помощью хост-кодируемого ДНК - полимеразы б , ошибочно вирусной ДНК-РНК для праймера и синтез двухцепочечной ДНК, аналогично механизм , как в грунтовочном удалении , где вновь синтезированная ДНК замещает исходную РНК - матрицу.
Процесс обратной транскрипции чрезвычайно подвержены ошибкам, и именно на этом этапе , который может произойти мутации. Такие мутации могут привести к лекарственной устойчивости .
Ретровирусы , называемые также класс В. И. оцРНК-RT вирусы, РНК обратного транскрибирование вирусов с помощью ДНК - промежуточного соединения. Их геномы состоят из двух молекул с положительной смысловой одноцепочечной РНК с микросхемой колпачок 5' и 3' полиаденилированой хвоста . Примеры ретровирусов включают вирус иммунодефицита человека ( ВИЧ ) и человеческий Т-лимфотропный вирус ( HTLV ). Создание двухцепочечной ДНК происходит в цитозоле в виде серии этих шагов:
Создание двухцепочечной ДНК также включает в себя перенос цепи , в которой происходит транслокация короткого продукта ДНК из исходного РНКА-зависимого синтеза ДНК в регионы шаблона акцептора на другом конце генома, которые затем достигли и обрабатывают с помощью обратной транскриптазы для его активности ДНК - ДНК-зависимой.
Ретровирусная РНК расположена в 5' - конца к 3' - концу. Сайт , где праймер отжигают с вирусной РНК называется сайт праймер-связывающий (PBS) , . РНК 5'на сайт PBS называется U5, а конец РНК 3' в PBS называется лидером. Праймера тРНК разматывается от 14 до 22 нуклеотидов и образует базовую спарены дуплекс с вирусной РНК в PBS. Тот факт , что PBS , расположен вблизи 5' - конца РНК вируса является необычным , поскольку обратной транскриптазы синтезируют ДНК от 3' - конца праймера в направлении 5' к 3' направлении (по отношению к вновь синтезированной цепи ДНК). Поэтому, праймер и обратной транскриптазы должны быть переведены в 3' конца вирусной РНК. Для того чтобы выполнить эту репозицию, несколько стадий и различные ферменты , включающие ДНК - полимеразы , рибонуклеазы H (РНКазы Н) и полинуклеотидной раскручивания нужны.
Обратной транскриптазы ВИЧ также имеет рибонуклеазы активностью , которая ухудшает вирусную РНК в ходе синтеза кДНК, а также ДНК - полимеразы ДНК-зависимую активность , которая копирует смысл цепь кДНК в антисмысловой ДНК с образованием двухцепочечной вирусной ДНК промежуточного (vDNA) ,
В эукариот
Самореплицирующихся участки эукариотических геномов , известные как ретротранспозоны используют обратную транскриптазу , чтобы перейти из одного положения в геноме к другому с помощью РНК - промежуточного соединения. Они найдены в изобилии в геномах растений и животных. Теломеразы является другой обратной транскриптазы во многих эукариот, включая человека, который несет свою собственную РНК шаблон; эта РНК используется в качестве шаблона для репликации ДНК .
В прокариот
Первоначальные доклады обратной транскриптазы в прокариот пришел еще в 1971 году (Beljanski и др., 1971а, 1972). Они с тех пор были широко описаны как часть бактериальных Retrons , различных последовательностей , которые кодируют обратной транскриптазы, и могут быть использованы в синтезе msDNA . Для того чтобы инициировать синтез ДНК, праймер необходим. У бактерий, праймер , синтезированный в процессе репликации.
Эволюционная роль
Валериан Dolja из штата Орегон утверждает, что вирусы, из-за их разнообразия, сыграли эволюционную роль в развитии клеточной жизни, с обратной транскриптазы играет центральную роль.
Состав
Обратной транскриптазы ферменты включают РНК-зависимой ДНК - полимеразы и ДНК-зависимой ДНК - полимеразы, которые работают вместе , чтобы выполнить обратную транскрипцию. В дополнении к функции транскрипции, ретровирусные обратные транскриптазы имеют домен , принадлежащие РНКазы Н семье, которая имеет жизненно важное значение для их репликации.
Репликация верность
Есть три различных системы репликации в течение жизненного цикла ретровирусов. Прежде всего, обратная транскриптаза синтезирует вирусную ДНК от вирусной РНК, а затем из новоиспеченного комплементарной цепи ДНК. Второй процесс репликации происходит, когда хост-клеточная ДНК-полимераза копирует интегрированную вирусную ДНК. Наконец, РНК-полимераза II переписывает провирусную ДНК в РНК, которые будут упакованы в вирион. Таким образом, мутация может произойти в течение одного или всех этих шагов репликации.
Обратные транскриптазы имеют высокую частоту ошибок при переписывании РНКА в ДНК , так как, в отличие от большинства других ДНК - полимераз , это не имеет никакого корректура способности. Эта высокая частота появления ошибок позволяет мутации накапливаются в ускоренном темпе относительно вычитать формы репликации. Коммерчески доступные обратные транскриптазы , производимые Promega цитирует их руководства как имеющая частоту ошибок в диапазоне от 1 в 17 000 оснований для AMV и 1 в 30000 оснований для M-MLV.
Другие , чем создание однонуклеотидных полиморфизмов , обратной транскриптазы также было показано, что участие в таких процессах, как транскриптов слитых , экзона перетасовки и создание искусственных антисмысловых транскриптов. Было высказано предположение , что этот шаблон переключение активность обратной транскриптазы, которая может быть продемонстрирована полностью в естественных условиях , может быть одной из причин для нахождения несколько тысяч Неаннотированных транскриптов в геномах модельных организмов.
Приложения
Поскольку ВИЧ использует обратную транскриптазу , чтобы скопировать свой генетический материал и создавать новые вирусы (часть окружности пролиферации ретровирусов), конкретные препараты были разработаны , чтобы нарушить процесс и тем самым подавить его рост. В совокупности эти препараты известны как ингибиторы обратной транскриптазы и включают нуклеозидные и нуклеотидные аналоги зидовудин (торговое название Ретровир), ламивудин (Эпивир) и тенофовир (Виреад), а также ненуклеозидные ингибиторы, такие как невирапин (Вирамун).
Обратный транскриптазы обычно используется в исследованиях для применения полимеразной цепной реакции технику РНК в технологии , называемой обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). Классическая ПЦР метод может быть применен только к ДНК нитей, но, с помощью обратной транскриптазы, РНК может быть транскрибируется в ДНК, что делает ПЦР анализ молекул РНК возможных. Обратные транскриптазы используются также для создания библиотек кДНКа из мРНКа . Коммерческая доступность обратной транскриптазы значительно улучшилась знание в области молекулярной биологии, так как, наряду с другими ферментами , это позволило ученым клонировать, последовательность, и характеризуют РНК.
Обратные транскриптазы также использованы в инсулине производстве. Вставив эукариотической мРНК для производства инсулина вместе с обратной транскриптазы в бактерии, мРНК может быть вставлена в геном прокариот в. Большое количество инсулина , то могут быть созданы, обходя необходимость урожая поджелудочной железы свиней и других таких традиционных источников. Непосредственно вставив эукариотической ДНК в бактерии не будет работать , потому что она несет интронов , так что не будет переводить успешно с помощью бактериальных рибосом. Обработка в эукариотической клетке в процессе производства мРНК удаляет эти интроны , чтобы обеспечить подходящий шаблон. Обратные транскриптазы превращают этот отредактированный РНК обратно в ДНК , так что можно было бы включить в геноме.
Читайте также:


