Что такое супрессия вируса
6.6. ЛЕЧЕНИЕ
Несмотря на то что лечение ВИЧ-инфекции остается сложнейшей и не-решенной проблемой, имеются, безусловно, некоторые успехи. Об этом, по мнению Е.С.Белозерова (2000), свидетельствуют следующие факты: если в 1986 году свыше 70% инфицированных в ближайшие 2 года заболели СПИ-Дом или умерли, то среди инфицированных в 1989 году – лишь 20%, так как к этому времени в практику лечения был внедрен азидотимидин.
Существуют 4 пути решения проблемы лечения ВИЧ-инфекции:
1) антивирусная терапия;
2) симптоматическая терапия, направленная на оппортунистическую бак-териальную, вирусную, паразитарную или грибковую инфекцию;
3) коррекция иммунодефицита и иммуномодулирующая терапия;
4) терапия онкопатологии.
В настоящее время разрабатывается и на различных стадиях течения ВИЧ-инфекции применяется в клинической практике значительное количе-ство препаратов.
Разработка этиотропной терапии базируется на ряде принципиальных подходов:
1) блокада лиганд вируса (в первую очередь gp120, gp41) анти gp120- и gp41- антителами;
2) создание препаратов, имитирующих рецепторы CD4, которые соединя-лись бы с лигандами вируса и блокировали его возможность соеди-няться с клеткой-мишенью;
4) ингибиторы регуляторных генов tat и rev, нарушающих транскрипцию и трансляцию вирусных белков;
5) ингибиторы посттрансляционных процессов.
Первичная цель антиретровирусной терапии – максимальная и продол-жительная супрессия вирусной нагрузки, восстановление и/или предупреж-дение нарушений функции иммунной системы, улучшение качества жизни, снижение летальности и смертности инфицированных ВИЧ.
Вирусная нагрузка является прогностическим фактором развития ВИЧ-инфекции. Снижение вирусной нагрузки под влиянием антиретровирусной терапии приводит к положительным клиническим изменениям. Высокоак-тивная антиретровирусная терапия часто приводит к повышению количества CD4+ на 100-200 клеток/мл и более. Повышение количества CD4+ обычно отражает степень супрессии вирусной нагрузки. И, наоборот, продолжитель-ная супрессия вирусов наблюдается при достижении наиболее высокого ко-личества CD4+ в процессе лечения.
В табл. 6 представлены положительные и отрицательные стороны ран-него начала противовирусной терапии ВИЧ-инфекции, а в табл. 7 – показа-ния к началу терапии больных на поздних стадиях заболевания.
До недавнего времени среди противовирусных препаратов, непосред-ственно действующих на ВИЧ, использовался только азидотимидин (зидову-дин, ретровир, тимозид). Этот препарат за счет ингибирования обратной транскриптазы тормозит репликацию ВИЧ-1, ВИЧ-2 и других ретровирусов. Применение азидотимидина позволило снизить летальность, уменьшить ко-личество оппортунистических инфекций в 5 раз. При лечении CD4+ лимфо-пения развивалась более замедленными темпами, у больных нарастала масса тела. Недостатком терапии азидотимидином является формирование устой-чивости вирусов при приеме свыше 6 месяцев. Побочные эффекты азидоти-мидина касаются прежде всего его влияния на гемопоэз. Нейтропения, ане-мия возникают примерно у 50% пациентов, у части больных возникает мио-патия.
Внедрение аналогов нуклеозидов нового поколения, ингибирующих об-ратную транскриптазу, синтез ряда ненуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы коренным образом изменили тера-пию ВИЧ-инфекции. Полагают, что заболевание перестало быть фатальной болезнью и можно говорить об эре терапевтического эффекта (Велла С., 1999). У 70-80% терапия позволила добиваться положительного эффекта. Активная противовирусная терапия в настоящее время позволяет перевести процесс в хроническое течение. К наиболее перспективным аналогам нуклео-зидов с активностью против обратной транскриптазы относятся диданозин, зальцитабин, ставудин, ламивудин, адефовир, ладанозин. Среди ненуклео-зидных аналогов с активностью против обратной транскриптазы в клиниче-скую практику внедрены делавирдин и невирапин (вирамун). Среди ингиби-торов протеазы в лечении ВИЧ-инфекции используются индинавир, саквина-вир, ритонавир, нельфинавир.
Полный текст:
Представлен обзор научной литературы по современным подходам к проведению антиретровирусной терапии пациентам, инфицированным вирусом иммунодефицита человека, контролю резистентности вируса к антиретровирусным препаратам, вирусологическому обоснованию, клиническим показаниям и результатам исследований по оценке эффективности упрощенных схем антиретровирусной терапии в виде монотерапии или комбинации двух антиретровирусных препаратов. Вирусологическая супрессия вируса иммунодефицита человека (вирусная нагрузка менее 50 копий/мл) является наиболее важным критерием эффективности антиретровирусной терапии, позволяет предотвратить формирование резистентности вируса к антиретровирусным препаратам. Перевод пациентов на упрощенные схемы антиретровирусной терапии позволяет уменьшить частоту нежелательных явлений и взаимодействий антиретровирусных препаратов, повысить приверженность к терапии, снизить стоимость лечения. Внедрение упрощенных схем терапии в клиническую практику возможно при использовании препаратов с высоким генетическим барьером к резистентности у тщательно отобранных пациентов, достигших вирусологической супрессии вируса иммунодефицита человека на стандартных трехкомпонентных схемах, не имевших в прошлом тяжелой иммуносупрессии (CD4+ T-лимфоциты
230009, Гродно, ул. Горького, 80.
3. Samji H., Cescon A., Hogg R.S., Modur S.P., Althoff K.N., Buchacz K., Burchell A.N., Cohen M., Gebo K.A., Gill M.J., Justice A., Kirk G., Klein M.B., Korthuis P.T., Martin J., Napravnik S., Rourke S.B., Sterling T.R., Silverberg M.J., Deeks S., Jacobson L., Bosch R.J., Kitahata M.M., Goedert J.J., Moore R., Gange S.J. North American AIDS Cohort Collaboration on Research and Design (NA-ACCORD) of IeDEA. Closing the Gap: Increases in Life Expectancy among Treated HIV-Positive Individuals in the United States and Canada. PLoS One, 2013, Vol. 18 (8), рр. 81355. DOI: 10.1371/journal.pone.0081355. eCollection 2013.
4. 90–90–90 An ambitious treatment target to help end the AIDS epidemic. URL: unaids.orghttp://www.unaids.org/sites/default/ files/media_asset/90–90–90_en.pdf.
6. Матиевская Н.В. Ко-инфекция ВИЧ/ВГС: этиология, эпидемиология, патогенез, клиника, диагностика, лечение. Гродно: ГрГМУ, 2013, 352 с. [Matevskaya N.V. Co-infection HIV/HCV: etiology, epidemiology, pathogenesis, clinic, diagnostics, treatment. Grodno: Grodno Medical University, Belarus, 2013, 352 p. (In Russ.)].
7. Girard P.M., Antinori A., Arribas J.R., Ripamonti D., Bicer C., Netzle-Sveine B., Hadacek B., Moecklinghoff C. Week 96 efficacy and safety of darunavir/ritonavir monotherapy vs. darunavir/ritonavir with two nucleoside reverse transcriptase inhibitors in the PROTEA trial. HIV Medicine, 2017, Vol. 18, рр. 5–12.
8. Bierman W.F., van Aftmael M.A., Nijhuis M., Danner S.A., Boucher C.A. HIV monotherapy with ritonavir-boosted protease inhibitors: a syste- matic review. AIDS, 2009, Vol. 23, рр. 279–291.
9. Mathis S., Khanlari B., Pulido F., Schechter M., Negredo E., Nelson M., Vernazza P., Cahn P., Meynard J.-L., Arribas J., Bucher H.C. Effectiveness of protease inhibitor monotherapy versus combination antiretroviral maintenance therapy: a meta-analysis. PLoS One, 2011, Vol. 6 (7), рр. 22003. DOI: 10.1371/journal.pone.0022003.
10. Taylor B.S., Olender S.A., Tieu H.-V., Wilkin T. J. CROI 2016: Advances in Antiretroviral Therapy. Top. Antivir. Med., 2016, Vol. 24 (1), рр. 59–81.
13. Scherrer A.U., von Wyl V., Yang W.L., Kouyos R.D., Böni J., Yerly S., Klimkait T., Aubert V., Cavassini M., Battegay M., Furrer H., Calmy A., Vernazza P., Bernasconi E., Günthard H.F. Swiss HIV Cohort Study Emergence of Acquired HIV-1 Drug Resistance Almost Stopped in Switzerland: A 15-Year Prospective Cohort Analysis. Clin. Infect. Dis., 2016, Vol. 62 (10), рр. 1310–1317. DOI: 10.1093/cid/ciw128.
16. Fabeni L., Alteri C., Orchi N., Gori C., Bertoli A., Forbici F., Montella F., Pennica A., De Carli G., Giuliani M., Continenza F., Pinnetti C., Nicastri E., Ceccherini-Silberstein F., Mastroianni C.M., Girardi E., Andreoni M., Antinori A., Santoro M.M., Perno C.F. Recent Transmission Clustering of HIV-1 C and CRF17_BF Strains Characterized by NNRTI-Related Mutations among Newly Diagnosed Men in Central Italy. PLoS One, 2015, Vol. 13 (10), pp. e0135325. DOI: 10.1371/journal.pone.0135325.
17. Armenia D., Di Carlo D., Calcagno A., Vendemiati G., Forbici F., Bertoli A., Berno G., Carta S., Continenza F., Fedele V., Bellagamba R., Cicalini S., Ammassari A., Libertone R., Zaccarelli M., Ghisetti V., Andreoni M., Ceccherini-Silberstein F., Bonora S., Di Perri G., Antinori A., Perno CF., Santoro M.M. Pre-existent NRTI and NNRTI resistance impacts on maintenance of virological suppression in HIV-1-infected patients who switch to a enofovir/emtricitabine/rilpivirine single-tablet regimen. J. Antimicrob. Chemother., 2017, Vol. 72 (3), рр. 855–865. DOI: 10.1093/jac/dkw512.
18. Swenson L.C., Min J.E., Woods C.K., Cai E., Li J.Z., Montaner J.S., Harrigan P.R., Gonzalez-Serna A. HIV drug resistance detected during low-level viraemia is associated with subsequent virologic failure. AIDS, 2014, Vol. 15 (28), рр. 1125–1234. DOI: 10.1097/QAD.0000000000000203.
19. Nozza S., Svicher V., Saracino A., d’Ettorre G., De Luca A., Maggiolo F., Bonora S., di Biagio A., Rusconi S., Mussini C. State of the Art of Dual Therapy in 2015. AIDS Rev., 2015, Vol. 17 (3), рр. 127–134.
21. Tyrer M., Swaden L., Marshall N.J., Johnson M. Switching to dual therapy with darunavir/ritonavir and etravirine: a simplification strategy. J. Int. AIDS Soc., 2010, Vol. 13 (4), рр. 51. DOI: 10.1186/1758-2652-13-S4-P51.
22. Stellbrink H.J., Le Fevre E., Carr A., Saag M.S., Mukwaya G., Nozza S., Valluri S.R., Vourvahis M., Rinehart A.R., McFadyen L., Fichtenbaum C., Clark A., Craig C., Fang A.F., Heera J. Once-daily maraviroc versus tenofovir/emtricitabine each combined with darunavir/rito- navir for initial HIV-1 treatment. AIDS, 2016, Vol. 30 (8), рр. 1229–1238. DOI: 10.1097/QAD.0000000000001058.
23. Ofotokun I., Sheth A.N., Sanford S.E., Easley K.A., Shenvi N., White K., Eaton M.E., Del Rio C., Lennox J.L. A Switch in Therapy to a Reverse Transcriptase Inhibitor Sparing Combination of Lopinavir/Ritonavir and Raltegravir in Virologically Suppressed HIV-Infected Patients: A Pilot Randomized Trial to Assess Efficacy and Safety Profile: The KITE Study. AIDS Res. Hum. Retroviruses, 2012, Vol. 28 (10), рр. 1196–1206. DOI: 10.1089/AID.2011.0336.
24. Merino D., Muñoz L., Pasquau J., Ojeda G., Bancalero P., Chueca N., Pineda J.A., Macías J., Recio E., Márquez M., García C., Jiménez P. Efficacy and safety of once-daily maraviroc plus ritonavir-boosted darunavir in pretreated HIV-infected patients in a real-life setting. HIV Med., 2014, Vol. 15 (7), рр. 417–424. DOI: 10.1111/hiv.12129.
25. Monteiro P., Perez I., Laguno M., Martínez-Rebollar M., González-Cordon A., Lonca M., Mallolas J., Blanco J.L., Gatell J.M., Martínez E. Dual therapy with etravirine plus raltegravir for virologically suppressed HIV-infected patients: a pilot study. J. Antimicrob. Chemother., 2014, Vol. 69 (3), рр. 742–748. DOI: 10.1093/jac/dkt406.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.


Одна из 16 тысяч
Все эти поиски — следствие отсутствия специфического препарата, который был бы предназначен для уничтожения именно коронавирусов. Различия между видами вирусов так велики, что препараты, предназначенные против подавления одних видов, не работают в других случаях.

Ученые выяснили, что одной из перспективных мишеней для противовирусных препаратов могут быть компоненты человеческой клетки — мембраны, которые вирус использует для размножения. Исследователи провели скрининг более 16 000 молекул, чтобы найти те, которые блокировали размножение вируса в клетках человека. Самую эффективную из них назвали K22.
Хитрый прием
Обычно мембраны не являются стандартными мишенями терапии — чаще она направлена на белки или полисахариды, но в данном случае подход дал определенный результат.
— Это необычная мишень и интересный механизм работы молекулы, — считает кандидат биологических наук, PhD, руководитель отдела молекулярной генетики инновационной биотехнологической компании BIOCAD Дмитрий Мадера. — Поэтому искать молекулы, которые будут схожи по механизму действия, а также пригодны в качестве лекарственного препарата, — правильное направление.
Поиск нужно продолжать, уверен он. Тем более когда-нибудь появятся штаммы, резистентные и к антиретровирусной терапии.

— Однако молекул можно найти много, но от этого очень далеко до лекарства. Она может оказаться токсичной для организма, нестабильной, плохо доставляться и т.д. Между К22, активной в культуре клеток, и активным, протестированным, зарегистрированным препаратом огромная дистанция, которую мало какие молекулы успешно проходят, — подчеркнул эксперт.
Экономика лекарства
С этим мнением согласен и директор Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского Сеченовского университета Александр Лукашев.
— Авторы в исходной статье говорят скорее о возможном новом направлении в разработке лекарств. По-хорошему на основе этой молекулы делают библиотеку сходных веществ, скрининг противовирусной активности, далее повторяют несколько раз этот цикл. Затем начинается процесс разработки лекарства из лучшего варианта, который занимает месяцы и годы, обычно 3–5 лет, и стоит порядка миллиарда долларов. Вероятность пройти весь путь у молекулы — около 1%, по многим причинам разработку бросают на полпути. В конце под препарат строят выделенные производственные линии и лицензируют. Поэтому К22 практически бесполезна в разрезе сегодняшней эпидемии.
Создание лекарств от редких (не ежегодных эпидемий) невыгодно фармкомпаниям. Именно это основная причина того, что до сих пор не существует ни одного препарата от коронавирусной инфекции. Непреодолимых технических или научных препятствий тут нет.

— Сейчас лекарство нужно, но еще месяц назад на него никто не выделил бы и миллиона долларов, не говоря уже о 100 млн, — отметил Александр Лукашев. — В прошлом году в США разорились три фирмы — разработчика новых антибиотиков, а у них экономика была на порядок лучше, чем для препаратов от коронавируса. Понятно, что обществу лекарство нужно, но разработка настолько дорогая, что фармкомпаниям это неинтересно.
Новый поворот

На первый взгляд К22 выглядит привлекательно, но процесс проработки вопроса с малыми молекулами может занять от пяти до десяти лет, напомнил Павел Волчков.
Через глаза
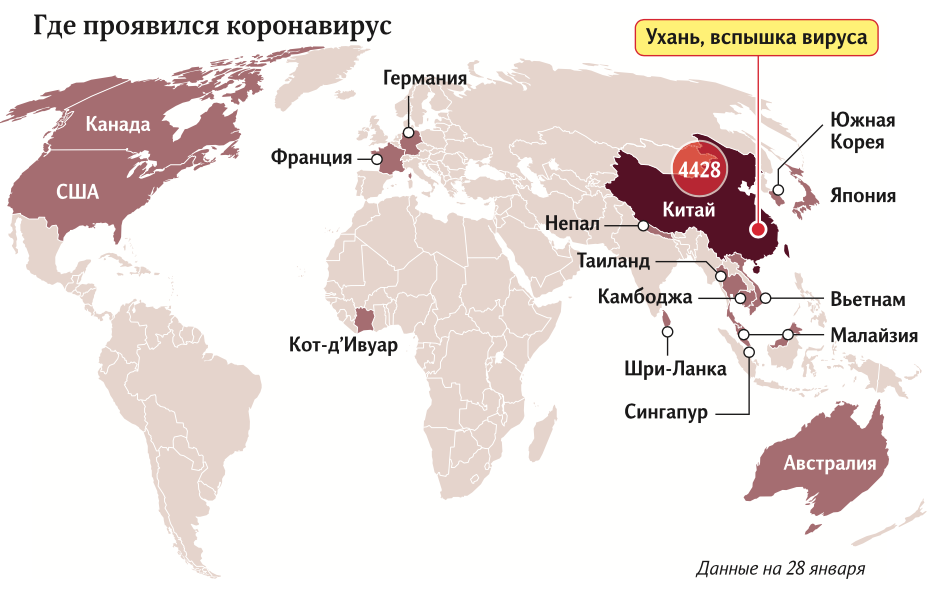
Во вторник власти Китая заявили, что общее число зараженных новым коронавирусом возросло до 4515 человек, 106 больных скончались. По сведениям госкомитета КНР по вопросам здравоохранения, среди заболевших 976 пациентов находятся в тяжелом состоянии. При этом 60 человек были выписаны из больниц.
Счетчик китайского издания South China Morning Post 28 января сообщил о 4635 случаях по всему миру (в понедельник вечером их было 2901). 4562 из них зарегистрированы на материковой территории Китая, восемь — в Гонконге, по семь — в Макао и Тайване, еще 36 — в других странах Азии.
Представитель госкомитета по вопросам здравоохранения Ли Синван сообщил и новые сведения о механизмах передачи коронавируса нового типа: 2019-nCoV может попасть в человеческий организм контактным путем через слизистую оболочку глаза.
По словам чиновника, для лечения заболевших требуется около недели, а в более тяжелых случаях — две. Китайские власти уверены, что пик распространения коронавируса в стране наступит через 7–10 дней, но масштабного роста заболеваемости уже не будет.
Больше 80 млн человек были инфицированы ВИЧ с момента начала его регистрации. Примерно половина из них погибла. До настоящего времени реальной системы учета ВИЧ-инфекции в мире, в отличие от России, нет. В нашей стране с появлением первого теста была создана очень четкая система учета больных с использованием базы данных с полной информацией о пациентах.
На самом деле в мире существует система учета ВИЧ-инфекции. Глобальный надзор за ВИЧ/СПИД и другими ЗППП осуществляют ВОЗ и ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по СПИДу). Рабочая группа ЮНЭЙДС/ВОЗ по глобальному надзору за ВИЧ/СПИДом и ИППП (инфекции, передаваемые половым путем) была создана в ноябре 1996 года.
Общие цифры выявленных ВИЧ-инфицированных в Москве — порядка 135 тыс. Это тотальный учет, то есть в базе находятся все, кто попал в поле нашего зрения. Значительная доля — иногородние, которые приезжали в наш город за получением медицинской помощи, обращались в больницы и уезжали домой. Учетные данные передаются в те регионы, откуда эти люди приехали. Поэтому мы видим достоверную картину по всей России: сколько реально больных живет в нашей стране.
Когда в Москве был пик выявления ВИЧ-инфекции в 1999 году и вирус попал в среду наркоманов, сразу и достаточно активно началась работа по борьбе с ней, была создана первая программа против ВИЧ, что позволило приостановить рост числа заболевших. В 1999 году выявили 6 356 больных, большая часть из них была наркозависимыми, поэтому мы начали активную работу именно с этой группой. В последние годы происходит снижение числа выявленных больных. По России мы такие данные видим только, наверное, последний год, но различные регионы России также сформировали негативный тренд развития ВИЧ-инфекции в стране. Максимальное количество приезжих пришлось на 2017 год, сегодня иногородних стало чуть меньше. Среди них ВИЧ-инфицированных больше, нежели среди москвичей. Основная категория больных в Москве и России в целом — наркозависимые. Еще один феномен для Москвы, в отличие от России: достаточно большая доля гомосексуалов — более 20% зараженных.

В Москве, как и в большей части регионов страны, создана межведомственная программа по работе с ключевыми группами населения, нацеленная на борьбу с ВИЧ. Ее работу координируют правительство Москвы, департамент здравоохранения, идет активная работа в городских СМИ, задействованы комитеты общественных связей, педагоги в Департаменте образования и НКО, работающие достаточно активно. Каждый больной, который стоит на учете в Московском центре, получает помощь всех организаций города Москвы.
Согласно докладу Роспотребнадзора в 2019 году, сразу в 13 регионах России заражен 1% населения (что составляет более 1 000 на 100 000 человек).
Академик, заведующий отделом по профилактике и борьбе со СПИДом Центрального НИИ эпидемиологии Роспотребнадзора Вадим Покровский назвал ситуацию в наиболее проблемных регионах генерализованной эпидемией (когда количество беременных женщин с ВИЧ от их общего числа среди жителей региона достигло 1%).
В стране продолжают заражаться, причем заражаются в основном через гетеросексуальные контакты. Население не использует презервативы — их продажи падают. Причины я вижу в том, что, с одной стороны, их стоимость высока, а покупательская способность населения падает, с другой стороны, люди не понимают, что эта проблема может коснуться их напрямую. Еще и власть рапортует, что ВИЧ в стране активно побеждается.

Но помогать первым больным, когда еще была только монотерапия МЗТ, оказалось очень сложно. На наших глазах появлялись первые схемы терапии, дававшие возможность больным хотя бы не умереть, а затем и препараты, позволившие инфицированным жить уже более-менее комфортно. Сегодня у нас достаточно большой перечень препаратов, которые можно предложить больным. Тем не менее, есть мультирезистентные формы инфекции и тогда надо решать проблему уже с ними. Если у пациента, кроме ВИЧ, есть наркозависимость, мы только в половине или даже меньшем количестве случаев добиваемся вирусной супрессии. У нас есть карты 33 тыс. больных ВИЧ-инфекцией, но, к сожалению, порядка 5 000 — люди наркозависимые, которые сегодня не лечатся и являются как раз источниками СПИДа.
Важнейшая проблема для нас — создание новых лекарств, в том числе выход на рынок пролонгов. Стараемся выполнить программу ООН по СПИДу, если не полностью вылечить ВИЧ-инфекцию через 10 лет, то хотя бы добиться иммуносупрессии у 90% больных.
Основной способ лечения ВИЧ — антиретровирусная терапия — применение лекарств, подавляющих вирус. Дополнительно проводится симптоматическая терапия — лечение вторичных инфекций.
Типы антиретровирусных препаратов
- Нуклеопрепараты: борются с трансформацией вируса в ДНК.
- Ненуклеозидные ингибиторы обратной транскриптазы: также блокируют трансформацию в ДНК, но другим способом.
- Ингибиторы протеазы: препятствуют формированию новых клеток вируса.
- Ингибиторы слияния: мешают присоединению вируса к клетке.
Поскольку вирус быстро мутирует, для эффективной борьбы с ним больному назначают 3-4 вида препаратов.
Мы долгое время исследовали вирус иммунодефицита, собирая образцы крови больных. Оказалось, что и незараженные клетки выделяют нечто подобное вирусу — экстраклеточные везикулы. И когда мы изучаем ВИЧ, на самом деле это не вирус, а смесь вирусных частиц и экстраклеточных везикул. Считается, что везикулы, выделяемые одной клеткой, несут информацию в виде ДНК и РНК, адресно перенося ее на другие клетки. Раньше мы считали, что так может делать только вирус. Сегодня обнаруживаются всё новые везикулы. По этой теме публикуется примерно 400 новых статей в месяц.
Прежде всего было интересно, влияют ли экзосомы на ВИЧ-инфекцию. Ученые выяснили: да, влияют. Блестящим примером может служить работа Юрия Садовского, показавшего, что устойчивость к вирусу, в том числе к ВИЧ, за счет трофобласта эмбриона можно передать другим клеткам, просто собрав в эти трофобласты везикулы и объединив их в пробирке с другими клетками. И связано это с передачей микроРНК. Везикулы от зараженных клеток несут вирусный белок, связанный с активацией Т-клеток и подавлением апоптоза и down-регуляцией MHC-1 и MHC-2, что тоже отражается на инфекции.
Экстраклеточные везикулы, экзосомы — микроскопические пузырьки, выделяемые клетками разных органов и тканей. Их физиологическая роль — перенос нуклеиновых кислот от одной клетки к другой, регуляция иммунитета за счет обмена сигналами между клетками, активация свертывания крови и другие функции. Влияют на клетки при помощи взаимодействия с рецепторами и переноса микроРНК.
Трофобласт — наружная клеточная масса эмбриона, которая в дальнейшем формирует ворсинки плаценты. Защищает зародыш и переносит питательные вещества и кислород в кровь зародыша из крови матери.
МикроРНК — короткие некодирующие РНК, участвующие в регуляции экспрессии генов. Поддерживают стабильность генома, иммунные реакции, контролируют гены, участвуют в пролиферации (размножении) и апоптозе (уничтожении) клеток.
Апоптоз — генетически запрограммированная гибель клеток, их распад и удаление макрофагами. При апоптозе не развивается воспаление.
MHC I и MHC II — классы генов, являющиеся центральными участниками формирования клеточного иммунитета: если в организм попал вирус, на их поверхности формируются его пептиды, их быстро распознают T-лимфоциты, и иммунная система уничтожает патоген.
Down-регуляция — снижение чувствительности рецепторов к воздействию лекарств, приводящая к необходимости повысить дозу.
Мы создали методику, позволяющую изучать антигенный состав индивидуальной частицы — вируса или везикулы. Мы присоединяем их к магнитным наночастицам размера 10–15 нм, а затем на этот комплекс наливаем различные антитела и смотрим, какие антигены есть на этих частицах.

Как отличить везикулу от вируса? Не все белки входят и в вирус, и в везикулы. Есть и белки, которые, как, например, CD45, присутствуют только в везикуле. Если взять препарат, который, как изначально предполагалось, состоит только из вирусов, а на самом деле — из смеси, и убрать при помощи магнитных частиц хотя бы часть везикул, а затем опять заразить культуру тканей матки или лимфатических узлов, то происходит уменьшение инфекции. Везикулы в данном случае способствуют инфекции: либо активируют клетки, либо действуют каким-то другим способом. Оказалось, что на везикулах, выделяемых зараженными клетками, имеются важнейшие вирусные белки — например, белок, отвечающий за слияние клеток с вирусами.
Все клетки, в том числе инфицированные, выделяют везикулы. Везикулы зараженного организма-хозяина стимулируют ВИЧ-инфекцию. Везикулы, выделяемые вагинальными лактобактериями, препятствуют заражению ВИЧ. То, что мы считали вирусами, на самом деле является смесью инфекционных частиц и везикул, некоторые из них несут вирусные белки. Теперь важно изучить все эти сложные взаимодействия между везикулами и вирусами для понимания патогенеза ВИЧ. И это наверняка приведет к новым подходам в профилактике и лечении вируса.
В какой-то степени инфекцию мы уже победили, другой вопрос — как победить эпидемию. Необходимо создание вакцины, которая сможет предотвратить передачу ВИЧ от человека к человеку.
В 2018 году в Европе поставили 141 тыс. новых диагнозов ВИЧ. А всего в регионе живет 2,2 млн инфицированных людей. Основная нагрузка заболевания приходится на Восточную Европу, потому что на Западе количество новых заражений снижается вследствие профилактических мер, хотя там до сих пор основная причина заражения — наркозависимые, не знающие о своем диагнозе ВИЧ-инфицированные и мигранты.
Тестирование на ВИЧ происходит в государственных больницах и частных центрах на уровне сервисов или сообществ. Это способствует и снижению стигматизации. Даже врачи общей практики могут проводить тестирование и анализы. Сегодня в Европе анализы доступны даже в домашних условиях.
В России также есть возможность пройти тестирование на ВИЧ на дому. Диагностика определяет антигены и антитела через четыре недели после заражения. Купить экспресс-тест можно практически в любой аптеке или заказать по интернету с доставкой на дом.
Существует два типа тестов для домашней диагностики ВИЧ: для анализа артериальной крови и для анализа с исследованием слюны. В набор входят тест-полоска, реагенты, салфетка с дезинфицирующим раствором, скарификатор для прокола пальца, пипетка или пробирка для забора крови либо лопатка для соскоба во рту. Тест дает результат через 15–30 минут после нанесения биоматериала на тест-полоску.
Результат почти 100%, но у беременных женщин, людей, больных онкозаболеваниями, вирусными инфекциями и сахарным диабетом может быть ложноположительный результат. Поэтому после домашней диагностики для точного диагноза стоит сдать кровь на ВИЧ в больнице.
Германия немного не дотягивает до этой цифры. Даже в стране с хорошей медициной, где бесплатно проводят анализы, всё равно идет стигматизация. Люди боятся приходить на анализ, рассказывать о своих сексуальных предпочтениях или признаваться, что употребляют наркотики. Из тех же, кто получает антивирусную терапию, фактически 90% и выше имеют супрессию вируса, что, безусловно, хороший результат.
Сегодня в Германии появились системы для домашнего анализа, их можно купить в аптеке. Это позволяет организовать анонимный анализ для людей, которые боятся стигматизации и не хотят рассказывать семье. Они сами могут заботиться о своем половом здоровье, регулярно тестироваться, поэтому доконтактная профилактика очень важна в тех странах, где она доступна.
Продолжительность жизни человека с ВИЧ практически сравнялась с жизнью обычного человека, особенно заметен эффект в Швейцарии. Если после терапии вирус не определяется, он не передается, и это главная мотивация для того, чтобы пациенты продолжали принимать терапию.
По данным Федерального департамента здравоохранения Швейцарии, в 2017 году было выявлено 447 новых случаев заражения, а в 2018 году — 425, что на 4,5% ниже прошлогоднего уровня. Снижению распространения вируса способствовали активное проведение тестов среди групп риска, прием антиретровирусных препаратов ВИЧ-отрицательными людьми для снижения риска заражения (доконтактная профилактика) и просветительская работа (например, сексуальное просвещение в школах).
Очень важный вопрос — кто именно должен назначать антиретровирусную терапию. Лучше, когда это делают специалисты, прошедшие подготовку в области инфекционных заболеваний.
Многие страны Европы переходят к одним и тем же стандартам медицинской помощи. В Боннском университете подробно описывают, как именно работать с людьми, живущими с ВИЧ, и это не только медицинская помощь — есть масса социальных вопросов. Важно не забывать про лечение сопутствующих заболеваний — туберкулеза или гепатита. Как только диагноз поставлен (и даже просто при большом количестве Т-клеток), можно начинать высокоактивную антиретровирусную терапию.

В борьбе с ВИЧ отлично себя показывают мультидисциплинарные команды: не только врачи, но и социальные службы, психиатры и психологи. Гепатологи и другие узкие специалисты лечат сопутствующие инфекции и заболевания. Нужно формировать мультикоманды — только так можно добиться высокого уровня супрессии, а также обеспечить высокий уровень здравоохранения. В результате их работы всё больше и больше пациентов с ВИЧ достигают преклонного возраста, больше половины наших пациентов старше 50.
Чтобы обеспечить лучшее здравоохранение в Европе, мы проводим совещания, приглашаем людей из различных регионов, наших институциональных партнеров из Объединенной программы ООН по ВИЧ/СПИД, Всемирной организации здравоохранения и многих других.
Мы должны комбинировать вакцины с доконтактной профилактикой ВИЧ, только тогда будет достигнуто стопроцентное предотвращение заболеваемости. Мы должны понимать, что сегодня доконтактная профилактика зачастую показывает стопроцентную эффективность. Поэтому важно понимать, что вакцина не всегда может действовать в одиночку, нужно совмещать усилия.
Для диагностики ВИЧ применяются прямые и косвенные тесты. Косвенные позволяют обнаружить в крови человека антитела к ВИЧ, а прямые — выявляют сам вирус и степень поражения организма.
Методы диагностики ВИЧ в России:
- иммуноферментный анализ — выявление антител к вирусу и его антигенов;
- иммуноблот — выявление антител к вирусным белкам;
- иммунохроматография — обнаружение антител непосредственно к ВИЧ;
- полимеразная цепная реакция — исследование генетики самого вируса.
Тесты на ВИЧ можно пройти в медицинских организациях по месту жительства или в специализированных СПИД-центрах.
Читайте также:



