Чем лечить вирус при онкологии
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
1 Шаповалова Ю.С. Клинико-фармакологическое обоснование и опыт применения инновационного релиз-активного препарата в лечении острых респираторных вирусных инфекций. Справочник поликлинического врача. 2015;2:38-42.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
4 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
12 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
неовир
В настоящее время исследована и исследуется* эффективность НЕОВИРа
в следующих случаях:
ЭФФЕКТОРНЫЙ
МЕХАНИЗМ
ЗАБОЛЕВАНИЕ
ВАРИАНТЫ
ПРИМЕНЕНИЯ
Антипрофилеративное и рецепториндуцирующее действие эндогенного a-интерферона
Рак молочной железы
В комбинации с антиэстрогенами (тамоксифен, торимифен) при неоперабельном раке III-IV ст.
Цитостатическое, антиинвазивное и антиметастатическое действие эндогенного a-интерферона
Рак почки Меланома Т-клеточные кожные лимфомы Волосатоклеточный лейкоз Хронический миелолейкоз
·*Монотерапия как вариант выбора на стадиях III-IV
·*В составе комбинированной и комплексной терапии на более ранних стадиях
·*Как компонент адьювантной и неадьювантной терапии.
Модификация индуцированными интерферонами метаболизма химиопрепаратов
Распространённый рак толстой кишки Распространённый рак прямой кишки
В комбинации с 5-фторурацилом
Распространённый рак лёгкого, желудка и др. органов
*Как компонент в схеме паллиативного лечения при неоперабельных случаях рака
При неоперабельном. местнораспространенном или диссеминированном раке молочной железы с возникшей резистентностыо к ранее эффективному тамоксифену НРЕОВИР назначается одно-двухмесячными курсами по 250 мг 2 разав неделю с продолжением приема антиэстрогена (тамоксифеча) в прежних дозах во время и после завершения курса НЕОВИРа. Перерыв между курсами НЕОВИРа 1-2 месяца.
Почечноклеточный рак и меланома - два раза в неделю по 500 мг. Длительность курса не ограничена.
Т-к.леточные лимфомы, волосатоклеточный лейкоз, хронический миелолейкоз - три раза в неделю по 250- 500 мг в течение 18- 20 месяцев.
При распространенном раке толстой (прямой) кишки - НЕОВИР применяется курсами по 250 мг. в/м З раза в неделю, фторурацил 500мг/м на поверхность тела в/в 1 раз в неделю в течение 4-х недель. При хорошей переносимости фторурацила и отсутствии прогрессирования введение фторурацилом можно продолжить до 8 недель.
В составе комплексной и комбинированой терапии рака и как иммунокорригирующее и иммуностимулирующее средство НЕОВИР назначается курсами по 250 мг два-три раза в неделю в течение 2-х месяцев.
Как средство для симптоматической и поддерживающей монотерапии у больных раком в далеко зашедших стадиях Т3-Т4 М+ НЕОВИР назначается по 250 мг 5-8 инъекций в месяц. При необходимости месячную дозу можно увеличить до 8-10 инъекции.
ИЗОПРИНОЗИН
Фармакологическое действие
Иммуностимулирующий препарат с противовирусным действием. Изопринозин - синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитарных клеток под влиянием глюкокортикостероидов, нормализует включение в них тимидина. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона гамма, интерлейкинов (ИЛ)-1 и ИЛ-2, снижает образование провоспалительных цитокинов - ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов.
Препарат проявляет противовирусную активность in vivo в отношении вирусов Herpes simplex, цитомегаловируса и вируса кори, вирус Т-клеточной лимфомы человека тип III, полиовирусов, гриппа А и В, ЕСНО-вирус (энтероцитопатогенный вирус человека), энцефаломиокардита и конского энцефалита. Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов, усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами интерферонов альфа и гамма.
При комбинированном назначении усиливает действие интерферона-альфа, противовирусных средств ацикловира и зидовудина.
Показания к применению
- Лечение гриппа и других ОРВИ
- инфекции, вызываемые вирусом Herpes simplex типов 1, 2, 3 и 4: генитальный и лабиальный герпес, герпетический кератит, опоясывающий лишай, ветряная оспа;
- инфекционный мононуклеоз, вызванный вирусом Эпштейна-Барр;
- цитомегаловирусная инфекция;
- корь тяжелого течения;
- папилломавирусная инфекция: папилломы гортани/голосовых связок (фиброзного типа), папилломавирусная инфекция гениталий у мужчин и женщин, бородавки;
- контагиозный моллюск.
Способ применения и дозы
Таблетки принимают после еды, запивая небольшим количеством воды.
Рекомендуемая суточная доза для взрослых и детей в возрасте 3 лет и старше (с массой тела от 15-20 кг) составляет 50 мг/кг массы тела в 3-4 приема, что составляет в среднем для взрослых - 6-8 таблеток в сутки, для детей - по 1/2 таблетки на 5 кг массы тела в сутки.
При тяжелых формах инфекционных заболеваний доза может быть увеличена индивидуально до 100 мг/кг массы тела в сутки, разделенных на 4-6 приемов. Максимальная суточная доза для взрослых 3-4 г/день, для детей в возрасте 3 лет и старше - 50 мг/кг/сутки
Продолжительность лечения:
Острые заболевания у взрослых и детей в возрасте 3 лет и старше обычно составляет от 5 до 14 дней. Лечение необходимо продолжать до момента исчезновения клинических симптомов и в течение еще 2 дней уже при отсутствии симптомов. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
При хронических рецидивирующих заболеваниях у взрослых и детей в возрасте 3 лет и старше лечение необходимо продолжать несколькими курсами по 5-10 дней с перерывом в приеме в 8 дней.Фармакологическое действие
ЦИКЛОФЕРОН
Иммуномодулятор. Меглумина акридонацетат является низкомолекулярным индуктором интерферона, что определяет широкий спектр его биологической активности (противовирусной, иммуномодулирующей, противовоспалительной). Интерфероногенная активность препарата при пероральном введении сохраняется в течение 3
Основными клетками-продуцентами интерферона после введения препарата являются макрофаги, Т- и В-лимфоциты. Препарат индуцирует высокие титры интерферона в органах и тканях, содержащих лимфоидные элементы (селезенка, печень, легкие), активирует стволовые клетки костного мозга, стимулируя образование гранулоцитов. Циклоферон® активирует Т-лимфоциты и естественные киллерные клетки, нормализует баланс между субпопуляциями Т-хелперов и Т-супрессоров. Усиливает активность α-интерферонов.
Обладает прямым противовирусным действием, подавляя репродукцию вируса на ранних сроках (1-5 сут) инфекционного процесса, снижая инфекционность вирусного потомства, приводя к образованию дефектных вирусных частиц. Повышает неспецифическую резистентность организма в отношении вирусных и бактериальных инфекций.
Циклоферон® эффективен в отношении вирусов клещевого энцефалита, гриппа, гепатита, герпеса, цитомегаловируса, вируса иммунодефицита человека, вируса папилломы и других вирусов. При острых вирусных гепатитах Циклоферон® препятствует переходу заболеваний в хроническую форму. На стадии первичных проявлений ВИЧ-инфекции способствует стабилизации показателей иммунитета.
Установлена высокая эффективность препарата в комплексной терапии острых и хронических бактериальных инфекций (нейроинфекции, хламидиозы, бронхиты, пневмонии, послеоперационные осложнения, урогенитальные инфекции, язвенная болезнь) в качестве компонента иммунотерапии. Меглумина акридонацетат проявляет высокую эффективность при ревматических и системных заболеваниях соединительной ткани, подавляя аутоиммунные реакции и оказывая противовоспалительное и обезболивающее действие.
Важно подчеркнуть, что существует множество противовирусных препаратов, и их можно и нужно применять при лечении онкологической патологии.
КОНСУЛЬТИРУЙТЕСЬ СО СПЕЦИАЛИСТАМИ!
![]()
Друзья, очень прошу совет!
Подскажите, пожалуйста, чем лечить простуду (без температуры)?
У мамы РМЖ и рак почек. На текущий момент проведено исключительно хирургическое лечение.
С насморком прокапались и слава Богу всё идёт на спад, но присоединился традиционный при таких простудах кашель и вот тут загвоздка - обычно отлично помогали горчичники или Меновазин на зону бронхов. сейчас это категорически запрещено, если верить интернету, ибо стимулирует кровообращение. как же быть, что можно использовать, чтобы это не "спускалось" дальше?
И можно ли пользоваться йодной сеткой на эту область?
Честное слово, сейчас как слепые котята. всё страшно, а каждый нюанс с онкологом не обсудишь, да и к терапевтам с простудой никогда не бегали.

![]()
Кашель сухой, а Мирамистином, Хлорофиллиптом полоскаемся.
По препаратам у нас загвоздка с почками. так бы на старте Парацетамолом, Ремантадином хорошо "гасить" простудные явления, но теперь нельзя.
![]()
![]()


Азирис Нуна (07 Март 2016 - 21:38) писал:
![]()
Всем спасибо! Бронхо Ваксом боюсь, почитала инструкцию, иммуностимулятор. Завтра в онкодиспансер, там ещё проконсультируемся.
Девочки, я сейчас в ужасе. увидела у мамы аж 4 синяка на ногах, уже желтеющих + есть момент сильного выпадения волос. у кого-то такое было? Что это вообще? Ведь ни лучевой, ни ХТ не было. С учётом имеющегося, всё подобное вызывает мгновенную панику.

Ирина, мы маме кашель лечили (если легкий) - то : ингаляции с эвкалиптом, либо беродуалом (или чередовали) + чай с алтеем, + откашливающие (АЦЦ, амброксол и т.д.). Ну как при обычном кашле.
А когда была проблема с легкими - то кололи антибиотики по назначению врача.
Про синяки - у мамы после 4-ой ХТ пошли жуткие синяки по всему телу - сделали коагулограмму, был повышен фибриноген. Думали начать принимать этамзилат, но это длилось малый срок, почти тут же синяки сошли и не возобновлялись. И кровь пришла в норму сама.
Сделайте коагулограмму, если синяки, то это что-то со свертываемостью крови.

Странно про выпадению волос. Ирина, я не учла, что у Вас Химии не было..
Да, симптомы как при отравлении химией.
У Вашей мамы проблема с почками..Наверное они не справляются с выводом токсинов.. Я не врач - просто догадка обывателя глупая.. Но лучше бы врача озадачить, что делать..

![]()

Азирис Нуна (07 Март 2016 - 21:38) писал:
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
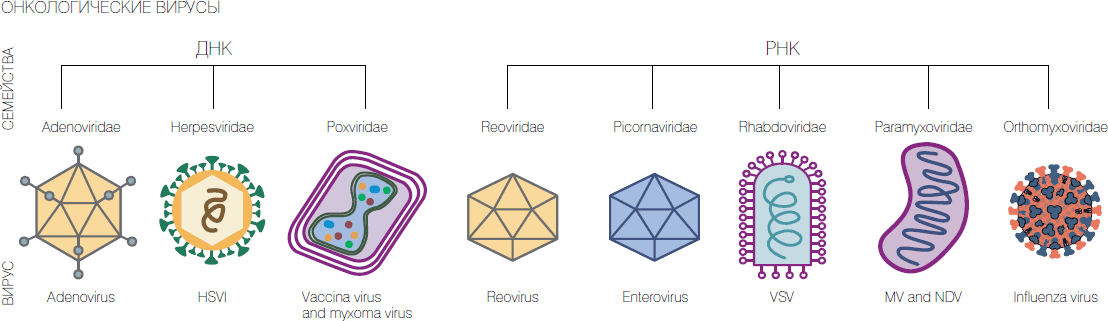
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
Читайте также:


