Бычий вирус что это

НОДУЛЯРНЫЙ ДЕРМАТИТ КРУПНОГО РОГАТОГО СКОТА (Dermatitis nodularis bovum), бугорчатка кожи кр. рог. скота, узелковая сыпь кр. рог. скота, инфекц. болезнь, характеризующаяся лихорадкой и образованием на коже специфич. узелков (бугорков). Протекает в виде эпизоотии. Болезнь наблюдалась в странах Юж. и Вост. Африки, Европы (Румыния, Венгрия, ФРГ), Азии и в Австралии; в СССР не зарегистрирована. Летальность 4 — 95%.
Этиология. Возбудитель Н. д. к. р. с.— неклассифицированный вирус. Предполагают, что болезнь вызывают 3 типа вирусов, к-рые отличаются друг от друга по патогенности для кр. рог.скота и лабораторных животных, цитопатогенному действию и, вероятно, иммунологически. Осн. возбудитель болезни — вирус типа нитлинг, к-рый чаще других выделяется из патол. материала. Вирус чувствителен к эфиру, прогреванию и хорошо сохраняется в высушенном состоянии (более 5 лет). Дезинфицирующие средства (3%-ный р-р щёлочи [щелочи] , 1%-ный р-р фенола, 3—5%-ные р-ры лизола, молочной к-ты и др.) и солнечный свет инактивируют вирус в течение нескольких часов. К вирусу восприимчивы кр. рог. скот, овцы, козы, кролики, морские свинки и новорождённые [новорожденные] мыши. Вирус выращивают в куриных эмбрионах, культурах клеток почки телят и эмбрионов овец, тестикул телят, фибробластов куриного эмбриона. Эпизоотология не изучена. Иммунитет, Переболевшие животные приобретают невосприимчивость к повторному заражению в течение 8—12 мес.
Симптомы и лечение. Н. д. к. р. с. протекает хронически. Инкубац. период от 3 до 13 сут. Болезнь начинается повышением темп-ры тела до 40 °C и выше; затем появляются водянистые истечения из глаз, вялость, отказ от корма, слюнотечение, скованная походка и прогрессирующее исхудание. На коже (чаще ног и живота) образуются бугорки с плоской поверхностью диам. 0,5—0,7 см, вые. 0,5 см. Через 1—3 нед с момента появления бугорков ткань внутри них полностью некротизируется и образуются секвестры. При благоприятном исходе они заполняются грануляц. тканью и животное выздоравливает и течение 4—6 нед. При тяжёлой [тяжелой] форме узелки обнаруживают в ротовой полости, в лёгких [легких] , органах пищеварения. В них образуются плоские круглые серовато-жёлтые [серовато-желтые] некротич. очажки, к-рые нагнаиваются и изъязвляются, изо рта выделяется густая тягучая слюна, из носа — слизь со зловонным запахом. У лактирующих коров поражённое [пораженное] вымя увеличено, в нём [нем] возникают узелки; молоко становится густым с розоватым оттенком, при нагревании образует гель. У быков при поражении семенников вирус выделяется со спермой более 2 мес после выздоровления.
Патологоанатомические изменения. Находят поражение лимфатич. узлов; звездчатые кровоизлияния под висцеральной плеврой, в раковинах носовых ходов, селезёнке [селезенке] , печени, рубце; отёк [отек] лёгких; [легких;] узелки в большинстве внутр. органов; явления общей интоксикации.
Диагноз ставят на основе эпизоотол. данных, клинич. картины, патологоанатомич. изменений и результатов лабораторного исследования (выделение возбудителя и биопроба). Н. д. к. р. с. дифференцируют от кожной формы туберкулёза [туберкулеза] , крапивницы, стрептотрихоза, дерматофилёза [дерматофилеза] , эпизоотич. лимфангита, оспы, демодекоза, а также поражений кожи после укусов насекомых.
Лечение. Вскрывшиеся узелки обрабатывают р-рами дезинфицирующих средств. Назначают сульфаниламиды и антибиотики для профилактики вторичной инфекции.
Профилактика и меры борьбы. Специфич. профилактика разработана не полностью. Для иммунизации против Н. д. к. р. с., вызываемого вирусом типа нитлинг, применяют штаммы вируса оспы овец. Неблагополучные х-ва карантинируют. Вывоз животного сырья разрешают только после его специальной обработки.
Лит.: Вирус бугорчатки рогатого скота, в кн.: Руководство по ветеринарной вирусологии, М., 1966, с. 634-36; Шарабрин О. И., Борисович Ю. Ф., Вирусная бугорчатка кожи крупного рогатого скота, в кн.: Диагностика инфекционных и протозойных болезней с.-х. животных, М., 1968, с. 72.
| Бычий вирус пенистый | |
|---|---|
| классификация Вирус | |
| Группа: | |
| Подсемейство: | |
| серологический тип | |
|
Бычий вирус пенистый содержаниеоткрытиеПервый пенный вирусный агент был выделен из структур печени в макаки резус в 1955 году вирус бычьей пенистого был выделен в 1969 году от крупного рогатого скота с лимфосаркома . На момент его открытия было мало известно о влиянии вируса или вообще играл ли какую - либо роль в развитии лимфосаркомы в крупного рогатого скота. Продолжение исследования показали , что распространенность инфекции ЛСК 40-85% во всем мире , но не имеет каких - либо значительных патогенного характера. Структура / Морфология
Бычий вирус пенистого является покрытой оболочкой сферическим вирусом. Частицы вируса приблизительно 80-100 нм в диаметре и содержат однонитевой, позитивно-смысловой РНК: сс (+) РНК. 20% выпущенных вирионов содержат двухцепочечную ДНК в качестве продукта поздней стадии обратной транскрипции. Внешняя оболочка вируса покрыта различными гликопротеинов , которые позволяют ему взаимодействовать с окружающей средой. Сразу за конверт является буфером между капсида и оболочки , известный как белковой матрицы . Матрица несет ответственность за сохранение формы мембраны, а также участвует в многообещающем процессе. Внутри матрица лежит капсид, белковую оболочку, содержащую вирусный intigrase , обратной транскриптазы и нуклеокапсида, внутри которого живет генетический материал вирусов. В связи с тенденцией вирусов расцветать в эндоплазматический ретикулум, что вирионы имеют тенденцию показывать незрелые белковые характеристики вокруг ядра, а также уникальные glycoptorien шипов на поверхности мембраны. Частицы ЛСК также обладают электронно-Lucent мембран , которые легко кросс-состоянии электронами. Вирусный геном
Б имеют monoparatie геном, а это означает , что весь его геном хранятся в одной молекуле оцРНКе (+) / дцДНКа. Эта молекула является линейным димерным геном содержит приблизительную 12.3kb информации. Молекула обладает 5'-колпачок и 3'poly-A хвостом. Каждый из этих концов обладает 600nt длинной последовательности терминалов повторов (LTR). Области объявления U5 U3, R содержатся в этих ДКП. 5' конец имеет сайт связывания праймера , а на 3' - конец обладает полипуриновую трактом. Вирусная записьПроцесс , посредством которого пенистые вирусы попадают в клетку не хватает определенных уровней характеристик, однако известно , что частица вируса прикрепляется к первой принимающей использованием SU гликопротеин присутствует на его оболочке. Связывание рецептор для пенных вирусов не совсем знает, однако известен , что вирус способен инфицировать настольный спектр клеток, то есть рецептор связывания должен быть весьма распространен в большинстве видов клеток. Исследования показали , что наиболее вероятным кандидатом для общего рецептора гепарансульфат (ГС), чрезвычайно распространенным гликозаминогликаны (ГАГ) , присутствующий на ECM многих клеток. После интернализации, вирусная частица должна сливаться с внутренним vessical и позволяет его генетический материал , чтобы избежать в цитоплазму. Вирусный синтез опосредован через TM гликопротеин . Процесс синтеза имитируется , когда белок ТМ расщепляется изменяющимися уровнями рН , который в свою очередь создает изменение конформации белка в, сплавлением мембрану вируса с внутренним vessical. цикл репликацииПосле того , как вирусная частица поставила свой генетический материал безопасно в цитоплазму хозяина, одна из двух вещей будут происходить. Если генетическая полезная нагрузка вириона была двухцепочечной ДНК, вирусная ДНК будет непосредственно интегрировать в геном хозяина с помощью вирусного фермента интегразы. Если полезная нагрузка была оцРНК РНК сначала копируется в sdDNA с помощью обратной транскриптазы , а затем случайным образом интегрирована в геном хозяина по интегразам. Затем клетка - хозяин выполняет свои естественные функции репликации, однако при этом , так что транскрипция вирусной РНК , которая затем переводится на предшественников полипротеинов . На данный момент в цикле, если какой - либо вирусной РНК остальные, она будет переписана в двухцепочечной ДНК, однако это слишком поздно , чтобы быть интегрированы в хост-клеточный геном. Это дц затем случайным образом упакованы во вновь образованных вирионов наряду с оцРНК. С этого момента вирусные частицы начинают расцветать. Наиболее бутон в эндоплазматической сети , которые затем упакованы и распространяется на другие клетки. Некоторые частицы удается бежать через мембрану , но это число, как правило , довольно низок. Будучи spumavirus , бычий вирус пенистый имеет уникальный жизненный цикл, даже по сравнению с другими ретровирусов . Одним из таких отличий является механизмом , используемым в многообещающем процессе. Вместо того , многообещающие через плазматическую мембрану , как более традиционный ретровирус , ЛСК и другие вирусы пенистого Бутона с использованием эндоплазматической сети . Другой аспект ЛСК , что делает его уникальным среди других ретровирусов, как в конце цикла репликации обратной транскрипции происходит. Это приводит в некоторых из вирионов , содержащих ДНК , а не типичной РНК . Это также приводит к некоторому уровню интеграции в клетки - хозяина ДНК в необычных способов. По этой причине ученые сравнивают вирусы пенистые с вирусами семейства Hepadnaviridae . Пенистые вирусы также содержат структурные гены, которые отличаются своей особой рода. Затычка белки не всегда правильно расщепляются в зрелую форму вирусного белка, как показаны в других членах retrovirdae , что приводит к общей незрелой морфологии FV. Ко почкования связанного белок , обнаруженный в трансмембранном домене в Viron содержит эндоплазматический ретикулум сигнал удержания , который вносит свой вклад в его способность бутона в ER . Принимающие взаимодействияНаиболее очевидный результат взаимодействия между вирусом и его хозяином является предательским образованием большого количества вакуолей по всей цитоплазме. Это называется вакуолизация, и это то, что дает spumaviruses свое имя. Большинство инфицированных клеток также начинают быстрое образование синцитий. Мысль этот эффект в видел довольно часто, его причина до сих пор еще предстоит определить. В некоторых более редких случаях гибель клеток была записана. Сопутствующие заболеванияНа сегодняшний день не известно, возбудитель не связан с вирусом бычьей пенистой. TropismБычий вирус пенистый, как известно, способны инфицировать широкий диапазон ячеек. К ним относятся фибробласты, эпителиальные клетки и нервные клетки. Используя методы, такие как ПЦР, бычий вирус пенистого могут быть идентифицированы в большинстве тканей зараженных животных. Что нужно знать о лейкозе КРС
Татьяна АГАРКОВА, канд. ветерин. наук, старший научный сотрудник лаборатории лейкоза Что нужно знать о лейкозе КРС Сразу оговорюсь, что в материале я использую сведения, материалы, данные своих коллег, научных наставников по проблеме лейкоза крупного рогатого скота. Для начала хотелось бы немного обратиться к истории изучения лейкоза крупного рогатого скота. Почему заболевание называется лейкозом? Несколько позднее появились сообщения по лейкозу животных. Первый случай лейкемии у лошади описал патологоанатом Дрезденского ветеринарного института Лейзеринг в 1858 году. Первый случай лейкоза крупного рогатого скота изложен немецким исследователем О. Siedagrotzky в 1878 г. Автор, выполнив обзор по лейкозам животных, пришел к заключению, что в Саксонии болезнь имеет тенденцию к дальнейшему распространению. С течением времени у крупного рогатого скота при лейкозе P. Knuth und О. Volkmann (1916) выявлены изменения в лейкоцитарной формуле. В частности, ими установлено увеличение общего количества лейкоцитов, лифмоцитов и появление ядерных клеток, служащих, по мнению исследователей, специфическим признаком заболевания. Лейкозом болеют 29 видов животных и 15 видов домашних и диких птиц По данным Сюрина В.Н. и др. (1998 г.), лейкозы животных диагностируют почти во всех странах мира. Лейкоз установлен также в Африке и Австралии. В нашей стране возникновение лейкоза связано с завозом племенного скота в 1940, 19451947 гг. из Германии в хозяйства Западной Сибири, Московской, Ленинградской, Калининградской областей, а также Украины, Латвии и Литвы. В дальнейшем лейкоз распространился в Таджикистан, Псковскую, Новгородскую области. Исследования, проведенные в различных регионах страны, показали повсеместное его распространение. По данным боенской статистики в 1979, 1980 и 1981 гг., опухолевые поражения установлены 52,4; 56,3; 58,0 туш на 10000 убитых животных. Лейкоз крупного рогатого скота – что это за болезнь? По справочнику болезней МЭБ (Международное эпизоотическое бюро) – лейкоз крупного рогатого скота (гемобластоз) – хроническая ретровирусная пролиферативная болезнь, характеризующаяся диффузной инфильтрацией тканей и появлением опухолей, на начальных стадиях протекающая бессимптомно. Вирусный лейкоз КРС на поздних стадиях выявляется по лимфоцитозу и злокачественному разрастанию кроветворных и лимфоидных клеток в различных органах. Уже из определения болезни следует выдвинуть проблему борьбы с этой инфекцией на первое место. Особенно после опубликования серий работ о близком генетическом и АГродстве ВБЛ с вирусом Тклеточного лейкоза человека (HTLV1 и HTLV2) диагностика и профилактика лейкоза КРС приобретают особую актуальность. Источником этой болезни становится крупный рогатый скот, инфицированный вирусом лейкоза. Возбудитель болезни передается внутриутробно от больных и инфицированных вирусом лейкоза КРС коровматерей, спермой быковпроизводителей, содержащей следы крови, при взятии крови, вакцинации, химиотерапии одной и той же иглой, вирус может передаваться через молоко больных коров телятам. Основной метод при искоренении лейкоза КРС – выбраковка. При проведении противолейкозных мероприятий на крупных стадах не более 3% заболевших коров приходится сдавать на мясо, не допуская развития у них опухолевых поражений. Плановые оздоровительные мероприятия обеспечивают получение максимального количества молока и потомства, позволяют сохранить и приумножить генофонд ценных высокопродуктивных животных. В чем опасность лейкоза для животноводства? В настоящее время лейкоз рассматривают как болезнь, представляющую потенциальную опасность для генофонда племенного молочного скота и при отсутствии планомерной борьбы имеющую тенденцию к дальнейшему распространению. Экономический ущерб от лейкоза складывается из: недополучения молока, приплода изза выбраковки и убоя; утилизации лейкозных туш; сдачи на мясо племенного молодняка от больных коров; расходов на проведение комплекса мероприятий. Убытки возникают в результате ограничений на экспорт животных. В тех странах, где действуют программы контроля лейкоза крупного рогатого скота, требуют сертификации, подтверждающей отсутствие ВЛКРС перед поставкой скота в эти регионы. ВЛКРС приводит к экономическим последствиям для производителей, так как инфекция может стать причиной преждевременной выбраковки или смерти животного. Одной из главных задач ветеринарной науки и практики является обеспечение эффективной защиты сельскохозяйственных животных от болезней. Только от здоровых животных можно получить большое количество и лучшего качества животноводческой продукции. Что является причиной лейкоза? Ученые ВИЭВ (г. Москва), ИЭВСиДВ (г. Новосибирск) внесли большой вклад в изучение проблемы лейкоза крупного рогатого скота. В нашей стране выполнены фундаментальные исследования по клиникогематологической и цитоморфологической диагностике. Было постоянное стремление установить природу этого заболевания. Установлению вирусной природы лейкоза крупного рогатого скота предшествовало множество экспериментов. Сообщения о вирусной природе лейкозов у некоторых видов млекопитающих обусловили поиски вирусного агента, ответственного за лейкоз крупного рогатого скота. Опыты по передаче заболевания от одного животного другому служат важными и надежными доказательствами участия в возникновении инфекции животных экзогенных факторов. Экспериментальные работы по воспроизведению лейкоза крупного рогатого скота проводились как на гомологичных, так и на гетерологичных видах животных. Эксперименты на гетерологичных животных связаны с поисками удобной и экономичной биологической модели, так как крупный рогатый скот (по сравнению с лабораторными животными, а также овцами и свиньями) является позднеспелым и дорогостоящим видом. В итоге 1969 г. вошел в историю как год открытия вируса лейкоза крупного рогатого скота (Национальный Центр болезней животных – штат Айова, США). В 19711976 гг. в нашей стране и за рубежом появилось большое количество информации с представлением экспериментальных данных по выделению из лимфоцитов больных лейкозом коров вирусных частиц типа С. На 21м Международном симпозиуме по лейкозу КРС (Брюссель, 1976) была принята резолюция, в которой отмечено: «Вирус бычьего лейкоза следует официально признать определяющим фактором в этиологии энзоотического лейкоза. В государственных программах, регламентирующих борьбу с лейкозом КРС, следует предусмотреть использование серологических тестов, направленных на выявление противовирусных АТ. По материалам VII доклада МКНВ в 2000 году, вирус лейкоза крупного рогатого скота (ВЛКРС , BLV) включен в семейство Retroveridae и входит в род Deltaretrovirus, в который также входят Тлимфотропные вирусы человека и обезьян 1, 2го типов и вирус лейкоза обезьян. В настоящее время выделенные у больного лейкозом крупного рогатого скота вирусные частицы типа С имеют несколько синонимов: вирусные частицы типа С, BLV (BJIB), онкорнавирус, ретровирус, РНКсодержащий вирус, вирус лейкоза. Что происходит при проникновении возбудителя в организм коровы? Патогенный агент, проникнув в клетку, может оставаться латентным в течение длительного периода жизни организма хозяина, не провоцируя болезни. При лейкозе происходит размножение, как правило, недифференцированных клеток с подавленной способностью к созреванию. Одновременно отмечают размножение главным образом недифференцированных клеток в очагах кроветворения, что является одним из обоснований опухолевой природы лейкоза. Вирус локализуется в лимфоцитах крови, где его не могут нейтрализовать циркулирующие антитела. Следовательно, после инфицирования животного ВЛКРС инфекция сохраняется пожизненно. При лейкозе крупного poгaтoго скота, как и при СПИДе у человека, различают болезнь и инфекцию. В первую очередь происходит инфицирование животного, но в этот период признаки болезни не проявляются. Затем болезнь – клиническое и/или гематологическое проявление инфекции. Опасность лейкоза крупного рогатого скота – переход стадии зараженности (инфицированности) в гематологическую стадию, когда происходят необратимые изменения в крови. Какие пути передачи ВЛКРС? Существует два основных пути передачи вируса: вертикальный – от матери плоду (внутриутробно, трансплацентарно) и горизонтальный – от одного (инфицированного) другому (интактному) животному. Частота вертикальной (внутриутробной) передачи ВЛКРС от больной лейкозом матери плоду составляет 1018%, а от инфицированной – 57%, в зависимости от интенсивности проявления инфекционного и неопластического процесса. При горизонтальном пути передачи заражение возможно при непосредственном и (или) опосредованном контакте инфицированных и здоровых животных, а также использовании быковпроизводителей для вольной случки коров и телок. Особую опасность при этом представляют животные в клиникогематологической стадии болезни, имеющие высокую концентрацию возбудителя. Там, где появляется вероятность передачи живых клеток крови от одного животного другому, существует и реальный риск передачи вируса лейкоза. Возможность заражения вирусом при прямом контакте (совместное содержание, пастьба и прогулки инфицированных и здоровых животных) минимальна, поскольку ВЛКРС не обладает высокой контагиозностью. Какие породы коров считаются наиболее и наименее восприимчивыми к данному заболеванию? Какие методы диагностики существуют? Чем опасен это вирус для человека? Ответы на эти и другие вопросы ищите в следующих выпусках журнала. ОСНОВНЫЕ ТЕРМИНЫ Реакция иммунодиффузии (РИД) в геле агара – серологический метод диагностики, позволяющий выявлять животных, инфицированных вирусом лейкоза крупного рогатого скота (РИДположительные животные). РИДположительное животное (серопозитивное) – это инфицированное ВЛКРС животное, пожизненный носитель основного этиологического агента – вируса лейкоза крупного рогатого скота. Инфицированное ВЛКРС животное, сохраняя свои продуктивные и репродуктивные свойства, является источником (иногда скрытым) инфекции ВЛКРС и представляет эпизоотическую опасность для здоровых животных в случае нахождения с ними в прямом или опосредованном контакте. Однако такое животное, если оно не исследовалось гематологически, не может считаться больным лейкозом. Инфекция вируса лейкоза крупного рогатого скота (инфекция ВЛКРС, онкорнавирусная инфекция) – результат взаимодействия вируса лейкоза с клетками иммунокомпетентной системы организма животного, сопровождается появлением в сыворотке крови специфических антител, которые определяются с помощью соответствующих специфических методов диагностики реакция иммунодиффузии (РИД) в геле агара и ИФА (иммуноферментный анализ) Гематологический метод диагностики используется при исследовании инфицированных ВЛКРС коров и позволяет выявлять, в зависимости от полученных результатов, больных лейкозом животных. Всероссийский научный аграрный журналЖурнал включен в Перечень ведущих рецензируемых научных журналов и изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученых степеней доктора и кандидата наук ISSN 2307-0005 (Online)
Программа международной научно-практической конференции МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ Нас индексируют:
AGRIS :: International Information System for the Agricultural Sciences and Technology КиберЛенинка — это научная электронная библиотека открытого доступа (Open Access) Аграрный вестник Урала № 05 (147) 2016 УДК:619:616.988:75:636
Ключевые слова: BHV-1, герпесвирусы, животные, персистенция, иммунитет, цитопатический эффект, иммуноглобулины, иммуносупрессия. Список литературы:
2. Аллен Г. П. ПЦР в реальном времени // Ветеринария. 2006. № 38. С. 252–257. 3. Антуан Н. Биологическая характеристика бычьего герпеса // Ветеринарная микробиология. 2006. № 113. С. 283–291. 4. Джонс С. Анализ бычьего герпеса 1 (BHV-1) // Ветеринарная микробиология. 2006. № 113. С. 199–210. 5. Лейте Ф. BHV-1-влияние на мононуклеарные клетки // Ветеринарная иммунология и иммунопатология. 2005. № 103. С. 87–193. 6. Клупп Б. Г. Герпесвирусная инфекция // Микробиология. 2006. № 9. С. 423–429. 7. Циглер Ю. Вирус простого герпеса 1 типа // Вирусология. 2005. № 79. С. 13047–13059. 8. Чжан С. Ю. Вирус простого герпеса // Наука. 2006. № 314. С. 308–312. 9. Уинн Р. Ф. Вирулентность вирусов в естественных условиях // Иммунология. 2006. № 176. С. 5078–5083. 10. Эстевес П. А. Моноклональные антитела бычьего герпесвируса в ИФА // Методы вирусологии. 2005. № 129. С. 191–193. Скачать статью в PDF: В нашей базе 2917 авторов На сайте опубликовано 2740 статей в 128 выпусках. Опечатки в №№ 9 – 11 от 2016 г.:
Ильясов Олег Рашитович, старший научный сотрудник ФГБНУ Уральский НИВИ, доктор биологических наук Убедительно просим вас ознакомиться с требованиями к представляемым статьям Пройдя по этой ссылке вы узнаете членов редакционного совета Здесь вашему вниманию представлена информация оредакции журнала Если у вас имеются какие-либо иные вопросы или требуется контактная информация, просим пройти сюда
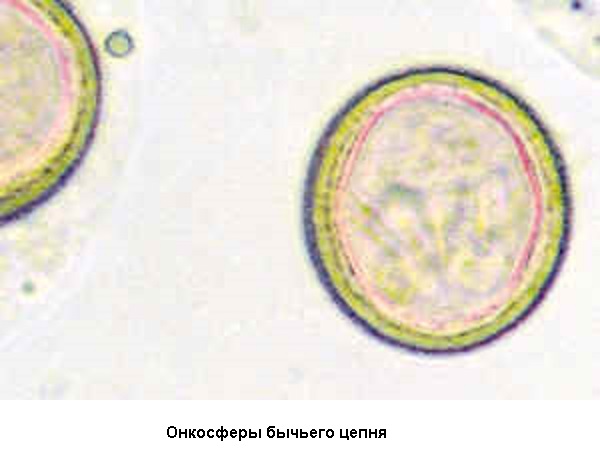
Управление ветеринарии Курганской области является уполномоченным в области ветеринарии органом исполнительной власти Курганской области, осуществляющим государственное регулирование в сфере ветеринарной деятельности на территории Курганской области, и входит в систему государственной ветеринарной службы Российской Федерации. Задачами Управления являются: Управление ветеринарии Курганской области обладает правами юридического лица, имеет гербовую печать. Финансирование Управления ветеринарии Курганской области и подведомственных учреждений осуществляется за счет средств областного бюджета. Почтовый адрес Управление ветеринарии Курганской области: 640002, г. Курган, ул. Володарского, 65 стр.1 часы работы с 9-00 до 18-00 телефоны: 8 (3522) 43-10-30 НовостиБычий цепень выявлен у человека Управление ветеринарии Курганской области призывает граждан быть бдительными не поддаваться искушению сиюминутной выгоды и предупреждает, что купленное на улице, в том числе спонтанных микрорынках мясо может таить в себе личинки опасных паразитарных заболеваний. По информации, поступившей из Управления Роспотребнадзора по Курганской области от 01.09.2015 г. на территории города Кургана выявлен случай заболевания человека тениаринхозом. Тениаринхоз (бычий цепень) Тениаринхоз является биогельминтозом хронического течения, регистрируемым повсеместно. Высокая частота случаев данного заболевания регистрируется в странах Африки, Южной Америки, Австралии. На территории России высокая заболеваемость регистрируется в Ямало-Ненецком автономном округе, Чеченской Республике, Республике Алтай, Коми, Дагестане и других, в которых показатель колеблется от 1,1 до 10 и выше случаев на 100 тыс. населения. В России помимо описанных выше регионов тениаринхоз с определенной частотой встречается в Удмуртии, Пермском крае, Красноярском крае, Новосибирской области, Краснодарском крае, Оренбургской области, Республике МариЭл. На других территориях РФ могут регистрироваться единичные случаи тениаринхоза с низким уровнем заболеваемости по региону. Тениаринхоз – паразитологическое заболевание человека, которое вызывается гельминтом бычий цепень, и характеризующееся нарушениями функции желудочно-кишечного тракта и склонностью к хроническому течению болезни. Причины развития тениаринхоза Возбудитель гельминтоза – это представитель класса Ленточные черви, вида Цепни – бычий цепень (Toeniarhinchus saginatus). Это достаточно крупный гельминт длиной в среднем 6-7 метров (от 4 до 12 метров). Бычий цепень состоит из головки, шейки и проглоттид или стробилл (члеников), количество которых велико – до 2000 шт. Зрелые членики, как и у других гельминтов, располагаются в дистальных отделах и имеют зрелую матку (соответственно паразит является гермафродитом), заполнены они онкосферами (яйцами) в количестве до 150 штук в каждом членике. Особенности цепня - 4 присоски на голове, способность члеников самостоятельно ползать по траве, наличие у каждого членика своей собственной половой системы. Окончательным хозяином является человек. В организме человека паразитирует половозрелая особь бычьего цепня, соответственно человек выделяет яйца с испражнениями в окружающую среду. Членики цепня могут самостоятельно после акта дефекации выползать и двигаться на теле больного. Выделяются членики на 80-й день после момента инвазии (заражения).
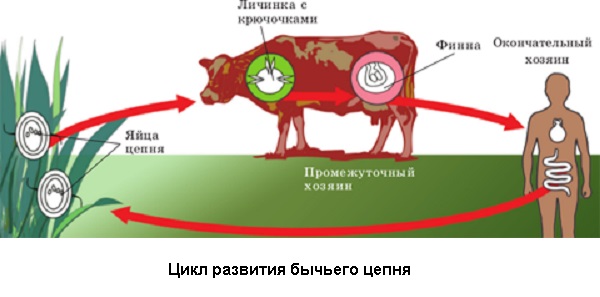
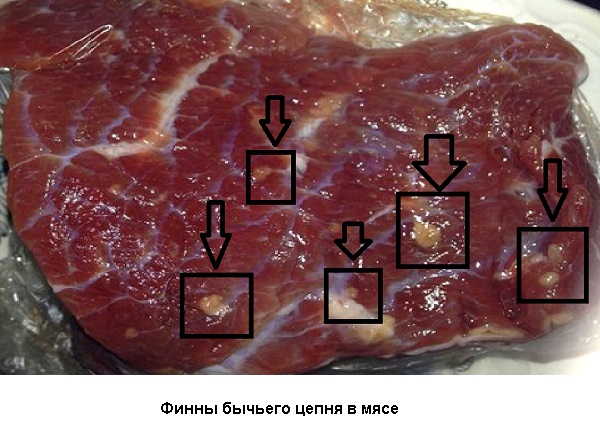
Промежуточный хозяин – крупнорогатый скот, олень, зебра, як, буйвол и другие. Промежуточный хозяин инфицируется при поедании онкосфер во время питания (с травой, почвой). В мышечной ткани происходит развитие цистицерка или финны (личинки цепня), которая становится опасной для инфицирования человека в среднем через 4-5 месяцев.
Механизм заражения – алиментарный, а путь - пищевой. Заражение человека происходит через сырое или плохо обработанное мясо, содержащее финны (инвазивные личинки).Больной человек для окружающих людей не заразен, онкосферы должны пройти путь развития до личинок в организме промежуточного хозяина, которые и опасны для заражения человека. Восприимчивость к тениаринхозу всеобщая, чаще заболевают взрослые лица.
Цикл развития бычьего цепня Яйца вместе с фекалиями попадают во внешнюю среду (они располагаются в стробилах - члениках, активно двигаются), из яйца выходят онкосферы (на траве, почве, сене). Онкосферы достаточно устойчивы во внешней среде – выдерживают низкие температуры (практически могут выдерживать в почве зимовку), погибают при высоких температурах (до 29-37º), при действии ультрафиолетовых лучей. Животные заражаются, поедая загрязненную фекалиями больного человека траву. В ЖКТ промежуточного хозяина выходят личинки, которые проникают через кишечную стенку в кровеносные сосуды и разносятся по организму. Оседают они в мышечной ткани или межмышечных соединительнотканных элементах (сердца, языка, жевательных, скелетных), где превращаются в цистицерк (финну) примерно за 4-5 месяцев. Продолжительность жизни финны в организме промежуточного хозяина - приблизительно 8-9 месяцев, после чего они гибнут. Если за это время финна попадает в организм человека (поедание финнозного мяса), цистицерк выворачивает сколекс, прикрепляется к слизистой оболочке чаще 12-перстной кишки и формируется половозрелая особь. Длительность паразитирования бычьего цепня в человеке около 20 лет. Иммунитет после перенесенного тениаринхоза нестерильный, нестойкий.
Патогенное действие бычьего цепня в организме человека 1) механическое воздействие (присоски, активность члеников), нарушение секреторной и моторной функций ЖКТ (катаральное воспаление слизистой кишечника); 2) провокация болевого синдрома при прохождении члеников через баугиниевую заслонку (как при аппендиците); 3) скопление цепней в кишечнике приводит к кишечной непроходимости или воспалению; 4) дефицит ценных питательных веществ из-за интенсивного потребления их цепнем; 5) сенсибилизация организма (развитие аллергической реакции). Выделяют раннюю и позднюю (хроническую) стадию тениаринхоза. Ранняя стадия изучена мало в силу невыраженных или отсутствующих симптомов, поэтому течение ранней стадии принято считать стертым и малосимптомным. В хроническую стадию тениаринхоза выделяют 4 основных синдрома: 1) астеновегетативный (общая слабость, недомогание, утомляемость, плохой сон, головокружения, головная боль, повышенная раздражительность); 2) диспепсический (тошнота, иногда рвота, изжога, неустойчивость стула нередко послабление, но иногда и склонность к запорам, гиперсаливация повышенное слюноотделение); 3) абдоминальный (болевой синдром в области живота без определенного места локализации: это может быть боль в области желудка – эпигастрии, боль в подвздошной области – внизу живота слева или справа); 4) особое изменение аппетита (снижение аппетита резко сменяется его повышением). Иногда одним единственным доказательством наличия заболевания является отхождение самого гельминта и его члеников из кишечника без предъявления каких-либо жалоб пациентом. В общем анализе крови: редко небольшая эозинофилия (увеличение эозинофилов), лейкопения (снижение лейкоцитов), анемия (снижение эритроцитов, гемоглобина). При исследовании желудочного сока – снижение кислотности в 70% случаев. При рентгенологическом исследовании кишечника – отмечается сглаженность рельефа слизистой оболочки тонкой кишки. - Кишечная непроходимость за счет скопления особи цепня и перекрытия просвета кишечника; - Перфорация (вскрытие) стенки кишечника самим цепнем и развитие перитонита; - Воспалительные явления (панкреатит, аппендицит, холангит, ДЖВП); - Нетипичное расположение паразита (желчный пузырь, аппендикс, полость носа). Прогноз заболевания в большинстве случаев благоприятный. Постановка диагноза сложна из-за малосимптоматичного течения паразитоза. Основные методы в постановке диагноза: 1) Сбор эпидемиологического анамнеза (факт употребления сырого или термически малообработанного мяса промежуточного хозяина); 2) Факт выхода из кишечника подвижных члеников паразита во время акта дефекации и вне его; 3) Овоскопия испражнений и перианального соскоба с последующей дифференциальной диагностикой между тениаринхозом и тениозом (микроскопия обнаруженных члеников с выявлением матки с боковыми ответвлениями – признак овоцист бычьего цепня); 4) Общий анализ крови (эозинофилия, лейкопения, анемия); 5) Рентгенологическое обнаружение паразита в кишечнике. Дифференциальный диагноз проводится с тениозом и дифиллоботриозом. Дегельминтизация проводится с помощью противопаразитарных средств. 1) Накануне и в дни лечения - безшлаковая диета. Бесшлаковая диета включает в себя следующие принципы: - исключить из питания жареное, жирное, копченое, соленое и сладкое; - в рационе должны присутствовать нежирные супы, бульон, рис, гречка, кисломолочные продукты, постная рыба, хлеб из муки грубого помола, компоты, чай, кисели; - категорически запрещается: свекла, капуста, чеснок, редька, щавель, шпинат, бобовые, абрикосы, виноград, персики, крыжовник и малина, пшенная крупа, перловая крупа, молоко, газированные напитки, кофе, шоколад, алкогольные напитки; - питаться небольшими порциями, 5-6 раз в день. 2) Основной препарат для лечения тениаринхоза - фенасал по одной их двух схем. - вечером легкий ужин, затем ½ ч.л. натрия гидрокарбоната в ¼ стакана кипяченой воды, через 10-15 минут разведенную в 1/2 стакана подслащенной воды взвесь фенасала (дозу пропишет врач, в среднем для взрослого это 2-3 гр.); - утром натощак те же самые процедуры в той же последовательности. После приема фенасала паразит погибает и выходит естественным путем при акте дефекации, никаких дополнительных мер предпринимать не нужно. Больной должен менять бельё ежедневно. Лечение проводится амбулаторно. Эффективность лечения оценивается по отсутствию члеников бычьего цепня в испражнениях в течение последующих 3х месяцев. 3) Альтернативный препарат - бильтрицид (празиквантель) однократно в дозе, которую пропишет лечащий врач. 4) Фитотерапия (экстракт мужского папоротника сухой в капсулах, семена тыквы). Накануне дегельминтизации ставят очистительную клизму, клизму же делают и утром в день дегельминтизации, после приема препарата (через 1,5 часа) дают солевое слабительное. Всю дозу пациент выпивает в течение 30 минут (чаще это желатиновые капсулы). Если в течение 3х часов стула не было, то опять ставят очистительную клизму, это поможет выходу паразита из кишечника. Контроль эффективности лечения проводят через 3-4 месяца. Больного наблюдают 2 года 2 раза в год. - Исключить возможность употребления в пищу сырого или полусырого мяса (говядина). - Тщательно осматривать мясо перед обработкой на предмет наличия в нем финн (личинок бычьего цепня), личинки в мясе видно не всегда, но если внимательно присматриваться, то можно заметить.
- Тщательная термическая обработка мяса во избежание инвазии гельминта: температура не менее 80 градусов внутри куска и продолжительность не менее 1 часа; финнозное мясо не выдерживает длительного замораживания (при -15 градусов в течение 5 дней). - Бережное отношение к собственному здоровью (при появлении симптомов болезни или неприятных ощущений в области ануса, обращение к доктору для обследования и возможной дегельминтизации). - Обследование по эпидемиологическим. показаниям лиц определенных профессий: пастухи, доярки, телятницы, животноводы. - Исследование туш скота на наличие финн на мясокомбинатах. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
| |