Активность вируса вычисляют методом спирмена кербера
ОФС.1.7.2.0002.15 Биологические методы испытания препаратов интерферона с использованием культур клеток
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Вводится впервые
Настоящая общая фармакопейная статья определяет основные требования к биологическим методам испытаний препаратов интерферона с использованием клеточных культур и распространяется на субстанции и лекарственные формы интерферона человеческого всех типов природного и генно-инженерного происхождения.
ОБЩИЕ ПОЛОЖЕНИЯ
Биологические методы с использованием клеточных культур применяют для определения следующих показателей качества препаратов интерферона:
- Специфическая активность
- Подлинность
Методы определения специфической активности и подлинности основаны на способности интерферона подавлять цитопатическое действие индикаторного вируса в культуре клеток в сравнении со стандартным образцом интерферона (СО). Испытания проводят с использованием соответствующих линий клеток, чувствительных к определенному типу интерферона и к индикаторному вирусу.
Наиболее часто используют следующие комбинации клетка/вирус:
- линия клеток карциномы легкого человека А-549, линия клеток почки африканской зеленой мартышки Vero, линия клеток карциномы гортани человека Нер-2с, линия клеток фибробластов мыши L-929/ вирус энцефаломиокардита мышей (EMCV);
- клетки бычьих почек Madin-Darby MDBK, линия клеток почки африканской зеленой мартышки Vero, линия лимфоидных клеток человека Л-41, линия клеток карциномы легкого человека А-549, линия клеток фибробластов мыши L-929, линия клеток амниона человека WISH/ вирус везикулярного стоматита (VSV);
- клетки фибробластов человека/ вирус леса Семлики (SFV), вирус Синдбис (virus Sindbis) или иные.
В качестве СО может быть использован международный стандартный образец активности интерферона соответствующего типа или стандартный образец, откалиброванный в Международных единицах (МЕ) по соответствующему международному стандарту.
Испытания проводят в асептических условиях.
Подготовка к испытаниям
Требования к клеточным линиям (общие условия культивирования и пересева клеток, пассаж, на котором клетки проявляют оптимальную эффективность при проведении испытания, допустимый предел жизнеспособности клеток при пересевах и при взятии клеточной суспензии в испытание, процент сформированного монослоя) указывают в нормативной документации.
Пробоподготовку испытуемых образцов проводят в соответствии с указаниями, приведенными в нормативной документации. Для некоторых лекарственных форм препаратов интерферона (суппозитории, мази, гели и т.д.) при пробоподготовке необходимо экстрагирование активного вещества (интерферона) в раствор, с соблюдением следующих условий: используемые реагенты не должны оказывать токсического действия на культуру клеток в разведениях, необходимых для исследования; использование реагентов для экстрагирования должно быть обоснованным.
Суспензию индикаторного вируса готовят в соответствии с указаниями в нормативной документации на лекарственное средство, содержащее интерферон. Титр вируса должен быть не менее 105ТЦД/мл.
К составу питательных сред, предназначенных для культур клеток животных и человека, предъявляют определенные требования. Для приготовления питательных сред обычно используются солевые растворы Эрла и Хенкса. Возможно использование стандартных коммерческих сред для ведения культур клеток: Игла MEM, МЕМ, DMEM (двойная модификация среды Игла), среды 199 , среды RPMI и др. Для стимуляции роста, прикрепления и деления клеток обычно добавляют 5 – 10 % инактивированной сыворотки коров/крупного рогатого скота. В среду для разведений интерферона добавляют 2 – 5 % сыворотки. Для обеспечения бактериологической стерильности в питательные среды вводят антибиотики: пенициллин (натриевая соль), стрептомицин (хлоркальциевый комплекс) из расчета 100—200 ЕД каждого на 1 мл среды , микостатин (нистатин) из расчета 20—25 ЕД на 1 мл или гентамицин (конечная концентрация 10 мкг/мл). Содержание L-глютамина в питательной среде должно быть около 292 мг/л.
В качестве поддерживающей среды обычно используют питательную среду без сыворотки с добавлением антибиотиков и L-глютамина.
Постоянство рН среды является одним из главных условий культивирования. Другим важным условием культивирования является осмотическое давление. Диапазоны рН и осмоляльности, при которых происходит размножение клеток, узки и варьируют в зависимости от типа клеток.
Оценить количество жизнеспособных клеток возможно при помощи красителей: метиленового синего, кристаллического фиолетового, тиазолинового синего (МТТ), Аламара голубого и других.
Раздел 1. Специфическая активность
Противовирусную активность интерферона определяют путем сравнения защитного действия испытуемого препарата (ИП) с аналогичным действием стандартного образца активности интерферона (СО).
Определение специфической активности препаратов интерферона проводят на монослое культур клеток, полученном при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2 в лунках 96-луночных плоскодонных культуральных планшетов.
Количество клеток, вносимых в каждую лунку планшета, должно быть достаточным для дальнейшего экспоненциального роста клеточной культуры и образования полноценного монослоя при вышеуказанных условиях культивирования в течение 24-48 ч.
Готовят серию разведений испытуемого препарата в среде для разведений интерферона с содержанием 2 – 5 % сыворотки (на 4 разведения выше и ниже предполагаемого титра активности). Параллельно готовят такие же разведения СО в среде для разведения интерферона. Рабочие разведения ИП и СО должны быть указаны в нормативной документации.
Из лунок планшетов с клеточным монослоем удаляют ростовую среду и вносят приготовленные разведения ИП и соответствующего СО, используя на каждое разведение не менее 4-х лунок с культурой клеток.
Возможно внесение ИП и СО в лунки планшета до внесения культуры клеток. В этом случае клеточный монослой будет формироваться с внесённым интерфероном.
Для контроля дозы индикаторного вируса оставляют 16 лунок с культурой клеток, а для контроля состояния монослоя клеток – 4 лунки. В эти 20 лунок вносят поддерживающую среду.
96-луночные планшеты с культурой клеток, разведениями ИП и СО инкубируют в течение 24-48 ч при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2. Затем в каждую лунку с ИП и соответствующим СО вносят вирусную суспензию, содержащую рассчитанную заранее дозу индикаторного вируса — 100 ТЦД50. В лунки контроля клеток вносят такой же объем поддерживающей среды.
Определение дозы индикаторного вируса начинают с установления его активности.
Для определения активности вируса-индикатора готовят десятикратные разведения вируса в поддерживающей среде (от 10-1 до 10-8). Из лунок 96-луночного планшета с клеточным монослоем удаляют ростовую среду. После этого вносят в лунки планшета, используемые для определения дозы вируса, поддерживающую среду в объеме, равном объему испытуемого образца. Затем вносят приготовленные разведения индикаторного вируса (не менее, чем по 4 лунки на каждое разведение) в объеме, равном объему внесенной до этого поддерживающей среды. 96-луночный планшет с разведениями вируса инкубируют в течение 24-48 ч при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2. За титр (активность) вируса принимают величину, обратную разведению вируса, при котором клеточный монослой в 50 % лунок оказался полностью пораженным цитопатическим действием. Титр вируса выражают в тканевых цитопатических дозах – ТЦД50/мл.
Активность вируса вычисляют методом Спирмена-Кербера по формуле:

Lg ED50 – десятичный логарифм титра вируса;
Dmax – десятичный логарифм разведения, ниже которого произошла 100 % гибель клеток (+);
d — десятичный логарифм интервала между разведениями (=1,0);
n — число лунок, приходящееся на каждое разведение вируса (=4);
р — число лунок, давших гибель (+) в разведении, ниже которого произошла 100 % гибель клеток, и последующих разведениях.
После установления активности вируса производят подсчёт дозы для последующего внесения в лунки с испытуемым препаратом (100 ТЦД50).
Одновременно с внесением вируса-индикатора осуществляют контроль взятой дозы вируса на 16-ти лунках с культурой клеток (по 4 лунки на каждое разведение вируса).
Вносят вирус, начиная с разведения, соответствующего 100 ТЦД50, и до разведения, соответствующего 0,1 ТЦД50 с коэффициентом разведения равным 10.
Лунки с культурой клеток для оценки состояния монослоя клеток остаются интактными.
После внесения индикаторного вируса в дозе 100 ТЦД50 96-луночный планшет инкубируют в течение 24-48 ч при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2 до появления первых признаков цитопатических изменений в клеточном монослое с индикаторным вирусом в дозе 1 ТЦД50. Монослой в лунках с 0,1 ТЦД50 индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учёт активности интерферона осуществляют через 24-48 ч при выполнении следующих условий:
- доза внесённого вируса соответствует 100 ТЦД50;
- в лунках с клетками и минимальными концентрациями ИП и СО, зараженными индикаторным вирусом, наблюдается практически полный цитопатический эффект (80 -100 %);
- в лунках с контролем клеток отсутствуют признаки дегенерации.
Учёт активности интерферона осуществляют визуально или инструментально.
производится микроскопически при 100-кратном увеличении через 24-48 ч после внесения индикаторного вируса. За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50 % лунок полностью защищена от цитопатического действия вируса.
Титр интерферона вычисляют методом Спирмена-Кербера по формуле:
Dmax – двоичный логарифм разведения, ниже которого произошла 100 % защита (-);
d — двоичный логарифм интервала между разведениями (=1,0);
n — число лунок на каждую дозу (=4);
р — число лунок, давших защиту (-) в разведении, ниже которого произошла 100 % защита, и последующих разведениях.
Противовирусную активность интерферона (Ах) в исследуемом образце в МЕ вычисляют по формуле:

Асо — противовирусная активность СО интерферона в МЕ;
Инструментальный учет активности интерферона предполагает селективное окрашивание живых клеток, защищенных интерфероном от действия вируса, элюирование красителя, фотометрирование оптической плотности элюата и статистическую обработку результатов с помощью метода параллельных линий.
Как правило, результаты исследования снижения цитопатического эффекта соответствуют сигмоидальному графику доза-ответ: зависимость значений оптической плотности элюата ИП и СО от логарифма их разведения.
При расчете активности интерферона по сигмоидальным кривым ИП и СО должны быть соблюдены следующие условия:
- Измеренные оптические плотности для ИП и СО должны находиться в одном диапазоне оптических единиц, ограниченном значениями оптической плотности, измеренными в лунках контроля клеток и вируса;
- Полученные данные должны отвечать требованиям к параллельности, линейности и величине угла наклона кривых доза-ответ для СО и ИП, указанным в нормативной документации.
Используя линейный участок графика, рассчитывают титр ИП и СО, а затем рассчитывают активность интерферона по формуле:

Асо — противовирусная активность СО интерферона в МЕ;
ах — титр ИП, то есть разведение ИП, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом;
асо — титр СО, то есть разведение СО, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом.
Описание инструментального метода приводят в нормативной документации.
Раздел 2. Подлинность
Подлинность препаратов интерферона определяют путем нейтрализации противовирусной активности ИП моно- или поликлональными антителами против соответствующего типа интерферона, предусмотренными в нормативной документации на препарат. Реакцию нейтрализации противовирусной активности ИП проводят в культуре клеток, чувствительных к данному типу интерферона, в присутствии индикаторного вируса.
Определение подлинности препаратов интерферона проводят на монослое культур клеток.
Количество клеток, вносимых в каждую лунку 96-луночных культуральных планшетов, должно быть достаточным для дальнейшего экспоненциального роста клеточной культуры и образования полноценного монослоя в условиях культивирования при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2 в течение 24-48 ч.
Нейтрализующие антитела разводят средой для разведения до концентраций, указанных в нормативной документации.
Для приготовления нейтрализованной смеси подготовленные разведения антител объединяют в равных объемах с рабочими дозами ИП и СО. Полученную смесь инкубируют при температуре (37±1) о С в атмосфере с (5,0±0,5) % СО2 в течение 1 ч.
Из лунок 96-луночного планшета с монослоем культуры клеток удаляют ростовую среду, вносят в лунки планшета нейтрализованную смесь, не менее чем по 4 лунки на каждое разведение антител.
Нейтрализованную смесь допустимо вносить в лунки 96-луночного планшета как до внесения культуры клеток, так и после него.
Для оценки качества монослоя клеток в процессе постановки реакции нейтрализации (контроль) оставляют не менее 4 лунок, в которые не вносят нейтрализованную смесь. В этих лунках заменяют ростовую среду на поддерживающую.
Для контроля защитного действия интерферона также оставляют по 4 лунки на рабочие разведения СО и ИП без нейтрализующих антител.
Индикаторный вирус в дозе 100 ТЦД50 вносят во все лунки 96-луночного планшета, кроме 4 лунок, предназначенных для контроля монослоя клеток.
После внесения индикаторного вируса в лунки с культурой клеток планшеты инкубируют при температуре (37±1) 0С в атмосфере с (5,0±0,5) % СО2 до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 ТЦД50 (обычно в течение 24-48 ч). Монослой в лунках с 0,1 ТЦД50 индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учёт результатов осуществляют при выполнении следующих условий:
- доза внесённого вируса соответствует 100 ТЦД50;
- отсутствуют признаки дегенерации в контроле клеток и в лунках с рабочими разведениями СО и ИП без нейтрализующих антител.
Нейтрализация активности испытуемого образца анти-интерфероновыми антителами в сравнении с СО в аналогичном разведении свидетельствует о том, что в испытуемом образце содержится интерферон соответствующего типа.
Подробное описание проведения реакции нейтрализации приводят в нормативной документации.
Противовирусную активность интерферона определяют путем сравнения защитного действия испытуемого препарата (ИП) с аналогичным действием стандартного образца активности интерферона (СО).
Определение специфической активности препаратов интерферона проводят на монослое культур клеток, полученном при температуре (37±1) 0 Св атмосфере с (5,0±0,5) % СО2 в лунках 96-луночных плоскодонных культуральных планшетов.
Количество клеток, вносимых в каждую лунку планшета, должно быть достаточным для дальнейшего экспоненциального роста клеточной культуры и образования полноценного монослоя при вышеуказанных условиях культивирования в течение 24-48 ч.
Готовят серию разведений испытуемого препарата в среде для разведений интерферона с содержанием 2 – 5 % сыворотки (на 4 разведения выше и ниже предполагаемого титра активности). Параллельно готовят такие же разведения СО в среде для разведения интерферона. Рабочие разведения ИП и СО должны быть указаны в нормативной документации.
Из лунок планшетов с клеточным монослоем удаляют ростовую среду и вносят приготовленные разведения ИП и соответствующего СО, используя на каждое разведение не менее 4-х лунок с культурой клеток.
Возможно внесение ИП и СО в лунки планшета до внесения культуры клеток. В этом случае клеточный монослой будет формироваться с внесённым интерфероном.
Для контроля дозы индикаторного вируса оставляют 16 лунок с культурой клеток, а для контроля состояния монослоя клеток – 4 лунки. В эти 20 лунок вносят поддерживающую среду.
96-луночные планшеты с культурой клеток, разведениями ИП и СО инкубируют в течение 24-48 ч при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2. Затем в каждую лунку с ИП и соответствующим СО вносят вирусную суспензию, содержащую рассчитанную заранее дозу индикаторного вируса100 ТЦД50. В лунки контроля клеток вносят такой же объем поддерживающей среды.
Определение дозы вируса-индикатора
Определение дозы индикаторного вируса начинают с установления его активности.
Для определения активности вируса-индикатора готовят десятикратные разведения вируса в поддерживающей среде (от 10 -1 до 10 -8 ). Из лунок 96-луночного планшета с клеточным монослоем удаляют ростовую среду. После этого вносят в лунки планшета, используемые для определения дозы вируса, поддерживающую среду в объеме, равном объему испытуемого образца. Затем вносят приготовленные разведения индикаторного вируса (не менее, чем по 4 лунки на каждое разведение) в объеме, равном объему внесенной до этого поддерживающей среды. 96-луночный планшет с разведениями вируса инкубируют в течение 24-48 ч при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2. За титр (активность) вируса принимают величину, обратную разведению вируса, при котором клеточный монослой в 50 % лунок оказался полностью пораженным цитопатическим действием. Титр вируса выражают в тканевых цитопатических дозах – ТЦД50/мл.
Активность вируса вычисляют методом Спирмена-Кербера по формуле:

,
где: LgED50– десятичный логарифм титра вируса;
Dmax – десятичный логарифм разведения, ниже которого произошла 100 % гибель клеток (+);
dдесятичный логарифм интервала между разведениями (=1,0);
nчисло лунок, приходящееся на каждое разведение вируса (=4);
р число лунок, давших гибель (+) в разведении, ниже которого произошла 100 % гибель клеток, и последующих разведениях.
После установления активности вируса производят подсчёт дозы для последующего внесения в лунки с испытуемым препаратом (100 ТЦД50).
Одновременно с внесением вируса-индикатора осуществляют контроль взятой дозы вируса на 16-ти лунках с культурой клеток (по 4 лунки на каждое разведение вируса).
Вносят вирус, начиная с разведения, соответствующего 100 ТЦД50, и до разведения, соответствующего 0,1 ТЦД50 с коэффициентом разведения равным 10.
Лунки с культурой клеток для оценки состояния монослоя клеток остаются интактными.
После внесения индикаторного вируса в дозе 100 ТЦД50 96-луночный планшет инкубируют в течение 24-48 ч при температуре (37±1) 0 Св атмосфере с (5,0±0,5) % СО2 до появления первых признаков цитопатических изменений в клеточном монослое с индикаторным вирусом в дозе 1 ТЦД50. Монослой в лунках с 0,1 ТЦД50 индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учёт активности интерферона осуществляют через 24-48 ч при выполнении следующих условий:
доза внесённого вируса соответствует 100 ТЦД50;
в лунках с клетками и минимальными концентрациями ИП и СО, зараженными индикаторным вирусом, наблюдается практически полный цитопатический эффект (80 100 %);
в лунках с контролем клеток отсутствуют признаки дегенерации.
Учёт активности интерферона осуществляют визуально или инструментально.
Визуальный учет активности интерферона производится микроскопически при 100-кратном увеличении через 24-48 ч после внесения индикаторного вируса. За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50 % лунок полностью защищена от цитопатического действия вируса.
Титр интерферона вычисляют методом Спирмена-Кербера по формуле: 
,
где: Dmax – двоичный логарифм разведения, ниже которого произошла 100 % защита ();
dдвоичный логарифм интервала между разведениями (=1,0);
nчисло лунок на каждую дозу (=4);
р число лунок, давших защиту () в разведении, ниже которого произошла 100 % защита, и последующих разведениях.
Противовирусную активность интерферона (Ах) в исследуемом образце в МЕ вычисляют по формуле:
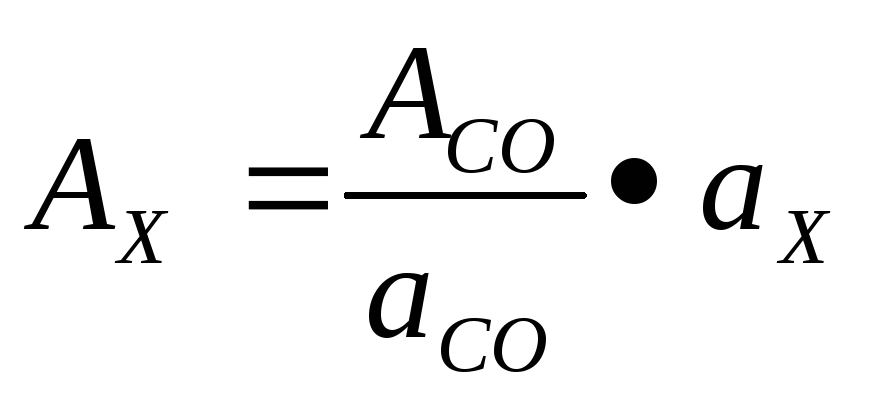
,
где: Асо противовирусная активность СО интерферона в МЕ;
Инструментальный учет активности интерферонапредполагает селективное окрашивание живых клеток, защищенных интерфероном от действия вируса, элюирование красителя, фотометрирование оптической плотности элюата и статистическую обработку результатов с помощью метода параллельных линий.
Как правило, результаты исследования снижения цитопатического эффекта соответствуют сигмоидальному графику доза-ответ: зависимость значений оптической плотности элюата ИП и СО от логарифма их разведения.
При расчете активности интерферона по сигмоидальным кривым ИП и СО должны быть соблюдены следующие условия:
Измеренные оптические плотности для ИП и СО должны находиться в одном диапазоне оптических единиц, ограниченном значениями оптической плотности, измеренными в лунках контроля клеток и вируса;
Полученные данные должны отвечать требованиям к параллельности, линейности и величине угла наклона кривых доза-ответ для СО и ИП, указанным в нормативной документации.
Используя линейный участок графика, рассчитывают титр ИП и СО, а затем рассчитывают активность интерферона по формуле:

,
где: Асо противовирусная активность СО интерферона в МЕ;
ах титр ИП, то есть разведение ИП, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом;
асо титр СО, то есть разведение СО, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом.
Описание инструментального метода приводят в нормативной документации.

МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННЫЙ СТАНДАРТ КАЧЕСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Биологические методы испытания препаратов ОФС
интерферона с использованием
Настоящая фармакопейная статья определяет основные требования к биологическим методам испытаний препаратов интерферона с использованием клеточных культур и распространяется на субстанции и лекарственные формы интерферона человеческого всех типов природного и генно-инженерного происхождения.
Биологические методы с использованием клеточных культур применяют для определения следующих показателей качества препаратов интерферона:
2. Специфическая активность
3. Токсичность (для интерферона альфа-типа).
Подготовка к испытаниям.
Клетки. Культуру клеток выращивают способом, предусмотренным для данного вида клеток в частной фармакопейной статье, таким образом, чтобы обеспечить образование полноценного монослоя в лунках культуральных планшетов в количестве, необходимом для проведения анализа.
Образцы препарата. Пробоподготовка используемых образцов для анализа производится в соответствии с указаниями, приведенными в частных фармакопейных статьях на конкретный препарат.
Приготовление суспензии индикаторного вируса. Суспензию индикаторного вируса готовят в соответствии с указаниями частной фармакопейной статьи на препарат.
Раздел 1. Подлинность
Подлинность препаратов интерферона определяют путем нейтрализации противовирусной активности испытуемого препарата (ИП) стандартным образцом анти-интерферонового иммуноглобулина (IgG) или анти-интерфероновыми поликлональными антителами, предусмотренными в нормативной документации (НД) на соответствующий препарат. Реакцию нейтрализации противовирусной активности ИП проводят в культуре клеток, чувствительных к данному типу интерферона, в присутствии индикаторного вируса.
Порядок определения подлинности
Для определения подлинности препаратов интерферона используют монослой культур клеток, чувствительных к исследуемому типу интерферона, полученного при температуре (37±1)оС в атмосфере с (5,0+0,5) % СО2 в 96-луночных культуральных планшетах, при конечной концентрации клеток 25000кл/лунку.
Готовят разведения стандарта анти-интерферонового иммуноглобулина или анти-интерфероновых поликлональных антител, рабочую дозу ИП и стандарта для определения активности интерферона (СО).
Испытуемый препарат и стандартный образец интерферона разводят таким образом, чтобы конечное разведение содержало 10 ед. противовирусной активности интерферона (без перевода в МЕ).
Готовят двукратные разведения стандарта анти-интерфероновых иммуноглобулинов или анти-интерфероновых поликлональных антител до концентраций, указанных в частных фармакопейных статьях на конкретные препараты.
Объединяют в пробирках равные объемы (по 0,5мл) соответствующих разведений анти-интерферонового иммуноглобулина (анти-интерфероновых поликлональных антител) с рабочей дозой испытуемого препарата и СО. Инкубируют полученные смеси при температуре (37±1) °С в течение 1 ч. Из лунок микропанелей с культурой клеток выливают ростовую питательную среду, в лунки вносят по 0,1мл нейтрализованной смеси, не менее чем по 4 лунки на каждое разведение анти-интерферонового иммуноглобулина (анти-интерфероновых поликлональных антител).
Для оценки качества монослоя клеток в процессе постановки реакции (контроль) оставляют не менее 4 лунок, в которые не вносят нейтрализованную смесь. В этих лунках заменяют ростовую питательную среду на поддерживающую, которая должна обеспечивать лишь переживание клеток в уже сформированном монослое при размножении в клетках вируса. В качестве поддерживающей среды обычно используют питательную среду без сыворотки плодов коров с добавлением антибиотиков.
Для контроля дозы индикаторного вируса оставляют 16 лунок в микропанели с культурой клеток, предварительно заменив в этих лунках ростовую питательную среду на поддерживающую.
После внесения индикаторного вируса в лунки микропанелей с культурой клетки инкубируют при температуре (37±1)0С в атмосфере с (5,0+0,5)% СО2 до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 ТЦД50/0,1 мл (обычно в течение 48 ч). Монослой в лунках с 0,1 ТЦД50/0,1 мл индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учет и интерпретация результатов.
Учёт результатов осуществляют при условии, что доза внесённого вируса соответствует 100 ТЦД50/0,1 мл и при отсутствии признаков дегенерации в контрольной культуре клеток.
Нейтрализация активности испытуемого образца анти-интерфероновым иммуноглобулином (поликлональными антителами) в сравнении с МСО/СО, свидетельствует о том, что в испытуемом образце содержится интерферон соответствующего типа.
Раздел 2. Специфическая активность
Определение специфической активности является основным методом количественной оценки качества препаратов интерферона.
Активность интерферона определяют путем сравнения протективного действия испытуемого препарата (ИП) с аналогичным действием международного стандартного образца (МСО) или соответствующего стандартного образца (СО), откалиброванного в Международных единицах (МЕ) по соответствующему международному стандарту.
Метод испытан в трех международных исследованиях под эгидой Всемирной организации здравоохранения (ВОЗ) на международных стандартах всех типов человеческого интерферона (альфа, бета, гамма) и продемонстрировал чувствительность, надежность и воспроизводимость.
Определение специфической активности препаратов интерферона проводят на монослое культур клеток, чувствительных к исследуемому типу интерферона, полученном при температуре (37±1)0С в атмосфере с (5,0+0,5) % СО2 в 96-луночных культуральных планшетах. Плотность клеточной культуры при этом составляет клеток в каждой лунке.
Противовирусную активность определяют в сравнении с МСО/СО активности человеческого лейкоцитарного интерферона для препаратов природного происхождения и в сравнении с МСО/СО активности человеческого рекомбинантного интерферона для генно-инженерных препаратов соответственно.
Готовят серию десятикратных и двукратных разведений исследуемого препарата в поддерживающей среде (на 4 разведения выше и ниже предполагаемого титра активности). Параллельно готовят соответствующие разведения стандартного образца.
Из лунок планшетов с клеточным монослоем удаляют ростовую среду и вносят приготовленные разведения испытуемого препарата и стандарта (по 100 мкл), используя на каждое разведение не менее 4 лунок с культурой клеток. Для контроля дозы индикаторного вируса оставляют 16 лунок с культурой клеток, а для контроля состояния монослоя клеток – 4 лунки. В эти 20 лунок вносят по 100 мкл поддерживающей среды, используемой для приготовления разведений испытуемых препаратов. Инокулированные и контрольные культуры клеток инкубируют в течение 24 ч при температуре (37±1)0С в атмосфере с (5,0+0,5) % СО2. Затем в каждую лунку с испытуемым материалом и стандартом вносят по 100 мкл вирусной суспензии, содержащей рассчитанную заранее дозу индикаторного вируса - 100 ТЦД50. В лунки контроля клеток вносят такой же объем (100 мкл) поддерживающей среды.
Определение дозы вируса-индикатора
Определение дозы индикаторного вируса начинают с установления его активности.
Для определения активности вируса-индикатора готовят десятикратные разведения вируса в поддерживающей среде в лунках 24-луночного планшета. Из лунок культурального планшета удаляют ростовую среду и вносят по 100 мкл приготовленных разведений вируса не менее чем по 6 лунок на каждое разведение. Инокулированные и контрольные культуры клеток инкубируют в течение 24 ч при температуре (37±1)0С в атмосфере с (5,0+0,5)% СО2. За титр (активность) вируса принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок оказалась полностью пораженной цитопатическим действием. Титр вируса выражают в тканевых цитопатических дозах – ТЦД50/мл.
где Dmax – lg разведения ниже которого произошла 100% гибель клеток (+)
d - lg интервала между разведениями (1,0)
n - число лунок на каждую дозу (4)
р - число лунок, давших гибель (+) в Dmax и последующих разведениях.
После установления активности вируса производят подсчёт дозы для последующего внесения в лунки с испытуемым препаратом.
Одновременно с внесением вируса-индикатора осуществляется контроль взятой дозы вируса на 16 лунках с культурой клеток, предназначенных для этих целей (по 4 лунки на каждое разведение вируса).
Вносят вирус по 100 мкл, начиная с разведения, соответствующего 100 ТЦД50/0,1 мл, и до разведения, соответствующего 0,1 ТЦД50/0,1 мл с коэффициентом разведения равным 10.
Лунки с культурой клеток для оценки состояния монослоя клеток остаются интактными.
После внесения индикаторного вируса культуру клеток инкубируют при температуре (37±1)0С в атмосфере с (5,0+0,5)% СО2 до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 ТЦД50/0,1 мл. Монослой в лунках с 0,1 ТЦД50/0,1 мл индикаторного вируса должен соответствовать состоянию клеток в контрольных лукнах.
Учёт активности интерферона осуществляют при условии, что доза внесённого вируса соответствует 100 ТЦД50/0,1 мл; в лунках с клетками, зараженными индикаторным вирусом, наблюдается практически полный цитопатический эффект (80-100%), а в контрольной культуре клеток отсутствуют признаки дегенерации.
За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50 % лунок полностью защищена от цитопатического действия вируса.
где Dmax – log2 разведения ниже которого произошла 100% защита (-)
d - log2 интервала между разведениями (1,0)
n - число лунок на каждую дозу (4)
р - число лунок, давших защиту (-) в Dmax и последующих разведениях.
Противовирусную активность интерферона в МЕ/мл вычисляют по формуле:
Ах - противовирусная активность интерферона в исследуемом образце в МЕ/мл
Аосо - противовирусную активность СО интерферона в МЕ/мл
ах - титр исследуемого образца
аосо - титр СО в данном опыте
Возможен инструментальный учет результатов с использованием селективного окрашивания живых клеток, защищенных интерфероном от действия вируса, элюирования красителя, фотометрирования оптической плотности элюата и последующей компьютерной обработки результатов. Описание инструментального метода приводят в частных фармакопейных статьях.
Раздел 3. Токсичность
Читайте также:


