Аденовируса крупного рогатого скота
Аденовирусная инфекция крупного рогатого скота (аденовирусная пневмония телят, аденовирусный пневмоэнтерит телят) (adenoviridae infection) — остро протекающее заболевание молодняка сельскохозяйственных животных, характеризующееся поражением органов дыхания, пищеварения, лимфоидной ткани, конъюнктивитами. Крупный рогатый скот часто является носителем латентных аденовирусов, вызывающих бессимптомные инфекции.
Этиология. Возбудителем аденовирусной инфекции является ДНК-геномный вирус, принадлежащий к семейству Adenoviridae, роду Mastadenovirus. Вирусные частицы имеют форму икосаэдра, размер — от 73 до 87 нм, суперкапсида отсутствует. В настоящее время известно 32 типа аденовирусов человека, 25 типов — крупного рогатого скота, 4 типа — овец, по 2 типа аденовирусов собак и мышей, 8 типов кур.
Штаммы аденовирусов крупного рогатого скота 1-го, 2-го и 3-го серотипов имеют общий комплементсвязывающий антиген, отличающийся от антигена типов 4, 5, 6. На основании этих свойств аденовирусы к.р.с. делят на 2 антигенные подгруппы. Аденовирусы первой подгруппы более близки по биологическим свойствам к аденовирусам человека. Отдельные серотипы аденовирусов обладают онкогенными свойствами.
Аденовирусы в зависимости от серотипа вызывают гемагглютинацию эритроцитов белых крыс (1-й и 2-й серотипы), белых мышей (2-й серотип), обезьян.
Эпизоотологические данные. В естественных условиях аденовирусной инфекцией чаще заражаются телята в возрасте от 2-недель до 4-мес., а также поросята, ягнята, цыплята, жеребята, щенята собак, лисиц, песцов. Установлена повышенная чувствительность к аденовирусной инфекции у жеребят арабских пород.
Источником возбудителя инфекции являются больные животные, выделяющие вирус с носовыми истечениями и фекалиями. Заражение происходит аэрогенным и алиментарным путями, через конъюнктиву глаз, при непосредственном контакте. Факторами передачи служат загрязненные выделениями больных животных, корм, вода, воздух, подстилка, инвентарь и др.
У взрослых животных аденовирусная инфекция протекает латентно, сопровождаясь длительным вирусоносительством. У молодняка болезнь проявляется спорадически или в виде энзоотических вспышек. У телят и поросят эта болезнь может перейти в опустошительную эпизоотию с острым течением, массовыми пневмониями, высокой летальностью. Отмечены случаи осложнений аденовирусной инфекции микоплазмами, бактериальной микрофлорой и другими вирусами.
Отмечена взаимосвязь течения аденовирусной инфекции крупного рогатого скота с лейкозом. При обследовании коров из неблагополучных по лейкозу хозяйств установлено, что серопозитивные коровы на 100% инфицированы аденовирусами.
Течение и симптомы. Инкубационный период у телят составляет 3-4 суток. Течение болезни у молодняка острое, в более старшем возрасте возможно и хроническое.
У телят устанавливают повышение температуры до 41,5°С, отказ от корма, вначале серозное, а затем слизисто-гнойное истечение из носа, слезотечение, кашель, затрудненное дыхание и понос.
Особенно тяжело болезнь протекает среди телят 15—20-суточного возраста, у которых выявляют понос с примесью крови и слизи, сильное угнетение, дегидратацию организма, гибель 50—60% больных за 1—3 суток болезни. У телят более старшего возраста отмечают кашель, поносы, истощение, отставание в росте и развитии.
Диагноз на аденовирусную инфекцию ставят комплексно на основании клинико-эпизоотологических данных, патологоанатомических изменений и лабораторных исследований. Лабораторная диагностика на аденовирусную инфекцию включает в себя проведение следующих исследований: выявление специфического антигена из биологического материала с использованием иммуноферментного анализа (ИФА) или иммунофлуоресценции (МФА), выделение вируса на культуре клеток и его идентификация в реакциях нейтрализации (РН) и торможения непрямой гемагглютинации (РТНГА). Сюда же входит реакция связывания комплемента (РСК), иммуноферментный анализ (ИФА), а также ретроспективная диагностика с помощью реакции непрямой гемагглютинации (РНГА), иммуноферментного анализа (ИФА), нейтрализации (РН), связывания комплемента (РСК).
Дифференциальный диагноз. Аденовирусную инфекцию, дифференцируют от инфекционного ринотрахеита, респираторно-синтициальной инфекции, вирусной диареи, парагриппа-3, хламидиоза, пастереллеза.
Лечение. Для лечения используют гипериммунные сыворотки и сыворотки реконвалесцентов, в которых имеются антитела к аденовирусу одновременно с антибактериальными и иммуностимулирующими препаратами. Применяют также симптоматические методы лечения.
Профилактика и меры борьбы. Для специфической профилактики используют инактивированные моновакцины, гипериммунные сыворотки. Для ликвидации заболевания используют общие противоэпизоотические мероприятия – ограничение движения скота, дезинфекция, карантинирование больных животных.
Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).
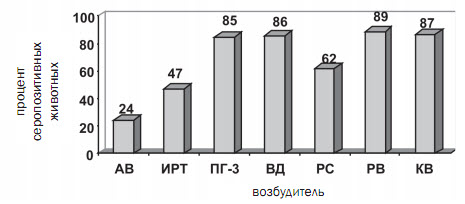
Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных








АДЕНОВИРУСНАЯ ИНФЕКЦИЯ КРУПНОГО РОГАТОГО СКОТА
Возбудитель относится к семейству AdenoviridaeДНК-содержащих вирусов, которое включает аденовирусы человека, животных, в том числе птиц, и состоит из двух родов: Mastadenovirus — аденовирусы млекопитающих и Aviadenovirus — аденовирусы птиц [1].
Вирус впервые был выделен в 1954 г., в США. Впервые аденовирусы у животных, в частности, у свиней выделил и описал в 1950 г. американский ученый Олсен. Аденовирусная инфекция крупного рогатого скота была установлена Клейном в 1959 г. В последующие годы аденовирусная инфекция была установлена у лошадей, овец, птиц. В настоящее время инфекция зарегистрирована во многих странах мира: Италии, Польше, Великобритании, ФРГ, Канаде, Молдове, Беларуси, на Украине.
Инфекцией чаще болеют телята от 2-недельного до 4-месячного возраста. Болезнь регистрируют в зимне-весенние месяцы при комплектовании хозяйств. Аденовирусная инфекция чаще проявляется небольшими вспышками, поражая отдельные группы животных, быстро распространяется на все стадо.
Источник возбудителя инфекции - больные и переболевшие животные, выделяющие вирус с истечениями из носа и фекалиями.Факторы передачи возбудителя - корма, вода, подстилка, предметы ухода, загрязненные выделениями больных животных. Заражение происходит воздушно-капельным и алиментарным путями, а также через конъюнктиву. Заболеваемость телят составляет 50-80 %, летальность - 15-60 % [4].
Инкубационный период длится 4-7 дней. Течение болезни зависит от условий содержания животных. Сначала появляются слезотечение и слизистые носовые истечения, которые в течение 3-5 дней переходят в гнойные. У телят снижается аппетит, учащаются пульс и дыхание, сухой кашель.Со 2-3-х суток заболевания у телят развиваются тимпания и диарея. На 3-4-й день повышается температура тела до 41,5 °С и удерживается до 9 дней. Диарея длится несколько дней. Фекальные массы жидкие, серо-коричневого цвета с примесью кусочков слизистой оболочки, иногда с кровью. Возможны колики. Летальность составляет 40-60 % [2].
Диагноз ставят комплексно с учетом эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований. Биологическая промышленность выпускает набор для диагностики аденовирусной инфекции крупного рогатого скота.
Для лабораторной диагностики используют: РИФ, РСК, РНГА, РТГА, РДП. Также выделяют возбудителя в культуре ткани тестикул бычка, почки эмбриона коровы или легких эмбриона коровы [3].
У переболевших животных иммунитет сохраняется до 5 мес. Иммуногенные животные остаются вирусоносителями, и при различных стрессовых воздействиях и обработке гормональными препаратами становятся источником возбудителя аденовирусной инфекции и могут заболеть повторно смешанной респираторно-кишечной инфекцией.
Лечение аденовирусной инфекции как таковое не разработано. Лечение проводится симптоматически.В основе профилактики болезни лежит соблюдение системы ветеринарно-санитарных мероприятий. С целью повышения устойчивости телят рекомендуется облучать их ультрафиолетовыми лучами в течение 7-10 дней.
Для активной иммунизации молодняка и стельных коров применяют инактивированную и живую бивалентную вакцины против аденовирусной инфекции и парагриппа, а также вакцины в других ассоциациях с антигенами инфекционного ринотрахеита, парагриппа-3, реовирусной и хламидийной инфекций крупного рогатого скота [5].
Библиографический список
1. Иванов, А. И. Инфекционные болезни молодняка сельскохозяйственных животных [Текст]: учеб. пособие / А. И. Иванов. - М-во сел. хоз-ва РФ, Башкирский ГАУ. - Уфа: БашГАУ, 2012. - 234 с.
2. Госманов, Р.Г. Ветеринарная вирусология [Текст]: учебник / Р. Г. Госманов, Н. М. Колычев, В. И. Плешакова - СПб.: Лань, 2010. - 482 с.
3. Петрянкин, Ф.П. Болезни молодняка животных [Текст]: учебное пособие / Ф.П. Петрянкин, О.Ю. Петрова. - СПб.: Лань, 2014. - 352 с.
4. Барышников, П.И. Лабораторная диагностика вирусных болезней животных: учебное пособие / П.И. Барышников, В.В. Разумовская. - СПб.: Лань, 2015. - 672 с.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Строганова И. Я.
В статье представлены результаты изучения распространения аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах Восточной Сибири по данным серологических исследований. Установлена циркуляция аденовирусов среди поголовья крупного рогатого скота и этиологическая роль аденовирусов в возникновении смешенных вирусных респираторных болезней крупного рогатого скота .
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Строганова И. Я.
CATTLE ADENOVIRAL INFECTION DISTRIBUTION ON THE EASTERN SIBERIA CATTLE-BREEDING FARMS
The results of cattle adenoviral infection distribution study on the Eastern Siberia cattle-breeding farms on the serological research data are given in the article. Adenovirus circulation among a number of cattle and their aetiological role in the process of cattle mixed virus respiratory illnesses occurrence is determined.
УДК 619:576.858:57.086.83 И.Я. Строганова
РАСПРОСТРАНЕНИЕ АДЕНОВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА В ЖИВОТНОВОДЧЕСКИХ ХОЗЯЙСТВАХ ВОСТОЧНОЙ СИБИРИ
В статье представлены результаты изучения распространения аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах Восточной Сибири по данным серологических исследований. Установлена циркуляция аденовирусов среди поголовья крупного рогатого скота и этиологическая роль аденовирусов в возникновении смешенных вирусных респираторных болезней крупного рогатого скота.
Ключевые слова: крупный рогатый скот, инфекция, животноводческое хозяйство, Восточная Сибирь.
CATTLE ADENOVIRAL INFECTION DISTRIBUTION ON THE EASTERN SIBERIA CATTLE-BREEDING FARMS
The results of cattle adenoviral infection distribution study on the Eastern Siberia cattle-breeding farms on the serological research data are given in the article. Adenovirus circulation among a number of cattle and their aetiolog-ical role in the process of cattle mixed virus respiratory illnesses occurrence is determined.
Key words: cattle, infection, cattle-breeding farm, Eastern Siberia.
В настоящее время в России отмечается тенденция интенсификации молочного скотоводства. Высокая молочная продуктивность коров часто сопровождается нарушением обмена веществ и другой патологией, что приводит, в частности, к рождению слабого молодняка, подверженного различным болезням, в том числе и вирусным, инфекционному ринотрахеиту крупного рогатого скота (ИРТ), вирусной диареи - болезни слизистых КРС (ВД-БС), респираторно-синцитиальной инфекции КРС (РСИ), парагриппу-3 КРС (ПГ-3) и аденовирусной инфекции (АД), а также каронавирусным инфекциям КРС.
Респираторные болезни молодняка крупного рогатого скота являются одной из причин экономического ущерба в индустрии молочного скотоводства, приводят к падежу или снижению скорости роста больных животных, затратам на лечение, диагностические и профилактические мероприятия.
По данным отечественных исследователей, в целом болезни этой группы в РФ могут приводить к снижению экономической эффективности скотоводства на 20-30 % [1].
Считается, что при интенсивном способе ведения молочного животноводства первопричиной возникновения 90 % пневмоний у телят являются вирусы, которые, вызывая инфекционный процесс в макроорганизме, приводят к иммуносупрессии, последствием которой является осложнение болезни бактериальными агентами и другими микроорганизмами 1. Вирусные болезни КРС регистрируются во многих регионах РФ, в том числе и Сибири.
Одним из многих этиологических агентов респираторных болезней, которые участвуют в возникновении смешенных инфекций вирусной природы, а также вирусно-бактериальной, являются аденовирусы КРС.
Вирус относится к семейству Adenoviridae, роду Mastadenovirus, Bovine adenoviruses A,B,C (1-10) [4].
Несмотря на то что инфекция крупного рогатого скота, вызванная аденовирусами, была описана в 1960 году, их роль в возникновении клинической болезни остается спорной. В настоящее время идентифицировано 10 серотипов вируса. Он выявляется у КРС во всем мире с преобладанием некоторых серотипов в отдельных географических регионах. Хотя эти вирусы были выделены от животных, больных респираторными болезнями, они часто выделялись и от здоровых животных 4.
Результаты некоторых серологических исследований свидетельствуют как о роли аденовирусов в возникновении респираторных болезней, так и об ее отсутствии 9.
Некоторые серотипы способны вызывать болезнь у новорожденных телят, не получивших молозива. В ряде работ приводятся данные о том, что вакцинация животных против аденовирусной инфекции снижает риск возникновения смешенных респираторных болезней у телят 7.
Аденовирусная инфекция КРС у телят может протекать остро и характеризуется поражением органов дыхания, пищеварения и коньюнктивитами. Чаще болеют телята от 2-недельного до 4-месячного возраста. Показано влияние аденовирусов КРС на иммунные механизмы организма животного [10].
Цель исследований. Изучение распространения аденовирусной инфекции крупного рогатого скота в Восточной Сибири.
Материалы и методы исследований. В первом регионе Восточной Сибири анализу были подвергнуты результаты серологических исследований 1564 однократных проб сыворотки крови КРС за 2008-2009 гг.
Во втором регионе Восточной Сибири анализу были подвергнуты результаты исследований 921 пробы парных сывороток крови КРС за 2006-2009 гг.
Сыворотки крови в основном получали от молодняка крупного рогатого скота, реже от взрослых животных из хозяйств молочного направления с различной в них концентрацией животных, чаще с наличием вспышек респираторных болезней крупного рогатого скота или без них, где не проводилась специфическая профилактика против аденовирусной инфекции КРС.
В первом регионе высчитывали процент сывороток крови, содержащих антитела к АД вирусу КРС, проверяли процент серопазитивности животных.
Во втором регионе при исследовании парных сывороток крови учитывали нарастание титра антител к АД вирусу КРС во второй сыворотке по сравнению с первой в четыре и более раз, то есть рассчитывали процент сероконверсии.
Результаты исследований и их обсуждение. В первом регионе Восточной Сибири в 2008 году было исследовано 1366 проб сыворотки крови КРС из 97 хозяйств и 21 района; данные представлены в таблице.
Результаты серологических исследований на аденовирусную инфекцию КРС в хозяйствах первого
региона Восточной Сибири
Показа- тель Район
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Всего
Исследовано проб сыворотки крови 43 140 125 60 23 31 25 81 40 42 60 75 70 74 183 20 108 75 10 60 17 1366
Выявлено положительных к АДВ 27 119 103 56 14 20 21 40 40 38 56 75 53 50 39 0 6 71 10 17 17 872
Выявлено положительных к АДВ КРС, % 62,79 85,00 82,40 93,33 60,86 64,52 84,00 49,38 100 90,48 93,33 100 75,71 67,57 20,86 0 5,56 94,67 100 28,33 100 63,84
Данные таблицы говорят о том, что аденовирусная инфекция КРС имеет широкое распространение в обследуемом регионе. Однако инфицированность животных по районам, а следовательно, по хозяйствам различна.
К аденовирусу КРС выявлены антитела в сыворотки крови, титр которых колебался от 1:2 до 1:256, а количество серопазитивных животных в 5 районах составило от 0 до 49,38 %, в остальных 17 - от 60,86 до 100 %, из них в 4 районах 100 %. Средний уровень серопазитивности по региону составил 63,84 %.
За 2009 г. в регионе было исследовано всего 198 проб сыворотки КРС и средний уровень серопазитивности к АДВ КРС составил 2,20 %.
Во втором регионе Восточной Сибири была исследована за 2006-2009 гг. 921 проба парных сывороток крови КРС из животноводческих хозяйств, в которых в 2006 году сероконверсия к АД-вирусу КРС соста-
вила 70,60 %. При респираторных болезнях телят выявляли смешенное течение вирусных инфекций: РС-АД - в 11,81 %, ВД-РС-АД - в 5,93, ВД- АД - в 5,93, РС-ПГ-3-АД - в 4,34, ИРТ- ВД-РС-АД - в 2,92 %.
В 2007 году сероконверсия к АД вирусу КРС составила 7,14 %. Отмечено смешанное течение вирусных инфекций: вД-РС-АД - в 1,82 %, ВД-аД - в 0,63, ИРТ- РС-АД - в 0,63 %.
В 2008 году сероконверсия к аденовирусу КРС составила 4,53 %. Выявлено смешенное течение вирусных болезней у телят: РС-АД - в 1,32 %, ВД-РС-АД - в 1,32, ПГ-3-АД - в 1,32 %.
В 2009 году уровень сероконверсии к аденовирусу КРС составил 36,43 %. Выявлено смешенное течение инфекций: РС-АД - в 11,52 %, ИрТ-РС-ПГ-3-АД - в 6,64 %.
1. С помощью серологических исследований выявлено наличие антител в сыворотке крови КРС к аденовирусу крупного рогатого скота, что подтверждает циркуляцию этого вируса среди поголовья КРС в животноводческих хозяйствах двух регионах Восточной Сибири.
2. Антитела к аденовирусу КРС выявляли у молодняка крупного рогатого скота, а также и у взрослых животных, что указывает на течение болезней с признаками острого респираторного заболевания и в скрытой форме, то есть на активную циркуляцию вируса в межэпизоотические периоды.
3. Уровень сероконверсии во втором регионе к аденовирусу КРС составил 70,60 и 36,43 %, что говорит о его этиологической роли в возникновении смешенных вирусных респираторных болезней молодняка крупного рогатого скота.
1. Эффективность инактивированной вакцины при факторных респираторных болезнях телят / Ю.А. Костыркин, В.А. Мищенко, В.В. Думова [и др.] // Вет. патология. - 2005. - № 14. - С. 72-75.
3. Крюков Н.Н., Зудилина З.Ф., Евдокимов С.И. Вирусные респираторные болезни крупного рогатого скота // Ветеринария. - 1976. - № 6. - С. 1-113.
4. Инфекционная патология животных / А.Я. Самуйленко, Б.В. Соловьев, Е.А. Непоклонов [и др.]. - М.: Академкнига, 2006. - Т. 1. - 90 с.
5. Pathological and microbiological studies on pneumonic lugs from Danish calves / C. Tegtmeier, A. Uttenthal,
N.F. Friis [et al] // Zentbl. Vet. Med. - 1999. - Vol. 46. - P. 693-700.
6. Вспышка острого респираторного заболевания телят, вызванная респираторно-синцитиальным вирусом и аденовирусом / В.Н. Муравьев, Г.В. Усманова, В.М. Беляев [и др.] // Ветеринария. - 1986. - № 7. - С. 11-13.
7. Нургазиев Р.З. Серодиагностика аденовирусной инфекции крупного рогатого скота // Тез. докл. IX Всесоюз. науч. конф. - М., 1990. - С. 54-55.
8. Нургазиев Р.З. Эпизоотология вирусных пневмоэнтеритов молодняка крупного рогатого скота и их специфическая профилактика: автореф. дис. . д-ра вет. наук. - Бишкек, 1997. - 49 с.
9. Adenovirus infection enhances in vitro ad he rence of streptococcus pneumonia / A. Hakansson, A. Kidd, G. Wadell [et al] // Infect. Immun. - 1994. - Vol. 62. - P. 2707-2714.
10. AdairB.M., McNultiM.S., Foster J.C. Effects of two adenoviruses (type 1 and type 8) on functional properties
of bovine alveolar macrophages in vitro Am // J. Vet. Res. - 1992. - Vol. 53. - P. 1010-1014.
Читайте также:


