Туберкулезный сепсис что это такое
Милиарный туберкулез: как вовремя остановить болезнь
Милиарный туберкулез представляет собой опасную форму туберкулеза, протекающую без ярко выраженной лимфогенной стадии. Туберкулезные бугорки могут образовываться в различных органах. Распространение возбудителя – гематогенное.
Милиарный туберкулез – заболевание с потенциальным летальным исходом, однако при своевременном лечении поддается терапии. Главная опасность данной патологии состоит в том, что милиарный туберкулез сложно диагностировать, клиническая картина этого заболевания обычно размытая.
В МКБ-10 милиарный туберкулез включен под номером А19. Вследствие характерного патогенеза (распространения с кровью и лимфой) милиарный туберкулез считается одной из форм диссеминированного туберкулеза.
Формы милиарного туберкулеза
- Острый милиарный туберкулез:
а) уточненной локализации;
б) неуточненной локализации;
в) множественной локализации.
- Острейший туберкулезный сепсис.
- Милиарный туберкулез неуточненной локализации.
- Обширный острый милиарный туберкулез с локализацией в легких.
- Генерализованный туберкулезный полисерозит.
Наиболее опасной формой милиарного туберкулеза считается острый туберкулезный сепсис. Летальный исход в этом случае возможет через две-три недели после появления первых симптомов.
Кроме того, выделяют хроническую форму милиарного туберкулеза, при которой периоды обострения сменяются ремиссиями.
Патогенез и причины заболевания
Возбудителем милиарного туберкулеза являются бактерии Mycobacterium. В общей сложности насчитывается 74 известных науке вида данных микроорганизмов, однако речь идет преимущественно о человеческом и бычьем видах (оба опасны для человека) – Mycobacterium tuberculosis и Mycobacterium bovis. Микроорганизмы, вызывающие туберкулез, кратко называют аббревиатурой МБТ (микобактерия туберкулеза).
У детей милиарный туберкулез в большинстве случаев является следствием первичного туберкулеза и развивается непосредственно после заражения. У взрослых заболевание может развиться из повторной активации гематогенных отсевов.
Проникновение МБТ в организм обычно происходит воздушно-капельным путем (другие способы заражения возможны, но встречаются реже). В норме дыхательная система имеет защитный механизм, заключающийся в образовании слизи, связывающей микобактерии, и последующем ее выведении. Однако если этот механизм не срабатывает (вследствие воспалительных процессов или воздействия токсичных вещест), бактерии попадают в легкие. Некоторое время МКБ размножаются очень медленно, не вызывая ответной реакции организма. Затем они распространяются по различным тканям и органам вместе с током лимфы и начинают более агрессивное размножение. В пораженных органах образуется множество мелких, размером с зерно проса, туберкулезных бугорков. Очаги со временем могут разрастаться и сливаться.
В случае алиментарного (с пищей), контактного или трансплацентарного заражения легкие могут избежать поражения, однако в таком случае усложняется процесс диагностики, поскольку рентгенография является наиболее простым способом обнаружения милиарного туберкулеза.
Симптомы милиарного туберкулеза
Субъективные симптомы данного заболевания неяркие, без специфических проявлений. Обычно больные жалуются на общее недомогание, слабость, повышение температуры, одышку и кашель. Частым симптомом является также сильное снижение веса без каких-либо видимых причин.
Диагностика милиарного туберкулеза
Выявить болезнь зачастую очень сложно. Из-за сниженной сопротивляемости организма реакция на пробу Манту нередко бывает отрицательной. Рентгенография и лабораторный анализ мокроты тоже не всегда помогают выявить болезнь. В случае подозрения на любую из форм милиарного туберкулеза необходимо тщательное обследование, включающее изучение анамнеза, клинические исследования крови, мочи и мокроты и рентгенографию.
Лечение и прогноз
Прогноз сильно зависит от формы и стадии заболевания. Главный метод лечения – комбинированная антибиотикотерапия (из 4-5 препаратов), которая сопровождается приемом иммуномодулирующих препаратов и специальным режимом (постельным или санаторным, в зависимости от состояния больного). Срок лечения составляет порядка 12 месяцев.
В случае подозрения на тяжелые формы болезни (особенно – на острейший туберкулезный сепсис) целесообразно назначение пробной терапии даже до постановки точного диагноза.
доктор медицинских наук, доцент кафедры инфекционных болезней с курсами эпидемиологии и фтизиатрии медицинского института,
117198, москва, ул. Миклухо-Маклая, д. 6
аместитель главного врача по лечебной работе,
614088, г. Пермь, ул. Свиязева, д. 21
614088, г. Пермь, ул. Свиязева, д. 21
105275, москва, 8 ул. Соколиной горы, д. 15
кандидат медицинских наук, доцент кафедры фтизиопульмонологииб
654005, г. Новокузнецк, пр. Строителей, д. 5
1. Литвинов В. И., Мороз А. М. Лабораторная диагностика туберкулеза. - М.: МНПЦБТ, 2001. - 184 с.
3. Соловьева Н. С., Оттен Т. Ф., Журавлев В. Ю. и др. Бактериологическая и молекулярно-генетическая верификация бактериемии у ВИЧ-инфицированных больных // Клин. микробиология и антимикробная химиотерапия. - 2014. - № 4. - С. 248-253.
4. Чеботкевич В. Н., Кайтанджан Е. И., Бурылев В. В., Щетинкина Е. Е. Современные методы лабораторной диагностики сепсиса // Клин. микробиология и антимикробная химиотерапия. - 2013. - Т. 15. - № 4. - С. 295-300.
5. Черноусова Л. Н., Севастьянова Э. В., Ларионова Е. Е. и др. Федеральные клинические рекомендации по организации и проведению микробиологической и молекулярно-генетической диагностики туберкулеза. - М., 2014. - 36 с.
6. Чучалин А. Г., Синопальников А. И., Козлов Р. С. и др. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых // Consilium medicum. - 2015. - № 3. - С. 8-37.
7. Ahmed N., Mohanty A. K., Mukhopadhyay U. et al. PCR-based rapid detection of Mycobacterium tuberculosis in blood from immunocompetent patients with pulmonary tuberculosis // J. Clin. Microbiol. - 1998. - Vol. 36, № 10. - P. 3094-3095.
8. Archibald L. K., den Dulk M. O., Pallangyo K. J., Reller L. B. Fatal Mycobacterium tuberculosis bloodstream infections in febrile hospitalized adults in Dar es Salaam, Tanzania // Clin. Infect. Dis. - 1998. - Vol. 26, № 2. - P. 290-296.
9. Banada P. P., Koshy R., Alland D. Detection of Mycobacterium tuberculosis in Blood by Use of the Xpert MTB/RIF Assay // J. Clin. Microbiol. - 2013. - Vol. 51, № 7. - P. 2317-2322.
10. Bouza E., Díaz-López M. D., Moreno S. et al. Mycobacterium tuberculosis bacteremia in patients with and without human immunodeficiency virus infection // Arch. Intern. Med. - 1993. - Vol. 22, № 153 (4). - P. 496-500.
11. Chiu Y. S., Wang J. T., Chang S. C. et al. Mycobacterium tuberculosis bacteremia in HIV-negative patients // J. Formos. Med. Assoc. - 2007. - Vol. 106, № 5. - P. 355-364.
12. Clark R. A., Blakley S. L., Greer D. et al. Hematogenous dissemination of Mycobacterium tuberculosis in patients with AIDS // Rev. Infect. Dis. - 1991. - Vol. 13, № 6. - P. 1089-1092.
13. Clough M. C. The cultivation of tubercle bacilli from the circulating blood in miliary tuberculosis // Am. Rev. Tuberc. - 1917. - Vol. 1. - P. 598-621.
14. Crump J. A., Morrissey A. B., Ramadhani H. O. et al. Controlled comparison of BacT/Alert MB system, manual Myco/F lytic procedure, and isolator 10 system for diagnosis of Mycobacterium tuberculosis Bacteremia // J. Clin. Microbiol. - 2011. - Vol. 49, № 8. - P. 3054-3057.
15. Crump J. A., Ramadhani H. O., Morrissey A. B. et al. Bacteremic disseminated tuberculosis in sub-saharan Africa: a prospective cohort study // Clin. Infect. Dis. - 2012. - Vol. 55, № 2. - P. 242-250.
16. Crump J. A., Tanner D. C., Mirrett S. et al. Controlled comparison of BACTEC 13A, MYCO/F LYTIC, BacT/ALERT MB, and ISOLATOR 10 systems for detection of mycobacteremia // J. Clin. Microbiol. - 2003. - Vol. 41, № 5. - P. 1987-1990.
17. Crump J. A., Wu X., Kendall M. A. et al. Predictors and outcomes of Mycobacterium tuberculosis bacteremia among patients with HIV and tuberculosis co-infection enrolled in the ACTG A5221 STRIDE study // BMC Infect. Dis. - 2015. - Vol. 13, № 15. - P. 12.
18. Doucette K., Fishman J. A. Nontuberculous mycobacterial infection in hematopoietic stemcell and solid organ transplant recipients // Clin. Infect. Dis. - 2004. - Vol. 38, № 10. - P. 1428-1439.
19. Drancourt M., Carrieri P., Gevaudan M. J., Raoult D. Blood agar and Mycobacterium tuberculosis: the end of a dogma // J. Clin. Microbiol. - 2003. - Vol. 41, № 4. - P. 1710-1711.
20. Dronda F., Chaves F., González López A. et al. Bacteremia due to Mycobacterium tuberculosis in patients coinfected with the human immunodeficiency virus // Med. Clin. (Barc.). - 1993 - Vol. 101, № 14. - P. 534-537.
21. El Sahly H. M., Teeter L. D., James M. M., Graviss E. A. Mycobacterium tuberculosis bacteraemia: experience from a non-endemic urban center // Clin. Microbiol. Infect. - 2014 - Vol. 20, № 3. - P. 263-268.
22. Eng R. H., Bishburg E., Smith S. M., Mangia A. Diagnosis of Mycobacterium bacteremia in patients with acquired immunodeficiency syndrome by direct examination of blood films // J. Clin. Microbiol. - 1989. - Vol. 27, № 4. - P. 768-769.
23. Esteban J., Fernández-Roblas R., Cabria F., Soriano F. Usefulness of the BACTEC MYCO/F lytic system for detection of mycobacteremia in a clinical microbiology laboratory // J. Microbiol. Methods. - 2000. - Vol. 40, № 1. - P. 63-66.
24. Falkinham J. O. Epidemiology of infection by nontuberculous mycobacteria // Clin.Microbiol. Rev. - 1996. - Vol. 9, № 2. - P. 177-215.
25. Feasey N. A., Banada P. P., Howson W. et al. Evaluation of xpert MTB/RIF for detection of tuberculosis from blood samples of HIV-infected adults confirms Mycobacterium tuberculosis bacteremia as an indicator of poor prognosis // J. Clin. Microbiol. - 2013. - Vol. 51, № 7. - P. 2311-2316.
26. Folgueira L., Delgado R., Palenque E. et al. Rapid diagnosis of Mycobacterium tuberculosis bacteremia by PCR // J. Clin. Microbiol. - 1996. - Vol. 34, № 3. - P. 512-515.
27. Gopinath K., Kumar S., Singh S. Prevalence of mycobacteremia in Indian HIV-infected patients detected by the MB/BacT automated culture system // Eur. J. Clin. Microbiol. Infect. Dis. - 2008. - Vol. 27, № 6. - P. 423-431.
28. Gray K. D., Cunningham C. K., Clifton D. C. et al. Prevalence of mycobacteremia among HIV-infected infants and children in northern Tanzania // Pediatr. Infect. Dis. J. - 2013. - Vol. 32, № 7. - P. 754-756.
29. Griffith D. E. et al. An Official ATS/IDSA Statement: Diagnosis, treatment and prevention of nontuberculous mycobacterial diseases // Am. J. Respir.Crit. Care Med. - 2007. - Vol. 175. - P. 367-416.
30. Grinsztejn B., Fandinho F. C., Veloso V. G. et al. Mycobacteremia in patients with the acquired immunodeficiency syndrome // Arch. Intern. Med. - 1997. - Vol. 157, № 20. - Р. 2359-2363.
32. Hadad D. J., Pignatari A. C., Machado M. A., Telles M. A. Mycobacterium tuberculosis bacteremia diagnosed in an HIV-negative patient in Brazil: a rare or an under-reported event? // Braz. J. Infect. Dis. - 2004. - Vol. 8, № 2. - P. 184-185.
33. Hanscheid T., Monteiro C., Melo Cristino J. et al. Growth of Mycobacterium tuberculosis in Conventional BacT/ALERT FA Blood Culture Bottles Allows Reliable Diagnosis of Mycobacteremia // J. Clin. Microbiol. - 2005 - Vol. 43, № 2. - P. 890-891.
34. Hänscheid T., Monteiro C., Marques-Lito L. et al. Usefulness of Myco/F Lytic bloodcultures (Bactec 9050) in the detection of Mycobacterium tuberculosis bacteraemia in HIV-infected patients in Portugal // Int. J. Infect. Dis. - 2004. - Vol. 8, № 4. - P. 253-254.
35. Heysell S. K., Thomas T. A., Gandhi N. R. et al. Blood cultures for the diagnosis of multidrug-resistant and extensively drug-resistant tuberculosis among HIV-infected patients from rural South Africa: across-sectional study // BMC Infect. Dis. - 2010. - Vol. 6, № 10. - P. 344.
36. Jacob S. T., Pavlinac P. B., Nakiyingi L. et al. Mycobacterium tuberculosis bacteremia in a cohort of hiv-infected patients hospitalized with severe sepsis in Uganda - high frequency, low clinical suspicion [corrected] and derivation of a clinical prediction score // PLoSOne. - 2013. - Vol. 8, № 8. - P. 10.
37. Lima J. F., Montenegro L. M., de Albuquerque Montenegro R. et al. Performance of nested PCR in the specific detection of Mycobacterium tuberculosis complex in blood samples of pediatric patients // J. Bras. Pneumol. - 2009. - Vol. 35, № 7. - P. 690-697.
38. McDonald L. C., Archibald L. K., Rheanpumikankit S. et al. Unrecognised Mycobacterium tuberculosis bacteraemia among hospital inpatients in less developed countries // Lancet. - 1999 - Vol. 354, № 9185. - P. 1159-1163.
39. Monkongdee P., McCarthy K. D., Cain K. P. et al. Yield of acid-fast smear and mycobacterial culture for tuberculosis diagnosis in people with HIV // Am. J. Respir. Crit. Care Med. - 2009. - Vol. 180, № 9. - P. 903-908.
40. Motyl M. R., Saltzman B., Levi M. H. et al. The recovery of Mycobacterium avium complex and Mycobacterium tuberculosis from blood specimens of AIDS patients using the nonradiometric Bactec NR 660 medium // Am. J. Clin. Pathol. - 1990. - Vol. 94, № 1. - P. 84-86.
41. Nakatani S. M., Messias-Reason I. J., Burger M., Cunha C. A. Prevalence of Mycobacterium avium and Mycobacterium tuberculosis in blood cultures of Brazilian AIDS patients after introduction of highly active retroviral therapy // Braz. J. Infect. Dis. - 2005. - Vol. 9, № 6. - P. 459-463.
42. Nakiyingi L., Ssengooba W., Nakanjako D. et al. Predictors and outcomes of mycobacteremia among HIV-infected smear-negative presumptive tuberculosis patients in Uganda // BMC Infect. Dis. - 2015. - Vol. 15, № 15. - P. 62.
43. Negre L., Bretey J. Role of Mycobacterium tuberculosis not completely developed in experimental tuberculous bactaremia in laboratory animals // CR Hebd. Seances. Acad. Sci. - 1954. - Vol. 238, № 1. - P. 171-172.
44. Pacios E., Alcalá L., Ruiz-Serrano M. J. et al. Evaluation of bone marrow and blood cultures for the recovery of mycobacteria in the diagnosis of disseminated mycobacterial infections // Clin. Microbiol. Infect. - 2004. - Vol. 10, № 8. - P. 734-737.
45. Pavlinac P. B., Naulikha J. M., John-Stewart G. C. et al. Mycobacterium tuberculosis bacteremia among acutely febrile children in Western Kenya // Am. J. Trop. Med. Hyg. - 2015. - Vol. 93, № 5. - P. 1087-1091.
46. Rebollo M. J., San Juan Garrido R., Folgueira D. et al. Blood and urine samples as useful sources for the direct detection of tuberculosis by polymerase chain reaction // Diagn. Microbiol. Infect. Dis. - 2006 - Vol. 56, № 2. - P. 141-146.
47. Richter C., Kox L. F., Van Leeuwen J. V. et al. PCR detection of mycobacteraemia in tanzanian patients with extrapulmonary tuberculosis // Eur. J. Clin. Microbiol. Infect. Dis. - 1996. - Vol. 15, № 10. - P. 813-817.
48. Shafer R. W., Goldberg R., Sierra M., Glatt A. E. Frequency of Mycobacterium tuberculosis bacteremia in patients with tuberculosis in an area endemic for AIDS // Am. Rev. Respir. Dis. - 1989. - Vol. 140, № 6. - P. 1611-1613.
49. Siddiqi S. H., Rusch-Gerdes S. MGIT Procedure Manual. Maryland, 2006. - 89 p.
50. Taci N., Yurdakul A. S., Ceyhan I. et al. Detection of Mycobacterium tuberculosis DNA from peripheral blood in patients with HIV-seronegative and new cases of smear-positive pulmonary tuberculosis by polymerase chain reaction // Respir. Med. - 2003. - Vol. 97, № 6. - P. 676-681.
51. Varma J. K., Kimberly D., McCarthy et al. Bloodstream infections among HIV-infected outpatients, Southeast Asia // Emerg. Infect. Dis. - 2010. - Vol. 16, № 10. - P. 1569-1575.
52. von Gottberg A., Sacks L., Machala S., Blumberg L. Utility of blood cultures and incidence of mycobacteremia in patients with suspected tuberculosis in a South African infectious disease referral hospital // Int. J. Tuberc. Lung. Dis. - 2001. - Vol. 5, № 1. - P. 80-86.
53. WHO. Xpert MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary TB in adults and children WHO Policy update. France, 2014. - 97 p.
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Больной Б., 32 года, житель г. Москвы, образование среднее, не работает, поступил в ТКБ № 7 г. Москвы 26.02.09г. с жалобами на повышение температуры тела до 39ºС, общую слабость, опухолевидное образование и боль в правой половине шеи, жидкий стул до 3-5 раз в сутки.
Из анамнеза заболевания выяснено, что ВИЧ-инфекция у пациента выявлена в 1999 г. Путь заражения – употребление внутривенных психоактивных веществ в период с 1994—1999гг., в дальнейшем – ремиссия. На учете в Центре по профилактике и борьбе со СПИДом состоит, но наблюдался и обследовался нерегулярно, АРВТ не получал. Из хронических заболеваний – хронический вирусный гепатит С.
Заболел месяц назад подостро. Появились температура, сначала субфебрильная, затем фебрильная с ознобами, болезненное образование в области шеи, стал терять в весе (на 9 кг за 1 месяц), госпитализирован в инфекционную клиническую больницу №2 г. Москвы, где был заподозрена туберкулезнаяаденофлегмона шеи, и 26.02.09 г., после консультации фтизиатра, больной был переведен в ТКБ №7 г. Москвы.
При поступлении в ТКБ №7 данные объективного обследования: общее состояние тяжелое за счет симптомов интоксикации, истощен. Кожные покровы бледные, на передней поверхности шеи справа имеется образование 4 х 5 см в диаметре, флюктуирующее в центре, без гиперимии кожи, вероятно обусловленное конгломератом увеличенных лимфатических узлов передне-шейной группы. Периферических отеков нет, температура тела – 38,6° С. На слизистой оболочке щек и языка имеются серые, легко смещаемые бляшки. Грудная клетка правильной формы. Обе половины равномерно участвуют в акте дыхания. При перкуссии над легкими обнаруживается легочной звук, при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхательных движений 26 в мин. Тоны сердца ясные, громкие, ритмичные. АД 100/70 мм.рт.ст., ЧСС 115 в мин. Живот мягкий, безболезненный во всех отделах. Печень увеличена на 2 см, селезенка не пальпируется.
Результаты обследования: в общем анализе крови Hb 80г/л, эр. 2,9•10¹², л. 9,4•10⁹, СОЭ — 35 мм/ч. В трех образцах мокроты МБТ методом люминесцентной микроскопии и посева не обнаружены. На обзорной рентгенограмме ОГК от 26.02.09г. – легочной рисунок усилен, левый корень неструктурен (рис. 1).

Рис. 1. Обзорная рентгенограмма больного Б., 32 года в начале заболевания.
Иммунологический статус от 21.02.09 г. (в КИБ №2): количество СD4-лимфоцитов 65 клеток/мкл (5%), СD8-лимфоцитов 810 клеток/мкл (64%), соотношение СD4/ СD8 = 0,08.
27.02.10 г. выполнено вскрытие и дренирование абсцесса правой половины шеи, выделилось 15 мл гнойного содержимого без запаха, рана промыта, рыхло тампонирована турундой с левосином.
В содержимом абсцесса шеи методом люминесцентной микроскопии обнаружены КУМ (3+), методом посева МБТ обнаружены 2+, культура чувствительная ко всем АБП, роста неспецифической микрофлоры не получено.
При сопоставлении клинико-лучевой картины и данных лабораторного обследования выставлен диагноз: ВИЧ-инфекция, стадия 4В, фаза прогрессирования при отсутствии АРВТ. Туберкулез внутригрудных лимфатических узлов слева (малый бронхоаденит). Туберкулез периферических лимфатических узлов шеи, абсцедирующая форма. Кандидозный стоматит. Токсическая анемия средней степени тяжести. Кахексия.
Больному назначена интенсивная фаза противотуберкулезной терапии по 1 режиму (рифампицин, изониазид, пиразинамид, этамбутол). К лечению добавлен триметоприм-сульфометоксазол (ТМП-СМЗ) в профилактической дозе по 960 мг через день.
На фоне проводимого лечения рана на шеи очистилась и практически зажила, но общее состояние больного прогрессивно ухудшалось, нарастала одышка и в результате легочно-сердечной недостаточности 16.03.09 г. на 18-й день госпитализации наступила смерть.
Посмертный клинический диагноз:
Основное заболевание: ВИЧ-инфекция, стадия 4В, фаза прогрессирования при отсутствии АРВТ. Туберкулез внутригрудных лимфатических узлов слева (малый бронхоаденит). Туберкулез периферических лимфатических узлов шеи. Вскрытие и дренирование специфического абсцедирующеголимфоаденита правой половины шеи от 27.02.09г. Кандидозный стоматит.
Осложнения: кахексия, токсическая анемия, легочно-сердечная недостаточность.
Сопутствующее заболевание: хронический вирусный гепатит С.
Основное заболевание: ВИЧ-инфекция стадия 4В, иммунный блот №, дата.
Вторичные заболевания: Генерализованный туберкулез в фазе прогрессирования с поражением шейных, внутригрудных, парааортальных лимфатических узлов (казеозный лимфаденит), милиарный туберкулез легких, печени, селезенки (посмертно гистобактериоскопически с окраской по Цилю-Нильсену выявлены кислотоустойчивые бактерии). Кандидозный эзофагит.
Осложнения: отек легких, отек головного мозг, кахексия.
Сопутствующее заболевание: хронический вирусный гепатит С.

Дата публикации: 01.03.2017 2017-03-01
Статья просмотрена: 1609 раз
Генерализованный туберкулез характеризуется гематогенным рассеиванием микобактерий туберкулеза (МБТ) в организме и образованием туберкулезных бугорков преимущественно в легких, серозных оболочках, лимфатических узлах и т. д. Процесс обусловлен распространением значительного числа микобактерий с током крови на фоне ослабления защитных сил организма. Возникающий при этом гематогенно-диссеминированный процесс имеет характер острейшего или тяжелейшего туберкулезного сепсиса, что не редко ведет к летальному исходу.
Такая форма туберкулеза требует немедленного начала комплексного лечения, с включением как этиотропных, так и симптоматических препаратов. К сожалению, не всегда удаётся обнаружить МБТ в биологическом материале для установления чувствительности к ПТП. Учитывая, что микобактерии медленно размножаются данные о результатах ТЛЧ приходиться ждать определенное время (в среднем от 4 до 8 недель).
Ниже приводим клиническое наблюдение. Пациент Х., 1978 г.р. (37 лет), поступил с жалобами на повышение температуры тела до 40°С, головные боли, двоение в глазах, онемение левой половины тела, сухой кашель, одышку в покое, сердцебиение, боли в животе, резкую слабость.
Из анамнеза выяснено, что больной в детстве перенес туберкулез. Ухудшение состояния отмечает с октября 2013 года. Заболевание началось с повышения температуры тела, болей в грудной клетке, сухого кашля, слабости. В это время больной находился в Казахстане, работал на стройке разнорабочим. Проживал в комнате с неудовлетворительными условиями, где еще находились 15 человек. В начале февраля 2014 г. состояние больного резко ухудшилось: появились боли при глотании, двоение в глазах, участилось сердцебиение, поднялась температура тела до 39°С. Больной самотеком обратился в сельский врачебный пункт, где была сделана рентгенография грудной клетки, заподозрен специфический процесс в легких. После дообследования больной был госпитализирован в терапевтическое отделение РСНПМЦФиП.
При осмотре: общее состояние больного тяжелое. Дыхание свободное, частота дыхания 24-26 в минуту. Над легкими перкуторнолегочной звук, аускультативно – везикулярное дыхание. Тоны сердца приглушены, ритмичные. АД 110/70 мм рт.ст., пульс 100 ударов в минуту, умеренного наполнения и напряжения. Язык обложен беловатым налетом, влажный. Живот обычной формы, мягкий, безболезненный при пальпации. Печень у края реберной дуги. Стул и диурез без патологии.
Нервная система: В сознании, больной ориентирован во времени и пространстве, на вопросы отвечает по существу. Менингеальные симптомы: отмечается ригидность затылочных мышц, симптом Кернинга положительный, брюшные рефлексы вяло положительные, повышены периферические рефлексы конечностей слева. Диплопия.
На обзорной рентгенограмме органов грудной клеткиот 17.02.14 г.: с обеих сторон тотально симметрично по всем легочным полям определяются однотипные множественные мелкие очаговые тени (просовидные), средней интенсивности, с довольно четкими контурами. Корни легких усилены, плотнены, мало структурные. Синусы свободные, сердце и аорта в пределах нормы (рисунок 1).
В анализах мокроты и ликвора микроскопически, с помощью молекулярно-генетического метода GeneXpertMBT/RIF не были выявлены МБТ. Биологические материалы были посеяны на твердые и жидкие питательные среды.
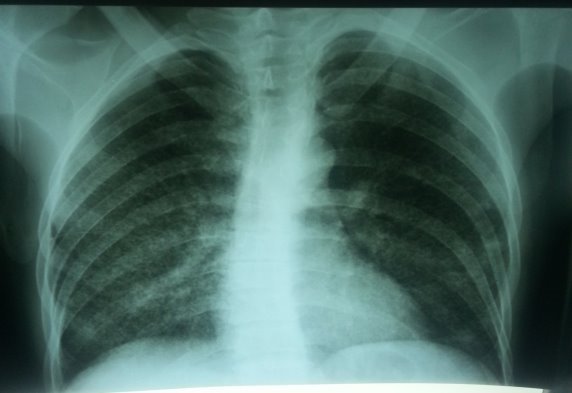
Рис. 1. Обзорная рентгенограмма больного при поступлении
В анализе ликвора –реакция Панди++, белок 0.165‰, лимфоциты 40%, нейтрофилы 60%, выпала фибриновая пленка. В общем анализе крови при поступлении: гемоглобин 92 г/л, эритроциты 3,0х10 12 /л, лейкоциты 4,5 тыс., п/я 2%, с/я 63%, лимфоциты 22%, моноциты 8%, эозинофилы 1%, СОЭ 30 мм/ч. В общем анализе мочи: белок 0,033‰, лейкоциты 2-3/1, эпителий единичный, эритроциты 1-2/1, кристаллы мочевой кислоты++. Биохимические показатели крови: АЛТ 0.43 ммоль/л, АСТ 0.36 ммоль/л, общий билирубин 12,6 ммоль/л, сахар 3,9 ммоль/л, мочевина 8,0 ммоль/л, креатинин 114 мкмоль/л. Анализ крови RW и ВИЧ: отрицательный. Больной был консультирован специалистами – невропатологом и специалистом по лечению туберкулезных менингитов.
На основании вышеперечисленных клинико-лабораторных данных был выставлен диагноз: Генерализованный туберкулез: Милиарный туберкулез обоих легких в фазе инфильтрации БК-. Туберкулезный менингит БК-. Туберкулома правого полушария. Соп.: Хроническая язвенная болезнь желудка и 12-перстной кишки, в стадии неполной ремиссии. Посттравматическая энцефалопатия, внутричерепная гипертензия. Астенизация ЦНС. Неврит нерва голени и бедра слева. Псевдоинсульт. Осл.: ЛСН II ст. Кахексия. Левосторонний гемисиндром.
Учитывая впервые выявленный процесс, больному была начата терапия по DOTSI категории в виде четырехкомпонентных препаратов (H75R150Z400E275) на фоне симптоматической и патогенетической терапии. После двух месяцев непрерывного приема препаратов по I категории DOTS, у больного отмечалась отрицательная рентгенологическая динамика в виде прогрессирования процесса (рисунок 2), а также сохранялись жалобы (головные боли, повышение температуры тела до 38-39 градусов, онемение левой конечности, больной прогрессивно худел). По решению лечебного консилиума больной был переведен на лечение по DOTS+ программе.
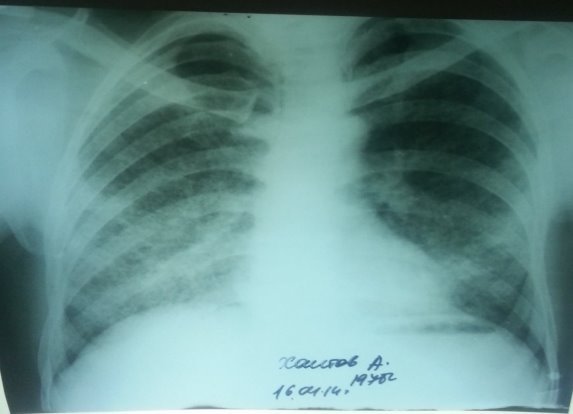
Рис. 2. Обзорная рентгенограмма больного в динамике через два месяца на фоне лечения препаратами 1 ряда
Больному были назначены Левофлоксацин 0.75 + Протионамид 0.75 + Канамицин 1.0 + ПАСК 8.0 + Пиразинамид 2.0 + Этамбутол 1.2.
На фоне обновленного лечения состояние больного уже через 10 дней стало улучшаться: стала снижаться температура, улучшился аппетит, уменьшились головные боли. Через 2 месяца состояние стало удовлетворительным, менингиальные симптомы исчезли, головные боли купировались, онемение левой конечности значительно уменьшилось, больной прибавил в весе 8 кг, рентгенологически отмечается значительная положительная динамика в виде рассасывания и уменьшения в количестве очагов диссеминации (рисунок 3).
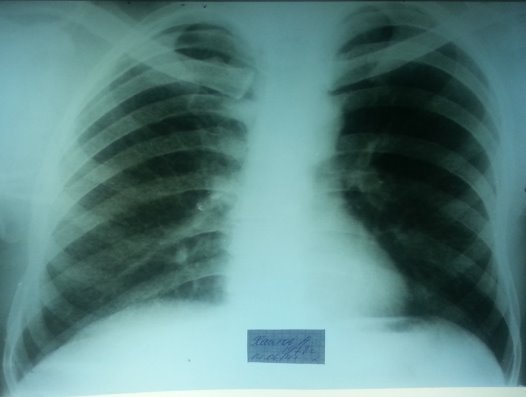
Рис. 3. Обзорная рентгенограмма больного в динамике через четыре месяца на фоне лечения препаратами 2 ряда
Через 6 и 13 месяцев после начала лечения препаратами второго ряда рентгенологически у больного отмечается полное рассасывание очагов диссеминации (рисунок 4, 5).
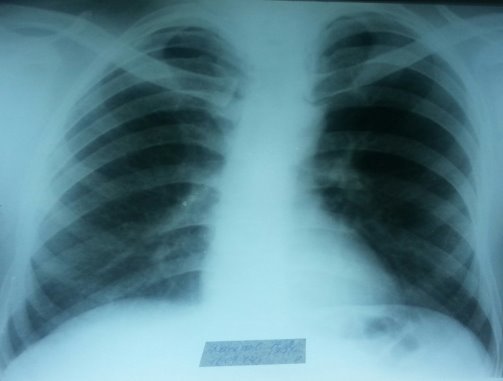
Рис. 4. Обзорная рентгенограмма больного в динамике через шесть месяцев на фоне лечения препаратами 2 ряда
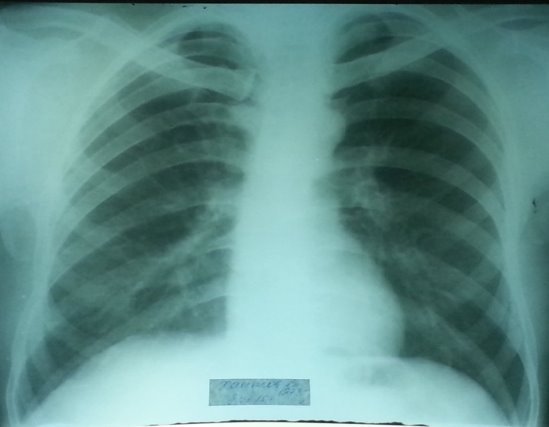
Рис. 5. Обзорная рентгенограмма больного в динамике через тринадцать месяцев на фоне лечения препаратами 2 ряда
Таким образом, представленный клинический пример показывает, что лечение больных генерализованным туберкулезом является трудной задачей, особенно при отсутствии МБТ в мокроте и ликворе, что не дало возможности определить чувствительность к противотуберкулезным препаратам в начале лечения из-за чего больной в течение двух месяцев получал не адекватную терапию, которая способствовала прогрессированию туберкулезного процесса. Кроме того, сопутствующие заболевания, также создавали трудности в лечении данного больного. Однако, удалось достичь успеха в лечении больного, благодаря своевременному назначению препаратов второго ряда на основании отрицательного клинико-рентгенологического течения заболевания, не дожидаясь результатов ТЛЧ культуры. Использование различных методов патогенетической и симптоматической терапии позволило улучшить общее состояние пациента. Совместная работа фтизиатров и невропатолога привела к положительному клиническому результату у больного с тяжелой сопутствующей патологией.
Туберкулез является одним из самых старых вирусных заболеваний и до сих пор — одним из самых опасных. До трети населения планеты инфицировано этим вирусом, ежедневно от него погибают до 5 тыс. человек в мире. Что нам сегодня известно о туберкулезе, какие меры предпринимаются для его ликвидации, нужно ли отказываться от вакцинации? Обо всем этом от экспертов Якутской городской больницы № 3.
Туберкулез – один из древнейших недугов
Туберкулез — глобальная проблема
Заболеваемость туберкулезом в районе обслуживания ЯГБ № 3
2012 год — 109,6 на 100 000 населения
2013 год — 96,9 на 100 000 населения
2014 год — 94,1 на 100 000 населения
2015 год — 83,6 на 100 000 населения
По данным ВОЗ сегодня туберкулез является главным инфекционным убийцей в мире, уносящим около 5 тыс. жизней ежедневно. В 2016 году заболело 10,4 млн человек. Хотя с 2000 года заболеваемость и смертность снижаются и удалось спасти 53 млн жизней благодаря существующим методам диагностики и лечения, бремя туберкулеза по-прежнему огромное.
Туберкулез встречается во всех частях света. В 2016 году наибольшее число случаев заболевания имело место в Азии (45% новых случаев), за ней следовала Африка с 25%.
По данным ВОЗ в 2016 году 87% пришлось на 30 стран с наибольшей заболеваемостью, а 64% всех новых случаев выявлено в семи странах: Индии, Индонезии, Китае, Филиппинах, Пакистане, Нигерии и Южной Африке.
Кроме того, тревогу вызывает устойчивость к противотуберкулезным лекарственным препаратам, ежегодно у 600 тыс. человек обнаруживаются формы туберкулеза, требующие длительного лечения более токсичными и дорогими препаратами.
Туберкулез – факторы риска
Заразиться может любой, ведь туберкулез передается воздушно-капельным путем
В основном туберкулез поражает взрослых в наиболее продуктивном возрасте. Однако риску подвержены все возрастные группы. У людей, инфицированных ВИЧ, риск развития активного туберкулеза в 20–30 раз выше, — отмечает Туйара Дьячковская, — также он выше у людей с ослабленной по другим причинам иммунной системой, среди которых недостаточное питание, курение, диабет, злоупотребление алкоголем и т.д. На развитие болезни влияют такие факторы, как бедность, проживание в скученных условиях, условия труда (например, работа в шахтах, оленеводческих стойбищах). Большое количество инфицированных может наблюдаться в тюрьмах. Но на самом деле заразиться может любой, ведь туберкулез передается воздушно-капельным путем, — подчеркивает завотделением.
Детский туберкулез
По данным ВОЗ на туберкулез у детей приходится около 11% всех случаев
Заболеваемость туберкулезом у детского населения в районе обслуживания ЯГБ № 3
2015 год — 15,1 на 100 000 населения
2012 год — 123,0 на 100000
2013 год — 79,9 на 100000
2014 год — 42,3 на 100 000 населения
2015 год — 83,4 на 100 000 населения
2016 год — 79,7 на 100 000 населения
Симптомы и диагностирование
Туяра Дьячковская:
«Общими симптомами активного легочного туберкулеза являются кашель иногда с мокротой и кровью, боль в груди, слабость, потеря веса, лихорадка и ночной пот.
Лечение
По оценкам экспертов, 53 миллионов человеческих жизней было спасено с 2000 по 2016 год благодаря диагностике и лечению туберкулеза.
Профилактика туберкулеза
Заместитель главного врача по лечебной работе Анна Парфенова: «В последние годы в районе обслуживания Якутской городской больницы №3 отмечается улучшение ситуации по туберкулезу. В 2016 году снизился на 20,1% в сравнении с показателями 2012 г. Показатель заболеваемости бациллярными формами туберкулеза снизился в 1,7 раз. 59,1% всех вновь выявленных больных являются бактериовыделителями.
Показатель общей смертности от всех причин в 2016г. составил 7,1 на 1000 населения. Доля умерших от туберкулеза среди всех случаев смерти составляет 0,8%. Однако это не уменьшает проблему туберкулеза. Среди всех умерших в 2016г. в стационаре от инфекционных и паразитарных болезней доля больных, смерть которых наступила от туберкулеза, составила 23,5%. Летальность от туберкулеза в течение первого года наблюдения – 1 случай.
Улучшить ситуацию по туберкулезу и, в первую очередь, снизить смертность от этого заболевания возможно, если своевременно выявить туберкулез, так как своевременно выявленный туберкулез — излечим. Наша задача — охватить как можно больше населения профилактическими флюорографическими осмотрами, привлекать к обследованию лиц, не обследованных на туберкулез 2 и более года. Но и в лечении туберкулеза существуют трудности: увеличивается число лекарственно устойчивых форм туберкулеза, при которых требуется проведение длительной химиотерапии.
Читайте также:


