Толщина кожной складки у коров при туберкулезе
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
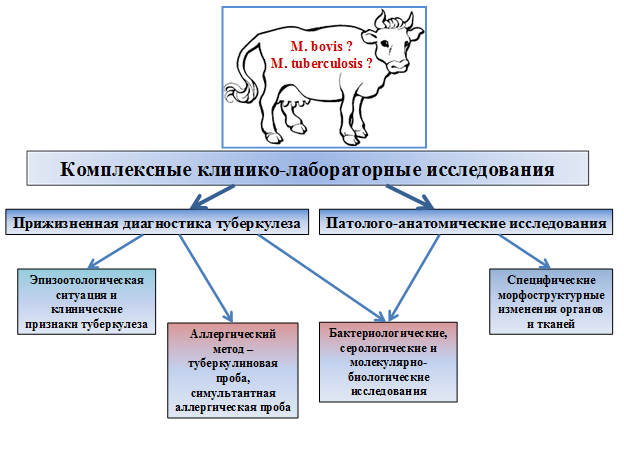
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
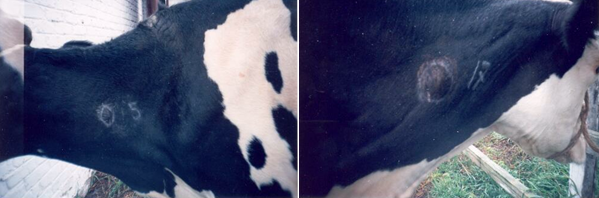
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
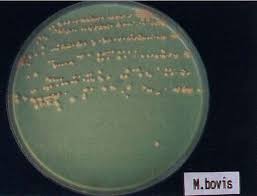
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
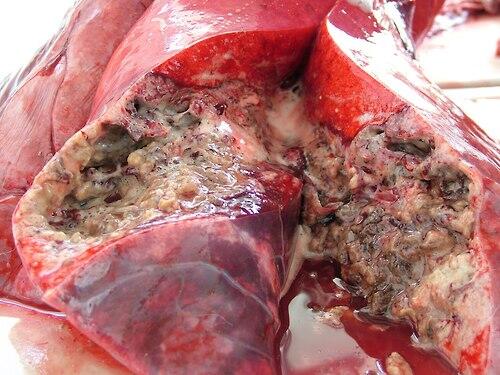
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
Нина Гавриловна Толстенко, к.в.н., ведущий научный сотрудник
Елена Петровна Вангели, к.б.н., ведущий научный сотрудник
Виктор Михайлович Калмыков, к.в.н., старший научный сотрудник
ФГБНУ Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я.Р. Коваленко
Представлены результаты изучения диагностической ценности однократной и двукратной внутрикожной туберкулиновой пробы на экспериментально сенсибилизированных и зараженных различными видами микобактерий телятах, на КРС из благополучных хозяйств и из благополучных хозяйств, где выявляются животные с неспецифическими реакциями на туберкулин, а также из неблагополучных по туберкулёзу хозяйств, где проводятся оздоровительные мероприятия различными методами.
Следует отметить, что в настоящее время двукратная проба нигде не применяется. Во всех странах применяют однократную внутрикожную пробу, и этот вопрос не обсуждается и ни у кого не вызывает сомнений.
Вопрос о диагностической ценности двукратной внутрикожной туберкулиновой пробы остается дискуссионным. Так, одни авторы считают, что применение двукратной пробы в неблагополучных хозяйствах выявляет реагирующих на туберкулин больных животных [1, 2, 3, 10, 11, 12, 13, 14, 15].
Другие считают, что при применении двукратной пробы в неблагополучных хозяйствах выявляются в массовом количестве реагирующие животные с неспецифическими реакциями на туберкулин [4, 5, 6, 7, 8, 9, 16, 17, 18, 19, 20].
В связи с указанным, необходимо напомнить, что оздоровительные мероприятия и методы диагностики должны применяться в соответствии с эпизоотической ситуацией по проблеме. Анализ эпизоотической ситуации по туберкулёзу крупного рогатого скота показывает, что на 01.01.2017 г. в РФ остаются шесть неблагополучных пунктов.
Проведенный анализ также выявляет, что в последние годы, по мере сокращения количества неблагополучных пунктов и количества заболевших туберкулёзом животных, увеличивается выявление неспецифических реакций в благополучных хозяйствах. Так, за 2001–2016 гг., то есть за последние 16 лет, было выявлено всего реагирующих – 808 139 животных, из них в благополучных хозяйствах – 734 124, или 90,7%, а в неблагополучных хозяйствах – 75 015 (9,3%). То есть, в благополучных хозяйствах выявляется более 90% реагирующих животных.
Кроме того, в последние годы всё чаще регистрируются случаи выявления неспецифических реакций в неблагополучных, оздоравливаемых от туберкулёза хозяйствах, то есть увеличивается проявление так называемой смешанной микобактериальной инфекции, особенно на заключительном этапе оздоровительных мероприятий.
В соответствии с санитарными и ветеринарными правилами оздоровление неблагополучных по туберкулёзу хозяйств проводится двумя методами: методом полной замены неблагополучного стада здоровыми животными и методом систематических диагностических исследований с выделением и убоем больных животных.
В ветеринарной практике нашей страны наиболее широко применяется оздоровление методом систематических исследований и убоем реагирующих на туберкулин животных. Реагирующих считают больными и сдают на убой. Аллергические исследования и убой всех реагирующих особей проводят до получения двух подряд отрицательных результатов аллергических исследований по всему стаду.
При этом совершенно не учитывается возможность наличия в неблагополучных хозяйствах так называемой смешанной микобактериальной инфекции (М. bovis, M. tuberculosis и различные виды нетуберкулёзных микобактерий). Известно, что неспецифические реакции, вызываемые атипичными микобактериями, в отличие от реакций, вызываемых микобактериями туберкулёза, в основном проявляются незначительным увеличением толщины кожной складки (на 3–5 мм) и являются нестабильными, т.е. у одних животных эти реакции выявляются, затем исчезают, но появляются у других. Поэтому от этих реакций невозможно избавиться методом убоя реагирующих особей. В практических условиях, при наличии в неблагополучных стадах животных с неспецифическими реакциями на туберкулин, можно годами исследовать на туберкулёз, перебить стадо и не получить отрицательного результата аллергических исследований (при применении двойной внутрикожной пробы, учёте реакции с 3 мм и учёте через 24 часа после повторного введения туберкулина).
В связи с указанным, целью нашей работы было представить результаты наших исследований по совершенствованию диагностики и оздоровительных мероприятий в неблагополучных по туберкулёзу хозяйствах Российской Федерации.
Материалы и методы
Исследования провели на 72 экспериментально сенсибилизированных различными видами микобактерий телятах (11 – M. bovis, 3 – M. tuberculosis, 12 – M. avium, 20 – M. fortuitum, 6 – M. intracellularae, 12 – M. paratuberculosis, 8 – контрольная группа), на 56 искусственно зараженных M. bovis телятах, на 1639 головах крупного рогатого скота в трёх благополучных по туберкулёзу хозяйствах, на 2142 коровах в трёх благополучных по туберкулёзу хозяйствах, где установлена сенсибилизация животных атипичными микобактериями и микобактериями птичьего вида, на 6403 головах КРС в семи неблагополучных хозяйствах с различной эпизоотической ситуацией по туберкулёзу.
В неблагополучных по туберкулёзу хозяйствах, с целью выяснения диагностической ценности повторного введения туберкулина, провели убой реагирующих на однократное и двукратное введение туберкулина и нереагирующих на двукратное введение туберкулина животных. Биоматериал от убитых особей исследовали на туберкулёз лабораторными методами.
Учёт аллергических реакций проводили через 72 часа после первого введения и через 24 часа после повторного введения туберкулина. Реагирующими считали животных с увеличением толщины кожной складки на 3 мм и выше.
Исследование экспериментально сенсибилизированных и заражённых телят. При исследовании 72 экспериментально сенсибилизированных телят установлено, что все 11 сенсибилизированных M. bovis телят реагировали на первое внутрикожное введение туберкулина. Сенсибилизированные микобактериями туберкулёза человеческого вида телята также реагировали на первое введение туберкулина, однако аллергические реакции у них были менее интенсивны.
Из 50 телят, сенсибилизированных микобактериями птичьего вида, микобактериями паратуберкулёза и атипичными микобактериями, 39 (78,0%) реагировало на первое, три (16%) – на повторное введение туберкулина. Контрольные телята не реагировали на первое введение туберкулина, а при повторном введении туберкулина реагировало два телёнка (25,0 %).
Из 56 экспериментально зараженных M. bovis телят 54 (96,4%) реагировали на первое введение туберкулина, два телёнка (3,5%) не реагировали на первое и второе введение туберкулина.
Полученные результаты исследований показывают, что экспериментально сенсибилизированные и зараженные M. bovis телята реагируют на первое внутрикожное введение туберкулина от 96,4% до 100% случаев.
Исследования в благополучных хозяйствах. В благополучных по туберкулёзу хозяйствах на двукратное введение ППД-туберкулина для млекопитающих реагировало до 15,3 % исследованных здоровых животных, с увеличением толщины кожной складки на 3–5 мм.
В благополучных по туберкулёзу хозяйствах, где установлена сенсибилизация животных атипичными микобактериями и микобактериями туберкулёза птичьего вида, установлено, что на двукратное введение туберкулина выявляется в 2–3 раза больше реагирующих животных, чем на однократное введение туберкулина.
Так, в хозяйстве №1 при исследовании 694 коров реагировало на первое введение – 29 (4,1%), на повторное введение туберкулина – 75 (10,8%) животных. В хозяйстве №2 при исследовании 177 голов ранее реагировавшего скота на первое введение реагировало 93 (52,5%), на второе – 84 (47,4%) животных. В хозяйстве №3 при исследовании 1271 головы крупного рогатого скота реагировало на первое введение – 96 (7,5%), на второе введение – 166 (13,0%) животных.
Полученные результаты исследований показывают, что в благополучных по туберкулёзу хозяйствах на повторное введение туберкулина могут реагировать до 15,3 % здоровых животных. В благополучных хозяйствах, где установлена сенсибилизация животных атипичными микобактериями и M. avium, на повторное введение туберкулина выявляется в два раза больше реагирующих.
Исследования в неблагополучных хозяйствах с различной эпизоотической ситуацией по туберкулёзу. В четырёх неблагополучных по туберкулёзу хозяйствах исследовали 1286 голов крупного рогатого скота. При этом на первое введение туберкулина реагировало 94 (7,3%), на повторное введение – 112 (8,7%) голов КРС.
При диагностическом убое 21 коровы из тех, что реагировали только на повторное введение туберкулина, характерные для туберкулёза изменения не обнаружили ни в одном случае. При гистологическом, бактериологическом и биологическом исследованиях патматериала от убитых коров туберкулёз не был подтверждён.
При исследовании КРС в группах передержки больного туберкулёзом скота в трёх длительно неблагополучных хозяйствах установлено, что в некоторых группах животных на первое внутрикожное введение туберкулина реагируют до 100% исследованных особей (в случаях, если группы передержки больного туберкулёзом крупного рогатого скота комплектовались ранее реагировавшими на туберкулин животными из неблагополучных стад).
В длительно неблагополучных по туберкулёзу хозяйствах при диагностическом убое 10 животных, реагировавших только на двукратное введение туберкулина, характерные для туберкулёза изменения обнаружили в двух (20%) случаях. В этих хозяйствах при убое 10 коров, не реагировавших на первое и второе введение туберкулина, характерные для туберкулёза изменения обнаружены также в двух (20%) случаях.
Полученные результаты исследований показывают, что в длительно неблагополучных хозяйствах двукратное внутрикожное введение туберкулина также недовыявляет больных туберкулёзом животных.
Исследования в неблагополучных по туберкулёзу хозяйствах, где применяли химиопрофилактику тубазидом. Исследования провели в четырёх хозяйствах одной области, где осуществлялись оздоровительные мероприятия с применением химиопрофилактики туберкулёза методом подкожного введения суспензии тубазида.
В этой же области анализировали данные четырёх хозяйств, где оздоровление проводили методом систематических исследований и убоя реагирующих животных без применения химиопрофилактики.
Результаты проведенных исследований представлены в таблице.

Скоро начнутся весенние ветеринарные обработки у сельскохозяйственных животных. Что же это такое?
В рамках государственного задания ветспециалисты проводят большую работу по своевременному выявлению заболеваний у животных. Одно из ветеринарных мероприятий - это туберкулинизация.
Туберкулинизация - аллергическая реакция, направленная на выявление больных туберкулезом животных. Проводится она дважды в год. В нашем районе по плану противоэпизоотических мероприятий на 2015 год туберкулинизация будет проведена только у крупного рогатого скота начиная с 2-х мес. возраста и независимо от периода стельности (по диагностической потребности может проводится у лошадей, верблюдов, свиней, птицы, собак и т.д.). Туберкулин вводится внутрикожно в выстреженную и обработанную поверхность шеи в дозе 0,2 мл. (у быков в подхвостовую складку). Читку реакции проводят через 72 часа. Животных считают положительными при увеличении кожной складки на 3мм и более по сравнению со здоровой кожной складкой (у быков более 2 мм).
- В благополучных хозяйствах животных, реагирующих на туберкулин, считают подозреваемыми в заражении возбудителем туберкулеза и проводят комплекс дополнительных исследований для подтверждения или исключения диагноза(офтальмопроба, внутривенная туберкулиновая проба - с целью отбора животного для диагностического убоя).
Инструкция
по применению туберкулина очищенного (ППД (PPD) - Пурифиед Протеин Дериватив (Purified Protein Derivative)) для млекопитающих
(Утверждена заместителем Руководителя Россельхознадзора 03.04.2006 года)
I. ОБЩИЕ СВЕДЕНИЯ
1. Туберкулин очищенный (ППД) для млекопитающих (Purified tuberculin (PPD) for mammals) - стандартный раствор.
2. Туберкулин очищенный (ППД) для млекопитающих представляет собой очищенную белковую фракцию продуктов роста и лизиса Mycobacterium bovis, выращенного на синтетической питательной среде и инактивированного термически.
3. Стандартный раствор ППД - туберкулина представляет собой прозрачную жидкость светло-коричневого цвета без осадка.
4. Стандартный раствор ППД-туберкулина расфасован в стерильные флаконы вместимостью 5, 10 и 20 см или ампулы вместимостью 1, 2, 3, 5, 10 и 20 см3 в объеме по 1-20 см3. Флаконы укупоривают резиновыми пробками и обкатывают алюминиевыми колпачками. Ампулы запаивают.
На флаконах (ампулах) с ППД-туберкулином должно быть указано сокращенное наименование организации или её товарный знак; сокращенное наименование диагностикума; количество туберкулина - см3; активность туберкулина - ME/ см3; номер серии; годен до (месяц, год).
Активность стандартного раствора ППД - туберкулина для млекопитающих составляет 10000 ME (международных единиц первого международного стандарта PPD bovine) в 1 см3.
Флаконы (ампулы) с ППД - туберкулином должны быть упакованы в коробки с разделительными перегородками. В каждую коробку вкладывают инструкцию по применению туберкулина.
ППД - туберкулин должен храниться в упаковке изготовителя в закрытых сухих помещениях при температуре от 2 °С до 8 °С.
Срок годности ППД - туберкулина в стандартном растворе - 2 года с даты изготовления.
II. БИОЛОГИЧЕСКИЕ СВОЙСТВА
5. ППД - туберкулин при введении животным, больным туберкулезом, в зависимости от способа применения вызывает местную или общую аллергическую реакцию.
6. Местная реакция на внутрикожное введение туберкулина может проявляться также у животных, инфицированных атипичными микобактериями разных видов, не вызывающими патологических изменений в органах и тканях.
При тяжелых формах туберкулеза, нарушениях обмена веществ, иммунодефицитах и т.п. больные животные могут не реагировать на введение туберкулина.
III. ПОРЯДОК ПРИМЕНЕНИЯ ТУБЕРКУЛИНА
8. Ту6еркулинизацию животных разрешается проводить только ветеринарным врачам или ветеринарным фельдшерам. под контролем ветеринарного врача.
8 1 каждый флакон с туберкулином перед применением просматривают. При нарушении целостности стекла или укупорки, отсутствии надписей на флаконах их выбраковывают.
8 2 Для внутрикожного и пальпебрального введения туберкулина используют шприцы с бегунком вместимостью 1 - 2 см и иглы для внутрикожных инъекций или безыгольные инъекторы БИ-7. ИБВ-02 и другие.
Для нанесения туберкулина на конъюнктиву применяют глазные пипетки, для внутривенного введения - шприцы вместимостью 5 - 10 см3 и иглы для подкожных инъекций.
8.3. Туберкулин используют только в день вскрытия флакона, остатки туберкулина инактивируют кипячением в течение 10 минут.
8.4 Инструменты, используемые для туберкулинизации, не разрешается применять для введения животным других вешеств.
Шприцы, иглы и глазные пипетки до и после их использования стерилизуют кипячением в течение 10 мин в дистиллированной или кипяченой воде без добавления дезинфицирующих вешеств. Безыгольные инъекторы стерилизуют в соответствии с наставлением по их применению.
Во время проведения внутрикожной, пальпебральной и внутривенной туберкулинизации для каждого животного используют отдельную стерильную иглу.
8.5.Для диагностического исследования на туберкулез применяют очищенный туберкулин (ППД) для млекопитающих:
- у свиней - одновременно очищенный туберкулин (ППД) для млекопитающих и очищенный туберкулин (ППД) для птиц;
- при исследовании на туберкулез крупного рогатого скота внутривенной туберкулиновой пробой, исследуемому животному вводят в яремную вену 50 % раствор туберкулина ППД для млекопитающих, разведенный стерильным-физиологическим раствором рН 7,0 ± 0,5 или растворителем микобактериальных аллергенов, из расчета 1 см3 на 100 кг массы тела.
- для исследования обезьян раствор туберкулина для млекопитающих разводят в 10 раз (к 1 см3 туберкулина добавляют 9 см1 стерильного физиологического раствора рН 7,0 ± 0,5 или растворителя микобактериальных аллергенов)
8.6. Внутрикожная и пальпебральная туберкулиновая проба
8.6.1. Туберкулинизации подвергают животных, начиная с двухмесячного возраста. Коров (нетелей), буйволиц, верблюдиц исследуют независимо от периода беременности. Самок других видов животных исследуют через 1 - 2 недели после родов
Не разрешается исследовать животных в течение трех недель после вакцинации против инфекционных болезней
8.6.2. Перед введением туберкулина волосяной покров у животных (кроме овец, коз и норок) выстригают, перья выщипывают, кожу обрабатывают 70 % этиловым спиртом. Вводить туберкулин в кожу, имеющую травматические повреждения, уплотнения и абсцессы, поражения грибами, клещами или гельминтами запрещается.
8.6.3. Туберкулин вводят внутрикожно в дозе 0,2 см3:
- крупному рогатому скоту, буйволам, зебувидным, оленям (маралам), кроме быков - в середине шеи (в этой области не разрешается вводить животным какие-либо другие биологические препараты и вещества).
- быкам - в подхвостовую складку;
- верблюдам - в кожу брюшной стенки в области паха на уровне горизонтальной линии седалищного бугра,
- свиньям - в области наружной поверхности уха в 2 - 3 см от его основания; при этом в кожу одного уха вводят туберкулин для млекопитающих, а в кожу другого уха - туберкулин для птиц. Поросятам в возрасте 2-3 месяцев туберкулин допускается вводить в кожу поясничной области, отступая от позвоночника на 5-8 см, используя для этого безыгольный инъектор.
- собакам, пушным зверям (кроме норок) туберкулин вводят с внутренней поверхности бедра или локтевой складки.
8.6.4. Туберкулин вводят внутрикожно в дозе 0.1 см3'
- кошкам - на внутренней поверхности уха;
- обезьянам - в области грудной стенки на 5 - 6 см uoll
8.6.5. Туберкулин вводят пальпебрально (в толщу века)''
- козам и овцам в дозе 0,2 см3 в нижнее веко, отступя от Р™
- норкам в дозе 0,1 см3- в верхнее веко. 6Г° Края на ] '5 " 2 см'
, 8.6.6. Учет и оценку реакции проводят у крупного рогатого скота, верблюдов и оленей через 72 часа после введения туберкулина, обезьян, пушных зверей - через 48 часов.
8.6.7. При учете реакции на введение туберкулина прощупывают место введения туберкулина. При также сравнивают веки левого и правого глаза.
_ При обнаружении припухлости в месте введения туберкулина у крупного рогатого скота, зебувидных, верблюдов, оленей измеряют кутиметром толщину кожной складки в миллиметрах и определяют величину ее утолщения сравниванием с толщиной складки неизмененной кожи вблизи от места введения туберкулина.
8.6.8. Животных считают реагирующими на туберкулин:
- крупный рогатый скот (кроме быков), буйволов, зебувидных, верблюдов, оленей - при утолщении кожной складки на 3 мм и более независимо от характера припухлости (отечности, болезненности, повышения местной температуры),
- быков (волов), коз, овец, свиней, собак, кошек, обезьян, пушных зверей - при образовании ощутимой припухлости в месте введения туберкулина.
8.6.9. В хозяйствах, неблагополучных по туберкулезу крупного рогатого скота, для более полного выявления больных животных применяют двукратную туберкулиновую пробу. С этой целью животным, не реагировавшим на первую инъекцию туберкулина, вводят его повторно сразу после учета реакции в то же место в той же дозе. Реакцию на повторное введение учитывают через 24 часа и оценивают, как указано выше.
8.6.11. В благополучных хозяйствах животных, реагирующих на туберкулин, считают подозреваемыми в заражении возбудителем туберкулеза и проводят комплекс дополнительных исследований для подтверждения или исключения диагноза.
8 7 Глазная туберкулиновая проба (офтальмопроба)
8 7 1 Глазную туберкулиновую пробу применяют для диагностики туберкулеза у лошадей. крупного рогатого скота эту пробу применяют одновременно с внутрикожной пробой для дополнительного выявления заражения в неблагополучных по туберкулезу хозяйствах .
При каждом учете реакции у всех обследуемых животных необходимо осматривать конъюнктивальный мешок, т.к. реакция может ограничиться кратковременным образованием гнойного секрета в виде зернышек.
8.8. Внутривенная туберкулиновая проба
8.8.1 Внутривенную туберкулиновую пробу применяют с целью отбора животных для диагностического убоя У больных туберкулезом животных реакция на внутривенное введение туберкулина характеризуется в большинстве случаев повышением температуры тела. Возможна обшая реакция организма в виде судорожных явлений, сильного беспокойства, редко - потеря сознания и гибель от анафилактического шока
8.8.2. Туберкулин вводят после проведения внутрикожной пробы только взрослым животным, за исключением коров в течение месяца до отела и месяца после отела.
Перед введением туберкулина у животных измеряют температуру тела. Животных с температурой тела 39,6 С и выше, внутривенной туберкулиновой пробой не исследуют.
8.8.3. Непосредственно перед применением раствор туберкулина разводят в два раза (один флакон раствора туберкулина разводят таким же количеством растворителя микобактериальных аллергенов или стерильного физиологического раствора) и получают его 50 % раствор.
8.8.4. Учет и оценку реакции проводят через 3, 6 и 9 часов после инъекции туберкулина путем измерения температуры тела животного.
Реагирующими на внутривенную пробу считают животных с повышением температуры тела хотя бы при одном измерении на один и более градусов выше 39,5 °С.
9. Применение туберкулина не требует ограничений в сроках убоя животных на мясо, использования молока и другой продукции.
10. Туберкулин по истечению срока годности не должен применяться.
IV. МЕРЫ ЛИЧНОЙ ПРОФИЛАКТИКИ
11. Туберкулин безвреден для людей, не больных туберкулезом, при работе с ним не требует применения мер безопасности.
12. Лицам, больным туберкулезом, работать с туберкулином не разрешается.
13 Туберкулин следует хранить в местах недоступных для детей.
Читайте также:


