Повышение трансаминаз при туберкулезе

Дата публикации: 19.01.2018 2018-01-19
Статья просмотрена: 1576 раз
Среди ПР при туберкулезе легких особое место занимает поражение печени [5, с.357; 7, с.17; 2, c.68], Туберкулезная инфекция создает предпосылки для поражения печени, угнетая ферментативную активность и гликогенобразование [3, с.5; 9, с.280], вызывая различного вида морфологические изменения [8,40]. Побочные реакции со стороны печени наблюдаются у 11–46,5 % больных туберкулезом. [9, с.15; 10, с.16],
Клинико-лабораторная характеристика состояния печени до химиотерапии трудна, так как изменения в печени, вызванные самим туберкулезным процессом, наслаиваются на изменения, обусловленные возможными последствиями перенесенного вирусного гепатита [6, с.19; 4, с.12].
С целью изучения состояния печени у больных с туберкулезом легких при побочных реакциях проведено наблюдение и комплексное обследование 226 больных туберкулезом легких, находившихся на лечении в терапевтических отделениях клиники РСНПМЦФиП 2001–2011 гг. Для оценки функционального состояния печени определяли в крови активность ферментов: аспартатаминотрансферазы — АсТ (N — 0,43±0,05 ммоль/ч.л.) и аланинаминотрансферазы — АлТ (N — 0,20±0,03 ммоль/ч.л.) методом S.Rautman — S.Frenkel (1957); холинэстеразы методом В. Г. Колба (1972; N — 74,98±10,15мкм/ч.л.), содержание общего билирубина и его фракций методом Йендрашека (1972; N — 7,4±0,25 мкмоль/л). [1 ,с.180],
Из общего числа обследованных мужчин было 111 (49,1 %), женщин — 115 (50,9 %) в возрасте от 17 до 65 лет. Инфильтративный туберкулез легких установлен у 134 (59,2 %) больных, фиброзно-кавернозный туберкулез легких у 30 (13,3 %), кавернозный и диссеминированный туберкулез легких 18 (8 %). Впервые выявленных больных было 194 (85,8), т. е. абсолютное большинство, ранее леченых — 32 (14,1 %).
Сопутствующие заболевания выявлены у 177 (77,8) больных: ХОБЛ — у 31 %, анемии — у 33,8±3,1 %, заболевания ЖКТ и печени — у 11,3 %, сахарный диабет — у 19,7 %.
В процессе химиотерапии побочные реакции отмечены у 145 больных (64,5 %). В своей работе мы применяли по синдромную классификацию побочных реакций от противотуберкулезных препаратов [9, с.31]. Частота и характер ПР представлены на рис. 1.
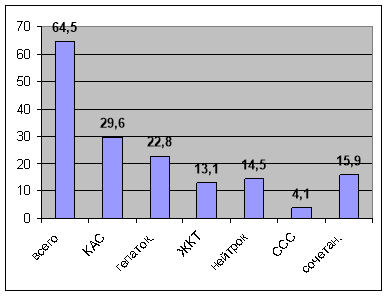
Рис. 1. Частота и характер побочных реакций от противотуберкулезных препаратов у больных туберкулезом легких
Как видно из рис 1, побочные реакции со стороны печени отмечены у 33 (22,8±3,4 %) больных.
Анализ характера клинических симптомов поражения печени при гепатоксических реакциях (рис.2) показывает преобладание диспепсического синдрома.
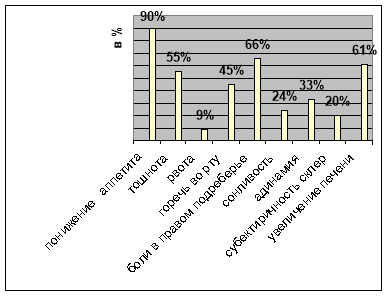
Рис 2. Клинические симптомы гепатотоксических реакций у больных туберкулезом легких
С целью установления взаимосвязи частоты и характера отдельных синдромов ПР с поражением печени и почек было изучено динамика нарушений функции печени на основе определения индикаторных ферментов в крови и моче.
Характеризуя функциональное состояние печени у больных нужно, прежде всего, отметить, что сама туберкулезная интоксикация сопровождается интоксикационным синдромом. Печень при этом обеспечивает удаление из крови продуктов микробных и поврежденных клеток, а также обезвреживание эндогенных метаболитов.
Кроме того, необходимо учитывать локализацию ферментов АсТ и АлТ в субклеточных структурах. Известно, что АсТ значительно в большей степени связана с митохондриями и ядерными структурами, чем АлТ, которая сосредоточена в гиоплазме. Поэтому АлТ легче попадает в кровь, и повышение ее активности при повреждении клеток печени определяется раньше.
Коэффициент Де Ритиса у всех больных особенно с гепатоксическими реакциями, был меньше 1,0, билирубиновый показатель также не превышал 50 %, что указывает на наличие нарушения на уровне мембраны гепатоцитов.
Функциональное состояние печени убольных туберкулезом при развитии побочных реакций от противотуберкулезных препаратов

Актуальность проблемы. Лекарственно-индуцированные поражения печени (ЛИПП) при лечении туберкулеза заслуживают особого внимания в связи с тем, что в последние десятилетия наблюдается рост заболеваемости туберкулезом и распространение его не только среди асоциальных слоев общества как в мире [5], так и в Российской Федерации [2]. А также широкое распространение лекарственно-устойчивых форм микобактерий туберкулеза, достигающее в последние годы 47,5-54,2 %, что вынуждает фтизиатров назначать одновременно несколько противотуберкулезных препаратов, при том, что все они в той или иной степени гепатотоксичны и назначение их в комбинации усиливает этот эффект. Следствием такого положения является частое (до 70 %) развитие поражений печени и гепатобилиарного тракта, что обусловлено различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков, наличием сопутствующих заболеваний) [4]. Данные о гепатотоксичности противотуберкулёзных препаратов достаточно противоречивы, поскольку это свойство связано не только с химическим строением препарата, но и с особенностями метаболических возможностей печени каждого больного, величиной печёночного кровотока, уровнем развития портокавальных анастомозов, степенью связывания препаратов белками плазмы [3]. Важной задачей в профилактике лекарственного гепатита, возникающего на фоне противотуберкулезной терапии (ПТТ), является применение фармакологической коррекции до возникновения его клинических проявлений, что невозможно без определения времени начала изменений биохимических показателей крови - маркеров цитолиза гепатоцитов. Учитывая высокую распространенность лекарственно-индуцированных поражений печени, разработка методов их профилактики и лечения является актуальной научной проблемой.
Цель исследования. Разработать современный комплексный метод мониторинга состояния печени у больных туберкулезом легких, получающих специфическую терапию. Исследовать гепатопротекторную активность таурина, и разработать рекомендации по профилактике и лечению лекарственно-индуцированных поражений печени.
Второй этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие 50 пациентов с туберкулезом легких, получающих специфическую терапию по 1 режиму. Контрольную группу составили 30 здоровых лиц, сопоставимых по полу и возрасту.
Третий этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие три группы пациентов по 20 человек с туберкулезом легких, получающих специфическую терапию по 1 режиму и дополнительно гепатопротекторные, антиоксидантные препараты или их комбинацию. Группу сравнения составили 20 больных туберкулезом, получающих специфическую терапию по 1 режиму, не получающих дополнительных гепатопротекторных средств, не отличающихся по полу и возрасту.
Материалы и методы. Для постановки диагноза гепатита и оценки функционального состояния печени применялся комплекс лабораторных исследований, включающий общий клинический анализ крови, общий анализ мочи, биохимические тесты: количественное определение общего билирубина и его прямой фракции, определение активности аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), щелочной фосфотазы (ЩФ), холестерина, триглицеридов (ТГ), концентрации белка и др. У всех больных методом иммуноферментного анализа (ИФА) определялись основные маркеры вирусных гепатитов. Обязательным условием включения пациента в исследование являлось отсутствие злоупотребления алкоголем в анамнезе и отрицательные результаты анализов на маркеры вирусных гепатитов. Оценивалась длительность пребывания больного в стационаре, выделение микобактерий после окончания курса химиотерапии. Переносимость лечения учитывалась при ежедневном опросе пациентов.
Статистическая обработка данных проводилась с помощью пакета статистических программ «Statistica 6.0 для Windows," с использованием непараметрического метода анализа с коэффициентом корреляции Спирмена [1].
Результаты ретроспективного анализа (I этап). На данном этапе были проанализированы истории болезни 250 пациентов с туберкулезом легких, находившихся на лечении в ВОКПД в 2007-2008 годах, с отрицательными результатами анализов на маркеры вирусных гепатитов и не злоупотребляющие алкоголем по анамнезу. Среди них 165 мужчин (66 %) и 85 женщин (34 %). Возраст больных от 15 до 73 лет (средний 38,9±6,6 лет). Преобладали пациенты с впервые выявленным туберкулезом легких, ранее не получавшие противотуберкулезные препараты - 231 пациент (92,4 %).
В зависимости от формы процесса и чувствительности микобактерии туберкулеза к антибактериальным препаратам больные получали лечение по стандартным режимам химиотерапии. 1-й режим - 166 человек (66,4 %), 2а - режим 12 человек (4,8 %), 2б режим - 52 человека (20,8 %), 3-й режим - 8 человек (3,2 %), 4-й режим - 12 человек (4,8 %).
Функциональные показатели оценивались ежемесячно по данным биохимических анализов крови (АлАТ, АсАТ, общий билирубин, тимоловая проба), входящих в стандарт обследования больных туберкулезом легких. Были выявлены достоверные гендерные различия в скорости развития цитолитического синдрома. Так, вне зависимости от схемы лечения у женщин наблюдался более выраженный подъем уровня АлАТ за первый месяц терапии - на 60 %, при этом у мужчин подъем составил 30 % от исходного уровня. Уровень АсАТ у женщин повысился на 28,5 %, у мужчин - на 21 %. Тимоловая проба возросла у женщин - на 22,8 %, у мужчин - на 12,8 %. Оценивалась также разновидность поражения печени на основании расчета коэффициента R (cоотношение АлАТ / щелочная фосфатаза). При 1 и 2-м режимах терапии преобладали гепатоцеллюлярные типы поражения печени (при значениях коэффициента R>5). При третьем режиме терапии преобладали комбинированные типы (2 0,05
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике.
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике. Поэтому для детей, больных туберкулезом или входящих в группу риска, чрезвычайно важно проведение наряду с химиотерапией и химиопрофилактикой и комплексного этиопатогенетического лечения [2, 5, 7].
Среди многообразных нарушений физиологических процессов при туберкулезе — нарушение функции печени. При туберкулезе печень работает с большей перегрузкой, вследствие массового уничтожения микобактерий туберкулеза (МБТ) и нейтрализации продуктов их обмена. Под влиянием токсинов МБТ в большей или меньшей степени выявляются нарушения белкового, углеводного и ферментативного обмена.
Одним из грозных осложнений химиотерапии туберкулеза являются медикаментозные поражения печени. Известно, что основные противотуберкулезные препараты (ПТП) (изониазид, пиразинамид и рифампицин) обладают гепатотоксическим действием и приводят к развитию токсического гепатита, а при их комбинированном применении усиливается токсический эффект, который наиболее часто возникает при сочетании препаратов с рифампицином или его аналогами. Значительный рост остропрогрессирующих и распространенных форм туберкулеза у детей, а также увеличение числа случаев полирезистентных форм МБТ вынуждают использовать в химиотерапии комбинацию из 5–6 препаратов, что также ведет к развитию токсического гепатита [1, 2, 3].
Под воздействием этих препаратов часто развиваются токсические реакции, сопровождающиеся появлением желтухи, ухудшением общего самочувствия, снижением аппетита, тошнотой, рвотой, увеличением размеров печени, появлением болей в правом подреберье, нарушением пищеварения, ухудшением биохимических показателей крови.
Между тем по литературным и статистическим данным известно, что более 30% детей до начала терапии ПТП уже имеют сопутствующую патологию со стороны желудочно-кишечного тракта (ЖКТ), печени, желчевыводящих путей или имеют в анамнезе перенесенные вирусные гепатиты. В патогенезе острых и хронических вирусных гепатитов лежит синдром цитолиза, который приводит к повышению проницаемости печеночно-клеточных мембран, к потере биологически активных веществ, к потере ферментов и, как следствие, к нарушению всех видов обмена. Все это приводит к нарушению внешнесекреторной функции печени, изменению нормального процесса пищеварения, нарушению желчеобразующей и желчевыделяющей функции [2, 4, 6].
Вышеизложенные данные создают определенные трудности при назначении ПТП. В связи с этим весьма актуальным является поиск методов профилактики гепатотоксических реакций у детей, получающих ПТП. Одним из способов защиты печени от токсических реакций является включение гепатопротекторов (Эссенциале, Сирепар, Карсил, Урсосан, ЛИВ.52) и желчегонных средств.
ЛИВ.52 оказывает достаточно выраженный гепатопротективный эффект: снижает застойные явления и устраняет воспаление печени, стимулирует процесс регенерации гепатоцитов, усиливает внутриклеточный обмен, уменьшает дегенеративные, жировые и фиброзные изменения, стимулирует биосинтез белков и фосфолипидов. Оказывает защитное действие против перекисного окисления липидов, благодаря повышению уровня токоферолов (антиоксидантов) печеночной клетки. Защищает эндоплазматический ретикулюм клеток печени, активизирует активность печеночных микросомальных ферментативных систем, повышает уровень цитохрома Р-450, играющего важную роль в метаболизме лекарственных средств и детоксикации ядов [5].
Актуально использование данного препарата как в лечении сопутствующей патологии печени, такой как острый и хронический вирусный гепатит, дискинезии желчного пузыря, так и при медикаментозных поражениях печени. ЛИВ.52 — это комплексный лекарственный препарат, в состав которого входит тысячелистник обыкновенный, паслен черный, цикорий обыкновенный, дымянка лекарственная, кассия западная, терминалия арджуна, тамарикс гальский, тиноспора сердцелистная, оксид железа [1, 8].
Материалы и методы исследования
Целью данной работы была оценка эффективности препарата ЛИВ.52 в профилактике гепатотоксических реакций у детей, больных туберкулезом как с поражением, так и без патологии печени, получающих противотуберкулезную терапию.
Нами были поставлены следующие задачи:
Под наблюдением находилось 150 детей, которые были разделены на 2 группы: 1 группа из 100 детей, получающих специфическую терапию и ЛИВ.52 (из них — 18 детей с поражением печени и 82 ребенка без патологии печени); контрольная группа из 50 детей без патологии печени, получающих специфические химиопрепараты, без назначения ЛИВ.52.
Все дети, больные туберкулезом, до назначения ЛИВ.52 подвергались тщательному клиническому обследованию, включающему в себя сбор жалоб, сбор данных анамнеза жизни, заболевания; объективному осмотру и общеклиническим и лабораторным методам исследования: общие анализы крови, мочи, биохимические исследования крови. У детей с сопутствующей патологией печени и желчевыводящих путей с особым вниманием наблюдали за аппетитом ребенка, режимом и характером питания, переносимостью тех или иных продуктов питания и аллергическими реакциями, болями в животе, частыми запорами или поносами.
Продолжительность курса лечения составила 3 месяца, все данные фиксировались в истории болезни. Для оценки эффективности препарата ЛИВ.52 в динамике лечения проводились комплексные наблюдения за объективным статусом ребенка среди детей обеих групп (оценка общего состояния, состояния кожных покровов, размеров печени), общеклинические исследования крови, мочи (стандартными методами), изучались состояния ЖКТ (тошнота, рвота, горечь во рту, тяжесть и боль в правом подреберье, анорексия). Также в динамике проводилось биохимическое исследование крови с определением содержания белка (альбумина и глобулиновых фракций) билирубина, холестерина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), тимоловой пробы 1 раз в месяц. При возникновении гепатотоксической реакции контроль над сроком ее исчезновения проводили 1 раз в 10 дней.
Несомненно, основным методом обследования детей для изучения состояния печени в процессе лечения в настоящее время стал ультразвуковой метод исследования (УЗИ), который по сравнению с другими методиками имеет определенные преимущества — отсутствие лучевой нагрузки, высокая информативность, неинвазивный метод обследования. УЗИ отражает в основном анатомическую структуру органа (форму, контур, размер, эхогенность, посторонние включения, новообразования и т. д.). Поэтому всем детям, больным туберкулезом с поражением и без патологии печени, получающим лечение химиопрепаратами, проводилось УЗИ органов брюшной полости и печени 1 раз в 3 месяца, при выявлении патологии — по показаниям.
В 1 группе из 100 детей под наблюдением находилось 18 детей с патологией печени в анамнезе; у всех наблюдались выраженные симптомы интоксикации, как по основному процессу, так и в связи с сопутствующей патологией печени. У 6 детей в анамнезе был перенесенный вирусный гепатит (ВГ): ВГА — у 2 детей, ВГВ — у 3 детей, ВГС — у 1 ребенка; также у этих детей наблюдалось наличие в крови НВsAg антигена. У 12 детей (ранее получивших лечение до поступления в институт) отмечались явления токсического гепатита. Из всех 18 детей с активным туберкулезом легких в сочетании с патологией печени — у 11 детей (в 61,1% случаев) отмечалось увеличение размеров печени на 2–3 см, с умеренной или выраженной болезненностью при пальпации в области правого подреберья. Жалобы были на снижение аппетита, тошноту, иногда на рвоту после приема пищи и химиопрепаратов.
Несмотря на поражение печени, всем больным детям назначалось полноценное специфическое химиотерапевтическое лечение 4 антибактериальными препаратами в сочетании с гепатопротектором ЛИВ.52. Особое внимание нами было уделено диетотерапии с содержанием достаточного количества растительной клетчатки, растительных жиров с содержанием в них полиненасыщенных жирных кислот, необходимых для обменных процессов в печени, и продуктов, стимулирующих отток желчи.
На фоне комплексного лечения отмечалось улучшение общего состояния, уменьшение симптомов как туберкулезной, так и печеночной интоксикации, повышение аппетита. Нормализация размеров печени отмечена: через 1 мес в 16% случаев, через 2 мес — 41%, через 3 мес — у 100% детей.
Патологические изменения в биохимических показателях крови до начала лечения ЛИВ.52 (повышение общего билирубина, трансаминаз, тимоловой проб, повышение уровня щелочной и кислой фосфатаз) отмечались в 72,2% случаев.
Нормализация биохимических показателей крови отмечена через 1 мес — в 23% случаев, через 2 мес — в 67% случаев, к концу 3-го мес — достигнута в 100% случаев. Дополнительным подтверждением эффективности препарата ЛИВ.52 является и более быстрая нормализация аминотрансфераз на 3–4 неделе лечения, т. е. купирование синдрома цитолиза, характерного для токсического гепатита. Это обусловлено его стимулирующим действием на регенерацию гепатоцитов, мембраностабилизирующим действием, что особенно ценно при длительной противотуберкулезной терапии. Отмечалось снижение активности щелочной и кислой фосфатаз, что свидетельствует о нормализации функциональной активности печени и функции желчеобразования.
По данным УЗИ детей с патологией печени, особенно после перенесенных вирусных гепатитов, у 4 детей (22,2% случаев) — усиление эхогенности печени за счет внутриклеточного холестаза, а также густой осадок в желчном пузыре. Ликвидация этих явлений зафиксирована у всех детей, получивших ЛИВ.52, на 5–6 неделе лечения. Также у 11 детей с увеличением печени отмечались изменения ультразвуковой картины печени в виде повышения плотности, увеличения размеров и выраженности стенок желчных протоков. При контроле за исчезновением изменений в области печени УЗИ проводилось 1 раз в 10 дней, нормализация показателей отмечалась через 3–4 недели лечения.
Таким образом, у детей с туберкулезом в сочетании с патологией печени включение в комплексную химиотерапию и гепатопротектора ЛИВ.52 приводило к более быстрой и благоприятной динамике клинико-лабораторных показателей и позволяло проводить полноценное лечение туберкулезного процесса.
В 1 группе детей с туберкулезом легких, но без патологии печени (82 ребенка), дети также получали наряду с химиопрепаратами гепатопротектор ЛИВ.52 с целью профилактики токсических реакций со стороны печени. Более половины детей переносили специфическое лечение удовлетворительно, и никаких нарушений со стороны функционального состояния печени у них не отмечено. В процессе лечения только у 2 детей наблюдались жалобы на рвоту, тошноту, расстройство стула, связанные с погрешностью в диете.
Функциональные нарушения со стороны печени в процессе лечения отмечены у 18 (21,5%) детей. Эти нарушения характеризовались невыраженными симптомами печеночной интоксикации, жалобами на подташнивание после приема препаратов и незначительным снижением аппетита. Общее состояние ребенка при этом не страдало и оставалось удовлетворительным, увеличения печени не отмечалось. В биохимических показателях крови были выявлены незначительные повышения общего билирубина или трансаминаз. Одной из причин таких нарушений со стороны печени явился длительный прием рифампицина или одновременный прием изониазида, рифампицина и пиразинамида, при такой комбинации гепатотоксические реакции развивались достоверно чаще. Другой причиной был одновременный прием 5–6 ПТП с включением как основных (изониазид, пиразинамид и рифампицин), так и резервных препаратов (протионамид, аминосалициловая кислота, капреомицин и т. д.) у детей с лекарственно-устойчивым туберкулезом, особенно с высоким уровнем полирезистентности МБТ к ПТП (к 3–4-м и более препаратам).
В контрольной группе больных (50 детей), с активным туберкулезным процессом и не получающих ЛИВ.52 на фоне приема специфических антибактериальных препаратов, у детей в 30,0% случаев наблюдались расстройства со стороны ЖКТ в виде тошноты, рвоты, расстройства стула и снижения аппетита. В 26,0% случаев к окончанию лечения специфическими препаратами была выявлена патология со стороны желчевыводящих путей (дискинезия желчевыводящх путей, острый холецистит) и у 2 детей были выявлены признаки реактивного панкреатита.
Заключение
Вышеизложенное позволяет заключить, что своевременное выявление заболеваний печени и оптимальный подбор противотуберкулезных препаратов позволяют обеспечивать непрерывность терапии туберкулеза и достигать положительного эффекта в легких, а также стойкого восстановления функции печени при ее изменениях в анамнезе в течение от 1,5 до 2 месяцев. У детей с сопутствующей патологией печени гепатотоксические реакции развиваются чаще, чем у больных без таковых, однако проведение превентивной коррекции функции печени путем введения гепатопротектора ЛИВ.52 позволяет снизить частоту гепатотоксических реакций.
Гепатопротектор ЛИВ.52 способствует ускорению нормализации биохимических показателей крови (снижение показателей билирубина, трансаминаз и тимоловых проб до нормальных величин). Снижение активности щелочной и кислой фосфатаз приводит к нормализации функциональной активности печени и функции желчеобразования.
ЛИВ.52 хорошо переносится детьми, не вызывает неприятных ощущений. Его защитное (антиоксидантное) действие при применении ПТП является благоприятным фоном для проведения адекватной химиотерапии у детей как с патологией печени, так и без патологии.
Таким образом, химиотерапия туберкулеза в комплексе с гепатопротекторами позволяет добиться желаемого эффекта при лечении туберкулеза у детей без токсических проявлений со стороны желудочно-кишечного тракта. Препарат ЛИВ.52 не проявляет токсичности, не оказывает побочных эффектов и способствует как профилактике, так и лечению гепатотоксических реакций и дает возможность проводить полноценное (без перерыва) специфическое лечение туберкулезного процесса.
Литература
В. А. Аксенова, доктор медицинских наук, профессор
В. Г. Мадасова
НИИ фтизиопульмонологии, ММА им И. М. Сеченова, Москва

Сологуб Т. В., Романцов М. Г., Кетлинская О. С., Петров А. Ю., Комиссаров С. Н., Кремень Н. В., Александрова Л. Н., Суханов Д. С., Ледванов М. Ю., Стукова Н. Ю., Козько В. М., Бондарь А. Е.,
Лекарственные поражения печени (ЛПП) являются одной из серьезных проблем в гепатологии. В настоящее время насчитывается более 800 лекарственных средств, способных вызывать поражения печени, а четверть фульминантных гепатитов связывают с острым токсическим лекарственным поражением.
Поражения печени (15-20%) у больных туберкулезом свидетельствуют о высокой частоте патологии печени при туберкулезе, обусловленной различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков наличием сопутствующих заболеваний, в том числе и вирусных гепатитов).
Печень представляет собой центральную лабораторию химического гомеостаза организма, где создается единый обменный и энергетический комплекс для метаболизма белков, жиров и углеводов. Особенно важна детоксикационная и клиренсная функции печени, так как 80% токсических веществ из организма выводится именно ею.
В целом, согласно МКБ X пересмотра, гепатопатии классифицируются на 2 большие группы:
1-я - поражения печени инфекционного и неинфекционного генеза (поражения специфическими гепатотропными вирусами; поражения неспецифическими инфекционными агентами (герпес, энтеровирус, цитомегаловирус);
2-я группа - токсические поражения печени (алкогольная болезнь; хронический гепатит, включая аутоиммунный).
Гепатопатии являются одной из ведущих видов патологии, не только в России, но и в мире. При этом, разные категории больных имеют различную частоту и причины поражения печени. Одной из таких групп больных, для которых поражения печени являются весьма актуальными, считаются больные туберкулезом.
В зависимости от структуры и состава лекарственных веществ может наблюдаться избыточное образование свободных радикалов, активизация перекисного окисления липидов (ПОЛ), денатурация белков, истощение запасов АТФ, нарушение функции митохондрий, образование гаптенов, связывание с ядерными и цитоплазматическими молекулами, мембранными рецепторами, блокада транспортной РНК, разрушение клеточного цитоскелета, обуславливая различные подходы к терапии этих состояний.
ЛПП принято подразделять на 3 группы: гепатоцеллюлярные, холестатические и смешанные. Мишенью токсического действия являются гепатоциты (некроз), желчные протоки и канальцы (холестаз) или синусоидальные клетки (эндотелий, жиросодержащие клетки). ЛПП повреждают паренхиму, приводят к некрозу или апоптозу, стеатозу, холестазу, образованию гранулем, сосудистым расстройствам, злокачественному перерождению и др. [Farwell G.S., (1994)].
Важную роль в подобных повреждениях играет генетический полиморфизм ферментов детоксикации ксенобиотиков(CYP450, NAT2). Риск развития гепатита при лечении противотуберкулезными препаратами в значительней степени определяется генным полиморфизмом изофермента СУР2Е1. У пациентов с гомозиготным диким генотипом CYP2E1 cl/cl риск гепатотоксичности высок (20%), чем у лиц с мутантным аллелем с2 (СYP2E1 с1/с2 или с2/с2; (9,0%) [Huang YS, (2003)]. Восприимчивость к гепатотоксическому действию противотуберкулезных препаратов продолжает увеличиваться [Nagayama N et al, (2003)]. Так, в период 1980-2000 гг. прошлого столетия частота развития гепатитов (при комбинированном применении изониазида и рифампицина) составляла от 9,0% до 27,4%, что связано с повышением частоты гепатотоксических реакций и неблагоприятным воздействием на печень факторов окружающей среды.
Лекарственные поражения при применении пиразинамида развиваются по тому же типу, что и при использовании изониазида. Осложнения редки при дозе менее 30 мг/кг, а в высоких дозах пиразинамид тормозит окислительное фосфорилирование, перекисное окисление липидов (ПОЛ), истощая антиоксидантные резервы, повреждая клеточные структуры, потенцируя гепатотоксическое действие рифампицина.
Аминогликозиды вызывают субклинические неспецифические реактивные гепатиты с умеренной гипераминотрансфераземией [Логинов А.С. и соавт., (1987)], в единичных случаях развивается острый цитолитический гепатит с гепатоцеллюлярным некрозом. В основе цитолитического гепатита лежат некрозы или стеатоз печени. Под действием лекарственного препарата наблюдается диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах ОВГ. Развитие распространенного массивного некроза печени описано при применении противотуберкулезных средств (изониазида, рифампицина, аминогликозидов). Лекарственные препараты вызывают диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах острого вирусного гепатита.
К развитию цирроза печени может вести длительное применение противотуберкулезных препаратов, вызывающих острый или хронический гепатит. По мнению В.Т.Ивашкина (2006) цирроз - это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов, являясь конечной стадией хронического поражения печени. Его тяжесть и прогноз зависит от объема сохранившейся функциональной паренхимы печени, выраженности портальной гипертензии и активности основного заболевания, приведшего к нарушению ее функций. Нарушение архитектоники печени даже при отсутствии цирроза ведет к развитию портальной гипертензии.
Поражение печени может стабилизироваться или регрессировать при прекращении приема противотуберкулезных препаратов, улучшая функциональное состояние печени, но эволюция гистологических изменений в печени происходит значительно медленнее. Продолжение приема лекарств приводит к прогрессированию ХГ с исходом в цирроз печени, формируя печеночную недостаточность.
Побочные явления непереносимости антибактериальных препаратов наблюдаются в клинике туберкулеза в 7,9-32% случаев. Их частота и характер в значительной мере обусловлены давностью и формой процесса, а так же наличием сопутствующих заболеваний, в частности ВГ. Токсическое действие наступает через 2 месяца после начала приема препаратов, в 19,7% связано с поражением печени. У половины пациентов с биохимическими нарушениями отсутствуют клинические признаки патологии печени.
Ассортимент лекарственных средств патогенетической терапии, применяемых при заболеваниях печени, насчитывает более 1000 наименований, но среди такого многообразия препаратов, выделяют сравнительно небольшую группу лекарственных средств [гепатопротекторов], оказывающих избирательное действие на печень. Их действие направлено на восстановление гомеостаза в печени, повышение устойчивости органа к действию патогенов, нормализацию функциональной активности и стимуляцию репаративно-регенеративных процессов в печени.
Современным подходом для улучшения эффективности патогенетической терапии является применение препаратов, восстанавливающих не только митохондриальную мембрану клеток, не только липидный слой мембран, но нормализующих окислительное фосфорилирование и модифицирующих клеточный обмен.
Это возможно за счет применения гепатопротекторов (реамберин, цитофлавин, ремаксол), обладающих антигипоксическим/антиоксидантным эффектом поскольку, печень является основным местом метаболизма и мишенью токсического действия с первичным нарушением функции мембран.
Указанные препараты являются метаболическими протекторами, в составе которых несколько активных компонентов, одним из основных является янтарная кислота. В основе нарушений функций организма лежат структурные изменения, обусловленные метаболическими расстройствами. Сложная динамика развития гипоксии в организме, вовлеченность в нее широкого спектра функционально-метаболических систем объясняет сложность решения вопросов, связанных с антигипоксической защитой организма. Повышение устойчивости к гипоксии обеспечивают интермедиаты цикла Кребса - фумаровая, лимонная и янтарная кислота, включаясь в энергетический обмен как субстраты, направляя процесс окисления по наиболее экономичному пути. При гипоксии происходит функционально-метаболическое нарушение, в котором ведущую роль играет снижение уровня макроэргов. Высокая биологическая активность янтарной кислоты послужила предпосылкой создания на ее основе эффективных лекарственных препаратов (реамберин, цитофлавин). Разработанная новая метаболическая композиция ремаксол (препарат завершает клинические исследования), ориентирована на патологические состояния, сопровождающиеся нарушением метаболизма и энергетического обмена, обладает выраженным гепатопротекторным эффектом за счет стимуляции распада жировых включений в паренхиматозных органах до ацетил-КоА, поступающего в цикл трикарбоновых кислот. В экспериментальных исследованиях установлен антитоксический и гепатопротекторный эффект ремаксола на моделях экспериментального токсического и аденовирусного гепатитов с активацией тканевого дыхания, уменьшением недоокисленных метаболитов, снижением уровня цитолитических ферментов, нормализацией перекисного окисления липидов. За счет купирования изменений в системе глутатиона установлена выраженная антиоксидантная активность препарата.
Читайте также:


