Пцр диагностика туберкулеза m tuberculosis m bovis

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
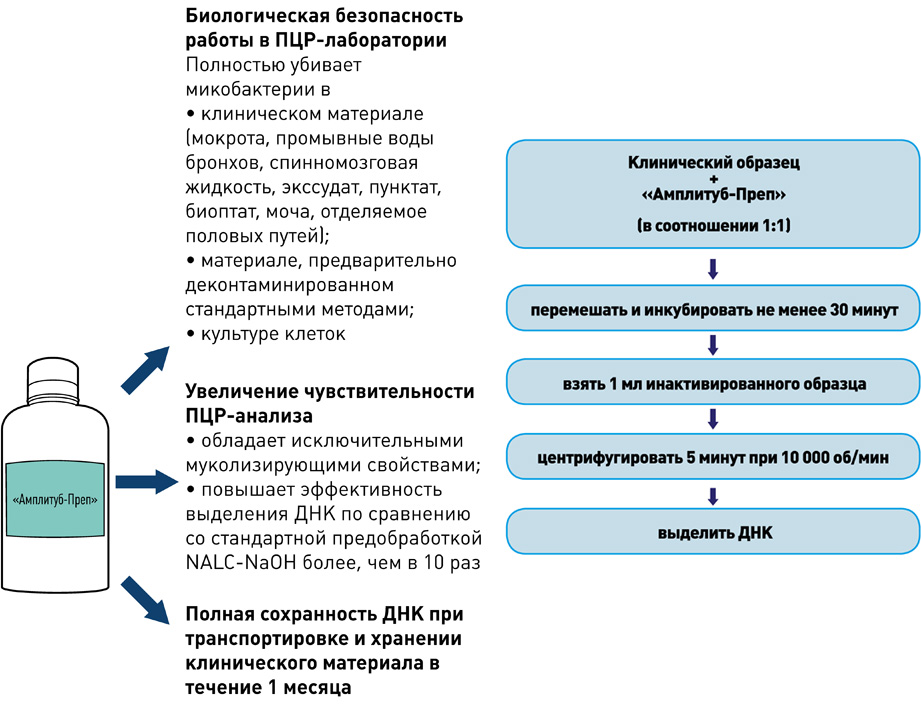
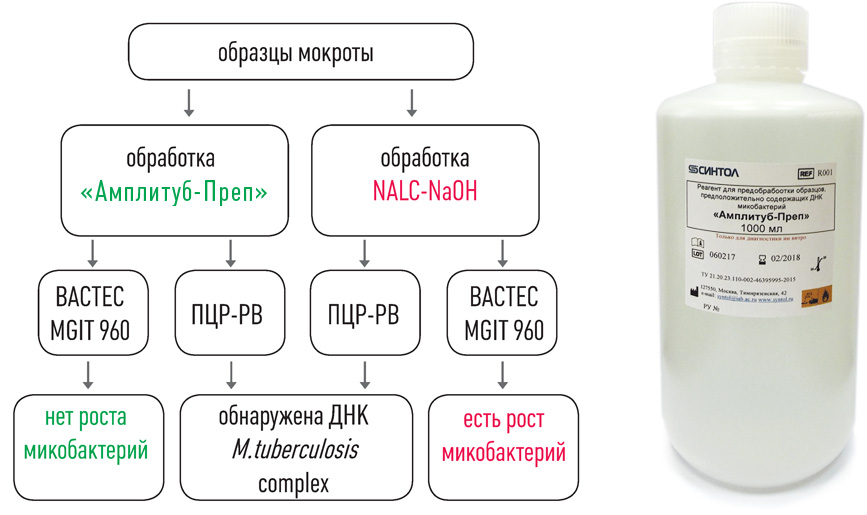
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
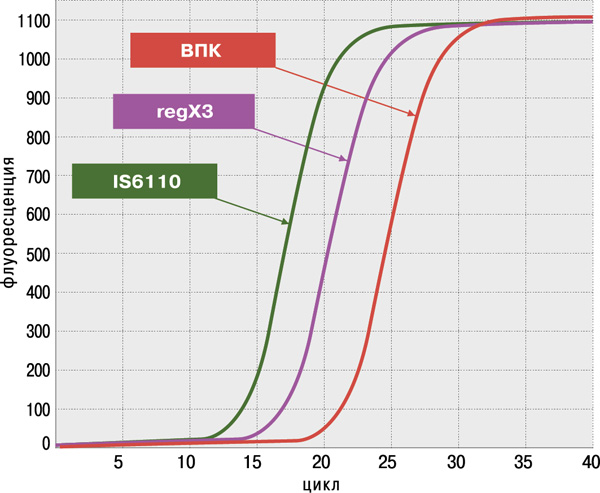
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
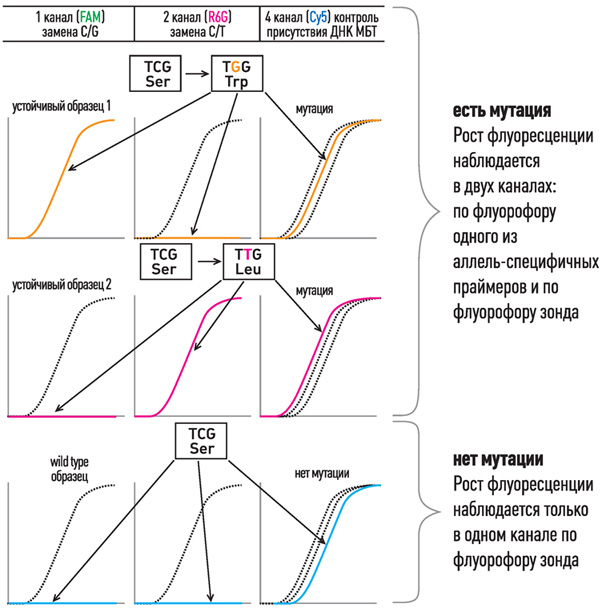
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
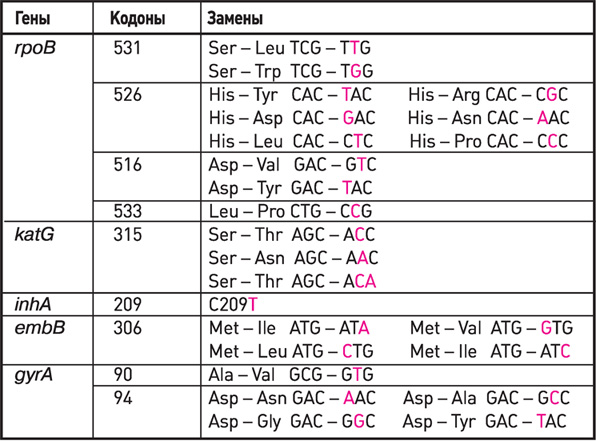
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
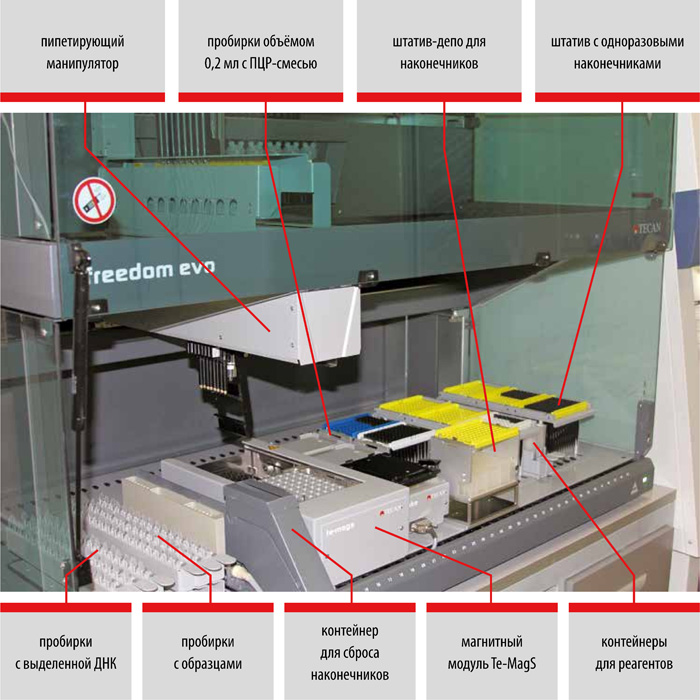
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
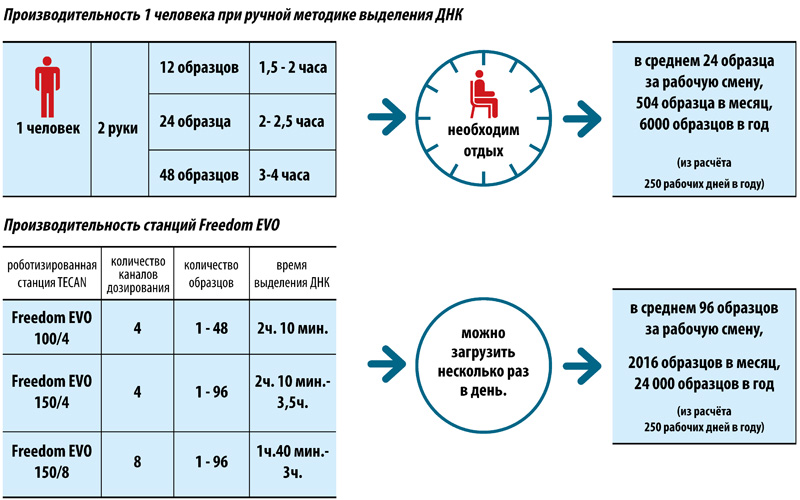

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Цена: 240 руб.
Материал: УГ соскоб, моча, эякулят
Время забора: 7:00-18:30сб. 7:00-13:00вс. 8:00-11:00
Выдача результатов: В день сдачи биоматериала через 6 часов, кроме субботы и воскресенья
Условия подготовки к анализам:
Не мочиться 2 часа
Mycobacterium tuberculosis-bovis - кач.
Определение ДНК возбудителей туберкулеза: комплекса микобактерий: M. tuberculosis, M. bovis, в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Туберкулёз (от лат. tuberculum — бугорок) – распространённое, социально зависимое заболевание человека. Болеют им и животные. Возбудитель туберкулёза открыт Р. Кохом в 1882 г. Это кислотоустойчивые аэробные бактерии (74 вида) рода mycobacterium, широко распространённые в почве, воде и у животных. У человека чаще всего возбудителем является Mycobacterium tuberculosis. Второй по частоте является Mycobacterium bovis. Оба вида очень очень устойчивы ко многим факторам внешней среды, а в организме очень долго остаются жизнеспособными и могут вызвать заболевание через многие годы после заражения. Очень важно, что микобактерии туберкулёза могут образовывать так называемые L-формы. Сохраняясь в организме, они создают противотуберкулёзный иммунитет. Длительное время туберкулёз может протекать скрыто и обнаруживаться случайно, хотя нередко уже проявляются такие симптомы, как слабость, быстрая утомляемость, субфебрильная температура, ночная потливость, а в крови – анемия и лейкопения. В настоящее время, несмотря на все достижения антимикробной терапии, туберкулёз угрожает будущему нации. Поэтому все методы диагностики, особенно его латентных форм являются крайне важными.
Существует много методов лабораторной диагностики туберкулёза: микроскопия мазка (чаще всего для этого используют мокроту), классический культуральный метод, ИФА. Всем им присущи достоинства, но и определённые недостатки, в частности, обнаружение микобактерий только в случае их достаточного количества.
В последние годы для диагностики используют полимеразную цепную реакцию (ПЦР). Её высокая чувствительность позволяет обнаружить в исследуемом материале единичные клетки и даже их фрагменты ДНК. Метод исключает перекрёстные реакции и специфичность достигает 100%. ПЦР позволяет дифференцировать ограниченные и диссеминированные формы туберкулёза, особенно у детей даже при отрицательных результатах микробиологических исследований.
- определяемый фрагмент - специфичные участки ДНК микобактерий;
- специфичность определения - 100%;
- чувствительность определения-100 копий ДНК микобактерии в образце.
Обследование женщин целесообразно проводить в первую половину менструального цикла, не ранее 5 –ого дня. Допустимо обследование во второй половине цикла, не позднее, чем за 5 дней до предполагаемого начала менструации. При наличии выраженных симптомов воспаления, взятие материала проводится в день обращения. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии (общей / местной) и во время menses, ранее 24- 48 часов после полового контакта, интравагинального УЗИ и кольпоскопии. Рекомендуется брать материал не ранее, чем через 14 дней после применения антибактериальных препаратов и местных антисептиков, и не ранее, чем через 1 месяц после применения антибиотиков перорально. Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 - 3 часов после мочеиспускания. Если для исследования берут мочу, следует собирать первую утреннюю порцию мочи в количестве 20-30 мл в стерильный флакон. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии.
- Воспаления эндометрия.
- Наличие перенесённого туберкулёза в анамнезе.
- Бесплодие при исключении гинекологической патологии у женщин.
- Ненормальная реакция на туберкулиновую пробу (гиперчувствительность или анергия) на фоне обострения какого-либо системного заболевания.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
Номенклатура МЗРФ (Приказ №804н): A26.21.048.001 "Определение ДНК микобактерий туберкулеза (Mycobacterium tuberculosis complex) в секрете простаты или эякуляте"
Биоматериал: Секрет простаты
Срок выполнения (в лаборатории): 7 р.д. *
Описание
Туберкулез — одна из самых распространенных и опасных инфекций человека. Ее вызывают бактерии Micobacterium tuberculosis (челевеческий тип) и Micobacterium bovis (бычий тип). Микроорганизы устойчивы к воздействию кислот и другим факторам окружающей среды.
Инфекция передается воздушно-капельным путем, а также через пищевые продукты, молоко, от инфицированной матери к плоду.
Клиническая картина достаточно неспецифична: слабость, повышенная утомляемость, субфебрильная температура, снижение массы тела, ночная потливость. И только позже присоединяется кашель с мокротой.
Особенно опасно инфицирование туберкулезом при явлении иммунносупрессии, на фоне тяжелых хронических заболеваний (сахарный диабет, почечная недостаточность, опухоли). Очень часто туберкулез развивается сочетано с ВИЧ инфекцией.
Одним из наиболее быстрых и высокочувствительных методов лабораторной диагностики туберкулеза является метод полимеразной цепной реакции (ПЦР). Данное исследование позволяет выявить возбудителя туберкулеза в случае внелегочных форм.
Показания к назначению
- диагностика туберкулеза легочной и внелегочной локализации в случае длительной субфебрильной температуры, снижении веса, ночной потливости, выраженной слабости;
- диагностика туберкулеза на фоне длительного кашлевого периода, особенно в сочетании с уплотненными лимфатическими узлами шейной группы;
- дифференциальная диагностика туберкулеза на фоне сомнительной рентгенологической картины;
- оценка эффективности противотуберкулезной терапии.
Подготовка к исследованию
Специальной подготовки не требуется. Взятие биоматериала (секрет простаты) осуществляет врач. Исследование не рекомендуется после проведения массажа простаты. На результат может влиять использование лекарственных препаратов ( антибактериальные, противовирусные препараты) , ингибирующее действие могут оказывать :гемоглобин, гепарин, билирубин и желчные кислоты, слизь, гормоны ферменты, соли, ионы металлов.
Интерпретация результатов/Информация для специалистов
Обнаружение ДНК Micobacterium tuberculosis и Micobacterium bovis complex в образце биоматериала свидетельствует о наличии возбудителя.
Где сдать анализ?
Адреса медицинских центров, в которых можно заказать исследование, уточняйте по телефону 8-800-100-363-0
Все медицинские центры СИТИЛАБ в г. Москва >>
| Код | Наименование | Срок | Цена | Заказ |
|---|---|---|---|---|
| 62-10-001 | Выявление ДНК Streptococcus pneumoniae (пневмококк) (кровь) | от 7 р.д. | 370.00 р. | |
| 62-10-002 | ДНК Streptococcus pyogenes (гемолитический стрептококк группы А), кровь | от 3 р.д. | 370.00 р. | |
| 62-10-770 | Выявление ДНК Listeria monocitogenes (кровь) | от 7 р.д. | 480.00 р. | |
| 62-10-800 | ДНК Chlamydia pneumoniae, кровь | от 3 р.д. | 370.00 р. | |
| 62-10-810 | ДНК Мусоplasma pneumoniae, кровь | от 3 р.д. | 370.00 р. |
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории.
Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Першикова Н. Л., Донченко Н. А.
В статье выявлено, что полимеразную цепную реакцию целесообразно применять для лабораторной диагностики туберкулеза крупного рогатого скота и как дополнительный экспресс-метод для изучения патолологического материала от животных, убитых с диагностической целью.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Першикова Н. Л., Донченко Н. А.
УДК 619:616.982.21:636 НЛ. Першикова, Н.А. Донченко
ИСПОЛЬЗОВАНИЕ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ ДНК МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
В статье выявлено, что полимеразную цепную реакцию целесообразно применять для лабораторной диагностики туберкулеза крупного рогатого скота и как дополнительный экспресс-метод для изучения патолологического материала от животных, убитых с диагностической целью.
Туберкулез - инфекционное заболевание многих видов животных, птиц и человека, характеризующееся поражением различных органов (легкие, печень, почки, селезенка и др.) с образованием в них специфических бугорков-туберкулов, подвергающихся казеозному некрозу. Болезнь протекает в хронической форме.
Возбудитель туберкулеза - микроорганизмы рода Mycobacterium (mycos - гриб, bacterium - палочка), который включает в себя более 38 самостоятельных видов. Болезнь у животных вызывают микобактерии туберкулеза бычьего (M.bovis), человеческого (M.tuberculosis) и птичьего (M.avium) видов [2].
В настоящее время основным способом диагностики туберкулеза остается внутрикожная туберкулиновая проба, а также бактериологическое исследование с постановкой биопробы на лабораторных животных [4, 5]. Однако данные методы диагностики туберкулеза занимают много времени, достаточно трудоемки и не всегда дают положительный результат. В последние годы для выявления возбудителей инфекционных болезней наиболее чувствительными и специфичными предлагаются методы, основанные на выявлении фрагментов генома возбудителя в биологическом материале с помощью молекулярной гибридизации и полимеразной цепной реакции (ПЦР). Освоение методов молекулярного анализа радикально расширило возможности изучения патогенеза инфекционных болезней и принципиально усовершенствовало диагностику [1, 3].
Наиболее перспективна ПЦР в определении некультивируемых и персистирующих форм возбудителей, патогенов, вызывающих хронические инфекции, и с выраженной антигенной изменчивостью внутриклеточных паразитов [2].
Целью наших исследований явилось использование полимеразной цепной реакции для обнаружения ДНК микобактерий в биоматериале животных.
Материалы и методы исследования. С использованием базы данных Medline и PubMed провели поиск литературы по изучению генетической структуры микобактерий, характеристике наиболее употребляемых молекулярно-генетических методов индивидуальной идентификации штаммов и культур микобактерий.
Хромосомную ДНК выделяли несколькими способами. Процедура подготовки пробы включала лизис микроба и экстракцию нуклеиновой кислоты. Выбор метода диктовался природой исследуемого образца, необходимостью предотвращать влияние ингибиторов ПЦР, сконцентрировать нуклеиновую кислоту в объеме, соответствующем формату ПЦР, и предотвратить действие ДНКаз и РНКаз.
1. К пробам добавляли по 500 мкл гуанидин-феноловой смеси, перемешивали. Экспозиция при комнатной температуре 10-15 мин.
2. Добавляли в пробы и в чистые пробирки по 100 мкл хлороформа, перемешивали и оставляли при комнатной температуре на 10-15 мин.
3. Центрифугировали 15 мин на максимальных оборотах и отбирали верхнюю фазу в пробирки, содержащие 100 мкл хлороформа. Перемешивали и 10-15 мин держали при комнатной температуре.
4. Центрифугировали 15 мин при максимальных оборотах, отбирали верхнюю фазу в пробирки, содержащие 4 мкл декстрана. Добавляли по 500 мкл изопропилового спирта и оставляли при +4оС на 40-60 мин.
Центрифугировали 15 мин при максимальных оборотах. Супернатант отбрасывали и промывали 2 раза 70%-м этанолом. Оставшийся осадок содержал выделенную ДНК, пригодную для дальнейших манипуляций.
Выделение микобактериальной ДНК из биоматериала проводили, основываясь на принципе седиментации дисперсных систем под действием силы тяжести с отделением дисперсной фазы в виде осадка, необходимого для обогащения жидкодисперсной части гомогенизата микобактериями туберкулеза, высвобожденных из тканей органов. Для этого ткани органов разрезали ножницами на кусочки и заливали 6%-м раствором щавелевой кислоты в соотношении 1:6, прикрывали фильтровальной бумагой и выдерживали 20-30 мин. После этого кислоту сливали, а биоматериал трижды промывали стерильной дистиллированной водой, растирали пестиком, добавляя стерильный песок до гомогенной массы. Гомогенизат разбавляли физиологическим раствором 1:5, взбалтывали и проводили седиментацию в течение 5 мин.
Чтобы освободиться от большого количества примесей проводили вторичную седиментацию. Для этого жидкодисперсную часть взвеси, полученную после седиментации в ступке, переносили в бактериологические пробирки, где и проводили вторичную седиментацию в течение 3 мин. Жидкодисперсную часть, полученную в пробирках, центрифугировали при 3500 оборотах в течение 20 мин. Надосадочную жидкость сливали, а осадок использовали для выделения микобактериальной ДНК.
Подбор праймеров. Для работы праймеров были подобраны такие фрагменты молекулы ДНК, которые отличались генетической консервативностью и присутствовали только у интересующего вида микроорганизмов или в исследуемом гене. Анализ последовательностей белков и генов, депонированных к настоящему времени штаммов микобактерий, проводили с использованием международных баз данных при помощи компьютерных программ PC-gene, Aligment-serves, CLUSTAL.
Компоненты полимеразной цепной реакции (ПЦР). Реакционная смесь для проведения ПЦР содержала в 25 мкл: 10*буфер рН 8,8, 2,5 мкл смеси четырех дезоксинуклеотидтрифосфатов, 5 мкл смеси праймеров, 0,5 мкл Тад-полимеразы, объем пробы доводили деионизованной (или поставляемой в наборе) водой. Исследуемую ДНК вносили в количестве 2,5 мкл. На поверхность наслаивали 1 каплю (20-25 мкл) минерального масла для ПЦР.
Второй вариант соотношения компонентов реакции соответствовал Протоколу проведения ПЦР для набора реагентов GenePak PCR Core.
Полимеразную цепную реакцию для выявления Mycobacterium tuberculosis - специфической ДНК, проводили с использованием пар праймеров 5'-CGCCTAGGCTCAAACTGCTG-3' и 5'-CAATACCCGGCGGATCTACC-3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 95°С х 5 мин (1 цикл), 95°С х 30 с, 50°С х 30 с, 72°С х 1 мин (40 циклов), 72°С х 5 мин. При использовании такого режима амплификации получали искомый фрагмент в 80 п.н.
Полимеразную цепную реакцию (ПЦР) для выявления M.avium complex - специфической ДНК, проводили с использованием пар праймеров, синтезированных на район гена IS 1245: 5'-
CCCGTTCAACGTCAACTTCC-3' и 5'-GGGCTCGCCGGTCATCAGGT -3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 95°С х 5 мин (1 цикл), 95°С х 30 с, 68°С х 2 мин, 72°С х 5 мин (30 циклов), 72°С х 4 мин. При использовании такого режима амплификации получается искомый фрагмент в 373 п.н.
Полимеразную цепную реакцию для выявления некоторых клинически значимых атипичных видов микобактерий - специфической ДНК, проводили с использованием пар праймеров, кодирующих повторяющиеся последовательности гена hsp 65: 5'-ACCAACGATGGTGTGTCCAT -3' и 5'-CTTGTCGAACCGCATACCCT -3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 94°С х 5 мин (1 цикл), 94°С х 1 мин, 60°С х 1 мин, 72°С х 1 мин (25 циклов), 72°С х 10 мин. При использовании такого режима амплификации получали искомый фрагмент в 440 п.н.
Результаты исследований. В опыте по выделению ДНК микобактерий были использованы пробы биоматериала (лимфатические узлы, печень, селезенка) от коров неблагополучного хозяйства Новосибирской области, органы от птиц и полевые культуры микобактерий, выделенные в различное время от коров из хозяйств Новосибирской области. В качестве положительного контроля использовали ДНК M.bovis, M. tuberculosis, M.avium и M. smegmatis, в качестве отрицательного контроля - органы от здоровых животных или
ДНК атипичных микобактерий. Для наработки инфицированного микобактериями биоматериала заражали морских свинок.
После убоя фиксировали видимые изменения внутренних органов и проводили бактериологическое исследование биоматериала.
Из результатов бактериологических исследований следует, что из 11 биологических образцов было выделено на питательных средах 8 изолятов микобактерий. Положительный или отрицательный сигнал при бактериологическом исследовании на наличие или отсутствие микобактерий совпал с результатами ПЦР в девяти и не совпал в двух случаях из одиннадцати исследованных образцов (табл.).
Результаты исследования биоматериала
№ опыта Бактериологическое исследование ПЦР Вид микобактерий
1 + + M. tuberculosis
7 + + Атипичные микобактерии
11 - + Атипичные микобактерии
Несовпадение результатов бактериологического анализа и метода ПЦР можно объяснить незначительным количеством микобактерий, обсеменивших биоматериал, или слабой жизнеспособностью микобактерий, а также возможным обсеменением биоматериала культурами сапрофитной микрофлоры.
Исследования показали эффективность ПЦР-анализа при обнаружении ДНК микобактерий туберкулеза и указывают на целесообразность более широкого применения этого метода в лабораторной диагностике туберкулеза сельскохозяйственных животных.
Применение комбинированных методов исследования позволяет получить более полную максимально достоверную характеристику изолятов.
1. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России I Э.В. ГeHepo3oe [и др.] II Молекулярная генетика, микробиология и вирусология. - 2000. - №1. -C. 11-16.
2. Дончєнко, А.С. Диагностика туберкулеза крупного рогатого скота I А.С. Дончєнко, Н.П. OedueHKO, Н.А. Дончєнко. - Новосибирск, 2004. - C. 3.
3. Макаров. В.В. ПЦР в диагностике лейкоза крупного рогатого скота I В.В. Макаров, Д.П. Гринишин II Ветеринария. - 2005. - №4. - С. 9-10.
4. Наставление по диагностике туберкулеза животных: утв. Департаментом ветеринарии Министерства с.х. РФ 18.11.2002 г.
5. Эффективность методов прижизненной диагностики туберкулеза I А.Н. Шаров [и др.] II Ветеринария. -2000. - № 2. - С. 16-18.
Читайте также:


