Наборы для пцр диагностики при туберкулезе

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
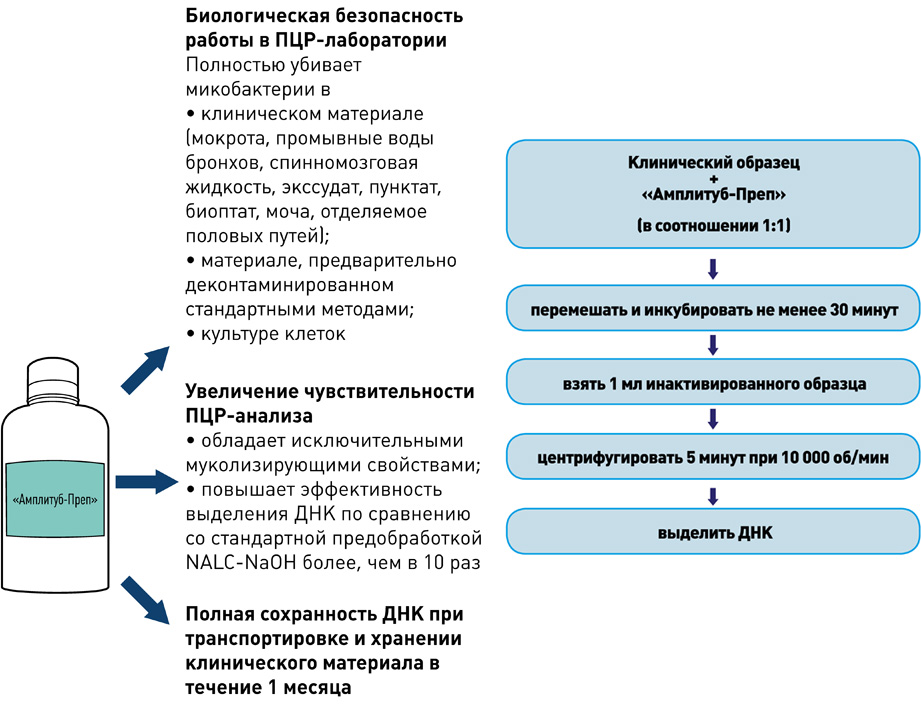
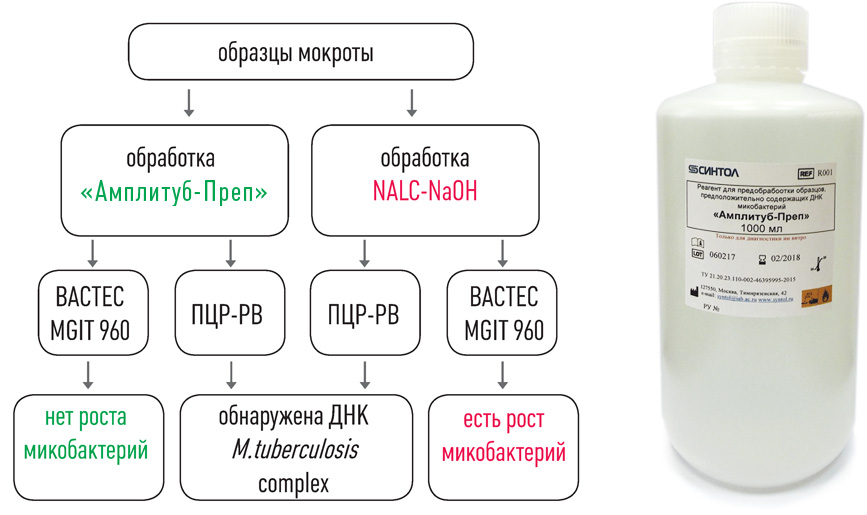
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
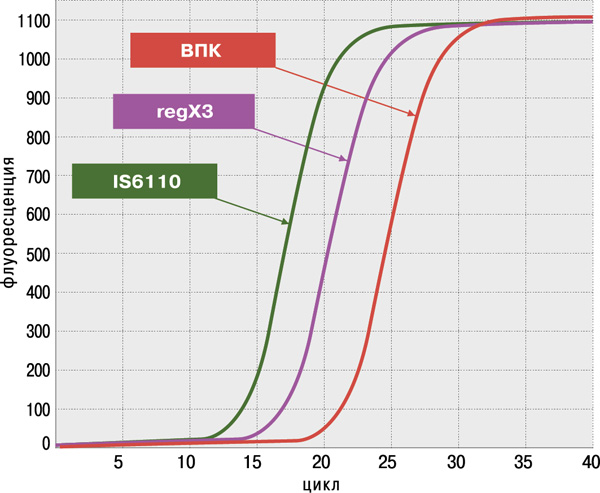
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
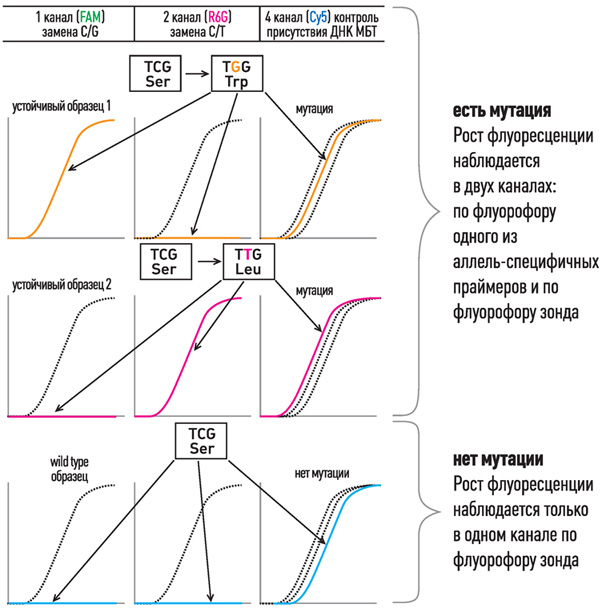
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
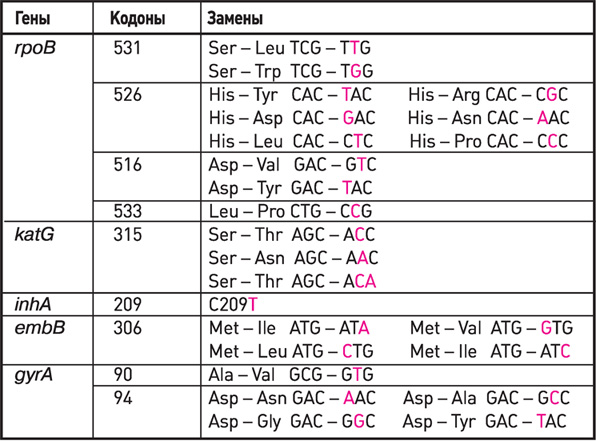
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
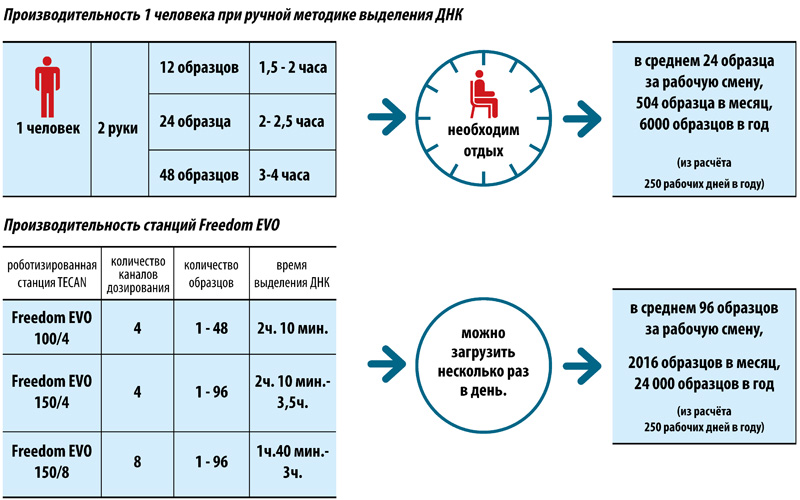

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
Т. Ю. Салина, Т. И. Морозова Государственный медицинский университет, областной противотуберкулёзный диспансер, Саратов.
Важной проблемой фтизиатрии остаётся диагностика и верификация диагноза туберкулёза у больных без выделения микобактерии. Туберкулёз без бактериовыделения часто труден для диагностики и дифференциальной диагностики [4]. До настоящего времени, несмотря на внедрение таких современных технологий, как компьютерная и магнитно-резонансная томография, и целый ряд инструментальных и инвазивных методов, диагноз туберкулёза и рака лёгких нередко ставится методом проб и ошибок. По-прежнему высок (34-40%) удельный вес ошибочной диагностики туберкулёза [3, 5]. Кроме того, существует определённая категория больных, у которых морфологическая верификация диагноза невозможна из-за возраста, тяжёлых сопутствующих заболеваний или отказа пациентов от применения инвазивных методов обследования. Разработка и внедрение в практику относительно простых, преимущественно нелучевых методов диагностики туберкулёза и его дифференциальной диагностики с другой лёгочной патологией позволяют обосновать реальные пути снижения смертности от этих заболеваний.
Целью исследования является изучение диагностической информативности прямых (молекулярно-генетических) и непрямых (серологических) методов в дифференциальной диагностике туберкулёза и других заболеваний лёгких, особенно онкологической природы.
Обследовано 96 больных с трудностями дифференциальной диагностики туберкулёза и другой лёгочной патологии, находившихся на стационарном обследовании и лечении в Саратовском областном противотуберкулёзном диспансере. Пациенты были в возрасте от 18 до 75 лет. Из них было 50 мужчин, 46 женщин. Отбор пациентов проводили слепым методом с последующей ретроспективной оценкой результатов обследования по окончательному диагнозу.
Для верификации диагноза применяли комплекс обследований, включающий микробиологические, рентгенотомографические и в ряде случаев инструментальные методы (фибробронхоскопию, компьютерную томографию органов грудной клетки, УЗИ внутренних органов, диагностическую торакотомию, плевроскопию с биопсией и последующим гистологическим и цитологическим исследованием материала).
Т. Ю. Салина, Т. И. Морозова Государственный медицинский университет, областной противотуберкулёзный диспансер, Саратов.
После комплексного клинико-рентгенологического и инструментального обследования диагноз активного туберкулёза установлен у 52 пациентов, онкологические заболевания - у 28, другие лёгочные заболевания - у 16. Морфологически при диагностической торакотомии и оперативном лечении диагноз верифицирован у 12 (12,5%) пациентов, посмертно по результатам патолого-анатомического вскрытия — у 2 (2,1%). В группе больных активным туберкулёзом у 25 пациентов установлен диагноз туберкуломы, у 21 больного - инфильтративного туберкулёза лёгких и у 6 - диссеминированного туберкулёза лёгких.
Среди онкологических больных периферический рак лёгкого установлен у 19 (67,9%) пациентов, центральный рак лёгкого - у 5 (17,9%), доброкачественные опухоли лёгких - у 3 (10,7%), метастатические поражения лёгких - у 1 (3,6%) пациента. Другие лёгочные заболевания были представлены пневмониями у 3 (18,8%) пациентов, саркоидозом у 2 (12,5%), паразитарными кистами лёгких у 2 (12,5%), хронической обструктивной болезнью лёгких у 8 (50%), лимфогранулематозом у 1 (6,3%) больного.
Всем пациентам проводили однократное исследование мокроты молекулярно-генетическим методом полимеразной цепной реакции в режиме реального времени (ПЦР Real Time ) и параллельное исследование сыворотки крови на антитела к микобактериям туберкулёза методом иммуноферментного анализа (ИФА). Забор материала для исследования проводили на догоспитальном этапе.
Базовая методология ПЦР в режиме реального времени основана на выделении очищенных нуклеиновых кислот, проведении ПЦР и гибридизации с высокоспецифичными ДНК-зондами, меченными флуорохромами, совмещении этапов амплификации и детекции результатов исследования.
Реакцию проводили с использованием ДНК- амплификатора с оптическим блоком iCycler Q ("BioRad", США). Исключение в данной методике этапа гель-электрофореза для детекции результатов позволило значительно снизить риск внутрилабораторной контаминации продуктами реакции. Использовали отечественные наборы реагентов ("ДНК-технология", Москва). Для детекции специфического продукта применяли краситель FAM, для внутреннего контроля - HEX. Результаты оценивали в соответствии с числом циклов, после которых детектировался подъем флюоресценции от изолинии.
Специфические антитела к М. tuberculosis в сыворотке крови определяли методом твердофазного ИФА (тест-система "АТ-ТУБ-Бест-стрип" ЗАО "Вектор-Бест", Новосибирск). Учет результатов проводили на многоканальном оптическом компараторе марки "Линкей" (НПО "Научные приборы", Санкт- Петербург).
Для оценки диагностической значимости указанных выше методов проводили вычисление их операционных характеристик: диагностической чувствительности, диагностической специфичности, диагностической эффективности, прогностической ценности положительного результата и прогностической ценности отрицательного результата.
Статистическую обработку результатов исследования проводили с помощью компьютерных программ " Microsoft Excel " для Windows и " Statistica ". Использовали специальные статистические методики - критерий соответствия % 2 на основе таблицы взаимной сопряженности ("четырехпольной таблицы"), для оценки достоверности разности относительных величин рассчитывали величину р, указывающую вероятность безошибочного прогноза.
Сравнительный анализ эффективности ПЦР ( Real Time ) и метода ИФА показал, что ПЦР отличается большей чувствительностью и специфичностью получаемых результатов. Так, методом ПЦР ( Real Time ) было обнаружено 40 (76,9%) положительных результатов в группе из 52 больных активным туберкулезом, в то время как методом ИФА антитела к М. tuberculosis были выявлены только у 29 (55,8%) из 52 пациентов (р = 0,0254). Из них при туберкулемах (п = 25) методом ПЦР обнаружено 20 (80%) положительных результатов, методом ИФА — 13 (52%) (р = 0,420) Не получены достоверные различия при обследовании пациентов с инфильтративным туберкулёзом (п = 21), чувствительность ПЦР составила 16 (76,2%) из 21, ИФА - 13 (61,9%) из 21 (р = 0,3325). Ложноположительные результаты ПЦР ( Real Time ) получены у 1 (3,6%) из 28 пациентов с онкологическими заболеваниями лёгких, методом ИФА - у 4 (14,3%) больных (у 2 пациентов с центральным раком лёгкого и у 2 - с периферическим раком лёгкого). Среди пациентов с неспецифическими заболеваниями лёгких получен 1 (6,3%) ложноположительный результат методом ПЦР у пациентки с лимфогранулематозом и 1 (6,3%) - методом ИФА у больного с эхинококковой кистой. Совпадение результатов исследования при использовании обоих методов наблюдалось у 31 (59,6%) из 52 больных активным туберкулёзом, у 21 (75%) из 28 больных с онкологическими заболеваниями лёгких и у 15 (93,8%) из 16 больных с неспецифическими заболеваниями лёгких, всего у 67 (69,8%) из 96 диагностированных больных. Обращает на себя внимание высокий удельный вес (14,3%) ложноположительных результатов, полученных методом ИФА, у больных с онкологическими заболеваниями лёгких.
По данным литературы [2], при постановке любых серологических проб у некоторых лиц, не больных туберкулёзом, могут определяться антитела к М. tuberculosis, что связано с возможностью перекрестных реакций на антигены других бактерий, общих с микобактериями туберкулёза, продукции антител в результате контакта с микобактериями окружающей среды, увеличением фонового уровня антител в результате поликлональной стимуляции и неспецифического связывания других сывороточных факторов. Кроме того, существуют некоторые виды опухолей (эпидермоидный рак лёгкого), которые, вероятно, обладают способностью экспрессировать антигены, сходные с антигенами микобактерий туберкулёза [1].
Сравнительная операционная характеристика ИФА и ПЦР ( Real Time ) представлена в таблице. Как следует из таблицы, метод ПЦР обладает большей чувствительностью (76,9%) и специфичностью (95,5%), чем метод ИФА (соответственно 55,8 и 88,6%). При обследовании онкологических больных специфичность метода ПЦР достигает 96,4%, тогда как специфичность ИФА на 10,7% ниже.
В результате исследования установлено, что использование новой молекулярно-генетической технологии ПЦР ( Real Time ) позволяет улучшить качество диагностики туберкулёза за счёт увеличения прогностической ценности положительного результата до 95,2% против 85,3% в ИФА (р = 0,0220) и прогностической ценности отрицательного результата до 77,7% против 62,9% соответственно (р = 0,0238), что особенно важно при обследовании дифференциально-диагностических больных. Однако методы серологической диагностики туберкулёза очень важны при обследовании пациентов, не выделяющих мокроту.
1. Кноринг Б. Е., Ариель Б. М. Оценка клинической значимости туберкулиновой сенсибилизации у больных раком легкого // Пробл. туб. - 1996. -№ 2. - С. 26-30.
2. Литвинов В. И., Гергерт В. Я., Мороз А. М. и др. Иммунология туберкулеза: современное состояние проблемы // Вестн. РАМН. -1999. - № 7. - С. 8-11.
3. Мишин В. Ю., Дейкина О. Н., Назарова Н. В. Дифференциальная диагностика туберкулеза легких и внебольничной пневмонии // Consilium Medicum . -2004. -Т. 6, № 4. - С. 232-238.
4. Хоменко А. Г. Туберкулез вчера, сегодня, завтра // Пробл. туб. — 1997. -№ 5. - С. 9-11.
5. ЮкелисЛ. И., Садиков П. В., Евфимьевский Л. В. Проблема раннего выявления и диагностики туберкулеза // Рус. мед. журн. - 2002. - Т. 10, № 16 (160). -С. 699-700.

Новый набор реагентов для выявления ДНК вируса герпеса человека 8 типа методом ПЦР в режиме реального времени РеалБест ДНК ВГЧ-8 more
Получена СЕ марка на ПЦР-наборы для диагностики ИППП, респираторных инфекций, кандидоза, ВПЧ-инфекции. more
ID] => 2423 [TIMESTAMP_X] => 18.06.2019 09:49:15 [
TIMESTAMP_X] => 18.06.2019 09:49:15 [MODIFIED_BY] => 9321 [
MODIFIED_BY] => 9321 [DATE_CREATE] => 18.06.2019 09:49:15 [
DATE_CREATE] => 18.06.2019 09:49:15 [CREATED_BY] => 9321 [
CREATED_BY] => 9321 [IBLOCK_ID] => 17 [
IBLOCK_ID] => 17 [IBLOCK_SECTION_ID] => 2403 [
IBLOCK_SECTION_ID] => 2403 [ACTIVE] => Y [
ACTIVE] => Y [GLOBAL_ACTIVE] => Y [
GLOBAL_ACTIVE] => Y [SORT] => 10800 [
SORT] => 10800 [NAME] => Туберкулёз [
NAME] => Туберкулёз [PICTURE] => [
PICTURE] => [LEFT_MARGIN] => 236 [
LEFT_MARGIN] => 236 [RIGHT_MARGIN] => 237 [
RIGHT_MARGIN] => 237 [DEPTH_LEVEL] => 2 [
DEPTH_LEVEL] => 2 [DESCRIPTION] => [
DESCRIPTION] => [DESCRIPTION_TYPE] => text [
DESCRIPTION_TYPE] => text [SEARCHABLE_CONTENT] => ТУБЕРКУЛЁЗ [
SEARCHABLE_CONTENT] => ТУБЕРКУЛЁЗ [CODE] => [
SOCNET_GROUP_ID] => [LIST_PAGE_URL] => /prod/index.php [
LIST_PAGE_URL] => /prod/index.php [SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2423 [
SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2423 [IBLOCK_TYPE_ID] => products [
IBLOCK_TYPE_ID] => products [IBLOCK_CODE] => catalog [
IBLOCK_CODE] => catalog [IBLOCK_EXTERNAL_ID] => [
EXTERNAL_ID] => [IPROPERTY_VALUES] => Array ( ) [PATH] => Array ( [0] => Array ( [ID] => 2403 [
ID] => 2403 [CODE] => root_pcr [
CODE] => root_pcr [XML_ID] => [
EXTERNAL_ID] => [IBLOCK_ID] => 17 [
IBLOCK_ID] => 17 [IBLOCK_SECTION_ID] => [
IBLOCK_SECTION_ID] => [SORT] => 8800 [
SORT] => 8800 [NAME] => ПЦР диагностика [
NAME] => ПЦР диагностика [ACTIVE] => Y [
ACTIVE] => Y [DEPTH_LEVEL] => 1 [
DEPTH_LEVEL] => 1 [SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2403 [
SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2403 [IBLOCK_TYPE_ID] => products [
IBLOCK_TYPE_ID] => products [IBLOCK_CODE] => catalog [
IBLOCK_CODE] => catalog [IBLOCK_EXTERNAL_ID] => [
IBLOCK_EXTERNAL_ID] => [GLOBAL_ACTIVE] => Y [
GLOBAL_ACTIVE] => Y [IPROPERTY_VALUES] => Array ( ) ) [1] => Array ( [ID] => 2423 [
EXTERNAL_ID] => [IBLOCK_ID] => 17 [
IBLOCK_ID] => 17 [IBLOCK_SECTION_ID] => 2403 [
IBLOCK_SECTION_ID] => 2403 [SORT] => 10800 [
SORT] => 10800 [NAME] => Туберкулёз [
NAME] => Туберкулёз [ACTIVE] => Y [
ACTIVE] => Y [DEPTH_LEVEL] => 2 [
DEPTH_LEVEL] => 2 [SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2423 [
SECTION_PAGE_URL] => /prod/index.php?SECTION_ID=2423 [IBLOCK_TYPE_ID] => products [
IBLOCK_TYPE_ID] => products [IBLOCK_CODE] => catalog [
IBLOCK_CODE] => catalog [IBLOCK_EXTERNAL_ID] => [
IBLOCK_EXTERNAL_ID] => [GLOBAL_ACTIVE] => Y [
GLOBAL_ACTIVE] => Y [IPROPERTY_VALUES] => Array ( ) ) ) ) [SECTIONS_COUNT] => 0 )
| № по каталогу | Наименование и краткое описание | Количество определений |
|---|---|---|
| D-2398 |
РеалБест ДНК МВТС (форма 1) Набор реагентов для выявления ДНК микобактерий туберкулёзного комплекса методом полимеразной цепной реакции в режиме реального времени. Содержит реагенты для выделения ДНК и предобработки проб. | 48 |
| D-2399 |



