Методы диагностики туберкулеза у животных пцр
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>

Оглавление диссертации Суханов, Игорь Павлович :: 1999 :: Москва
1. Обзор литературы.
1.1. Методы диагностики туберкулеза крупного рогатого скота.
1.2. Методы прижизненной диагностики.
1.2.1. Клинический осмотр.
1.2.2. Аллергическое исследование.
1.2.3. Серологическое исследование.
1.3. Методы послеубойной (посмертной) диагностики туберкулеза крупного рогатого скота. ^
1.3.1. Патологоанатомическое исследование. I ^
1.3.2. Бактериологическое исследование.
1.3.2.2. Культуральное исследование.
1.3.2.3. Биологическое исследование (биопроба).
1.4. Полимеразная цепная реакция в диагностике туберкулеза крупного рогатого скота. ^з
2. Собственные исследования.
2.1. Материалы и методы исследования.
2.2. Результаты исследования.
2.2.1 .Сравнительная оценка тест-систем ПЦР.
2.2.2 Определение режима тепловой обработки лабораторной посуды для разрушения ДНК возбудителя туберкулеза.
2.2.3.Разработка метода деконтаминации биоматериала от животных с поверхности от возбудителя туберкулеза и его ДНК.
2.2.4.Сравнительная оценка в остром опыте микроскопического, кулыуралыюго, биологического, серологического, патологоанато-мического методов исследований и ПЦР для диагностики туберку леза у крупного рогатого скота.
2.2.4.1 .Прижизненная диагностика.
2.2.4.2 .Послеубойная диагностика. 85 2.2.6.Идентификация культур кислотоустойчивых микроорганизмов.
Введение диссертации по теме "Ветеринарная эпизоотология, микология с микотоксикологией и иммунология", Суханов, Игорь Павлович, автореферат
Актуальность темы. Туберкулезом из сельскохозяйственных животных наиболее часто поражается крупный рогатый скот. Неблагополучные по туберкулезу хозяйства несут убытки, которые складываются из стоимости погибших от туберкулеза животных и выбракованных туш, пораженных органов, снижения удоев, качества молока, недополучения приплода и молока при преждевременной сдаче на убой выявленных больных коров, а также затрат на проведение противотуберкулезных мероприятий, ограничений хозяйственной деятельности и т.п. Больные животные представляют опасность для здоровья людей (12, 13, 44, 57).
Эта проблема до настоящего время актуальна для многих регионов России, в которой заболеваемость крупного рогатого скота туберкулезом составляет около 2% от имеющегося поголовья (1) и достигает 30% от общей инфекционной патологии у взрослых животных этого вида (27, 68).
В основу противотуберкулезных мероприятий в нашей стране положен комплекс мер, научно разработанных С.Н. Вышелесским совместно с В.Н. Матвеевым, дополненный и усовершенствованный П.П. Вишневским, М.К. Юсковцом . и др. (138).
В общей системе мер борьбы с туберкулезом наиболее важным звеном является своевременная и достоверная диагностика (133, 163,174). Вместе с тем, имеющиеся на ветеринарном вооружении тесты не в полной мере отвечают предъявляемым к ним, необходимым на сегодняшний день, требованиям. Многие из них весьма трудоемки и не отличаются достоверностью (133, 134, 185).
Основное в профилактике туберкулеза - разрыв контакта с источником инфекции, которым является больное животное. Поэтому своевременное выявление таких животных - главное звено противотуберкулезных мероприятий.
Особенностью туберкулеза, как одной из хронических инфекций, является преобладание латентных форм и случаев бактерионосительства (83, 85, 86). Случаи клинического проявления болезни у крупного рогатого скота возникают обычно лишь при длительном течении и особенно в неблагоприятных условиях его содержания и кормления. За это время, до обнаружения заболевания может произойти перезаражение значительной части поголовья скота (195, 196). Основой прижизненной диагностики туберкулеза является туберкулиновая проба (115,129, 153). Однако нередкими являются случаи проявления парааллергической реакции на туберкулин, вызываемые сенсибилизацией организма животных некоторыми атипичными микобактериями (17,42, 51, 52, 100). Такая ситуация может приводить к ошибочной диагностике с последующими неоправданными расходами на проведение специальных патологоанатомических, бактериологических и аллергических исследований. При послеубойном осмотре крупного рогатого скота, реагировавшего на туберкулин, не всегда удается установить туберкулезные изменения во внутренних органах и тканях животных (83-86).
Лабораторные исследования на туберкулез проводятся в сроки до трех месяцев, а в некоторых случаях могут длиться до полугода и более. Кроме того, выявление инфекционного агента при туберкулезе может быть осложнено из-за наличия у бактерий ультрамелких и Ь- форм. На проведение таких исследований затрачивается до двух лет (71-73).
Сложность определения состояния стада по туберкулезу состоит еще и в том, что заболевание считается установленным при обнаружении характерных признаков болезни на секции или выделении возбудителя, но не может быть полностью исключено при отрицательных данных этих исследований, если в стаде есть животные, реагирующие на туберкулин.
В последние годы для диагностики ряда болезней предложена поли-яеразная цепная реакция, которая является высокочувствительным экспресс методом исследования (16, 40, 43, 45, 46, 74,82). Налажено производство тест - систем ПЦР, в т.ч. и для туберкулеза.
В то же время совсем не разработаны условия исследования на туберкулез: какой биоматериал, в каком виде и объеме необходимо исследовать в ПЦР и какая требуется предварительная подготовка этого материала для исключения возможности получения ложноположительных и ложноотрица-тельных результатов ПЦР.
В связи с этим разработка метода диагностики туберкулеза крупного рогатого скота с применением полимеразной цепной реакции (ПЦР), применение этой реакции для индикации и идентификации возбудителя в пробах, который не может быть быстро выявлен по каким либо причинам (длительный срок и низкая эффективность исследования, невозможность определения Ь - форм микобактерий, сложность выявления клеток возбудителя в биоматериале без выраженных туберкулезных поражений), традиционными методами исследования, является актуальной проблемой и одним из важнейших направлений научных исследований по туберкулезу.
Цель исследований. Разработать метод диагностики туберкулеза у крупного рогатого скота с применением полимеразной цепной реакции (ПЦР).
Для достижения поставленной цели было необходимо решить следующие задачи:
1 .Провести испытание отечественных тест - систем ПЦР для индикации возбудителя туберкулеза в биоматериале.
2.Разработать методы разрушения ДНК возбудителя туберкулеза на поверхности биоматериала и лабораторной посуды.
3 .Испытать ПЦР для прижизненной диагностики туберкулеза у телят в эксперименте. Определить динамику появления и сохранения агглютининов в крови зараженных телят с помощью реакции агглютинации латекса (РАЛ).
4.Определить в остром опыте эффективность ПЦР при диагностике туберкулеза у животных в сравнении с традиционными методами исследования.
5.Разработать наставление по диагностики туберкулеза у крупного рогатого скота с применением полимеразной цепной реакции.
Установлено, что разрушение ДНК М.Ьо^ на поверхности контами-нированного биоматериала происходит при четырехкратном фламбировании пробы.
Доказано, что воздействие концентрированным раствором перманга-ната калия и пергидроля с содержанием 30% перекиси водорода в течение соответственно 10 и 60 мин не разрушает ДНК М.Ьот.
Показано, что разрушение ДНК М.Ьот на поверхности лабораторной посуды достигается прогреванием ее при 180-200 °С в течение двух часов.
Выявлено, что для индикации ДНК М.Ьоу18 необходимо исследование в ПЦР гомогенизированного биоматериала.
Установлено раннее - от 5 до 23 суток появление возбудителя туберкулеза в носовой слизи после алиментарного заражения животных и возможность с помощью ПЦР выявления таких животных.
Установлена возможность локализации М.Ьот в миндалинах зараженных животных, что делает целесообразным включение этого органа в число проб для исследования на туберкулез.
Испытания показали, что имеются отечественные высококачественные тест-системы ПЦР для диагностики туберкулеза.
Разработаны методы отбора и обработки проб биоматериала от крупного рогатого скота для исследования на туберкулез методом ПЦР.
Сделан сравнительный анализ чувствительности и специфичности традиционных методов диагностики туберкулеза крупного рогатого скота и ПНР. Установлено, что ПЦР может быть использована для контроля благопо лучия животных по этой болезни путем регулярного исследования носовой слизи животных.
Установлено, что ПЦР высоко эффективна при идентификации и дифференциации возбудителя туберкулеза; по достоверности получаемого результата, а также скорости исследования во много раз превосходит культу-ральные и биологические методы идентификации M.bovis и М.tuberculosis.
На основании проведенных исследований разработано "Наставление по диагностике туберкулеза крупного рогатого скота с применением полиме-разной цепной реакции (ПЦР)", утвержденное Департаментом ветеринарии 23.02.99. Издан приказ Департаментом ветеринарии № 23 от 08.06.99. "О проведении широкого производственного испытания метода диагностики туберкулеза у крупного рогатого скота с применением полимеразной цепной реакции (ПЦР)", с использованием указанного наставления.
На защиту выносятся:
1 .Результаты испытания отечественных тест-систем ПЦР для диагностики туберкулеза.
2.Результаты разработки методов деконтаминации лабораторной посуды и поверхности биоматериала от ДНК M.bovis.
3 .Результаты диагностики туберкулеза с помощью полимеразной цепной реакции и реакции агглютинации латекса.
Заключение диссертационного исследования на тему "Диагностика туберкулеза крупного рогатого скота с применением полимеразной цепной реакции"
1 .Исследованиями установлено, что имеются отечественные тест-системы ПЦР для диагностики туберкулеза, обладающие достаточно высокой чувствительностью и специфичностью. Эти тест-системы высокоэффективны для прижизненной диагностики туберкулеза, при идентификации и дифференциации М.Ьо\т8 и М.ШЬегси^з.
2.ПЦР может быть использована для контроля благополучия молодняка крупного рогатого скота по туберкулезу и выявления зараженных животных путем регулярных исследований носовой слизи животных.
При исследовании послеубойного материала ПЦР уступает по эффективности биологическому методу диагностики. Повышение чувствительности этой реакции может быть достигнуто увеличением количества исследуемых проб и гомогенизацией плотного биоматериала. Положительные результаты реакции наиболее часты при исследовании заглоточных, подчелюстных, сре-достенных и бронхиальных лимфатических узлов.
Культуральный метод исследования мало эффективен для прижизненной диагностики туберкулеза.
3.При механической контаминации лабораторной посуды и поверхности плотного биоматериала разрушение ДНК возбудителя обеспечивается прогреванием посуды при (180-200) °С в течение двух часов и при четырехкратном фламбировании биоматериала.
Насыщенный раствор перманганата калия и пергидроль с содержанием 30% перекиси водорода при воздействии соответственно 10 и 60 мин не обеспечивает разрушение фрагментов ДНК на поверхности биоматериала.
4.С помощью реакции агглютинации латекса возможно выявление противотуберкулезных антител в разные сроки после заражения животных.
1 .В лабораторию ПЦР - диагностики должен поступать гомогенизированный биоматериал, предварительно деконтаминированный от механического загрязнения ДНК М.Ьот.
2.ПЦР может быть использована для прижизненной диагностики туберкулеза молодняка крупного рогатого скота путем регулярного исследования носовой слизи животных.
3.На основании полученных результатов исследований составлено и утверждено Департаментом ветеринарии Минсельхозпрода РФ 23.02.99 "Наставление по диагностике туберкулеза крупного рогатого скота с применением полимеразной цепной реакции (ПЦР)"
По результатам наших исследований издан приказ Департаментом ветеринарии № 23 от 08.06.99. "О проведении широкого производственного испытания метода диагностики туберкулеза у крупного рогатого скота с применением полимеразной цепной реакции (ПЦР)", с использованием указанного наставления.
Наши исследования показали, что ПЦР в настоящее время может быть использована в качестве основного метода прижизненной диагностики туберкулеза у крупного рогатого скота и как дополнительный метод при после
115 убойной диагностике болезни. Положительный результат ПЦР - анализа дол жен рассматриваться как основание для постановки диагноза на туберкулез.
Данный метод исследования требует проведения широких производственных испытаний, после чего можно будет сделать окончательный вывод о том какое место ПЦР займет в диагностики туберкулез крупного рогатого скота.
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
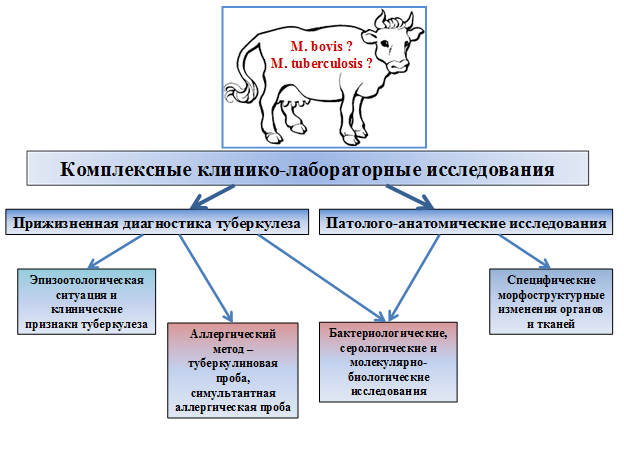
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
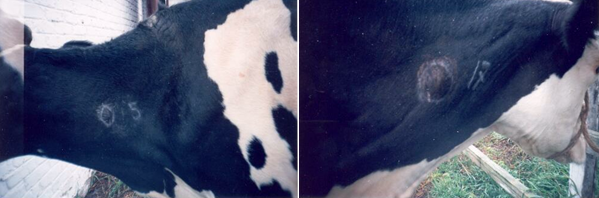
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
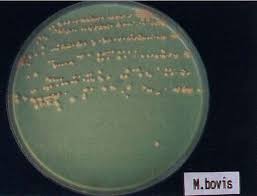
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
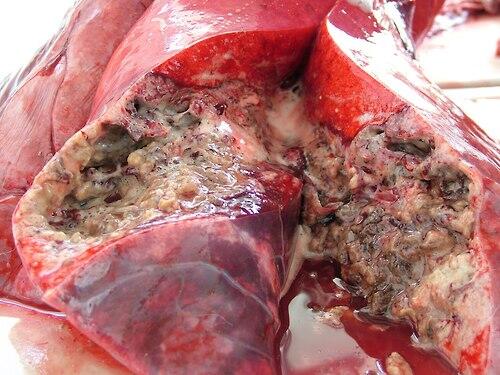
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
Туберкулез — инфекционная хронически протекающая болезнь животных всех видов и человека, характеризующаяся поражением органов и тканей с образованием в них специфических бессосудистых узелков — туберкулов с творожистым перерождением и обызвествлением пораженной ткани.
Болезнь у животных вызывают микобактерии туберкулеза бычьего, человеческого и птичьего видов.

Туберкулез животных: 1 – микробактерии туберкулеза под микроскопом ( окраска по Цилю — Нельсену );
2 – рост микобактерий туберкулеза вида Mykobacterium на среде Петраньяни ;
3 – положительная внутрикожная реакция на туберкулин у коровы ;
4 – положительная внутрикожная реакция на туберкулин у курицы ;
5 – положительная внутрикожная реакция на туберкулин у свиньи ;
6 – лобулярный казеоз в легких с обызвествлением и осумкованием ;
8 – первичный аффект в легком и лучистый казеоз бронхиальных лимфатических узлов .
Микобактерии туберкулеза бычьего вида патогенны для крупного рогатого скота. К ним также восприимчивы все млекопитающие животные и человек. К возбудителю туберкулеза человеческого вида восприимчивы, кроме человека, свиньи, козы, кошки, собаки. Возбудитель туберкулеза домашних и диких птиц может вызывать патологические изменения у свиней. У крупного рогатого скота возбудитель туберкулеза птичьего вида вызывает кратковременную сенсибилизацию организма к туберкулину.
Способность микобактерий туберкулеза длительное время сохраняться в различных объектах внешней среды и продуктах животноводства, высокая устойчивость их к воздействиям неблагоприятных факторов, восприимчивость к этим микроорганизмам всех позвоночных животных, птиц и человека делают эту болезнь трудно искоренимой.
В борьбе с туберкулезом наиболее важна своевременная диагностика болезни, недопущение ее распространения и оперативное принятие мер по ликвидации возникших эпизоотических очагов.
При диагностике туберкулеза у животных используют эпизоотологический, клинический, патологоанатомический, гистологический, бактериологический, аллергический и молекулярно-генетический (полимеразная цепная реакция- ПЦР) методы исследования.
Основными, обязательными методами исследования на туберкулез являются внутрикожная (у овец, коз и пушных зверей: норок, песцов- пальпебральная, у лошадей- глазная) туберкулиновая проба, патологоанатомическое и бактериологическое исследование.
В целях контроля благополучия поголовья проводят клинический осмотр и плановые поголовные туберкулинизации животных:
-коров и быков-производителей – 2 раза в год: весной, перед выгоном на пастбище и осенью, перед постановкой скота на зимнее содержание, а молодняк крупного рогатого скота (начиная с 2х мес. возраста) и скота откормочных групп – 1 раз в год;
— свиней в племенных хозяйствах 1 раз в год, а на остальных свинофермах – в зависимости от эпизоотической обстановки.
На туберкулин реагируют не только животные, инфицированные возбудителем туберкулеза, но и животные, сенсибилизированные атипичными микобактериями, микобактериями птичьего вида, возбудителем паратуберкулеза, а также могут быть псевдоаллергические реакции, вызванные наличием паразитов, гнойно-некротических процессов в организме, что ведет к неоправданному убою высокопродуктивных здоровых животных.
Для диагностики туберкулеза у крупного рогатого скота при первичной постановке диагноза, а также для контроля за благополучием животных по туберкулезу в хозяйствах, где реакции на туберкулин обусловлены сенсибилизацией атипичными микобактериями применяют симультанную аллергическую пробу.

Одновременно с внутрикожной туберкулиновой пробой применяют пальпебральный метод туберкулинизации крупного рогатого скота для дифференциации специфических и параспецифических реакций при первичной постановке диагноза. На пальпебральную пробу реагирует только крупный рогатый скот, зараженный возбудителем бычьего или человеческого видов. Животные, инфицированные атипичными микобактериями, на пальпебральную пробу не реагируют.
Офтальмопробу можно использовать одновременно с внутрикожной туберкулиновой пробой при отборе животных для диагностического убоя. Наиболее часто диагноз на вскрытии подтверждается у животных, реагирующих одновременно на внутрикожную пробу и офтальмопробу.
В общем комплексе мер борьбы с туберкулезом сельскохозяйственных животных в ряде случаев решающее значение имеет лабораторная диагностика, целью которой является подтверждение специфических слабовыраженных и отсутствующих изменений в органах специальным патоморфологическим их изучением и обнаружение возбудителя туберкулеза в биологическом материале убитых животных посредством микроскопии, бактериологических посевов и постановкой биологической пробы.
Сущность бактериологического метода исследования заключается в выявлении и выделении культур микобактерий, определении вида возбудителя туберкулеза.
Важно правильно организовать проведение диагностического убоя реагирующих на туберкулин животных и качественно взять материал для исследования. При диагностике туберкулеза обязательному осмотру подвергают у млекопитающих: заглоточные, подчелюстные, бронхиальные, средостенные, брыжеечные, портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы, легкие, печень, селезенку, молочную железу, плевру, брюшину, кишечник. У птиц – печень, селезенку, кишечник в области илеоцекального соединения.
Патологоанатомические изменения при туберкулезе характеризуются образованием в органах и тканях гранулем (туберкулов). Туберкулы плотные, светло-серого или серовато-желтого цвета с творожистой массой в центре (казеозный некроз), частично или полностью обызвествленные, окруженные соединительнотканной капсулой.
Материал для лабораторных исследований отбирают от каждого животного в отдельности. Для бактериологического исследования направляют от млекопитающих – лимфатические узлы: заглоточные, подчелюстные, бронхиальные, средостенные, брыжеечные; лимфатические узлы, взятые в области илеоцекального соединения и подвздошной кишки, упаковывают отдельно от остальных лимфатических узлов. Портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и внутренние органы (легкие, печень, почки) направляют только при наличии туберкулезных изменений.
Парные лимфатические узлы отбирают оба, указав их название на этикетке, которую помещают вместе с пробой.
Лабораторные исследования на туберкулез должны быть проведены в срок до 3 месяцев. Определение вида возбудителя – в срок до 3 месяцев после выделения культуры.
Нередки факты, когда у реагирующих на туберкулин животных при убое не обнаруживают специфических для туберкулеза изменений, а лабораторные исследования не дают положительных результатов. Вероятно, это связано с тем, что возбудитель не всегда в организме находится в типичной палочковидной форме и классическими бактериологическими методами они не обнаруживаются. Исследованиями многих отечественных и зарубежных ученых была доказана изменчивость возбудителя туберкулеза. Были обнаружены Л-формы – микроорганизмы, частично или полностью утратившие клеточную стенку и способные к репродукции в таком состоянии, а при возникновении определенных условий способных к реверсии в исходную бактериальную форму. Исследование материала для выделения Л-форм микобактерий туберкулеза проводят при постановке первичного диагноза и в оздоравливаемых хозяйствах в случае выявления реагирующих на туберкулин животных при контрольных исследованиях.
При постановке диагноза на туберкулез применяют молекулярно-генетический метод исследования (ПЦР).
Гистологическое исследование проводят для дифференциации патологоанатомических изменений, типичных для туберкулеза, и сходных изменений, наблюдаемых при других болезнях.
Читайте также:


