Лаборатория молекулярной диагностики туберкулеза сеченова

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
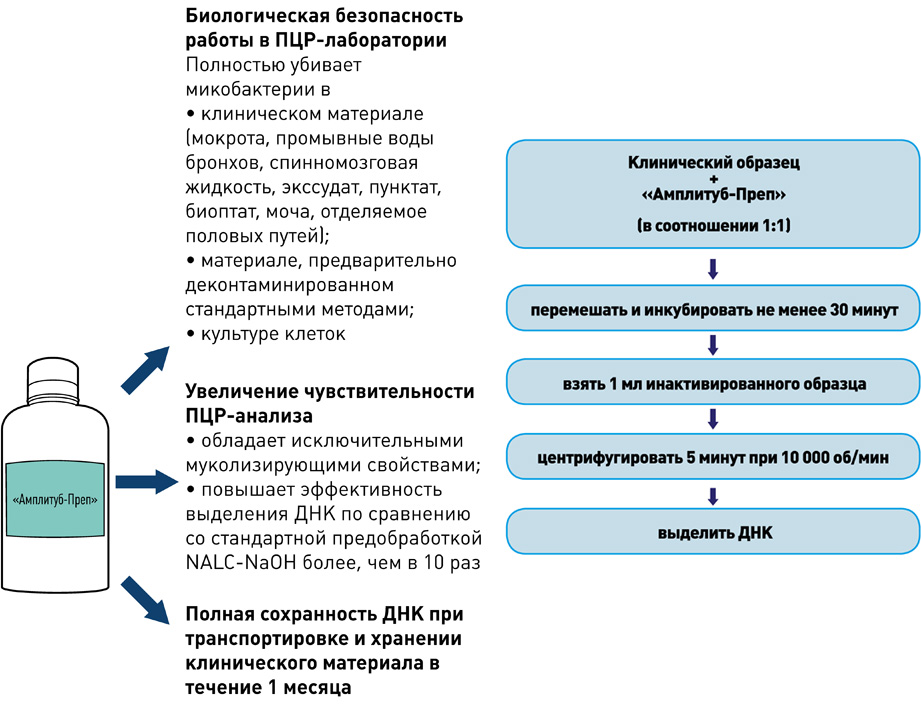
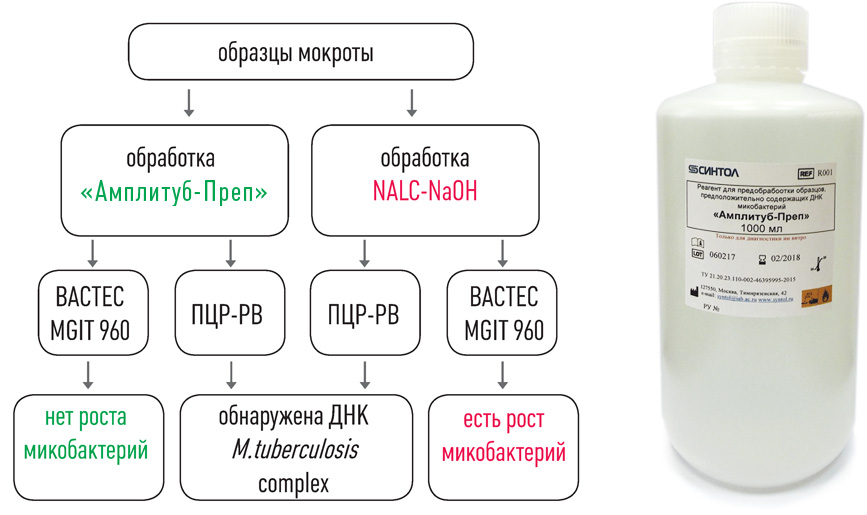
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
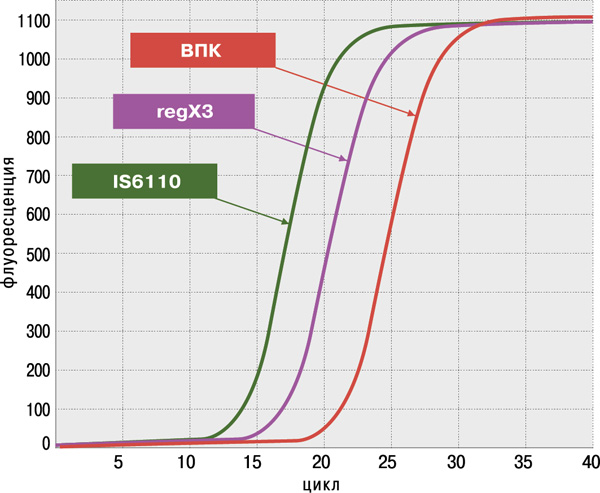
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
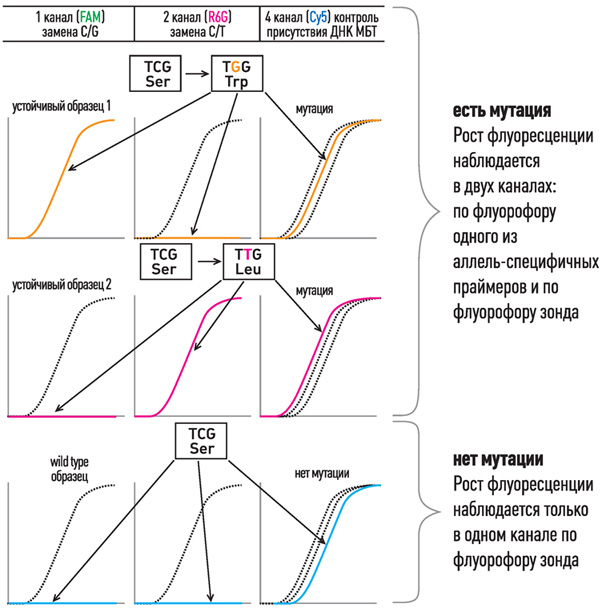
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
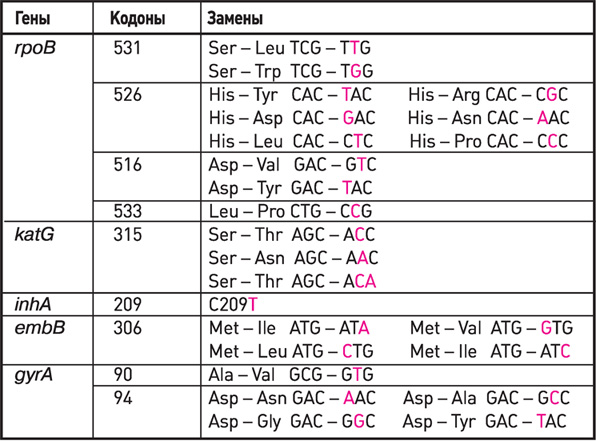
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
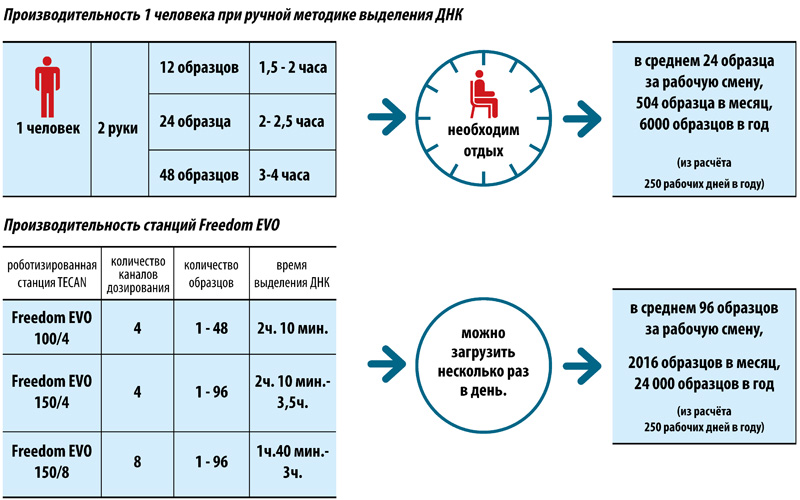

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Инфекции органов репродукции, массовое параллельное секвенирование (NGS); диагностика, эпидемиология и лечение туберкулеза; трансфузиология и трансплантология; инфекционные патологии желудочно-кишечного тракта; внутрибольничные инфекции и проблемы антибиотикорезистентности.
Отчет о пленарном заседании и пресс-брифинге
Отчет о секциях первого дня
Художник: Саша Кук

Художник: Саша Кук
Елена Клещенко, Алексей Торгашев, при участии Марии Альварес Фигероа
Заслуженный деятель науки РФ Алевтина Савичева (НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта, Санкт-Петербург) рассказала об инновационных методах диагностики репродуктивно значимых инфекций.
Докладчица рассказала о преимуществах молекулярных методов диагностики, однако подчеркнула, что начинать с молдиагностики не следует, нужно оценить микробиоценоз влагалища, цервикального канала и уретры.
Аналогичная ситуация с бактериальным вагинозом (БВ). Из 124 женщин с диагнозом врача БВ обнаружился только у 42.
Юрий Тюленев (ФБУН ЦНИИЭ Роспотребнадзора, Москва) рассказал о проблеме экстрагенитальной локализации ИППП и тактике обследования пациентов, подчеркнув, что у мужчин, практикующих секс с мужчинами, мазки надо брать из ротовой полости и ануса.
О генетическом и генотипическом разнообразии штаммов Chlamydia trachomatis, выявляемых в мазках-соскобах из урогенитального тракта, рассказала Людмила Рубаник (Республиканский НПЦ эпидемиологии и микробиологии, Минск).
Олег Гусев (RIKEN-KFU Translational Genomics Unit, RIKEN, Япония) рассказал о консорциуме MUSCLE-FANTOM — это первый консорциум по геномике, которым руководят русские исследователи. Среди задач, которые стоят перед консорциумом, —исследование методами NGS регуляторных механизмов формирования и ремоделинга мышц человека, создание атласа активности промоторов и энхансеров транскрипции РНК в мышечной ткани в норме и при патологии. Теперь приходит понимание, что значительная часть клинически важных мутаций находится не в кодирующих областях, которые обычно секвенируют, а, например, в сильно удаленных от них энхансерах, и эти мутации крайне важны для диагностики. Фактически происходит смена парадигмы. Ожидается, что результаты работы консорциума найдут применение в медицинской и спортивной генетике.
Тема доклада Алины Мацвай (ЦНИИЭ Роспотребнадзора, Москва) — поиск вирусных патогенов в биологических образцах с помощью NGS. Для ПЦР в реальном времени необходимо знать заранее или хотя бы предполагать, что мы можем найти в данном образце, чтобы использовать праймеры к определенной последовательности. Выявлять не известного заранее возбудителя можно с помощью NGS, но нет смысла секвенировать всю ДНК в биообразце, где надо определить вирусы, поскольку большая ее часть принадлежит хозяину. Для решения этой задачи используются специфические зонды (ДНК-баркодинг, или штрихкодирование). Очень важно правильно выбрать маркерную область; хорошо известны в этом качестве гены 16S РНК. Однако у вирусов с их высоким разнообразием такой общей области нет, поэтому маркер выбирают для каждого рода с помощью множественного выравнивания.
Сотрудники ЦНИИЭ создали праймерную панель, которая покрывает 22 рода вирусов, для исследования вириома перелетных птиц. Задача была в том, чтобы постановкой одной ПЦР выявить максимальное число вирусных геномов. Авторы работы составили также коктейль праймеров для вирусов, переносимых клещами, уделяя особое внимание орбивирусам.
Павел Скумс (факультет информатики Университета штата Джорджия) рассказал о том, как применяются биоинформатические методы для расследования вспышек вирусных заболеваний. Прорыв в этой области произошел благодаря технологиям NGS, позволяющим получать в короткое время множество последовательностей вирусных геномов. Для вирусов характерна высокая скорость мутаций, и если представить данные графически, то вместо отдельных точек мы теперь видим разветвленные деревья: популяции вирусов, или квазивиды.
Построение таких деревьев помогает установить, кто кому передал вирус (докладчик отметил, что исследования финансируются Национальными институтами здоровья). В США вирусы гепатитов и ВИЧ активно распространяются среди наркоманов через инъекции. Задача математика — получить геномные последовательности, выявить кластеры и историю трансмиссий. Сравнительно простой случай — когда наркозависимый медработник использует шприцы, предназначенные для пациентов. Но если геномы вирусов в организме одного человека не идентичны, и другому человеку передается вирус из минорного кластера, с высокой вероятностью он не будет обнаружен и реконструировать путь передачи не удастся.
Докладчик остановился на недостатках филогенетического анализа: прежде всего, его тяжело автоматизировать, кроме того, филогенетическое дерево дает лишь приближенные пути трансмиссии. Он также рассказал об алгоритмах для подсчета расстояний между вирусными популяциями, о методах, которые используют не только геномные, но и эпидемиологические данные. Однако в случае хронических болезней эпидемиология не очень помогает, потому что время заражения часто бывает неизвестно, поэтому новое поколение алгоритмов использует только геномы вирусных популяций. Автор доклада с коллегами разработал алгоритм QUENTIN, в основе которого лежит понятие о социальной сети индивидов, контактирующих друг с другом. У такой сети есть определенные математические свойства, и если их учитывать, предсказание станет точнее.
С новостями об успехах секвенирования третьего поколения выступила Луиза Ладбрук (отдел продаж Oxford Nanopore Technologies, Великобритания). Цель нанопорового секвенирования, как заявляет компания, — сделать возможным прочтение генома любого живого организма любым человеком в любых условиях. Его преимущество — возможность определять последовательности единичных молекул нуклеиновых кислот (не только ДНК, но и РНК). Докладчица сообщила, что в последний год были сделаны важные усовершенствования метода, улучшены условия анализа и алгоритмы обработки данных. Удалось повысить точность (с точностью были связаны основные претензии к нанопоровому секвенированию), достигнута рекордная длина рида — более 2200000 нуклеотидов.
Луиза Ладбрук коротко рассказала о приборах, которые предлагает компания, от MinION, который уже используют в России, до PromethION, способного прочитать 7 терабаз за 48 часов, а также перечислила плюсы технологии, важные для клинических применений: гибкость, чувствительность, многофункциональность и низкая цена. Технология подходит для исследования инфекций в полевых условиях (например, для наблюдений за распространением вируса Эбола), работы в лаборатории или больнице. Среди недавних достижений нанопорового секвенирования — диагностика полирезистентного туберкулеза с получением данных через 8 часов (в два раза быстрее, чем на MiniSeq), исследование транслокаций в раковом геноме. Есть проект по борьбе с вирусными болезнями кассавы — важного пищевого растения тропических регионов.
Георг Папотсойглу (Bionano Genomics, Сан-Диего, США) представил доклад о полногеномном картировании структурных изменений при онкологических и генетических заболеваниях с помощью технологий компании BioNano. Структурные вариации генома — транслокации, инверсии, вариации числа копий (CNV) — причина многих болезней, при этом экзомное секвенирование выявляет только меньшую их часть. Поскольку геном человека богат повторами, длина рида имеет значение, и в этом преимущество BioNano.
Принцип метода следующий: экстракция длинных ДНК, мечение флуоресцентными метками определенных сайтов, линеаризация молекул на чипе и визуализация. По расположению меток программное обеспечение осуществляет сборку генома de novo, что позволяет разрешить конфликты между сборками NGS. Структурные варианты выявляются при сравнении геномов с референсами или друг с другом. Например, при миодистрофии Дюшенна (это редкое заболевание связано как раз со структурными вариациями) технология BioNano обнаружила инверсию длиной в 1 Mb, которую пропустили полногеномное секвенирование, ПЦР и секвенирование по Сэнгеру. Аналогичным образом выявлялись инверсии в солидных опухолях, делеция в 27 Mb при лейкемии.
В конце доклада Папотсойглу сообщил о стратегическом партнерстве между Bionano и Genoptix (ведущая лаборатория клинической онкологии в США, специализируется на гематологии и солидных опухолях)
Затем Натальин остановился на применениях NGS в онкологии для выявления неспецифических мутаций и повышения эффективности терапии. Он рассказал о тест-системах Thermo Fisher — панелях для детской онкологии, жидкостной биопсии, иммуноонкологии. Предиктивной силы одиночных маркеров недостаточно для иммунотерапии, сложная среда опухоли требует мультимаркерного подхода, подчеркнул докладчик, а поскольку терапия дорогостоящая, использовать тест перед терапией выгодно и в финансовом отношении.
Кроме высокопроизводительного секвенирования, есть ДНК-микрочипы. Эти технологии обнаруживают разные типы мутаций: NGS выявляет инсерции и делеции, микрочипы осуществляют анализ копийности высокого разрешения, генотипирование. Среди продуктов Thermo Fisher, упомянутых докладчиком, — тест-система для обнаружения носительства различных наследственных заболеваний, чипы для упреждающей фармакогеномики, которые позволяют заранее установить, можно ли пациенту с конкретным типом метаболизма назначить, например, кодеин.
Докладчица отметила сложности с подготовкой образцов, особенно из фальсифицированного меда, рассказала о том, как проверяли воспроизводимость на продукте с достоверно известным происхождением, об ошибках в открытых базах геномной информации NCBI. Как сообщила Сперанская, для своих целей они создали собственную базу данных на основе NCBI, очистив ее от неверно аннотированных последовательностей.
Мы попросили соведущего секции Камиля Хафизова поделиться впечатлениями о том, как она прошла, что изменилось по сравнению с предыдущими конференциями.
На секции было рассмотрено актуальное состояние вопроса молекулярно-генетических исследований, применяемых в различных областях исследований микобактерий туберкулеза.
В докладе были рассмотрены вопросы законодательного обеспечения применения молекулярно-генетических методов в клинической лабораторной практике разных стран, включая РФ. Кроме того были представлены экспериментальные результаты применения разработанных в ЦНИИ эпидемиологии наборов реагентов для выявления, видовой дифференциации M. tuberculosis complex и определения мутаций, ассоциированных с устойчивостью к противотуберкулезным препаратам рифампицин и изониазид.
В Республике Беларусь в настоящий момент применяется набор реагентов Xpert MTB/RIF (США). Практически происходит организация централизованной противотуберкулезной лабораторной службы. Всем больным, помимо традиционных микробиологических исследований, проводят исследование для выявления и определения чувствительности к противотуберкулезным препаратам рифампицин и изониазид.
Мария Злотникова (Республиканский НПЦ трансфузиологии и медицинских биотехнологий, Минск) рассказала о внедрении методов молекулярно-генетического типирования в лабораторное сопровождение трансплантации органов и тканей. Гены, кодирующие HLA (human leucocyte antigens) I и II классов расположены в коротком плече шестой хромосомы. Во многих случаях важны также другие антигены – MICA. Докладчица кратко остановилась на методах типирования SSP (Sequence Specific Primers, т.е. ПЦР с использованием аллель-специфических праймеров) и SSO (ПЦР, где для детекции применяется гибридизация ампликонов с олигонуклеотидными зондами), упомянула также методы определения антител к HLA.
Как сообщила докладчица, в РНПЦ проведено 359 исследований доноров, в основном доноров почек, 99 потенциальных доноров сердца. Число типирований постоянно растет, как и число трансплантаций. Важен не только поиск подходящего донора для пациента, но и посттрансплантационный мониторинг. Современные методы улучшают качество жизни реципиента и увеличивают период жизни транплантата. В заключение Злотникова отметила, что Беларусь входит в топ-20 мировых лидеров этой области медицины.
Тему продолжил доклад Геннадия Семенова (Республиканский НПЦ трансфузиологии и медицинских биотехнологий, Минск), посвященный молекулярно-генетическим методам в практике HLA-типирования доноров гематопоэтических стволовых клеток. Он отметил, что современные представления о HLA развились в целую науку: ими занимаются иммуногенетика, популяционная генетика, изучается их связь с болезнями, их роль в репродукции, в трансплантации.
При онкогематологических заболеваниях родственно совместимого донора удается найти только в 30% случаев, остальным нужен неродственный. Цель исследования, которое проводится в РНПЦ, — создать республиканский регистр доноров костного мозга. В качестве потенциальных доноров рассматриваются доноры крови и волонтеры. Первые имеют ряд преимуществ: уже состоят на учете, их здоровье контролируется, они ведут здоровый образ жизни.
Чтобы подсчитать вероятность нахождения донора для определенного реципиента, важно определить частоты встречаемости в популяции тех или иных HLA-типов. Пока не обнаружено корреляций с этническими группами (были исследованы жители западной Европы, восточнославянские и западнославянские популяции). Как сообщил докладчик, в базу данных регистров на сегодня включено более 20 тыс. доноров, типированных по I и II классам HLA.
Виталий Чеботкевич (Российский НИИ гематологии и трансфузиологии ФМБА, Санкт-Петербург) сделал сообщение о молекулярных методах диагностики бактериальных инфекций в донорской крови и начал выступление с похвалы белорусским коллегам. Затем акцентировал внимание на отличиях бактерий от вирусов: их минимальная опасная концентрация в крови ниже оптимума для анализа; многие бактерии способны размножаться в крови, хотя скорость размножения у разных видов различна. Золотым стандартом остаются бактериологические методы, но также важны NAT-методы скрининга (амплификация нуклеиновых кислот). Амплифицируются участки генов рибосомной 16S, 23S РНК, чувствительность составляет 100—1000 КОЕ/мл, результат можно получить через 3–4 часа. Возможны ложноположительные результаты из-за ДНК бактерий, убитых стерилизацией. И наконец, нет точных данных о том, какое количество осложнений связано с бактериальной инфекцией. Существуют коммерческие тесты, например SepsiTest компании MolZym, позволяющий анализировать ДНК патогенов в крови, однако стоимость его высока, и в РФ он не зарегистрирован.
Федор Карпенко (Республиканский НПЦ трансфузиологии и медицинских биотехнологий, Минск) рассказал о том, как обеспечивается инфекционная безопасность продуктов крови в Беларуси. Он отметил, что молекулярные методы позволяют резко снизить количество ложноотрицательных результатов анализа. Также он остановился на современных технологиях инактивации вирусов в гемокомпонентах и подчеркнул, что в педиатрической практике желательно использовать именно их.
Современные решения для проведения цервикального скрининга
Молекулярные методы диагностики состояний кишечника
Готовое решение для автоматизации исследований компонентов донорской крови на базе станции Microlab STARlet
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ЦНИИ туберкулеза РАМН, Москва
В настоящее время лабораторная диагностика занимает ведущее место в выявлении многих инфекционных заболеваний. Подтверждение диагноза туберкулеза основывается на результатах микробиологических анализов при выделении из биологического материала возбудителя – микобактерий туберкулеза. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на выявление возбудителя, определение лекарственной чувствительности и типирование микобактерий.
Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов с использованием светового микроскопа с окраской по Циль–Нильсену и люминесцентного с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата. Однако возможности ее ограничены из–за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован ВОЗ в качестве основного для выявления заразных больных (табл. 1).
При антибактериальной терапии обнаружение микобактерий туберкулеза имеет прогностическое значение. Поэтому бактериовыделение оценивается количественно. Золотым стандартом выявления микобактерий признаны культуральные исследования. Для посева патологического материала используют яичные среды: Левенштейна–Йенсена, среду Финна II, Мордовского и др. Количество микобактерий (или колоний в пробирке при культуральном методе исследования) в процессе химиотерапии является ориентировочным показателем ее эффективности или косвенным свидетельством развития устойчивости микобактерий к противотуберкулезным препаратам.
Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие в автоматизированных системах учета роста типа BACTEC, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют до двух с половиной месяцев. При отсутствии роста к этому времени посев считается отрицательным. Наиболее чувствительным способом обнаружения микобактерий туберкулеза считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно–генетических исследований является полимеразная цепная реакция (ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Интереснейшая область исследования, которая открывается благодаря ПЦР–диагностике, – изучение латентной инфекции M. tuberculosis. По современной концепции туберкулезной инфекции, из 100 человек, контактирующих с M. tuberculosis, 90 могут быть инфицированы, но только у 10 развивается активная болезнь. У остальных 90% инфекция будет оставаться латентной из–за противотуберкулезного иммунитета. Положительные ответы ПЦР при отрицательных результатах посевов патологического материала отмечаются у 55% лиц, подвергавшихся бытовым контактам с M. tuberculosis, и у 80% лиц, у которых туберкулез протекал без рентгенографических проявлений. Проведение ПЦР–исследований у пациентов из групп риска выявляло больных с отрицательными результатами микроскопии и посевов, но с субклинической инфекцией M. tuberculosis [11]. Подобные результаты были получены и в наших исследованиях [6].
Определение лекарственной устойчивости микобактерий
Для определения лекарственной устойчивости микобактерий используется несколько групп методов (табл. 2). По приказу № 558 МЗ РФ от 1978 г. в бактериологических лабораториях России используется метод абсолютных концентраций. В лаборатории ЦНИИТ РАМН внедрен ускоренный метод по тестированию нитратредуктазной активности микобактерий с помощью реактива Грисса.
В крупных противотуберкулезных центрах используются методы определения лекарственной устойчивости в жидких средах с автоматизированной радиометрической и флюоресцентной системой учета роста микобактерий типа ВАСТЕК, позволяющие сокращать срок анализа до 14 дней.
В последнее время разрабатываются новые методы оценки лекарственной устойчивости на уровне генотипа [10]. Работа по изучению молекулярных механизмов резистентности показала наличие у микобактерий генов, связанных с устойчивостью к различным препаратам: к изониазиду – гены katG, inhA, kasA, к рифампицину – rpoB, к стрептомицину – rpsL и 16SрРНК, к этамбутолу – emb1, к фторхинолонам – gyrA и т.д. [7].
Широкомасштабные исследования по изучению спектра мутаций в геноме устойчивых микобактерий показали, что наиболее распространенными были мутации в 531, 526 и 516 кодонах rpoB гена, устойчивость к изониазиду характеризовалась мутациями в 315 кодоне katG гена. В целом спектр мутаций не отличался от выявленных исследователями в разных регионах мира [2].
Доступность данных по молекулярной основе лекарственной устойчивости к противотуберкулезным препаратам дала возможность разработки новых, основанных на ПЦР, методов, представленных в табл. 2. Наши работы, проведенные совместно с Институтом физико–химической медицины МЗ РФ и Институтом молекулярной биологии РАН, продемонстрировали перспективность использования молекулярно–генетических методов для быстрого определения лекарственной устойчивости [1, 3, 4].
Наибольшие надежды по совершенствованию методов для определения лекарственной устойчивости микобактерий связаны с развитием микрочиповой технологии, позволяющей определять устойчивость одновременно к нескольким противотуберкулезным препаратам микобактерий непосредственно из диагностического материала в течение 2 дней [9].
Комплекс методов имеется и для типирования микобактерий, когда используются традиционные культуральные и биохимические методы, биологические, а также молекулярно–генетические (табл. 3). На основе молекулярно–генетического типирования микобактерий интенсивно развивается область молекулярно–эпидемиологических исследований, в которой по генотипу микобактерии выявляются очаги и прослеживаются пути распространения туберкулезной инфекции [5, 8].
#Pt6982.gif В заключение необходимо подчеркнуть, что в настоящее время имеется научный потенциал для совершенствования бактериологических исследований, а благодаря успехам молекулярной биологии существует возможность значительного сокращения сроков выявления микобактерий, определения лекарственной устойчивости и контроля за эффективностью химиотерапии.
1. Альтшуллер М.Л. и др. Применение аллель–специфической амплификации и SSCP для выявления устойчивости к рифампицину клинических изолятов Mycobacterium tuberculosis. // БЭБиМ, 1999; 128(11): 555–8.
2. Генерозов Э.В. и др. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России. // Молекулярная генетика, микробиология и вирусология, 2000; 1: 11–7.
3. Генерозов Э.В.и др. Детекция и характеристика мутаций в rроВ гене резистентных к рифампицину клинических штаммов Mycobacterium tuberculosis. // Проблемы туберкулеза, 1999; 2: 39–42.
4. В.М. Михайлович и др. Использование методов гибридизации и ПЦР на специализированном ТБ–микрочипе для обнаружения рифампицин–резистентных штаммов Mycobacterium tuberculosis // БЭБ и М, 2001, 1: 112–7.
5. Черноусова Л.Н.и др. Молекулярная эпидемиология туберкулеза в тюрьмах. // Актуальные проблемы пенитенциарной медицины. Мат–лы международной научно–практич. конференции, Минск, 2001: 48–50.
6. Черноусова Л.Н., Ларионова Е.Е., Севастьянова Э.В., Голышевская В.И. Роль ПЦР–анализа в комплексных бактериологических анализах во фтизиатрии. // Проблемы туберкулеза, 2001; 3: 58–60.
Читайте также:


