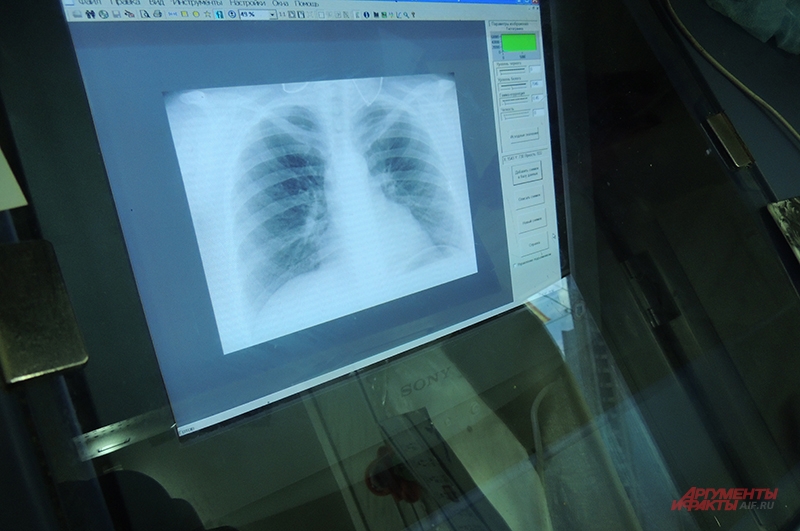
Как принимать пиразинамид при туберкулезе

У Вас нет причин для беспокойства. Туберкулез может быть вылечен и лечиться с помощью лекарств, за исключением некоторых редких случаев. Однако, это важно, чтобы Вы аккуратно принимали лекарства в соответствии с инструкциями Вашего врача или медицинской сестры.
Туберкулез является болезнью, которая лечится с помощью лекарств. Чтобы убить все туберкулезные бактерии, необходимо принимать более чем одно лекарство. Поэтому, Вы будете получать несколько разных противотуберкулезных препаратов в одно и то же время. Наиболее распространенными препаратами, которые используются при лечении туберкулеза, являются:
- рифампицин
- изониазид
- пиразинамид
- этамбутол и
- стрептомицин
Для того чтобы убить все туберкулезные бактерии, требуется много времени. Поэтому, лечение продолжается минимум шесть месяцев, часто дольше. Обычно в течение первых двух месяцев используются четыре разных противотуберкулезных препарата, после чего, лечение продолжается с использованием двух препаратов.
Как правило, Вы будете чувствовать себя лучше после нескольких недель приема лекарств. Однако, некоторые туберкулезные бактерии в Вашем организме все еще остаются жизнеспособными. Даже если Вы больше не будете иметь симптомов, очень важно продолжать принимать лекарства до тех пор, пока все бактерии не будет убиты.
Лечение начинается в больнице и потом продолжается на дому. Ваш врач является ответственным за планирование Вашего лечения, выбор противотуберкулезных препаратов, доз и продолжительности лечения. Вы можете спросить Вашего врача о конкретных деталях, касающихся лечения.
Лечение под непосредственным наблюдением
Противотуберкулезные препараты даются под непосредственным наблюдением (DOT).
Вы имеете право получить поддержку и совет в течение всего периода лечения. Лечение туберкулеза длится несколько месяцев, и количество лекарств является большим, поэтому это не просто принимать их регулярно каждый день. Цель непосредственного наблюдения – помочь Вам регулярно принимать лекарства, проверить возможные побочные эффекты противотуберкулезных препаратов и помочь Вам вылечиться как можно скорее.
Вы будете принимать противотуберкулезные препараты под наблюдением медицинской сестры или другого квалифицированного работника, который будет следить, что Вы проглотили каждую дозировку. В то же время, они проверят возможные побочные эффекты противотуберкулезных препаратов, следят за Вашими улучшениями и ответят на Ваши вопросы. Если пациентом является ребенок, родители могут давать противотуберкулезные препараты ему под наблюдением медицинского работника.
Ваш лечащий врач решает, когда начинается наблюдение за лечением и когда оно может быть закончено. В больнице медицинская сестра наблюдает, когда Вы принимаете противотуберкулезные препараты. До того, как Вы сможете продолжить лечение на дому, должно быть согласовано, как Вы сможете получать свои лекарства в домашних условиях. Лекарства могут быть приняты в амбулаторном отделении больницы, в поликлинике, в медпункте на работе, в школе или в приемном центре для лиц, ищущих убежище. Если Ваше состояние требует этого, медицинская сестра может контролировать лечение у Вас дома или в другом месте, где Вы живете. Организация непосредственного наблюдения зависит от муниципалитета.
Прерывание лечения самостоятельно или время от времени пропуск приемов некоторых противотуберкулезных препаратов может быть опасным. Туберкулезные бактерии могут размножаться, и Ваше лечение будет продолжаться дольше. Туберкулезные бактерии также могут стать устойчивыми к тем препаратам, которыми Вы лечитесь. Возможно, Вам придется принимать новые препараты, если предыдущие уже не являются эффективными. Новые препараты необходимо принимать значительно дольше по времени, и обычно они вызывают больше побочных эффектов.
- Только противотуберкулезные препараты, которые принимаются регулярно, убивают туберкулезные бактерии.
- Туберкулез может быть вылечен, если Вы принимаете лекарства согласно инструкциям.
- Не изменяйте и не прерывайте лечение.
- Продолжайте принимать лекарства, даже если Вы чувствуете себя лучше.
- Лечение устраняет риск передачи инфекции.
Контрольные визиты к врачу
За Вашим выздоровлением во время лечения будут внимательно следить в амбулаторном отделении больницы с интервалами 1-2 месяца. При осмотре Вам сделают рентген грудной клетки, возьмут анализы крови и образцы слизи/мокроты во время кашля. Вы также имеете возможность задать врачу интересующие Вас вопросы.
В клинической практике часто имеют место симптомы поражения печени у пациентов больных туберкулезом и получающих противотуберкулезную терапию. Симптомы поражения печени могут быть вызваны следующими причинами:
- основным заболеванием, так как при туберкулезе часто наблюдаются амилоидоз, жировая дистрофия и собственно туберкулез печени.
- действием самих противотуберкулезных препаратов.
Практически все противотуберкулезные препараты применяются в больших дозах и длительными многократными курсами. Под их воздействием у больных туберкулезом часто развиваются токсические гепатиты (1-3), сопровождающиеся появлением желтушности, снижением аппетита, уменьшением массы тела, ухудшением общего самочувствия, тошнотой, рвотой. Гепатотоксические реакции (ГТР) вызывают увеличение размеров печени, появление болей в правом подреберье, нарушение пищеварения, ухудшение биохимических показателей крови.
Так известно, что Изониазид может вызвать гепатитоподобную симптоматику. Возможность развития хронического активного гепатита связывают с пролонгированным применением Изониазида. Негативное воздействие на печень часто наблюдается при применении пара-амно-салициловой кислоты. Поражение печени отмечается при применении таких противотуберкулезных препаратов, как Пиразинамид и Этионамид (5). Среди пациентов, получающих Рифампицин, повышен процент случаев гепатита. Brij Kishore (1978) указывает, что при применении Этионамида и Пиразинамида, гастро-интестинальные симптомы, такие как тошнота, рвота, анорексия развиваются в 22.7% и 30% случаев соответственно. Нарушения со стороны печени, такие как желтушность кожных покровов, повышение уровня трансаминаз и других печеночных маркеров, признаки гепатита при биопсии, выявляются у 18.8% пациентов получающих курс Этионамида, и у 10% пациентов, получающих Пиразинамид. (10) Пиразинамид в комбинации с Изониазидом и Рифампицином повышает вероятность развития гепатотоксических эффектов (12).
Одним из путей предупреждения и устранения ГТР, возникающих при специфической терапии у больных туберкулезом, является использование в комплексной терапии гепатопротекторов, одним из которых является Лив.52.
Лив.52 - комплексный растительный аюрведический препарат. Растения, входящие в состав Лив.52 достаточно эндемичны для средней полосы России. Это Цикорий обыкновенный, Паслен черный, Редис посевной, Тысячелистник обыкновенный, Дымянка лекарственная. Кроме того, в препарат входят растения непосредственно произрастающие в Индии и входящие в состав древних аюрведических прописей. Это Кассия западная, Терминалия арджуна, Тамарикс гальский, Тиноспора сердцелистная и другие лекарственный растения, а так же оксид железа. Поскольку Лив.52 является комплексным растительным препаратом, то каждый ингредиент, обладая своим специфическим действием, в то же время усиливает и потенциирует действие других компонентов.
Антитоксическое действие Лив.52 обусловлено тем, что препарат защищает эндоплазматический ретикулум печеночных клеток, повышает уровень цитохрома Р-450, входящего в микросомальную систему гидроксилирования, играющую важную роль в метаболическом превращении лекарственных веществ и детоксикации ядов (4). Лив.52 оказывает защитное действие против перекисного окисления липидов, благодаря повышению уровня эндогенных токоферолов (7, 8).
В экспериментах на животных было показано, что при введении противотуберкулезных препаратов животным, в печени имеет место супрессия активности GSH (Глютатиона) и антиоксидантного энзима (супероксид дисмутазы), каталазы, GPX ( глютатион-пероксидазы) и GST (глютатион-s-трансферазы) в сочетании с повышением выработки свободных липидных радикалов. Как следует из таблицы, Лив.52 снижает уровень перекисного окисления липидов, воздействую на уровень пероксида, тем самым защищая печень. Кроме того, Лив.52 способствует нормализации других биохимических параметров и улучшению анти-оксидантного статуса организма (12).
Таблица 1. Действие препарата Лив.52 (500 мг/кг веса) на проявление гепатотоксичности антитуберкулезных препаратов у крыс (Изониазид 7.5 мг/кг веса, Рифампицин 10 мг/кг веса, Пиразинамид 35 мг/кг веса)
| № | Терапия | LPO | SOD | CAT | GSH | GST | GPX |
| 1 | Норма | 0.63+-0.08 | 8.77+-0.73 | 130,72+-12.80 | 8.887+-0.780 | 0.350+-0.029 | 7.225+-0.710 |
| 2 | Лив.52 (А) | 0.64+-0.06 | 8.53+-0.84 | 128+-12.30 | 8.270+-0.810 | 0.348+-0.0032 | 7.320+-0.690 |
| 3 | Противотуберкулезные препараты (В) | 1.28+-0.12* | 5.47+-0.56* | 88.73+-8.70* | 4.795+-0.500* | 0.250+-0.028* | 4.848+-0.500* |
| 4 | В + А | 0.82+-0.09* | 7.17+-0.74* | 116.10+-10.90* | 6.025+-0.540* | 0.320+-0.029# | 6.240+-0.610# |
LPO - содержание Липид пероксида в тканях;
GSH - активность глютатиона;
SOD - активность супероксид дисмутазы;
CAT - активность каталазы;
GPX - активность глютатион пероксидазы;
GST - активность глютатион S-трансферазы.
Данный механизм действия Лив.52, по всей видимости, обусловлен составом препарата. Было выявлено, что экстракты Цикория обыкновенного и Паслена черного, входящие в состав препарата Лив.52, содержат большое количество полифенольных соединений, в частности флавоноидов. Антиоксидантная активность препарата может быть обусловлена присутствием полифенольных соединений (9).
Существенной проблемой, связанной как непосредственно с туберкулезом, так и с действием противотуберкулезных препаратов, является анорексия и, как следствие, потеря веса. Применение препарата Лив.52 в комплексной терапии туберкулеза способствует улучшению аппетита в 84% случаев, быстро поднимается уровень альбумина и гемоглобина крови (11). Пациенты, получающие комбинированную противотуберкулезную терапию и Лив.52 за месяц прибавляли в весе до 4-6 кг.
Применение препарата Лив.52 при лечении гепатомегалии у детей больных туберкулезом, позволяет в два раза сократить период нормализации размеров печени (6).
Препарат Лив.52 производится фирмой "Хималайя Драг Ко" и экспортируется более чем в 50 стран. Препарат выпускается в форме таблеток и капель (специализированная лекарственная форма для детей). В России эксклюзивным дистрибьютором "Хималайя Драг Ко", осуществляющим импорт и сертификацию Лив.52, является ЗАО "Трансатлантик Интернейшнл Пте Лтд".

Сологуб Т. В., Романцов М. Г., Кетлинская О. С., Петров А. Ю., Комиссаров С. Н., Кремень Н. В., Александрова Л. Н., Суханов Д. С., Ледванов М. Ю., Стукова Н. Ю., Козько В. М., Бондарь А. Е.,
Лекарственные поражения печени (ЛПП) являются одной из серьезных проблем в гепатологии. В настоящее время насчитывается более 800 лекарственных средств, способных вызывать поражения печени, а четверть фульминантных гепатитов связывают с острым токсическим лекарственным поражением.
Поражения печени (15-20%) у больных туберкулезом свидетельствуют о высокой частоте патологии печени при туберкулезе, обусловленной различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков наличием сопутствующих заболеваний, в том числе и вирусных гепатитов).
Печень представляет собой центральную лабораторию химического гомеостаза организма, где создается единый обменный и энергетический комплекс для метаболизма белков, жиров и углеводов. Особенно важна детоксикационная и клиренсная функции печени, так как 80% токсических веществ из организма выводится именно ею.
В целом, согласно МКБ X пересмотра, гепатопатии классифицируются на 2 большие группы:
1-я - поражения печени инфекционного и неинфекционного генеза (поражения специфическими гепатотропными вирусами; поражения неспецифическими инфекционными агентами (герпес, энтеровирус, цитомегаловирус);
2-я группа - токсические поражения печени (алкогольная болезнь; хронический гепатит, включая аутоиммунный).
Гепатопатии являются одной из ведущих видов патологии, не только в России, но и в мире. При этом, разные категории больных имеют различную частоту и причины поражения печени. Одной из таких групп больных, для которых поражения печени являются весьма актуальными, считаются больные туберкулезом.
В зависимости от структуры и состава лекарственных веществ может наблюдаться избыточное образование свободных радикалов, активизация перекисного окисления липидов (ПОЛ), денатурация белков, истощение запасов АТФ, нарушение функции митохондрий, образование гаптенов, связывание с ядерными и цитоплазматическими молекулами, мембранными рецепторами, блокада транспортной РНК, разрушение клеточного цитоскелета, обуславливая различные подходы к терапии этих состояний.
ЛПП принято подразделять на 3 группы: гепатоцеллюлярные, холестатические и смешанные. Мишенью токсического действия являются гепатоциты (некроз), желчные протоки и канальцы (холестаз) или синусоидальные клетки (эндотелий, жиросодержащие клетки). ЛПП повреждают паренхиму, приводят к некрозу или апоптозу, стеатозу, холестазу, образованию гранулем, сосудистым расстройствам, злокачественному перерождению и др. [Farwell G.S., (1994)].
Важную роль в подобных повреждениях играет генетический полиморфизм ферментов детоксикации ксенобиотиков(CYP450, NAT2). Риск развития гепатита при лечении противотуберкулезными препаратами в значительней степени определяется генным полиморфизмом изофермента СУР2Е1. У пациентов с гомозиготным диким генотипом CYP2E1 cl/cl риск гепатотоксичности высок (20%), чем у лиц с мутантным аллелем с2 (СYP2E1 с1/с2 или с2/с2; (9,0%) [Huang YS, (2003)]. Восприимчивость к гепатотоксическому действию противотуберкулезных препаратов продолжает увеличиваться [Nagayama N et al, (2003)]. Так, в период 1980-2000 гг. прошлого столетия частота развития гепатитов (при комбинированном применении изониазида и рифампицина) составляла от 9,0% до 27,4%, что связано с повышением частоты гепатотоксических реакций и неблагоприятным воздействием на печень факторов окружающей среды.
Лекарственные поражения при применении пиразинамида развиваются по тому же типу, что и при использовании изониазида. Осложнения редки при дозе менее 30 мг/кг, а в высоких дозах пиразинамид тормозит окислительное фосфорилирование, перекисное окисление липидов (ПОЛ), истощая антиоксидантные резервы, повреждая клеточные структуры, потенцируя гепатотоксическое действие рифампицина.
Аминогликозиды вызывают субклинические неспецифические реактивные гепатиты с умеренной гипераминотрансфераземией [Логинов А.С. и соавт., (1987)], в единичных случаях развивается острый цитолитический гепатит с гепатоцеллюлярным некрозом. В основе цитолитического гепатита лежат некрозы или стеатоз печени. Под действием лекарственного препарата наблюдается диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах ОВГ. Развитие распространенного массивного некроза печени описано при применении противотуберкулезных средств (изониазида, рифампицина, аминогликозидов). Лекарственные препараты вызывают диффузный некроз, который трудно дифференцировать от диффузного некроза при тяжелых формах острого вирусного гепатита.
К развитию цирроза печени может вести длительное применение противотуберкулезных препаратов, вызывающих острый или хронический гепатит. По мнению В.Т.Ивашкина (2006) цирроз - это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов, являясь конечной стадией хронического поражения печени. Его тяжесть и прогноз зависит от объема сохранившейся функциональной паренхимы печени, выраженности портальной гипертензии и активности основного заболевания, приведшего к нарушению ее функций. Нарушение архитектоники печени даже при отсутствии цирроза ведет к развитию портальной гипертензии.
Поражение печени может стабилизироваться или регрессировать при прекращении приема противотуберкулезных препаратов, улучшая функциональное состояние печени, но эволюция гистологических изменений в печени происходит значительно медленнее. Продолжение приема лекарств приводит к прогрессированию ХГ с исходом в цирроз печени, формируя печеночную недостаточность.
Побочные явления непереносимости антибактериальных препаратов наблюдаются в клинике туберкулеза в 7,9-32% случаев. Их частота и характер в значительной мере обусловлены давностью и формой процесса, а так же наличием сопутствующих заболеваний, в частности ВГ. Токсическое действие наступает через 2 месяца после начала приема препаратов, в 19,7% связано с поражением печени. У половины пациентов с биохимическими нарушениями отсутствуют клинические признаки патологии печени.
Ассортимент лекарственных средств патогенетической терапии, применяемых при заболеваниях печени, насчитывает более 1000 наименований, но среди такого многообразия препаратов, выделяют сравнительно небольшую группу лекарственных средств [гепатопротекторов], оказывающих избирательное действие на печень. Их действие направлено на восстановление гомеостаза в печени, повышение устойчивости органа к действию патогенов, нормализацию функциональной активности и стимуляцию репаративно-регенеративных процессов в печени.
Современным подходом для улучшения эффективности патогенетической терапии является применение препаратов, восстанавливающих не только митохондриальную мембрану клеток, не только липидный слой мембран, но нормализующих окислительное фосфорилирование и модифицирующих клеточный обмен.
Это возможно за счет применения гепатопротекторов (реамберин, цитофлавин, ремаксол), обладающих антигипоксическим/антиоксидантным эффектом поскольку, печень является основным местом метаболизма и мишенью токсического действия с первичным нарушением функции мембран.
Указанные препараты являются метаболическими протекторами, в составе которых несколько активных компонентов, одним из основных является янтарная кислота. В основе нарушений функций организма лежат структурные изменения, обусловленные метаболическими расстройствами. Сложная динамика развития гипоксии в организме, вовлеченность в нее широкого спектра функционально-метаболических систем объясняет сложность решения вопросов, связанных с антигипоксической защитой организма. Повышение устойчивости к гипоксии обеспечивают интермедиаты цикла Кребса - фумаровая, лимонная и янтарная кислота, включаясь в энергетический обмен как субстраты, направляя процесс окисления по наиболее экономичному пути. При гипоксии происходит функционально-метаболическое нарушение, в котором ведущую роль играет снижение уровня макроэргов. Высокая биологическая активность янтарной кислоты послужила предпосылкой создания на ее основе эффективных лекарственных препаратов (реамберин, цитофлавин). Разработанная новая метаболическая композиция ремаксол (препарат завершает клинические исследования), ориентирована на патологические состояния, сопровождающиеся нарушением метаболизма и энергетического обмена, обладает выраженным гепатопротекторным эффектом за счет стимуляции распада жировых включений в паренхиматозных органах до ацетил-КоА, поступающего в цикл трикарбоновых кислот. В экспериментальных исследованиях установлен антитоксический и гепатопротекторный эффект ремаксола на моделях экспериментального токсического и аденовирусного гепатитов с активацией тканевого дыхания, уменьшением недоокисленных метаболитов, снижением уровня цитолитических ферментов, нормализацией перекисного окисления липидов. За счет купирования изменений в системе глутатиона установлена выраженная антиоксидантная активность препарата.

Об этом мы беседуем с главным фтизиатром Минздрава РФ, заведующей отделом фтизиатрии ЦНИИ туберкулёза РАМН, доктором медицинских наук Ириной Васильевой.
Иллюзия победы
Ирина Васильева: — Оптимизм был связан со значительными успехами в лечении заболевания, которые имели место в то время.
До 40‑х годов ХХ века туберкулёз считался приговором. Санаторно-курортное лечение, богатое белком питание, смена климата — вот, в общем, и всё, что было в арсенале врачей. В 1944 году был открыт стрептомицин, и это стало революцией — у специалистов появилась возможность воздействовать непосредственно на возбудителя заболевания, палочку Коха.
Чуть позже стали применяться и другие лекарства, но наиболее знаковым стало открытие в 1966 году рифампицина. Он показал наибольшую активность в отношении микобактерий туберкулёза, действовал на все их разновидности.
Достаточно быстро фтизиатры сформировали новую схему терапии туберкулёза, в которую вошли рифампицин, стрептомицин, пиразинамид и изониазид. Она демонстрировала высокую эффективность и безопасность, давала минимальный процент рецидивов. Туберкулёз пошёл на убыль во всём мире, и так продолжалось вплоть до 90‑х годов, пока болезнь не заявила о себе с новой силой.
— Это произошло из-за ухудшения социальной обстановки в нашей стране?
— Социальные изменения, безусловно, сыграли свою роль. Микобактерией туберкулёза инфицируются многие, однако в нормальных условиях заболевает после этого лишь один человек из десяти. Стрессы, скудное питание, физические перегрузки — мощнейшие провокаторы болезни, потому что они снижают иммунитет. Люди теряли работу, были дезориентированы — разумеется, начались вспышки туберкулёза. Способствовала этому и активизация миграционных процессов. В итоге в первой половине 90‑х заболеваемость выросла в три раза.
Прерванное лечение
— В чём основная сложность МЛУ-туберкулёза?
— Он поддаётся лечению хуже, чем обычный. Когда стало понятно, что самые мощные препараты не действуют, фтизиатры стали подбирать комбинации из лекарств, которые до того считались средствами второго ряда и использовались нечасто. Их эффект слабее, поэтому нужно назначать не 3–4, а 5–7 препаратов. Курс лечения тоже должен быть дольше — до 2 лет. И это создаёт ряд проблем, потому что чем дольше терапия, тем выше риск, что больной не долечится.
— Неужели кто-то решается не долечить туберкулёз? Это же смертельно опасное заболевание.
— К сожалению, так бывает. Более того, одной из причин распространения множественной лекарственной устойчивости в России в 90‑х годах стало именно то, что больные перестали долечиваться. Во многих тубдиспансерах наблюдался недостаток лекарств, ослаб контроль за пациентами, и их приверженность к терапии снизилась.
У недолечившегося пациента туберкулёзный процесс рано или поздно активизируется. Если раньше палочка Коха у такого больного хорошо реагировала на стандартную терапию, то после перерыва в лечении она становится резистентной к лекарствам, которые использовались. Если человек не сразу приходит к врачу (а так обычно и бывает), он заражает окружающих этой резистентной разновидностью микобактерии.
А теперь давайте представим, что человек не долечит не простой, а МЛУ-туберкулёз. Лекарств, которые действуют на такую инфекцию, и без того мало, а теперь и они не подействуют — его попросту будет нечем лечить. Развивается уже не множественная, а тотальная лекарственная устойчивость, и мы возвращаемся в XIX век, когда рекомендовать можно только смену климата и полноценное питание.
Болезнь бедных?
— Перспектива устрашающая. Можно ли как-то добиться, чтобы люди долечивались?
— Знаете, больного по-человечески можно понять. Схема терапии туберкулёза делится на два этапа: сначала человека лечат в стационаре, а затем отпускают домой, с тем чтобы он в течение года (при обычном туберкулёзе) каждый день приходил в дневной стационар и получал лекарства. Нигде в мире больным не дают препараты домой, потому что лечение должно контролироваться. Но прийти или нет — это добрая воля пациента. А он уже хорошо себя чувствует (улучшение наблюдается в первые месяцы пребывания в стационаре), никаких проявлений у него нет. Он думает, зачем пить таблетки, которые негативно влияют на печень, дают побочные эффекты, и не приходит. Конечно, ему звонят. Его пытаются вернуть, но курс всё равно уже прерван.
Приверженность пациента к лечению — это во многом заслуга врача, который должен объяснить, зачем продолжать терапию, должен быть немного психологом. Но и беседы действуют не на всех, и тогда надо искать другие пути решения проблемы. Например, не так давно в Томской, Воронежской, Орловской и Белгородской областях был запущен пилотный проект. Пациентам, которые всю неделю исправно приходили за лекарствами, в конце неё вручали социальный пакет, вплоть до продуктового набора. Опыт показал, что такая мотивация прекрасно работает. При этом стоимость наборов не идёт ни в какое сравнение с теми затратами, которые может понести государство, если больной не пролечится. Сегодня есть план расширить действие данных программ и на другие территории.
— Результаты пилотных программ ещё раз подчёркивают, что туберкулёз — заболевание социально незащищённых групп населения.
— Безусловно, эти программы были созданы, чтобы повысить приверженность к лечению именно социально неблагополучных больных. Состоятельный и, главное, образованный человек придёт за лекарствами и после простой беседы с врачом. Но туберкулёз сегодня — вовсе не болезнь бедных, как это принято считать. Да, в небольших городах, в сёлах болеют преимущественно те, у кого плохие социальные условия, но не только они одни. А в Москве, Санкт-Петербурге и других крупных городах, где высока концентрация населения и велик уровень миграции, такая закономерность вообще не прослеживается. Здесь может заболеть любой, потому что туберкулёз передаётся воздушно-капельным путём. Часто болеют как раз успешные и молодые, потому что у них активная жизнь, высокий уровень стресса, они много работают, недосыпают, из-за нехватки времени нерегулярно питаются.
Вообще стереотип о маргинальности туберкулёза — серьёзнейшее препятствие на пути к тому, чтобы взять болезнь под контроль. Из-за этого человек, узнав о своём диагнозе, скрывает его от коллег — боится, что уволят. Он не говорит знакомым, потому что опасается, что с ним перестанут общаться. Боится даже прийти в диспансер — вдруг кто-то его увидит. В итоге он несвоевременно принимает лекарства, заражает окружающих, лишает их возможности прийти к врачу и обнаружить заболевание на раннем этапе. Эту парадигму надо менять.
Плоды усилий прошлого
— В последнее время появляется всё больше сообщений о том, что заболеваемость туберкулёзом и смертность от него снижаются. С чем это связано?
Это отрадно, но это лишь начало пути, ведь Россия по-прежнему входит в список 22 стран с наиболее неблагоприятной эпидемиологической обстановкой по туберкулёзу.
К тому же случаи туберкулёза с множественной лекарственной устойчивостью в последние годы стали выявляться чаще. Правда, это во многом обусловлено улучшившейся диагностикой заболевания.
— Что в ней изменилось?
— Золотым стандартом лабораторной диагностики туберкулёза являются культуральные исследования. Они применяются давно и весьма точны, однако результаты анализа нужно ждать около трёх месяцев. В последние годы появились методы, которые дают ответ значительно быстрее. Например, молекулярно-генетические исследования позволяют за несколько часов (максимум в течение двух дней) выявить мутации в геноме микобактерий, ответственные за устойчивость к наиболее применяемым препаратам — изониазиду и рифампицину. Это даёт возможность понять, с чувствительной или устойчивой к лекарствам формой болезни мы имеем дело.
Если нужно проверить устойчивость к остальным препаратам, на помощь приходит другой метод, который позволяет в ускоренном режиме вырастить культуру микобактерии в автоматизированной системе. На это уходит 2–3 недели, после чего культуру можно тестировать на все препараты, а затем индивидуально выстраивать режим лечения конкретному больному, исходя из анализа. Конечно, терапия в этом случае будет более эффективной, чем если бы мы подбирали её эмпирически. Лечение МЛУ-туберкулёза без данных методик — это уже прошлый век.
— Насколько доступны эти технологии?
— Сейчас они есть практически в каждом региональном центре. В последние годы большинство лабораторий были переоснащены, хотя этот процесс продолжается и многие лаборатории ещё нуждаются в современном оборудовании.
В основном для борьбы с туберкулёзом используются средства региональных бюджетов. Но федеральное правительство выделяет крупные дотации на диагностическое оборудование и реактивы для него. Так что регионы имеют возможность закупать всё это в нужном объёме. Многое зависит от того, есть ли понимание между администрацией региона и противотуберкулёзной службой. Там, где оно есть, дела идут хорошо. Там, где руководство не понимает важности борьбы с туберкулёзом, появляются проблемы, жалобы на нехватку средств. На самом деле ресурсы есть, просто их нужно рационально использовать.
Чего не хватает
— Сегодня врачи самых разных специальностей поднимают вопрос о лекарственном обеспечении своих больных. Как с этим обстоят дела во фтизиатрии?
— Лекарственное обеспечение — это важнейшая часть борьбы с туберкулёзом. От него зависят как эффективность лечения, так и вероятность развития у возбудителя множественной лекарственной устойчивости (МЛУ). Поэтому хорошо, что правительство дотирует покупку препаратов второго ряда для лечения МЛУ—туберкулёза, стоимость которых значительно выше препаратов для стандартных схем лечения.
Особенность лекарственной терапии туберкулёза в том, что в неё всегда входят несколько препаратов в определённых сочетаниях. Важно, чтобы не было перекосов, когда, например, для больного в избытке закупается один препарат и в недостаточном количестве — другой. Поэтому сейчас мы разработали специальную электронную программу по расчёту потребностей в препаратах. Она должна не только облегчить работу врача, но и помочь в оптимизации расходов на лечение.
— Всё-таки задача экономить средства стоит?
— Сейчас все стремятся к оптимизации затрат. Фтизиатрическая служба не исключение, хотя лечение туберкулёза полностью финансируется государством и не включено в систему ОМС. В перспективе одним из решений может стать перевод части стационарных больных на койки дневного стационара сразу после того, как пациенты перестанут быть заразными. Экономия будет огромной, самому пациенту так комфортнее, а состояние многих стационаров сегодня всё равно оставляет желать лучшего.
— Что вы имеете в виду?
— Многие туберкулёзные стационары были построены в 70‑е годы. Тогда был совсем другой подход к санитарной безопасности и инфекционному контролю, так что многие больницы не отвечают современным требованиям. Чтобы борьба с заболеванием давала результаты, важно свести к минимуму риск внутрибольничного заражения. Люди с чувствительной формой туберкулёза должны быть изолированы от тех, у кого лекарственно-устойчивая форма. Они не должны пересекаться ни в палате, ни в коридорах. Из каждой палаты должен быть вентиляционный выход с отрицательным давлением. Требуются индивидуальные средства защиты: пациенты, когда выходят из палаты, должны быть в медицинских масках, медперсонал — в респираторах. К сожалению, пока такие условия есть не везде. Над этим обязательно нужно работать, потому что всех больных на дневной стационар не переведёшь, какое-то время они должны находиться в больнице.
— А фтизиатров хватает?
— Проблемы с кадрами есть. Но так было и раньше — студенты медвузов никогда не считали фтизиатрию престижной специализацией. Хотя туберкулёз — это очень интересная болезнь как в научном, так и в клиническом плане. Возбудитель один, а формы многообразны — от малого очага до тотального поражения, от диссеминации до развития каверн. Тактика лечения может варьироваться от терапевтической до хирургической, есть патогенетическое лечение, есть бронхологические методы. К тому же больной находится под наблюдением длительное время, в этот период у него наблюдаются и другие болезни. Врачу приходится быть компетентным не только во фтизиатрии, но и в других специальностях. Это патология ЖКТ, почек, сахарный диабет (особая группа риска — в нашем институте есть целое отделение для таких больных). Всех таких пациентов ведут фтизиатры, потому что заразного больного нельзя отправить в общий стационар. Мы можем позвать специалиста для консультации, но всё равно контролировать и наблюдать терапию нам.
Фтизиатр — это интересная специальность, и мы хотим, чтобы к нам приходила молодёжь. Многим кажется, что высок риск заразиться. На самом деле это не так. Если врач соблюдает все меры инфекционного контроля, риск у него гораздо ниже, чем, скажем, у терапевта, сидящего на приёме в поликлинике. Терапевт в первые минуты общения не может знать, почему пришедший к нему пациент кашляет — ОРВИ у него или открытая форма туберкулёза. А фтизиатр точно знает, какой из его больных заразен, а какой — нет.
Нужны новые лекарства
— Нынешнее снижение заболеваемости внушает в вас оптимизм? Как думаете, удастся всё-таки подавить туберкулёз полностью?
— На эти вопросы сложно ответить однозначно. Всемирная организация здравоохранения поставила перед нами цель — элиминировать туберкулёз в мире к 2050 году. Российские специалисты много для этого делают. Например, в 2013–2014 годах на основании международных рекомендаций и собственных данных Российское общество фтизиатров разработало клинические протоколы по лечению больных туберкулёзом, в том числе туберкулёзом с множественной лекарственной устойчивостью. Они не копируют рекомендации Всемирной организации здравоохранения. В последних построение режима терапии проводится на основе того, к какой категории относится больной: новый это случай туберкулёза, рецидив, хроническое течение. Мы строим режим, исходя из данных о свойствах возбудителя — чувствительный он или устойчивый к препаратам. Эти протоколы получили положительную оценку европейского бюро ВОЗ.
В России разработаны программы по снижению смертности, в том числе и региональные, потому что ситуация в регионах порой сильно различается. В такие программы включены все мероприятия: и медицинские, и социальные, и организационные.
Работа идёт, но, чтобы к 2050 году угроза туберкулёза была исключена, темпы снижения заболеваемости должны быть от 10 до 20% в год. Это станет возможно, только если будут разработаны новые противотуберкулёзные препараты. Не один, а несколько, причём они должны быстро справляться с инфекцией, не за два года, как сейчас, а примерно за 3–4 месяца.
— Такие разработки идут?
Ещё один препарат — российская разработка. Он уже зарегистрирован, но исследования по оценке его безопасности ещё проведены не в полном объёме. Пока он рекомендован только для сострадательного использования, а не для широкого применения.
Остальные лекарства — на разных стадиях доклинических и клинических испытаний, из них в практику войдут лишь некоторые. Но и врачи, и пациенты этого ждут. Для лечения туберкулёза требуется комбинация минимум из трёх препаратов. У них должен быть иной, чем у препаратов стандартной схемы, механизм действия, не должно быть перекрёстной резистентности с другими лекарствами. В нашей стране длительное время шла разработка новых препаратов одной и той же группы. Это тоже хорошо. Но если у микобактерии есть устойчивость к препарату самой первой генерации в этой группе, она будет и у последующих генераций. А нужно, чтобы любая палочка Коха не была устойчивой. В этом ключ к решению проблемы.
Читайте также: