Ифа тест система туберкулеза
Антитела к возбудителю туберкулеза (M. tuberculosis) – это специфические иммуноглобулины, вырабатываемые иммунной системой в ответ на инфицирование возбудителем туберкулеза.
Суммарные антитела к Mycobacterium tuberculosis, иммуноглобулины класса G и M к возбудителю туберкулеза (микобактерии).
Anti-mycobacterium tuberculosis IgA, IgG, IgM, M. tuberculosis antibodies, IgA, IgG, IgM, MBT antibodies, total.
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Туберкулез – это инфекционное заболевание, возбудителями которого являются аэробные микобактерии (M. tuberculosis, M. bovis, M. africanus, M. microti), распространенные в почве, воде и у животных. Mycobacterium tuberculosis – это вид микобактерий, который вызывает туберкулез у человека в 92 % случаев.
M. tuberculosis передается воздушно-капельным путем от больных туберкулезом в активной форме. У 90 % людей после первичного инфицирования микобактерии оседают в нижних отделах легких и не приводят к развитию заболевания, так как вырабатывается иммунный ответ, не допускающий увеличения количества бактерий. Однако в случае сильного ослабления иммунной системы туберкулезные палочки начинают активно размножаться и туберкулез переходит из латентной формы в активную. Возможно поражение легких, костей, суставов, мочеполовых органов, лимфатической системы, кожи, глаз и нервной системы.
Микроскопическое исследование посева мокроты по-прежнему считается "золотым стандартом" в диагностике туберкулеза. Однако данный метод имеет как свои достоинства (высокая специфичность), так и недостатки (низкая чувствительность, т. к. необходима определенная концентрация бактерий в образце). Эффективность метода ниже в отношении специфических категорий лиц (ВИЧ-инфицированных, людей старше 60 лет и детей, у которых к тому же существуют сложности со сбором мокроты). Кроме того, данное исследование занимает продолжительное время, т. к. для роста бактерий требуется 6-8 недель. Наряду с бактериологическим методом широко распространено рентгенологическое исследование. Оба метода применимы только к легочным формам туберкулеза. С другой стороны, при помощи метода туберкулиновой пробы практически невозможно дифференцировать латентную и активную формы туберкулеза.
Дифференциальная скрининговая диагностика активного туберкулеза возможна при помощи определения специфических антител к М. tuberculosis методом иммуноферментного анализа.
На активной стадии туберкулеза начинается интенсивная выработка IgG и IgM антител к специфическим антигенам, которые могут быть выявлены в сыворотке крови уже через месяц с начала активизации микобактерий. Среди антител при туберкулезе у взрослых обычно преобладают IgG, реже подавляющее количество антител представлено IgA. Антитела IgM у взрослых встречаются достаточно редко и более характерны для начальных стадий заболевания. У детей высокие титры специфических IgA и IgM отмечаются гораздо чаще, причем высокий уровень IgM иногда может сохраняться даже при большом стаже заболевания и относительно низких уровнях IgG и IgA-антител. В целом картина антительного ответа на туберкулез очень индивидуальна, сложна и зависит от большого числа факторов. Данный тест позволяет выявлять суммарный пул специфичных к антигенам микобактерий антител, что дает возможность охватить максимально большой спектр вариантов гуморального ответа на туберкулез. Высокая специфичность теста достигается использованием специфических для M. tuberculosis антигенов, что исключает ложноположительные результаты у вакцинированных и инфицированных другими микобактериями лиц. Чувствительность данной тест-системы составляет от 61 % (туберкулез лимфатических узлов) до 100 % (туберкулезный экссудативный плеврит) в зависимости от локализации инфекции; специфичность – 95 %.
Для чего используется исследование?
- Для выявления активного туберкулеза, в особенности внелегочных форм.
- Для мониторинга эффективности лечения туберкулеза.
- Для выявления инфицированных лиц.
- Для подтверждения диагноза (наряду с использованием дополнительных диагностических исследований).
Когда назначается исследование?
- Когда известно, что пациент имел длительный контакт с больными туберкулезом или что его работа связана с постоянным контактом с людьми из групп риска (бездомными, инъекционными наркопотребителями, лицами, находившимися в местах лишения свободы).
- При соответствующих симптомах: слабости, быстрой утомляемости, субфебрильной температуре тела, ночной потливости, персистирующем кашле в течение 2-3 недель, боли в грудной клетке (легочном туберкулезе), хронических болях в спине, суставах, брюшной области с невыясненной этиологией.
- При длительном безрезультатном лечении хронического простатита, цистита, пиелонефритов и при воспалении эндометрия (туберкулезе мочеполовых органов).
- При анемии, лейкоцитозе.
Что означают результаты?
- Отсутствие активной формы заболевания.
- Активная форма туберкулеза различной локализации.
- Антитела, оставшиеся после перенесенного заболевания.
- Тубинфицированность – присутствие микобактерий в организме (если нет клинических проявлений заболевания).
Что может влиять на результат?
Эффективное лечение туберкулеза сопровождается резким увеличением количества антител, уровень которых приходит в норму по истечении некоторого времени.
- Этот тест особенно важен, когда при отрицательном результате рентгенологического исследования, микроскопии и методе ПЦР есть симптомы неясного происхождения, схожие с проявлениями туберкулеза внелегочных форм.
- Положительный результат – недостаточное основание для постановки диагноза "активный туберкулез", так как данный анализ должен сопровождаться другими диагностическими тестами (микроскопией бактериальных культур, ПЦР) в соответствии с клинической картиной и предполагаемыми очагами локализации инфекции для более углубленного обследования.
- На ранней стадии инфекции тест может дать отрицательный результат из-за того, что еще не выработалось достаточное количество антител. В таких случаях при симптомах инфекции рекомендуется повторить исследование через 2-7 недель или провести другие виды тестирования.
- Тест нечувствителен к БЦЖ-вакцинации, так как в нем задействованы антигены, специфичные для M. Tuberculosis и нехарактерные для M. Bovis.
- Возможность ложноположительных результатов данного анализа исключена в связи с отсутствием взаимовлияния с другими видами микобактерий.
- Тест рассчитан на выявление только активной формы туберкулеза вне зависимости от его локализации.
- Данное исследование подходит для пациентов с иммунодефицитами различного происхождения (ВИЧ, онкологией), так как тест-система позволяет обнаружить иммуноглобулины всех трех классов (G, M, A).
Кто назначает исследование?
Фтизиатр, инфекционист, терапевт, врач общей практики.
Васильева Е.В. 1 , Вербов В.Н. 1 , Беклемишев А.Б. 2 , Перемолотова И.А. 3 , Тотолян А.А. 1
- 1 ФГУН научно-исследовательский институт эпидемиологии и микробиологии им. Пастера Роспотребнадзора, Санкт-Петербург.
- 2 НИИ биохимии СО РАМН, Новосибирск.
- 3 ФГУП "Гос.НИИ ОЧБ" ФМБА России, Санкт-Петербург, E-mail: alenalenkina@gmail.com.
Основная цель иммунологических исследований при туберкулезе - оценка состояния и выявление возможных изменений в иммунной системе, которые могут быть использованы для дифференциальной диагностики. Учитывая многокомпонентность и сложность структуры иммунного ответа, для его оценки необходимо использовать комплекс тестов, отражающих интенсивность как клеточного, так и гуморального иммунитета [1].
Цель работы заключалась в сравнении туберкулезных антигенов, используемых в непрямом варианте ИФА при обнаружении IgG - антител к возбудителю туберкулеза, для оценки гуморального иммунитета. Были изучены два антигена: первый антиген - PPDN-3, который представляет собой ультрафильтрат культур возбудителя туберкулеза штаммов DТSТ и Valee и используется в тест-системе "ИФА-анти-ТУБ", выпускаемой НИИЭМ имени Пастера (г.Санкт-Петербург); второй антиген - специфический рекомбинантный антиген P38 M. tuberculosis, полученный одним из авторов методом генетической инженерии в НИИ биохимии СО РАМН (г.Новосибирск). Сорбцию антигенов в лунках полистирольных планшетов проводили при следующих концентрациях: 2,5 мкг/мл для P38 и 40 мкг/мл для PPDN-3. Методика постановки ИФА - согласно инструкции по применению "ИФА-анти-ТУБ". Для каждого антигена было исследовано в диагностическом разведении 97 сывороток крови, полученных от больных с активным туберкулезным процессом, и 45 сывороток крови от здоровых доноров.
При этом у 12,5 % больных был ответ только на антиген Р38 и у 17,5 % - только на антиген PPDN-3, 52,5 % больных имели антитела к обоим белкам. Из полученных данных следует, что совместное использование микобактериальных антигенов P38 и PPDN- 3 в серодиагностике туберкулеза позволит достигнуть чувствительности 82,5% и специфичности 93,2% (табл. 1). Отсутствие антител у 17,5% больных туберкулезом позволяет предположить, что у них гуморальное звено иммунного ответа не является преимущественным.
Таблица 1.
В качестве маркера для оценки напряженности клеточного иммунного ответа используют гамма-интерферон [2]. Количественное измерение гамма-интерферона (ИФН-гамма) позволяет диагностировать не только острые формы туберкулезной инфекции, протекающие преимущественно с клеточным типом иммунного ответа, но и латентную туберкулезную инфекцию (ЛТБИ). В качестве индуктора гамма-интерферона используют микобактериальный белок ESAT-6, секретируемый микобактериями на ранней стадии роста. Этот белок содержит эпитопы, распознаваемые протективными Т-клетками [3].
Иммунодоминантный белок ESAT-6 был разбит на отдельные, 15-ти членные фрагменты с перекрыванием в 9 аминокислотных остатков с помощью программы PeptGen. Для выделенных фрагментов были синтезированы 15 пептидов длиной 13-15 аминокислотных остатков. Синтез пептидов проводили на многоканальном синтезаторе пептидов Apex 396 на TentaGel полимерах (Rapp Polymere, GmbH) с использованием Fmoc-технологии твердофазного синтеза. В качестве временной защитной группы использовали флюоренилметилоксикарбонильную группу, для защиты боковых цепей трифункциональных аминокислот применялись защиты третбутильного и тритильного типов. После сборки полипептидной цепи полученные пептиды отщепляли от полимера с одновременным удалением постоянных защитных групп под действием трифторуксусной кислоты в присутствии скавенджеров. Чистоту полученных соединений определяли с помощью аналитической обращено-фазовой хроматографии. Масс-спектральный анализ выявил наличие пика молекулярного иона с расчетной молекулярной массой в каждом продукте синтеза.
Для предварительной оценки диагностической значимости полученных пептидов было обследовано 7 больных в возрасте 27-55 лет, проходивших лечение в СПб НИИ Фтизиопульмонологии. Из них с установленными диагнозами: фиброзно-кавернозный туберкулез легких, МБТ(+) - 6 пациентов; туберкулема S6 правого легкого, МБТ(-) - 1 пациент. Обследовано также 3 здоровых донора.
Образцы цельной венозной гепаринизированной крови были разлиты по 1 мл в 3 разные маркированные пробирки: контрольная проба без антигена и 2 опытные пробы, в одну из которых вносили 10 мкл фитогемаглютинина (ФГА) с концентрацией 25 мкг/мл, а в другую - 10 мкл исследуемых пептидов с концентрацией 10 мкг/мл. Лунки с ФГА использовали в качестве положительного контроля. Образцы крови инкубировали при 37 °С в течение 20-24 ч на ротаторе. Затем отбирали по 200 мкл образцов полученной плазмы, в которых определяли концентрацию ИФН-гамма методом твердофазного ИФА. Для оценки продукции ИФН-гамма использовали следующий коэффицент:
ИС = Кинд/Кспн, где ИС - индекс стимуляции, Кинд - значение индуцированной продукции цитокина (пг/мл), Кспн - значение спонтанной продукции цитокина (пг/мл).
Были получены следующие результаты. У больных туберкулезом наблюдается резкое увеличение спонтанной продукции ИФН-гамма (343,5 пг/мл - среднее значение, 289-398 пг/мл - разброс) по сравнению с группой здоровых (111,5 (58-165)). При оценке ИС индуцированной продукции ИФН-гамма у больных туберкулезом наблюдается угнетение продукции ИФН-гамма (1,162 (0,78-1,544)) в присутствии ФГА по сравнению с группой здоровых доноров (3,69 (1,38-6,00)). В случае стимуляции пептидами наблюдается обратная закономерность: у больных туберкулезом имеет место увеличение продукции ИФН-гамма (2,31 (0,58-4,04)) по сравнению с группой здоровых доноров (0,93 (0,68-1,18).
Таким образом, комплексное определение наличия антител в диагностическом разведении и количественное определение гамма-интерферона до и после стимуляции иммунокомпетентных клеток крови специфическими митогенами позволит с большей уверенностью ставить диагноз заболевания и, возможно, прогнозировать его тяжесть и излечиваемость.
- Чернушенко Е. Ф., Кадан Л. П., Панасюкова О. Р., Петишкина В.Н. Цитокиновая регуляция и развитие вторичных иммунодефицитных состояний при туберкулезе легких (научный доклад на заседании Ученого совета ДУ "Национальный институт фтизиатрии и пульмонологии имени Ф.Г. Яновского АМН Украины" 16.06.2009 года).
- Г.-Р. Бурместер, А. Пецутто Наглядная иммунология // Пер.с англ. - М.: БИНОМ. Лаборатория знаний, 2007. - С. 230-231.
- Doherty TM, Demessie A, Olobo J, et al // Immune responses to the Mycobacterium tuberculosis-specific antigen ESAT-6 signal subclinical infection among contacts of tuberculosis patients.J Clin Microbiol 2002. - P. 704-06.
Т. Ю. Салина, Т. И. Морозова Государственный медицинский университет, областной противотуберкулёзный диспансер, Саратов.
Важной проблемой фтизиатрии остаётся диагностика и верификация диагноза туберкулёза у больных без выделения микобактерии. Туберкулёз без бактериовыделения часто труден для диагностики и дифференциальной диагностики [4]. До настоящего времени, несмотря на внедрение таких современных технологий, как компьютерная и магнитно-резонансная томография, и целый ряд инструментальных и инвазивных методов, диагноз туберкулёза и рака лёгких нередко ставится методом проб и ошибок. По-прежнему высок (34-40%) удельный вес ошибочной диагностики туберкулёза [3, 5]. Кроме того, существует определённая категория больных, у которых морфологическая верификация диагноза невозможна из-за возраста, тяжёлых сопутствующих заболеваний или отказа пациентов от применения инвазивных методов обследования. Разработка и внедрение в практику относительно простых, преимущественно нелучевых методов диагностики туберкулёза и его дифференциальной диагностики с другой лёгочной патологией позволяют обосновать реальные пути снижения смертности от этих заболеваний.
Целью исследования является изучение диагностической информативности прямых (молекулярно-генетических) и непрямых (серологических) методов в дифференциальной диагностике туберкулёза и других заболеваний лёгких, особенно онкологической природы.
Обследовано 96 больных с трудностями дифференциальной диагностики туберкулёза и другой лёгочной патологии, находившихся на стационарном обследовании и лечении в Саратовском областном противотуберкулёзном диспансере. Пациенты были в возрасте от 18 до 75 лет. Из них было 50 мужчин, 46 женщин. Отбор пациентов проводили слепым методом с последующей ретроспективной оценкой результатов обследования по окончательному диагнозу.
Для верификации диагноза применяли комплекс обследований, включающий микробиологические, рентгенотомографические и в ряде случаев инструментальные методы (фибробронхоскопию, компьютерную томографию органов грудной клетки, УЗИ внутренних органов, диагностическую торакотомию, плевроскопию с биопсией и последующим гистологическим и цитологическим исследованием материала).
Т. Ю. Салина, Т. И. Морозова Государственный медицинский университет, областной противотуберкулёзный диспансер, Саратов.
После комплексного клинико-рентгенологического и инструментального обследования диагноз активного туберкулёза установлен у 52 пациентов, онкологические заболевания - у 28, другие лёгочные заболевания - у 16. Морфологически при диагностической торакотомии и оперативном лечении диагноз верифицирован у 12 (12,5%) пациентов, посмертно по результатам патолого-анатомического вскрытия — у 2 (2,1%). В группе больных активным туберкулёзом у 25 пациентов установлен диагноз туберкуломы, у 21 больного - инфильтративного туберкулёза лёгких и у 6 - диссеминированного туберкулёза лёгких.
Среди онкологических больных периферический рак лёгкого установлен у 19 (67,9%) пациентов, центральный рак лёгкого - у 5 (17,9%), доброкачественные опухоли лёгких - у 3 (10,7%), метастатические поражения лёгких - у 1 (3,6%) пациента. Другие лёгочные заболевания были представлены пневмониями у 3 (18,8%) пациентов, саркоидозом у 2 (12,5%), паразитарными кистами лёгких у 2 (12,5%), хронической обструктивной болезнью лёгких у 8 (50%), лимфогранулематозом у 1 (6,3%) больного.
Всем пациентам проводили однократное исследование мокроты молекулярно-генетическим методом полимеразной цепной реакции в режиме реального времени (ПЦР Real Time ) и параллельное исследование сыворотки крови на антитела к микобактериям туберкулёза методом иммуноферментного анализа (ИФА). Забор материала для исследования проводили на догоспитальном этапе.
Базовая методология ПЦР в режиме реального времени основана на выделении очищенных нуклеиновых кислот, проведении ПЦР и гибридизации с высокоспецифичными ДНК-зондами, меченными флуорохромами, совмещении этапов амплификации и детекции результатов исследования.
Реакцию проводили с использованием ДНК- амплификатора с оптическим блоком iCycler Q ("BioRad", США). Исключение в данной методике этапа гель-электрофореза для детекции результатов позволило значительно снизить риск внутрилабораторной контаминации продуктами реакции. Использовали отечественные наборы реагентов ("ДНК-технология", Москва). Для детекции специфического продукта применяли краситель FAM, для внутреннего контроля - HEX. Результаты оценивали в соответствии с числом циклов, после которых детектировался подъем флюоресценции от изолинии.
Специфические антитела к М. tuberculosis в сыворотке крови определяли методом твердофазного ИФА (тест-система "АТ-ТУБ-Бест-стрип" ЗАО "Вектор-Бест", Новосибирск). Учет результатов проводили на многоканальном оптическом компараторе марки "Линкей" (НПО "Научные приборы", Санкт- Петербург).
Для оценки диагностической значимости указанных выше методов проводили вычисление их операционных характеристик: диагностической чувствительности, диагностической специфичности, диагностической эффективности, прогностической ценности положительного результата и прогностической ценности отрицательного результата.
Статистическую обработку результатов исследования проводили с помощью компьютерных программ " Microsoft Excel " для Windows и " Statistica ". Использовали специальные статистические методики - критерий соответствия % 2 на основе таблицы взаимной сопряженности ("четырехпольной таблицы"), для оценки достоверности разности относительных величин рассчитывали величину р, указывающую вероятность безошибочного прогноза.
Сравнительный анализ эффективности ПЦР ( Real Time ) и метода ИФА показал, что ПЦР отличается большей чувствительностью и специфичностью получаемых результатов. Так, методом ПЦР ( Real Time ) было обнаружено 40 (76,9%) положительных результатов в группе из 52 больных активным туберкулезом, в то время как методом ИФА антитела к М. tuberculosis были выявлены только у 29 (55,8%) из 52 пациентов (р = 0,0254). Из них при туберкулемах (п = 25) методом ПЦР обнаружено 20 (80%) положительных результатов, методом ИФА — 13 (52%) (р = 0,420) Не получены достоверные различия при обследовании пациентов с инфильтративным туберкулёзом (п = 21), чувствительность ПЦР составила 16 (76,2%) из 21, ИФА - 13 (61,9%) из 21 (р = 0,3325). Ложноположительные результаты ПЦР ( Real Time ) получены у 1 (3,6%) из 28 пациентов с онкологическими заболеваниями лёгких, методом ИФА - у 4 (14,3%) больных (у 2 пациентов с центральным раком лёгкого и у 2 - с периферическим раком лёгкого). Среди пациентов с неспецифическими заболеваниями лёгких получен 1 (6,3%) ложноположительный результат методом ПЦР у пациентки с лимфогранулематозом и 1 (6,3%) - методом ИФА у больного с эхинококковой кистой. Совпадение результатов исследования при использовании обоих методов наблюдалось у 31 (59,6%) из 52 больных активным туберкулёзом, у 21 (75%) из 28 больных с онкологическими заболеваниями лёгких и у 15 (93,8%) из 16 больных с неспецифическими заболеваниями лёгких, всего у 67 (69,8%) из 96 диагностированных больных. Обращает на себя внимание высокий удельный вес (14,3%) ложноположительных результатов, полученных методом ИФА, у больных с онкологическими заболеваниями лёгких.
По данным литературы [2], при постановке любых серологических проб у некоторых лиц, не больных туберкулёзом, могут определяться антитела к М. tuberculosis, что связано с возможностью перекрестных реакций на антигены других бактерий, общих с микобактериями туберкулёза, продукции антител в результате контакта с микобактериями окружающей среды, увеличением фонового уровня антител в результате поликлональной стимуляции и неспецифического связывания других сывороточных факторов. Кроме того, существуют некоторые виды опухолей (эпидермоидный рак лёгкого), которые, вероятно, обладают способностью экспрессировать антигены, сходные с антигенами микобактерий туберкулёза [1].
Сравнительная операционная характеристика ИФА и ПЦР ( Real Time ) представлена в таблице. Как следует из таблицы, метод ПЦР обладает большей чувствительностью (76,9%) и специфичностью (95,5%), чем метод ИФА (соответственно 55,8 и 88,6%). При обследовании онкологических больных специфичность метода ПЦР достигает 96,4%, тогда как специфичность ИФА на 10,7% ниже.
В результате исследования установлено, что использование новой молекулярно-генетической технологии ПЦР ( Real Time ) позволяет улучшить качество диагностики туберкулёза за счёт увеличения прогностической ценности положительного результата до 95,2% против 85,3% в ИФА (р = 0,0220) и прогностической ценности отрицательного результата до 77,7% против 62,9% соответственно (р = 0,0238), что особенно важно при обследовании дифференциально-диагностических больных. Однако методы серологической диагностики туберкулёза очень важны при обследовании пациентов, не выделяющих мокроту.
1. Кноринг Б. Е., Ариель Б. М. Оценка клинической значимости туберкулиновой сенсибилизации у больных раком легкого // Пробл. туб. - 1996. -№ 2. - С. 26-30.
2. Литвинов В. И., Гергерт В. Я., Мороз А. М. и др. Иммунология туберкулеза: современное состояние проблемы // Вестн. РАМН. -1999. - № 7. - С. 8-11.
3. Мишин В. Ю., Дейкина О. Н., Назарова Н. В. Дифференциальная диагностика туберкулеза легких и внебольничной пневмонии // Consilium Medicum . -2004. -Т. 6, № 4. - С. 232-238.
4. Хоменко А. Г. Туберкулез вчера, сегодня, завтра // Пробл. туб. — 1997. -№ 5. - С. 9-11.
5. ЮкелисЛ. И., Садиков П. В., Евфимьевский Л. В. Проблема раннего выявления и диагностики туберкулеза // Рус. мед. журн. - 2002. - Т. 10, № 16 (160). -С. 699-700.
С. Е. Гладкова, С. С. Решетников, В. Н. Пряхина*
Кафедра фтизиопульмонологии Новосибирского государственного медицинского университета
Ведущую роль в диагностике туберкулёза в настоящее время продолжают играть классические методы: идентификация культуры возбудителя в посеве мокроты пациента и иных биологических жидкостях, гистологическое определение микобактерий в мазках после окраски прочным синим (AFB-метод), рентгеноскопия грудной клетки и очагов поражения в других органах [1–3]. Ограничения этих методов диагностики хорошо известны: невозможность выявить возбудителя при абациллярной форме туберкулёза, длительность процедуры культивирования возбудителя, неоднозначность картины рентгеноскопии при ряде сопутствующих заболеваний (СПИД, онкологические заболевания и др.) [3–5]. Из серологических методов, применяемых для лабораторной диагностики туберкулёза, чаще используется комбинация классических тестов, основанных на реакциях непрямой гемагглютинации (РНГА), поглощения комплемента (РПК) и пассивного гемолиза (РПГ). Несколько реже используются различные варианты определения циркулирующих антител (АТ) к антигенам микобактерий, основанные на методе иммуноферментного анализа (ИФА) [1, 3, 6–8].
Справедливости ради следует отметить, что в среде практикующих фтизиатров все еще продолжается дискуссия об обоснованности диагностики туберкулёза, опирающейся на определение специфических антител в периферической крови. Дискуссия базируется в основном на том постулате, что при туберкулёзе главное (протективное) значение имеет клеточный иммунитет и при заболевании именно он должен претерпевать наиболее значимые изменения. Вместе с тем невозможно отрицать то, что все реакции иммунной системы взаимосвязаны и, следовательно, изменение клеточного звена иммунитета неизбежно должно сопровождаться изменением ее гуморального звена.
Известно, что туберкулёзная инфекция (не заболевание, а именно инфекция без клинических признаков заболевания) широко распространена в популяции и охватывает до 90 % населения старше 35–40 лет [1, 9, 10]. Достаточно часто (но не всегда!) объективным подтверждением наличия инфекции является проба Манту, свидетельствующая об определенной напряженности клеточного иммунитета. Практически у всех таких людей в крови можно обнаружить и антитела к возбудителю туберкулёза. Однако уровни специфических антител при этом, как правило, остаются достаточно низкими. При снижении иммунитета и индукции заболевания уровни соответствующих антител в крови и / или других биологических жидкостях существенно возрастают, причем часто это происходит раньше появления первых клинических признаков. Однако досадное своеобразие туберкулёза заключается в том, что в процессе развития заболевания могут формироваться различного типа преходящие (лабильные) иммунодефициты, осложняющие иммунодиагностику [1, 11, 12].
Конечно, диагностика туберкулёза, основанная на определении специфических АТ, имеет некоторые ограничения. Однако если ясно представлять иммунологический феномен активного туберкулёза и интерпретировать результаты анализа АТ с учетом всей совокупности клинических признаков и результатов объективной диагностики, то появляется возможность дифференцировать заболевание, определить его фазу или составить обоснованный прогноз его дальнейшего развития. Диагностическая ценность соответствующих иммуноферментных тест-систем подтверждена их широким применением в лабораторной диагностике туберкулёза за рубежом [1, 6–8].
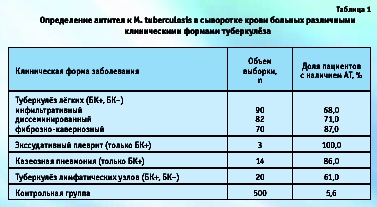
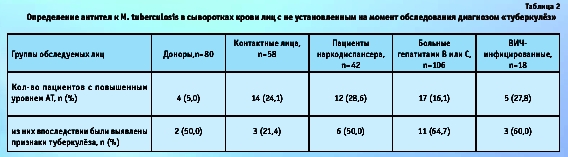
Сероположительной оказалась также почти треть пациентов наркологического диспансера и ВИЧ-инфицированных лиц, а у больных гепатитами В или С антитела к микобактериям были выявлены в 16 % случаев. Большое количество положительных результатов среди обследованных наркоманов, скорее всего, обусловлено соответствующими социальными условиями, а среди пациентов, инфицированных ВИЧ или вирусами гепатитов, тем, что данные хронические заболевания нередко приводят к значительному снижению иммунного статуса.
Все лица с повышенным уровнем АТ к M. tuberculosis были направлены на углубленное клиническое обследование, в результате которого у большинства из них был действительно выявлен активный туберкулёз (табл. 2). Причем признаки туберкулёза были обнаружены и у 50 % (2 из 4) условно здоровых доноров с наличием АТ к микобактериям, хотя этот факт мог быть связан с ранее перенесенным заболеванием.
Опубликованные другими авторами и наши собственные данные показывают [1, 6–8, 13], что диагностика туберкулёза, основанная на определении АТ к M. tuberculosis с помощью ИФА, является вполне эффективной и должна иметь среди других диагностических методов свою четко очерченную нишу. Широкая освоенность ИФА лабораториями, простота его постановки и возможность получения результатов исследования большого количества проб за 2–3 ч позволяют успешно использовать данный метод серодиагностики туберкулёза для скрининга, выявления групп риска и оценки эпидемиологической обстановки. Хотя сам по себе факт превышения порогового уровня специфических АТ у пациента не свидетельствует об активном туберкулёзе, он становится весомым поводом для проведения дальнейшего углубленного обследования с привлечением других методов и данных клиники. Определение АТ к M. tuberculosis у выздоравливающих больных может быть полезно при выборе дальнейшей тактики лечения, а у выздоровевших — для оценки вероятности возникновения рецидива. Наконец, результаты данного исследования могут дать ценную информацию для дифференциальной диагностики туберкулёза в сложных и сомнительных случаях, например при внелегочной локализации процесса или при онкопатологии в области грудной клетки.
2. Туберкулёз: Руководство для врачей / Под ред. А. Г. Хоменко. М.: Медицина, 1996. 258 с.
3. Хоменко А. Г. // Русский медицинский журнал. 1995. № 1. С. 5–21.
4. Васильев А. В., Карпов А. В. // Проблемы туберкулёза. 1996. № 1. С. 13–15.
6. Карпов А. В. // Вестн. Новгородск. гос. университета. 1998. № 7. С.1–3.
7. Chan E. D., Reves R., Belisle J. T. et al. // Am. J. Respir. Crit. Care Med. 2000. V. 161. Р. 1713–1719.
8. Al Zahrani K., AL Jahdali H., Poirier L. et al. // Am. J. Res-pir. Crit. Care Med. 2000. V. 162. Р. 1323–1329.
10. Хоменко А. Г. Туберкулёз органов дыхания. М., 1981. 487 с.
11. Беклемишев Н. Д. Иммунопатология и иммунорегуляция (при инфекциях, инвазиях и аллергиях). М.: Медицина, 1986. 256 с.
12. Шендерова Р. И., Якунова О. А., Новикова Н. С. и др. // Иммунология. 1998. № 6. С. 25–28.
— Почему чувствительность набора не достигает 100 %?
— Почему специфичность набора менее 100 %?
Для определения специфичности анализа использовали группу условно здоровых доноров со станции переливания крови. Нельзя исключить, что некоторые из них когда-то болели или болеют активным туберкулезом. Специфичность анализа, в принципе, можно повысить, увеличив концентрацию специфических АТ в отрицательном контрольном образце, определяющем пороговый или фоновый уровень противотуберкулезных АТ. Однако это приведет к снижению чувствительности анализа, поскольку она имеет обратную связь со специфичностью. Набор в этом случае будет менее эффективно выявлять АТ у больных туберкулезом с гуморальными иммунодефицитами.
— Каков будет результат анализа при обследовании здоровых людей, никогда не болевших туберкулезом, с положительной реакцией Манту или вакцинированных БЦЖ?
— Будет ли результат анализа положительным при обследовании людей, когда-либо болевших туберкулезом?
Да, такая вероятность достаточно велика, поскольку специфические иммуноглобулины класса G (IgG) циркулируют в крови лиц, переболевших туберкулезом длительное время. В этом случае необходимо обязательно анализировать всю информацию о перенесенных заболеваниях в анамнезе.
— Возможен ли положительный результат анализа при нетуберкулезном заболевании, но с симптоматикой, похожей на туберкулез?
Нет, невозможен, такие случаи могут быть обусловлены только ранее перенесенным туберкулезом.
— Влияет ли на результаты анализа ВИЧ-инфекция?
Нет, не влияет, если она еще не переросла в развитый СПИД с глубокими поражениями иммунной системы. Это относится также и к иммунодефицитам другой этиологии.
— Может ли анализ быть положительным при других заболеваниях?
Он может быть положительным при туберкулезе, вызванном не M. tuberculosis, а такими микобактериями, как M. bovis, M. afrikanum, M. avium, M. intracellulare и др., а также БЦЖ. Кроме того, он будет положительным при проказе, вызываемой M. leprae. Однако это заболевание легко отличить от туберкулеза по общей клинической картине.
— Может ли набор использоваться для мониторинга эффективности лечения?
В большинстве случаев не может, так как специфические IgG у некоторых пациентов могут обнаруживаться в крови длительное время и после полного излечения.
— Каким должен быть вывод, если результат анализа положительный, а микобактерии в мазке или мокроте не обнаружены?
— Каким должен быть вывод, если результат анализа положительный, однако у пациента отсутствуют характерная симптоматика, объективные положительные данные рентгеноскопии, а также микобактерии в мазке или мокроте?
— Каким должен быть вывод, если результат анализа отрицательный, а в мазке или мокроте обнаружены микобактерии?
— Какими должны быть действия фтизиатра, если при наличии туберкулезоподобной симптоматики результат анализа отрицательный?
Необходимо провести дополнительное углубленное обследование пациента с помощью всей совокупности методов диагностики туберкулеза.
— Зачем определять специфические АТ, если можно воспользоваться пробой Манту?
— Зачем определять специфические АТ,если можно применить такие современные методы, как ПЦР-анализ или анализ индукции цитокинов?
Перечисленные методы, также как и ИФА, являются современными методами диагностики, имеющими свои достоинства и недостатки. Так, например, ПЦР в силу своей высокой чувствительности не всегда может отличить активный туберкулез от туберкулезной инфекции. Анализ индукции цитокинов — высокочувствительный, но пока еще недостаточно специфичный метод. В принципе, все эти тесты могут внести свою лепту в диагностику туберкулеза, ее эффективность может возрасти при их комплексном использовании.
1. Карпов А. В. // Вестн. Новгородск. гос. университета. 1998. № 7. С.1–3.
2. Chan E. D., Reves R., Belisle J. T. et al. // Am. J. Respir. Crit. Care Med. 2000. V. 161. Р. 1713–1719.
3. Al Zahrani K., AL Jahdali H., Poirier L. et al. // Am. J. Respir. Crit. Care Med. 2000. V. 162. Р. 1323–1329.
Читайте также:


