Экспресс диагностика микобактерий туберкулеза
ПУТИ ОПТИМИЗАЦИИ ВЫЯВЛЕНИЯ ТУБЕРКУЛЕЗА В ПУЛЬМОНОЛОГИЧЕСКОМ ОТДЕЛЕНИИ
Цель: оптимизировать выявление туберкулеза в пульмонологическом отделении. В пульмонологическом отделении пациентам с подозрением на туберкулез проводили диагностический минимум: ставили пробу с аллергеном туберкулезным рекомбинантным, проводили анализ мокроты (трехкратно) и жидкости бронхоальвеолярного лаважа (БАЛЖ) методами микроскопии по Цилю - Нильсону, в лаборатории противотуберкулезной службы диагностический материал исследовали с помощью GeneXpert MTB/RIF, Bactec MGIT. Проанализировали результаты диагностического процесса у 70 больных с этиологически подтвержденным диагнозом. Целенаправленный опрос, сбор анамнеза были информативными в 4%, проба с АТР - в 27,1%, GeneXpert MTB/RIF - в 100%, Bactec MGIT - в 97,1%. Внедрение ускоренных методов диагностики в пульмонологическом отделении сокращает средний койко-день от поступления до установления диагноза туберкулеза и перевода в противотуберкулезный стационар до 9,80 ± 4,72 дня. Молекулярно-генетический метод можно рекомендовать в общую лечебную сеть как диагностический минимум при обследовании пациентов с высоким риском подозрения на туберкулез. Своевременное выявление больных туберкулезом в первичном звене здравоохранения является определяющим фактором как в выздоровлении пациента, так и эпидемической обстановки по туберкулезу в целом. Средние сроки диагностики туберкулеза в общей лечебной сети составляют 1,5-2,0 мес. Наиболее часто с проблемой диагностики туберкулеза сталкивается врач-пульмонолог стационарного отделения. Обнаружение микобактерий туберкулеза (МБТ) имеет решающее значение не только для диагностики туберкулеза, оно чрезвычайно важно при прогнозировании течения процесса, выборе рациональной схемы лечения и правильной оценке его эффективности. Наиболее надежным способом подтверждения диагноза туберкулеза легких является обнаружение Mycobacterium tuberculosis в мокроте или бронхо-альвеолярной жидкости (БАЛЖ). Основными методами подтверждения диагноза туберкулеза остаются сочетание микроскопического и бактериологического методов выявления МБТ. Бактериоскопическое исследование является доступным, быстрым и дешевым методом выявления кислотоустойчивых микобактерий (КУМ). Однако метод эффективен в основном у пациентов с прогрессирующим, деструктивным туберкулезом. Бактериоскопические методы имеют такие недостатки, как низкая чувствительность, невозможность дифференцировать микобактерии туберкулезного комплекса от нетуберкулезных микобактерий и определить жизнеспособность микобактерий. В последнее десятилетие получили распространение молекулярно-генетические методы (МГМ) выявления ДНК МБТ, самый применяемый в настоящее время - GeneXpert MTB/RIF. Основными недостатками этого метода являются высокая стоимость, необходимость хорошо оснащенных лабораторий, высокая квалификация персонала. Эти ограничения не позволяют широко использовать методику в первичном звене здравоохранения, возможности применения GeneXpert MTB/RIF имеются только в специализированных лабораториях противотуберкулезных учреждений. Методика GeneXpert MTB/RIF не определяет жизнеспособность выявляемых микобактерий, в результате чего возможны ложноположительные результаты. В настоящее время в практике диагностических лабораторий противотуберкулезных учреждений используют GeneXpert MTB/RIF как экспресс-метод для поиска МБТ при обязательном параллельном применении классических методов диагностики. Цель: оптимизировать выявление туберкулеза в пульмонологическом отделении. Исследование проводилось в 2 пульмонологических отделениях (150 коек) городской больницы, принимающей ежедневно больных пульмонологического профиля по экстренной помощи. При поступлении пациентов с легочной патологией и с подозрением на туберкулез проводилась консультация фтизиатра с обязательным выполнением диагностического минимума. При опросе выяснялись наличие контакта с больным туберкулезом, перенесенный туберкулез в анамнезе, отягощенная наследственность. Уже в приемном отделении всем проводили рентгенограмму в прямой и боковой проекции, анализ мокроты на МБТ методом микроскопии по Цилю - Нильсену. В стационаре в течение первых 2 сут ставилась кожная пpoбa с аллергеном туберкулезным рекомбинантным (АТР), 3-кратно повторялась микроскопия мокроты с обязательным взятием утренней порции. При отрицательном результате проводили забор БАЛЖ при бронхоскопии и ее исследование. Диагностический материал направляли на МГМ GeneXpert MTB/RIF и на посев (Bactec MGIT) в лабораторию противотуберкулезной службы. В анализ включены только случаи туберкулеза с подтвержденным положительным анализом на МБТ. В пульмонологическом отделении за 10 мес. 2017 г. из 1 900 госпитализированных пациентов подозрение на туберкулез было у 350 больных. Туберкулез, подтвержденный бактериологически, выявлен у 70 пациентов. Среди пациентов с установленным диагнозом туберкулеза легких мужчин было 72,8% (51/70), женщин - 27,2% (19/70), соотношение 3:1, возраст от 18 до 70 лет (36,4 ± 9,3). При проведении диагностического минимума при поступлении контакт с больным туберкулезом выяснен при опросе только в 4 (5,7%) случаях, в 1 случае пациент вернулся из мест лишения свободы. Относились к группам риска по соматическим заболеваниям 78,5% (55), из них пациенты с ВИЧ-инфекцией составили 68,5% (48). По данным рентгенологического обследования инфильтраты, характерные для туберкулезного поражения, были в 62,8% (44) случаях, все они описывались рентгенологом как негомогенные, с нечеткими контурами, с дорожкой к корню легкого. В 11,4% (8) диагностировался плевральный выпот. В 24,2% (17) выявлена двусторонняя диссеминация, чаще мелкоочаговая, по всем легочным полям. В 1 случае установлено наличие деструкции, фиброза легочной ткани, смещение органов средостения в пораженную сторону. Всем пациентам ставилась проба с АТР. Положительный результат был в 27,1% (19), при этом папула более 15 мм -в 89,4% (17), гиперемия - 2 случая. Отрицательный результат - в 72,9% (48). ВИЧ-инфекция была выявлена у 72,9% (48) пациентов, из них состояли на учете в СПИД-центре 45,8% (22) в течение 3-5 лет, принимали АРТВ-терапию 50% (11), выявлена ВИЧ-инфекция впервые при данной госпитализации у 54,2% (26). При проведении анализа мокроты методом микроскопии по Цилю - Нильсену КУМ выявлены в 24,3% (17), эти пациенты переведены в противотуберкулезный стационар, кроме 1 больного, перевод которого был невозможен из-за тяжести состояния, он умер на 3-й сут поступления в отделение реанимации и интенсивной терапии. Пациентам с положительным анализом на КУМ по совокупности клинико-рентгенологических и лабораторных данных поставлен диагноз: фиброзно-кавернозный туберкулез в 8,3% (1), диссеминированный туберкулез в 23,5% (4), инфильтративный туберкулез в стадии распада - в 70,5% (12) случаев. Бронхоскопия со взятием БАЛЖ на БК проведена в 74,2% (52), отказались от обследования 25,7% (18). По результатам исследования БАЛЖ методом бактериоскопии обнаружены КУМ в 21,1% (11/52). У этих пациентов по данным клинико-рентгенологического обследования поставлены диагнозы: инфильтративный туберкулез - у 91% (10/11), плеврит туберкулезной этиологии с туберкулезом бронхов - у 9% (1/11). Сроки постановки диагноза для этих пациентов составили 7,2 ±1,3 койко-дня. Пациенты с обнаружением КУМ в БАЛЖ были переведены в противотуберкулезный стационар, кроме 1 больного ВИЧ-инфекцией с инфильтративным туберкулезом, который умер в отделении реанимации и интенсивной терапии на 5-е сут после поступления. Полученный в первые 3 сут поступления в пульмонологическое отделение диагностический материал от больного (мокрота, БАЛЖ, плевральная жидкость) направляли на исследование с помощью GeneXpert MTB/RIF и Bactec MGIT в лабораторию противотуберкулезной службы. Отрицательные анализы на КУМ при бактериоскопии и БАЛЖ среди направленных анализов составили 60% (42). При исследовании с помощью GeneXpert MTB/RIF получены в 100% положительные результаты. За это время в ОРИТ умер еще 1 пациент с диагнозом диссеминированного туберкулеза, в переводе которого в профильное учреждение было отказано из-за отрицательного анализа мокроты и БАЛЖ на КУМ, по результатам патолого-анатомического обследования у пациента диагностирован мили-арный туберкулез. При посеве всех образцов диагностического материала на жидкие среды (Bactec MGIT) получен рост микобактерий в 97,1% (68) случаев. По результатам обследования поставлены диагнозы: инфильтративный туберкулез - 62,2% (44), диссеминированный туберкулез - 22,2% (16), экссудативный плеврит туберкулезной этиологии - 11,4% (8), но 1 (2,1%) случаю милиарный и фиброзно-кавернозный туберкулез. Направлены на лечение в противотуберкулезное лечебное учреждение 67 (95,7%) пациентов, умерло в отделении реанимации и интенсивной терапии 3 (4,2%). Средний койко-день от поступления до установления диагноза туберкулеза и перевода в противотуберкулезный стационар составил 9,80 ± 4,72 дня. Сложившаяся многолетняя практика по выполнению стандартного диагностического минимума при подозрении на туберкулез у пациента в пульмонологическом отделении показывает низкую эффективность, метод бактериоскопии, наиболее доступный в общей лечебной сети, позволяет выявить туберкулез только в 24,2% от всех случаев с бактериологическим подтверждением туберкулеза. Анамнез и выявление возможного контакта оказываются информативными на момент поступления пациента только в 4%, кожная проба с АТР положительна в 27,1%. Применение экснресс-метода GeneXpert MTB/RIF позволило выявить МБТ в течение 2 нед. от начала госпитализации с подтверждением положительного результата на жидких средах (Bactec MGIT) в 97,1%. Целесообразно рекомендовать в первичное звено здравоохранения МГМ GeneXpert MTB/RIF для обследования пациентов с подозрением на туберкулез. Применение GeneXpert MTB/RIF как экспресс-метода в выявлении ДНК МБТ позволит значительно сократить сроки выявления туберкулеза.
Новый диагностический тест на туберкулез, включая его самую распространенную устойчивую форму, рекордными темпами вводится в использование, а его основным потребителем является Южная Африка. Теперь необходимо обеспечить лечение для новых случаев заболевания. Репортаж Клэр Китон (Claire Keeton).
Молекулярная технология, первоначально разработанная для выявления возбудителя сибирской язвы в почтовых отправлениях в Соединенных Штатах Америки, приводит к радикальным изменениям в области диагностики туберкулеза, особенно в странах, где туберкулез является одной из основных причин смерти среди ВИЧ-инфицированных людей. Xpert MTB/RIF — это полностью автоматизированный экспресс-тест на основе амплификации нуклеиновых кислот, ставший первым крупным прорывом в области диагностики туберкулеза после того, как более 100 лет назад была разработана микроскопия мазка мокроты.
Но в отличие от микроскопии мазка мокроты, для которой характерна низкая чувствительность в отношении ВИЧ-позитивных людей, или от посева мокроты, при проведении которого на получение основных результатов уходит от трех до шести недель, а на получение результатов тестов на лекарственную чувствительность еще больше времени, новый тест позволяет выявлять Mycobacterium tuberculosis и устойчивость к рифампицину, широко используемому противотуберкулезному препарату, менее чем за два часа.
Новый тест начинает применяться в 77 странах, но ни в одной из этих стран его внедрение не осуществляется с таким энтузиазмом, как в Южной Африке. На сегодняшний день эта страна, расположенная к югу от Сахары, приобрела 288 аппаратов Xpert и более одного миллиона картриджей для проведения тестов на туберкулез, что составляет 59% глобальных поставок.

Для проведения нового теста пациенты сдают образцы мокроты (жидкости, выделяемой из легких), как и в случае таких диагностических методик, как микроскопия и посев. Образец смешивается с реагентом, и смесь вводится в картридж, который вставляется в модуль аппарата. Результаты выводятся на экран компьютера.

С тех пор как в Южной Африке был введен новый тест, показатели диагностирования туберкулеза среди людей с симптомами в центрах первичной медико-санитарной помощи почти что удвоились — с 9 до примерно 16%. Примерно в 7% всех подтвержденных случаях заболевания туберкулез является устойчивым к рифампицину.
Лекарственно-устойчивый туберкулез представляет большую проблему, в частности, потому что пациентам необходимо лечение дорогими препаратами второй линии, которые приводят к более тяжелым побочным эффектам, чем препараты первой линии, а на эффективное лечение уходит до 24 месяцев. А если эти пациенты имеют ВИЧ-инфекцию, шансов выжить у них немного.
И хотя на сегодняшний день новый туберкулезный тест наиболее широко применяется в Южной Африке, последние данные мониторинга ВОЗ за его глобальным внедрением свидетельствуют о том, что Индия, Китай, Российская Федерация и Филиппины, на которые, по оценкам, приходится 60% случаев заболевания туберкулезом с лекарственной устойчивостью в мире, заказали аппараты Xpert, имеющие, в общей сложности, 404 модуля, и 131 820 картриджей MTB/RIF.
В то время как ВОЗ играет ключевую роль во внедрении этой технологии с точки зрения разработки политики и руководящих принципов, Фонд для инновационных и новых диагностических средств (ФИНД), некоммерческая структура, базирующаяся в Женеве и работающая над улучшением диагностики в бедных странах, первым признал потенциальные возможности этой технологии в борьбе с туберкулезом.
Система Xpert была разработана в 2002 году компанией Cepheid Inc., базирующейся в Саннивейле, США, для тестирования на сибирскую язву после серии терактов, произошедших в почтовых службах в 2001 году.
ФИНД обратился к Cepheid Inc. и заключил с ней соглашение о совместной разработке. Впоследствии эта компания адаптировала эту технологию для диагностики туберкулеза в партнерстве с Университетом медицины и стоматологии Нью-Джерси и при финансировании, предоставляемом Национальными институтами здоровья США и Фондом Билла и Мелинды Гейтс.
На переговорах, посредником на которых был ФИНД, Cepheid Inc. согласилась поставлять аппараты Xpert MTB/RIF в государственный сектор 145 стран по льготным ценам. Первоначально была достигнута договоренность о снижении цены на аппараты и картриджи на 75%. Таким образом, стоимость одного картриджа составляла около 18 долларов США, значительно меньше, чем в частном секторе (60-80 долларов США).
Но даже при такой уступке тест все равно был вне досягаемости для бедных стран, поэтому к решению этой проблемы присоединились Правительство США (ЮСЭЙД и ПЕПФАР), Фонд Билла и Мелинды Гейтс и финансовая организация в области здравоохранения ЮНИТЭЙД. Это привело к соглашению с Cepheid Inc. в августе 2012 года о снижении цены на картридж до 9,98 доллара США для 145 стран.
Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из патологического материала (в большинстве случаев - мокроты). При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Использование метода флотации повышает выявляемость микобактерий на 10%, но в связи с отмеченными выше недостатками этого метода, он не может быть рекомендован для широкого применения в клинико-диагностических лабораториях.
Чувствительность метода флуоресцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Обогащение материала для микроскопии путем обработки иммуномагнитным сорбентом, обеспечивающим концентрацию возбудителя в осадке гомогенизированной мокроты, позволяет значительно повысить эффективность метода, особенно при незначительном количестве микобактерий туберкулеза в материале. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Культуральный метод выявления микобактерий туберкулеза дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их колонии можно наблюдать только через 2-2,5 месяца.
Чаще всего применяется посев на твердую яично-картофельную среду Левенштайна-Йенсена, реже на среды Фин-2 и В.А. Аникина.
Диагностические возможности культурального метода ограничиваются длительным периодом роста микобактерий, а также тем, что при активном туберкулезе легких этим методом возбудитель выделяется только в 52 - 65% случаев. При внелегочном туберкулезе процент выявлений культуральным методом еще ниже. Так, например, при туберкулезном менингите рост микобактерий на питательных средах наблюдается только в 3% случаев. При нефротуберкулезе частота выявления варьирует от 26,7% до 73% случаев.
Российским НИИ фтизиопульмонологии Министерства здравоохранения рекомендуется комплексная методика исследования мочи на наличие микобактерий туберкулеза. Из одной и той же порции одновременно выполняется люминесцентная микроскопия осадка, окрашенного ауромином, и посев не менее чем на две питательные среды. Микобактерии, потерявшие кислотоустойчивость, но сохранившие жизнеспособность, выявляются посевом, а потерявшие жизнеспособность, но сохранившие кислотоустойчивость - бактериоскопией.
К сожалению, широкое внедрение этой методики сдерживается, как уже было отмечено выше, высокой стоимостью лабораторного оборудования для люминесцентной микроскопии. Также существует ряд факторов, ограничивающих широкое применение культурального метода, в частности, необходимость использования дорогостоящих питательных сред.
Значительные трудности представляет обнаружение микобактерий у лиц со скудным их выделением. Это притом, что среди впервые выявленных больных у одной трети бактериовыделение бывает однократным.
За рубежом широкое распространение получила радиометрическая система Bactec, дающая возможность быстрого обнаружения микобактерий туберкулеза в жидкой питательной среде. Микобактерии культивируются в жидкой среде Bactec, где в качестве источника углерода используется меченая С14 пальмитиновая кислота. При положительных данных бактериоскопического исследования рост микобактерий обнаруживается радиометрически на 7-10 день, а при отрицательных - на 14-21 день. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся: высокая стоимость исследований, необходимость применения радиоактивных изотопов, специального радиометрического оборудования, сложность работы с изотопной технологией, необходимость дополнительного посева на плотные питательные среды при возникновении проблем с идентификацией возбудителя.
В настоящее время для культуральной диагностики туберкулеза также используется автоматизированная система MB/BacT фирмы Organon Teknika. В результате использования этой системы среднее время детекции роста микобактерий составляет 18,7 дня против 33,2 на стандартной плотной среде Левенштайна-Йенсена. К сожалению, высокая стоимость оборудования делает повсеместное внедрение этого метода в практику лабораторной диагностики туберкулеза маловероятным.
Иммуноферментный анализ (ИФА) получил широкое распространение в диагностике различных инфекционных заболеваний в связи с высокой чувствительностью и специфичностью, высокой производительностью, простотой проведения анализа и регистрации результатов, возможностью микроколичества диагностического материала и автоматизации процесса. ИФА используется для определения в биологических жидкостях, как антигенов, так и антител к этим антигенам.
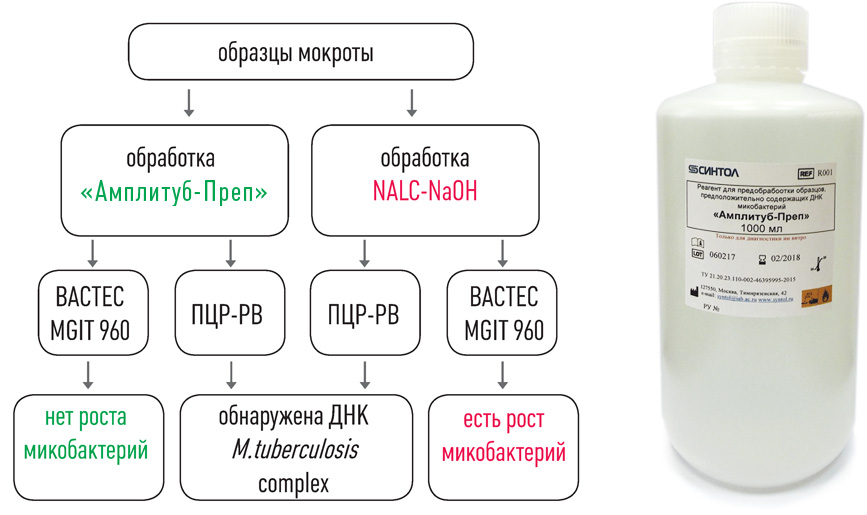
Полимеразная цепная реакция (ПЦР), основанная на обнаружении участка ДНК, характерного только для данного возбудителя, может служить одним из методов экспресс-диагностики туберкулеза. Высокая чувствительность ПЦР позволяет обнаружить в исследуемом материале единичные клетки или даже фрагменты ДНК возбудителя в течение 4-5 часов. Благодаря отсутствию перекрестных реакций с ДНК бактерий - возбудителей других легочных инфекций (L.pneuphila, M.pneumoniae, K.pneumoniae, Y.pestis, Y.pseudotuberculosis, S.aureus, E.coli, F.tularensis), а также с ДНК человека, ПЦР обладает высокой специфичностью (100%). Чувствительность ПЦР при тестировании образцов патологического материала полученного от больных с различными формами туберкулеза легких составляет: мокроты - 63,5-80,0%, мочи - 50,0-78,8%, плевральной жидкости - 45,8-54,5% и крови - 17,2-42,8%. Моча достаточно часто служит прекрасным материалом для выявления специфической ДНК у больных с распространенным туберкулезом легких, без сопутствующего специфического процесса в почках и мочевыделительной системе. ПЦР дает возможность дифференциальной диагностики при ограниченных формах туберкулеза (очаговых инфильтратах, туберкулемах, туберкулезе внутригрудных лимфатических узлов), а также при диссеминированной форме туберкулеза, при которых дифференциальная диагностика с использованием только традиционных микробиологических методов весьма затруднена в связи с редким обнаружением возбудителя в мокроте. Обобщая результаты бактериоскопии, посева на плотные питательные среды и исследования методом ПЦР материала, полученного от больных ограниченными формами туберкулеза можно сделать вывод о том, что последняя обладает значительно более высокой чувствительностью по сравнению с традиционными методами. В частности при сравнительном исследовании одного и того же материала бактериоскопией было получено 11,2% положительных результатов, методом посева на питательные среды - 19,3%, и методом ПЦР - 51,6% таких результатов.
Практически полное совпадение результатов сравнительного исследования патологического материала микробиологическими методами и методом ПЦР отмечается только при хронических деструктивных формах туберкулеза легких: кавернозной и фиброзно-кавернозной. Такое совпадение результатов обусловлено наличием у пациентов постоянного массивного бактериовыделения, характерного для таких форм туберкулеза. ПЦР достаточно информативна при необходимости подтверждения диагноза туберкулеза у детей и подростков при отрицательных результатах традиционных микробиологических методов исследования.
Использование ПЦР в диагностике туберкулеза рекомендовано Минздравом РФ (приказ от 21.02.2000 №64 "Об утверждении номенклатуры клинических лабораторных исследований", п. 9.4.5. приложения).
Использование ПЦР раскрывает возможности проведения, параллельно с традиционным бактериологическим способом определения лекарственной резистентности, экспресс-диагностики резистентности микобактерий туберкулеза к лекарственным препаратам методом выявления точечных мутаций в генах. В настоящее время известны следующие гены микобактерии туберкулеза, мутации в которых вызывают резистентность к лекарственным препаратам: rpoB - к рифампицину, katG, inhA, oxyR, ahpC, kasA - к изониазиду, rpsL - к стрептомицину, gyrA - к фторхинолонам, pncA - к пиразинамиду, embCAB - к этамбутолу. При этом, в большинстве случаев, исследованные клинические изоляты, устойчивые к рифампицину, оказались резистентными и к другим противотуберкулезным препаратам. Таким образом, устойчивость к рифампицину является маркером полирезистентности.
Кроме того, последние результаты изучения спектра MDR-штаммов микобактерии туберкулеза у впервые выявленных больных можно позволяют сделать вывод о снижении показателя удельного веса штаммов, устойчивых к стрептомицину и этамбутолу, и о наличии тенденции к увеличению частоты выделения штаммов, устойчивых к изониазиду и рифампицину.
Разработанный в Институте молекулярной биологии метод определения лекарственной резистентности микобактерии туберкулеза к рифампицину на микрочипах позволяет обнаружить 30 мутантных вариантов ДНК микобактерии туберкулеза.
Использование данного метода позволило выявить резистентность к рифампицину у 64,8% больных в течение 3-х дней до начала лечения. Режим химиотерапии данной когорты больных изначально состоял из комбинации препаратов резервного ряда (канамицин, офлоксацин, этионамид, циклосерин) и пиразинамида. Спустя 3 три месяца методом абсолютных концентраций выявлена лекарственная резистентность, по крайней мере, к изониазиду и рифампицину у 34 из 35 (97,2%) пациентов данной группы.
Применение молекулярно-генетических методов в эпидемиологии позволяет провести генотипирование клинических изолятов микобактерий, выделенных от больных на определенной территории.
В частности, в Томской области молекулярно-генетическими исследованиями, проведенными Нью-Йоркским институтом общественного здравоохранения, совместно с Центральным научно-исследовательским институтом туберкулеза РАМН, установлено, что 45% всех выделенных культур микобактерий туберкулеза представлено всего двумя штаммами, один из которых является эндемичным для Томской области. Данным методом было выявлено уникальное семейство микобактерии туберкулеза KY, ранее не встречавшееся в базе данных Нью-Йоркского института, а также преобладание микобактерий W- (20 штаммов) и Al- (8 штаммов) семейств. Молекулярное типирование показало, что более 60% штаммов, выделенных от больных из учреждений УИС Ивановской области, принадлежало к W-семейству, а около 12% культур было представлено смесью штаммов микобактерий туберкулеза двух генотипов.
Выявление путей распространения возбудителей туберкулеза, основанное на методах молекулярной эпидемиологии, способствует принятию эффективных мер по предотвращению дальнейшего распространения туберкулеза в УИС и дальнейшему снижению заболеваемости.

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
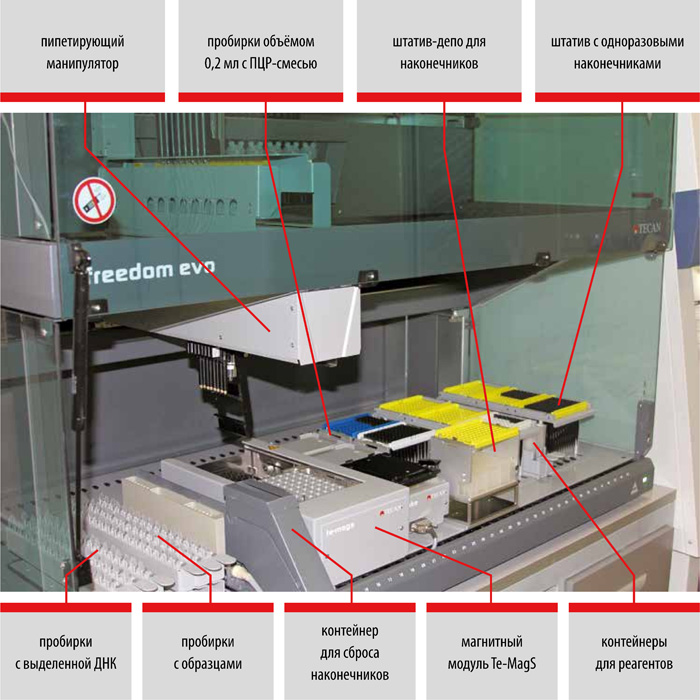
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
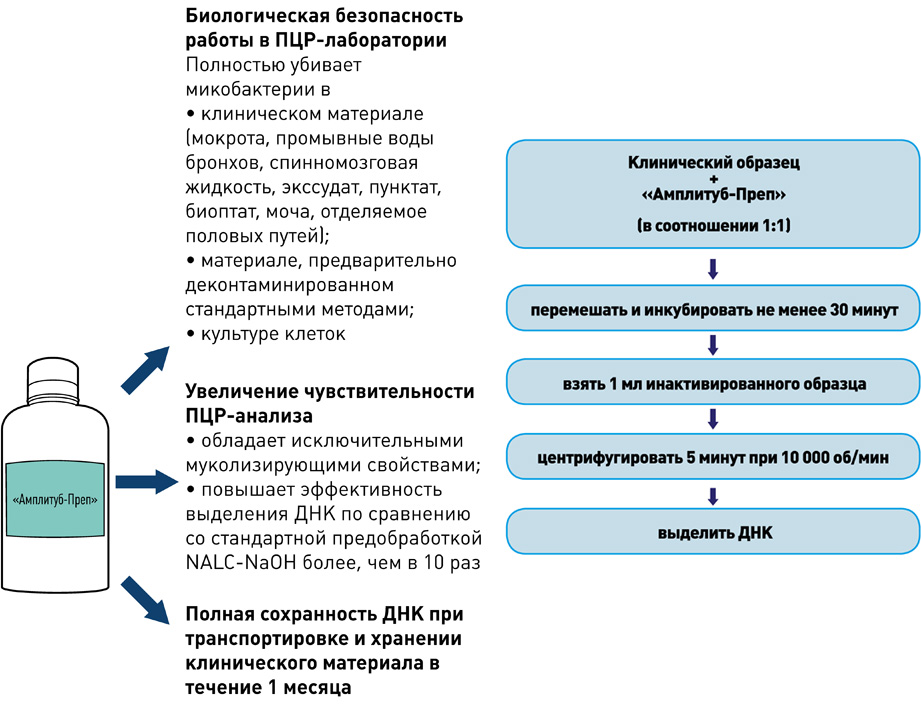
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
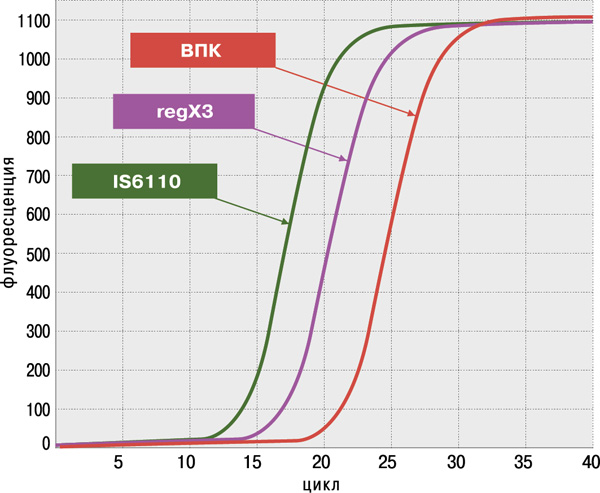
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
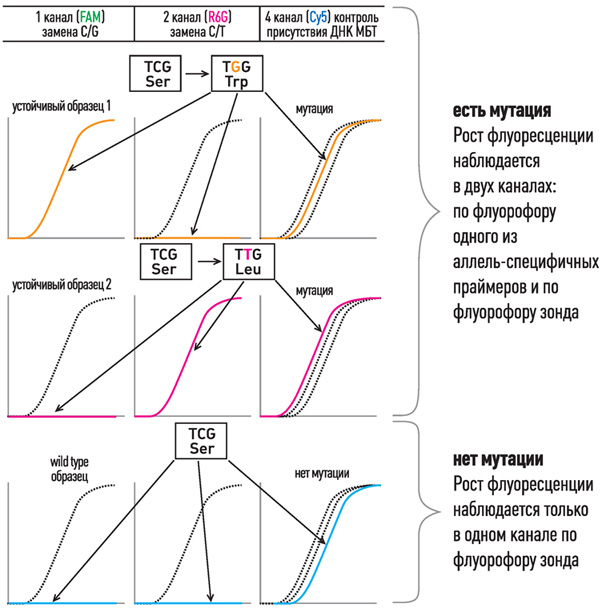
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
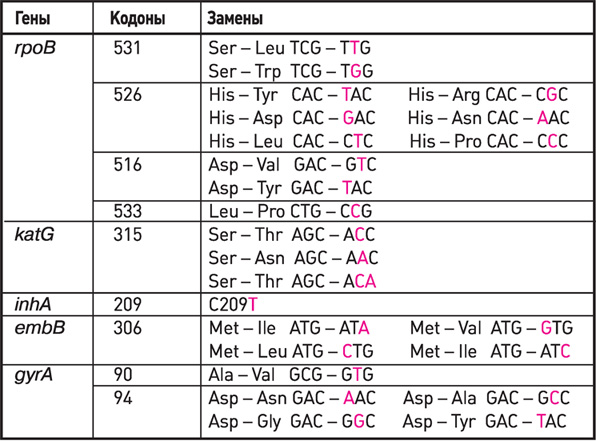
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
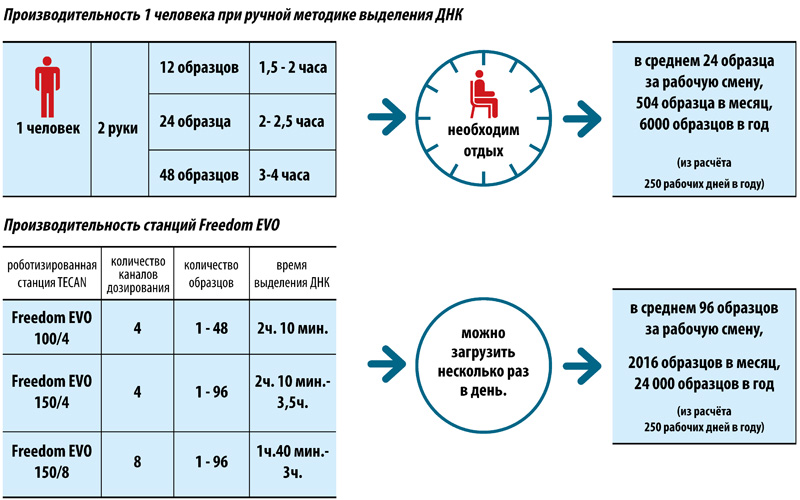

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Читайте также:


