Взятие и пересылка материала при паразитарных болезнях
Взятие материала при паразитарных болезнях

От больных животных берут кровь (в период наиболее выраженных симптомов болезни) к делают мазки обычно из первой капли крови (в ней больше паразитов). Мазки можно готовить и из крови трупов. В лабораторию вместе с мазками посылают в пробирке клещей, собранных с разных участков тела и фиксированных в 70%-ном спирте. Внутрь пробирки вкладывают этикетки из плотной бумаги с обозначением наименования хозяйства, даты и др. Нередко при тех или иных паразитарных болезнях в лабораторию направляют мазки-отпечатки из разных органов, а также сами пораженные органы. Для исследования на гельминты в лабораторию доставляют пробы кала (завернутые в пергаментную бумагу); паразитических червей консервируют в 70%-ном спирте или в жидкости Барбагалло (3%-ный раствор формалина на изотоническом растворе поваренной соли, 30 мл формалина, 9 г поваренной соли, 1000 мл дистиллированной воды) и помещают в пробирки или флаконы.
Для исключения паразитов кожи берут соскобы, чаще на границе со здоровой тканью с мелкими корочками и патогистологическое. Консервируют обычным способом и помещают в пробирки для отправки в лабораторию.
АНАТОМИЯ ДОМАШНИХ ЖИВОТНЫХ
- ВВЕДЕНИЕ (9)
- АППАРАТ ДВИЖЕНИЯ (46)
- КОСТНАЯ СИСТЕМА, ИЛИ СИСТЕМА СКЕЛЕТА (2)
- ОСЕВОЙ СКЕЛЕТ (7)
- ЧЕРЕП, ИЛИ СКЕЛЕТ ГОЛОВЫ (7)
- СКЕЛЕТ ГРУДНОЙ КОНЕЧНОСТИ (6)
- СКЕЛЕТ ТАЗОВОЙ КОНЕЧНОСТИ (5)
- СОЕДИНЕНИЕ КОСТЕЙ СКЕЛЕТА (14)
- СКЕЛЕТНАЯ МЫШЕЧНАЯ СИСТЕМА (4)
ПАТОЛОГО-АНАТОМИЧЕСКАЯ ДИАГНОСТИКА БОЛЕЗНЕЙ КРУПНОГО РОГАТОГО СКОТА
- АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ (15)
- ПАТОЛОГО-АНАТОМИЧЕСКОЕ ВСКРЫТИЕ КРУПНОГО РОГАТОГО СКОТА (20)
- ПРАВИЛА ВЗЯТИЯ И ПЕРЕСЫЛКИ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (6)
- ДОКУМЕНТАЦИЯ ПАТОЛОГОАНАТОМИЧЕСКОГО ВСКРЫТИЯ (8)
- МЕТОДЫ СОХРАНЕНИЯ ОРГАНОВ (7)
- ИНФЕКЦИОННЫЕ БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ МИКРОБАМИ (17)
- КЛОСТРИДИОЗЫ (7)
- БОЛЕЗНИ НОВОРОЖДЕННЫХ ТЕЛЯТ (7)
- БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ ВИРУСАМИ (17)
- БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ МИКОПЛАЗМАМИ, РИККЕТСИЯМИ И ХЛАМИДИЯМИ (4)
- БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ ПРОСТЕЙШИМИ (11)
- ГЕЛЬМИНТОЗЫ (16)
- ЛЕЙКОЗЫ (2)
- УРОДСТВА (1)
- НЕЗАРАЗНЫЕ БОЛЕЗНИ (84)
- ГИПОВИТАМИНОЗЫ (5)
- ЭНДЕМИЧЕСКИЕ БОЛЕЗНИ (10)
- ОТРАВЛЕНИЯ (15)
- БОЛЕЗНИ ОРГАНОВ ПИЩЕВАРЕНИЯ (9)
- БОЛЕЗНИ ПЕЧЕНИ (7)
- БОЛЕЗНИ ОРГАНОВ ДЫХАНИЯ И ПЛЕВРЫ (2)
- ПНЕВМОНИИ (4)
- БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ (5)
- БОЛЕЗНИ ОРГАНОВ КРОВЕТВОРЕНИЯ И ИММУННОЙ СИСТЕМЫ (5)
- БОЛЕЗНИ МОЧЕПОЛОВОЙ СИСТЕМЫ (5)
- БОЛЕЗНИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ (10)
- ФИЗИОПРОФИЛАКТИКА (3)
Последние записи
ВНУТРЕННИЕ НЕЗАРАЗНЫЕ БОЛЕЗНИ СЕЛЬСКО-ХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
- ТЕОРЕТИЧЕСКИЕ И ОРГАНИЗАЦИОННЫЕ ОСНОВЫ ОБЩЕЙ И ЧАСТНОЙ ПРОФИЛАКТИКИ (9)
- ОСНОВЫ ОБЩЕЙ ТЕРАПИИ (17)
- СЕРДЕЧНО-СОСУДИСТЫЕ БОЛЕЗНИ (25)
- БОЛЕЗНИ ДЫХАТЕЛЬНОЙ СИСТЕМЫ (25)
- БОЛЕЗНИ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ (61)
- БОЛЕЗНИ РТА, ГЛОТКИ, ПИЩЕВОДА (11)
- БОЛЕЗНИ ПРЕДЖЕЛУДКОВ ЖВАЧНЫХ (13)
- ЗАБОЛЕВАНИЯ ПЕЧЕНИ (13)
- БОЛЕЗНИ МОЧЕВОЙ СИСТЕМЫ (17)
- БОЛЕЗНИ СИСТЕМЫ КРОВИ (12)
- НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ (37)
- БОЛЕЗНИ НЕРВНОЙ СИСТЕМЫ (17)
- БОЛЕЗНИ МОЛОДНЯКА (15)
- БОЛЕЗНИ ПТИЦ (29)
ПОИСК ПО САЙТУ
КОРМЛЕНИЕ МОЛОДНЯКА КРС
ПРАКТИКУМ ПО ВЕТЕРИНАРНОЙ ПАТОЛОГИЧЕСКОЙ АНАТОМИИ И ВСКРЫТИЮ
- ВОСПАЛЕНИЕ (6)
- ПОСМЕРТНЫЕ ИЗМЕНЕНИЯ (1)
- РАССТРОЙСТВА ОБМЕНА ВЕЩЕСТВ В ТКАНЯХ (15)
- ПРИСПОСОБИТЕЛЬНЫЕ И ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ В ОРГАНИЗМЕ (5)
- РАССТРОЙСТВА КРОВООБРАЩЕНИЯ И ВОДНОГО ОБМЕНА (6)
- ОПУХОЛИ (11)
- НЕИНФЕКЦИОННЫЕ БОЛЕЗНИ (6)
- ГРИБКОВЫЕ ЗАБОЛЕВАНИЯ (5)
- ИНВАЗИОННЫЕ БОЛЕЗНИ (6)
- ВСКРЫТИЕ ТРУПОВ ЖИВОТНЫХ (13)
- ТЕХНИКА ИЗГОТОВЛЕНИЯ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ (3)
Успешное выполнение намеченной ХХVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозных болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные в справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
Методические указания по лабораторной диагностике
болезни Ауески животных
(Рекомендованы 18 мая 1978 г.)
обнаружении и идентификации вируса этой болезни в патологическом материале методами непрямой гемагглютинации (РНГА) или иммуноосмофореза;
выявлении специфических антител в сыворотке крови больных и переболевших животных в РНГА или в реакции нейтрализации (PH) на культуре клеток (ретроспективная диагностика);
постановке биологической пробы.
1.2. РНГА, реакцию иммуноосмофореза и PH применяют для исследования патологического материала и сывороток крови только от невакцинированных против болезни Ауески животных.
1.3. Лабораторный диагноз на болезнь Ауески ставят при получении положительного результата хотя бы по одному из методов исследования, указанных в п. 1.1.
Окончательный диагноз на болезнь Ауески устанавливают на основании эпизоотологических, клинических и патологоанатомических данных с учетом результатов лабораторного исследования.
2.1. В качестве исследуемого материала отбирают пробы патологического материала из разных участков головного мозга (полушарий, мозжечка, продолговатого мозга), заглоточных и бронхиальных лимфоузлов, легких, печени, селезенки, почек свиней, павших или вынужденно убитых в агональном состоянии.
Патологический материал измельчают, растирают в ступке и готовят суспензию (1:5) на физиологическом растворе для РНГА и суспензию (1:5) на веронал-мединаловом буферном растворе (pH 8,6) для метода иммуноосмофореза.
2.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные антителами к вирусу болезни Ауески);
контрольный положительный антиген (вакцинный штамм вируса болезни Ауески) в рабочем разведении;
контрольный отрицательный антиген в рабочем разведении;
нормальная лошадиная сыворотка.
2.2.2. Подготовка исследуемого материала. Суспензию из органов (1:5) выдерживают одни сутки при температуре минус 20 °С в холодильнике, затем центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость очищают хлороформом, добавляя его в количестве 1/4 части объема жидкости, затем вновь центрифугируют при 4 тыс. об/мин в течение 20 мин.
Надосадочную жидкость используют в РНГА в качестве испытуемого антигена.
Испытуемые и контрольные антигены разводят 1:2 и выше в объеме 0,05 мл 1 %-ным раствором нормальной лошадиной сыворотки. Затем добавляют по 0,025 мл эритроцитарного диагностикума. Смесь встряхивают и выдерживают при комнатной температуре в течение 2 - 3 ч.
контрольный положительный антиген + эритроцитарный диагностикум;
контрольный отрицательный антиген + эритроцитарный диагностикум;
эритроцитарный диагностикум + 1 %-ный раствор нормальной лошадиной сыворотки.
2.2.4. Учет реакции. Учет РНГА проводят при полном оседании эритроцитов в контроле с отрицательным антигеном. Положительными считают те пробы антигенов, которые в разведении 1:8 и выше вызывают агглютинацию эритроцитов при положительном результате в контроле со специфическим антигеном и отрицательном результате с контрольным отрицательным антигеном.
2.3. Реакция иммуноосмофореза.
2.3.1. Компоненты реакции:
специфическая к вирусу болезни Ауески иммуноасцитическая жидкость белых крыс (ИАЖ);
контрольный положительный антиген;
контрольный отрицательный антиген;
Для постановки реакции необходимо иметь камеру из плексигласа для электрофореза, универсальный источник питания УИП-1, агар Дифко, веронал-мединаловый буфер с pH 8,6, стекла обезжиренные (9×12), металлический штамп, пробирки, центрифугу.
2.3.2. Подготовка исследуемого материала. Суспензию из органов (1:5) подвергают однократному замораживанию (при минус 15 - 20 °С) с последующим оттаиванием. Затем суспензию центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость используют в качестве испытуемого антигена.
2.3.3. Приготовление агаровой среды. Для постановки реакции готовят 1,5 %-ный гель из агара Дифко на веронал-мединаловом буфере с pH 8,6. Пропись буфера: веронал - 1,66 г, мединал - 10,51, молочнокислый кальций - 1,536 г, дистиллированная (слегка подогретая) вода - 1 л. В качестве антибактериального средства в агаровую среду вносят мертиолят из расчета 1:10000 и хранят в холодильнике.
Для постановки реакции агар, расплавленный и остуженный до 50 - 56 °С, наносят пастеровской пипеткой на стекла размером 9×12 см. Толщина агаровой пластинки 4 - 5 мм. Расход агара около 15 мл. В затвердевшем агаре выштамповывают лунки диаметром 5 мм, с расстоянием между лунками 5 мм.
2.3.4. Постановка реакции. В лунки, которые расположены ближе к катоду, вносят исследуемые антигены; в лунки, расположенные ближе к аноду, вносят специфическую асцитическую жидкость в рабочем разведении. Иммуноосмофорез проводят в камере для электрофореза на бумаге при напряжении тока 200 - 220 В в течение 1 - 2 ч. В качестве контроля используют положительный антиген со специфической асцитической жидкостью.
2.3.5. Учет реакции. Результаты иммуноосмофореза учитывают через 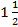
- 2 ч с момента включения камеры в сеть.
Реакция считается положительной при образовании линии преципитации между лунками с исследуемыми антигенами и специфической асцитической жидкостью при положительном результате в положительном контроле (контрольный положительный антиген + ИАЖ) и отрицательном результате в отрицательном контроле (контрольный отрицательный антиген + ИАЖ).
3.1. Ретроспективная диагностика основана на обнаружении специфических к вирусу болезни Ауески антител в сыворотке крови больных и переболевших животных в реакции непрямой гемагглютинации, а также в реакции нейтрализации на культуре клеток.
3.2. Реакция непрямой гемагглютинации.
3.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные вакцинным штаммом вируса болезни Ауески);
контрольная положительная иммуноасцитическая жидкость;
3.2.2. Подготовка исследуемых и контрольных сывороток. Перед постановкой РНГА исследуемые и контрольные сыворотки разводят 1:2 забуференным раствором, инактивируют в водяной бане при температуре 56 °С в течение 30 мин и истощают эритроцитами барана.
В 1 мл сыворотки вносят 0,1 мл 5 %-ной взвеси отмытых эритроцитов барана, выдерживают в термостате при температуре 37 °С в течение 30 - 40 мин и удаляют эритроциты центрифугированием. При массовых исследованиях сыворотки после истощения можно выдерживать в течение 12 - 24 ч при 4 °С, затем их исследуют в РНГА в разведении 1:2 и выше.
3.2.3. РНГА проводят по методике, описанной в п. 2.2.
3.2.4. Учет реакции. Результаты реакции учитывают при полном оседании эритроцитов в контроле с отрицательной асцитической жидкостью.
Положительными к вирусу болезни Ауески считают те пробы сывороток, в которых при разведении 1:8 и выше наблюдают агглютинацию эритроцитов.
3.3. Реакция нейтрализации.
3.3.1. Реакцию нейтрализации проводят на культуре клеток ПП, СПЭВ и первично-трипсинизированной культуре куриных фибробластов.
3.3.2. Компоненты реакции:
вирус болезни Ауески (вакцинный штамм);
исследуемые сыворотки крови (инактивированные);
контрольная положительная сыворотка.
3.3.3. Для постановки реакции необходимо предварительно провести пассаж вакцинного штамма вируса болезни Ауески на культуре клеток и определить его титр.
3.3.4. Чтобы провести пассаж вакцинного штамма вируса, содержимое ампулы разводят до нативного состояния (1:1), затем готовят разведение вируса 1:10 на питательной среде. Разведенный вирус в дозе 1 мл вносят в культуру клеток, выращенную в пенициллиновых флаконах, и инкубируют при температуре 37 °С. Через 24 ч клетки сморщиваются, округляются, монослой нарушается и образуются островки клеток. Через 72 ч монослой полностью нарушается и на стекле остаются единичные клетки.
Культуральный (вакцинный) штамм вируса хранят в холодильнике при температуре 4 °С и освежают один раз в 3 мес.
3.3.5. Для титрования вируса готовят десятикратные разведения вируса (от 10 -1 до 10 -8 ) на питательной среде без сыворотки. Каждым разведением в объеме 1 мл заражают отмытую раствором Хенкса культуру клеток (по 4 пенициллиновых флакона). Культуру клеток инкубируют при 37 °С, ежедневно просматривая ее под микроскопом. Окончательный учет результатов проводят через 72 ч.
Титром вируса считают наибольшее его разведение, вызывающее цитопатическое действие (ЦПД) в 50 % культур клеток. Титр вычисляют по методу Рида и Менча и выражают количество ЦПД в 1 мл.
3.3.6. Постановка реакции нейтрализации. PH ставят с дозой вируса, равной 100 ТЦД50 в 0,1 мл. Исследуемые сыворотки разводят 1:2 и выше в объеме 0,5 мл. К каждому разведению сыворотки добавляют равный объем (0,5 мл) вируссодержащей культуральной жидкости. Пробирки со смесью встряхивают и оставляют при температуре 37 °С в течение 60 мин. После инкубации смесь вируса с сывороткой вводят во флаконы с культурой клеток и результаты учитывают через 72 ч.
Для контроля заражают культуру клеток смесью вируса с контрольной положительной сывороткой, вирусом без сыворотки и одновременно в одном флаконе с культурой клеток сменяют питательную среду (контроль культуры клеток).
3.3.7. Учет реакции нейтрализации. Подавление цитопатического действия вируса специфической (контрольной) сывороткой и исследуемыми сыворотками при наличии ЦПД в контроле (культура клеток, зараженная вирусом без сыворотки) указывает на наличие специфических антител к вирусу болезни Ауески в сыворотке крови свиней.
4.1. Для постановки биопробы патологический материал (селезенку, печень, головной мозг, легкие) растирают в ступке с физиологическим раствором в соотношении 1:10. Полученную суспензию вводят внутримышечно кролику или кошке в дозе 1 мл. Через 2 - 3 сут после заражения при наличии вируса в патологическом материале животное заболевает.
Болезнь характеризуется беспокойством, зудом, расчесами на месте инъекции. Если зараженные животные погибают на 3 - 6-й день, но у них не наблюдалось зуда и расчесов, то патологический материал от павшего кролика (или кошки) пассируют еще раз на таких же животных.
14.1 Для подтверждения диагноза на пироплазмоз (лошадей, крупного рогатого скота, овец, собак, свиней), тейлериоз, франсаиеллез, бабезиоз (крупного рогатого скота и овец), нутталлиоз лошадей, анаплазмозы (крупного рогатого скота, овец) необходимо послать на исследование мазки из периферической крови.
14.1.1 Мазки крови следует брать от больных животных в период развития у них симптомов болезни, при повышенной температуре и до применения специфического лечения. При тейлериозе, кроме того, посылают мазки из материала, полученного путем пункции из увеличенных лимфатических узлов.
14.1.2 Для приготовления мазка при исследовании на кровопаразитарные болезни берут первую каплю крови (в первой капле паразитов больше, чем в последующих). Если крови мало или она свернулась, то ватой снимают сгусток и мазок делают из вновь выступившей капли.
14.1.3 Мазки делают тонкие, берегут от мух и прямых солнечных лучей, предохраняют от запыления и держат в сухом месте. Сухие мазки фиксируют в спирт-эфире, этиловом спирте и посылают в лабораторию в количестве не менее двух. Зимой приготовленные мазки немедленно опускают в спирт.
14.1.4 Если мазки делают из материала трупа животного, то для их приготовления берут периферическую кровь из уха и из почек, селезенки, печени, сердца. Мазки необходимо брать из свежих трупов.
14.1.5 Для реакции связывании комплимента при исследовании на анаплазмозы посылают пробы цельной крови или сыворотки.
14.1.6 Мазки от каждого животного заворачивают в чистую бумагу. Вместе с мазками посылают в пробирках клещей, собранных с разных участков тела больных животных и фиксированных в 70%-ном спирте. Внутрь пробирки вкладывают этикетки из плотной бумаги, надписанные простым карандашом, с указанием наименования хозяйства, вида животного и даты сбора.
14.2.1 Для микроскопического исследования на месте (в хозяйстве) делают раздавленные капли из экссудата и соскобов.
14.3. Для микроскопического исследования на Су-ауру (трипанозомоз) верблюдов, ослов, лошадей, собак приготовляют мазки и толстые капли крови из уха. Для установления диагноза необходимо материал брать повторно. В лабораторию направляют (или исследуют на месте) сыворотку крови или цельную кровь для исследования методом постановки формолреакции.
От трупа берут кусочки селезенки, печени, почек, костного мозга и лимфатических узлов, делают мазки и посылают в лабораторию. Мазки готовят не позже чем через 6-12 часов после смерти животного.
14.4 Для микроскопического и бактериологического исследований на трихомоноз в лабораторию посылают:
- от коров — влагалищные и маточные выделения, абортированный плод, плодовые воды и оболочки;
- от быков — сперму и смыв (физиологическим раствором) из препуция.
Материал пересылают в плотно закрытой стерильной посуде (пробирки, флаконы), который доставляют в лабораторию не позднее 24 часов после взятия.
14.4 При подозрении на лейшманиоз собак для микроскопического исследования посылают трубчатую кость, мазки из селезенки, лимфатических узлов, печени и костного мозга.
От больных животных при наличии у них поражения кожи (язв, рубцов) посылают мазки, приготовленные из соскобов, сделанных с пораженных участков кожи путем скарификации. При отсутствии пораженной кожи делают пункцию селезенки и из полученного материала готовят мазки.
14.5 При подозрении на кокцидиоз для исследования посылают фекалии, стенки пораженного кишечника, кусочки печени (кроликом), почек. Трупы мелких животных и птиц доставляют целиком.
14.6 При подозрении на токсоплазмоз для микроскопического исследования посылают мазки-отпечатки из головного мозга, паренхиматозных органов, околоплодной жидкости, влагалищных выделений, спинномозговую жидкость, кусочки органов (для биопробы). Для РСК посылают пробы свежей крови или неконсерзированную сыворотку.
14.7 При подозрении на балантидиоз свиней в лабораторию для исследования посылают свежие фекалии, но лучше исследование проводить в хозяйстве.
14.8 При подозрении на спирохетоз кур для исследования в лабораторию посылают мазки крови от больных или павших птиц, трупы птиц.
14.9 При подозрении на гистомоноз в лабораторию посылают мазки из содержимого клоаки, кишечника и отпечатки из очагов некроза печени от павших птиц, трупы птиц.
14.10 При подозрении на эперитрозооноз овец в лабораторию посылают мазки крови. Для постановки биопробы посылают свежую кровь от подозрительных по заболеванию животных.
14.11. Для подтверждения диагноза безноитиоз крупного рогатого скота, в лабораторию посылают мазки крови (из сосудов уха), кусочки подкожной клетчатки, склеры, имеющие на поверхности цисты (узелки).
14.12 При подозрении на гельминтозы в лабораторию для исследования доставляют пробы фекалий (30-50 г), завернутые в пергаментную бумагу, на которой ставят номер пробы. Патологические препараты фиксируют в 10%-ном растворе формалина.
Паразитических червей доставляют в пробирках или банках в консервированном виде, как указано ниже.
14.12.1 Трематод и цестод (сосальщики и ленточные) извлеченных из органов гельминтов помещают (для сохранения естественной формы тела) в кюветы с водой или физиологическим раствором. Затем целых гельминтов или отдельные части их — стробилы прессуют между двумя предметными стеклами в чашке Петри, наполненной 70%-ным спиртом (несколько часов), помещают в пробирку или банку с 70%-ным спиртом и пересылают в лабораторию.
14.12.2 Акантоцефал (скребней) фиксируют в 70%-ном спирте. Следят за тем, чтобы хоботок у них был в вытянутом состоянии. Этого достигают легким надавливанием, пока паразит свежий (живой или недавно погибший). Убедившись (под лупой или микроскопом), что хоботок лежит правильно, паразита помещают в пробирку или банку со спиртом.
14.12.3 Нематод (круглые черни) после кратковременного промывания в воде переносят в пробирку или банку с жидкостью Барбагалло (30 мл формалина, 9 г поваренной соли, 1000 мл дистиллированной воды). Исключение составляют филярии, которых сразу после извлечения из органов переносят в жидкость Барбагалло.
14.12.4 Пузырчатые формы ленточных червей — эхинококки, финны, ценурусы и др. фиксируют в жидкости Барбагалло.
14.13.1 У остриженных овец берут соскобы со складок или уплотненных участков кожи в надглазничных ямках, с внутренней поверхности ушных раковин, с подхвостовой складки и с других неостриженных мест. У неостриженных овец соскобы делают с участков взъерошенной и склеенной шерсти, а также мест, покрытых корочками.
14.13.2 У лошадей, верблюдов, северных оленей, крупного рогатого скота, свиней соскобы делают более глубокие, снимая слой эпидермиса до появления в соскобе сукровицы.
14.13.3 У птиц соскобы делают под роговыми чешуйками передней поверхности конечностей кожи, с перьев (роговые чешуйки выщипывают с кожи, с перьев соскобы делают скальпелем).
14.13.4 Соскобы не консервируют; их посылают в чистых пробирках, закрытых обязательно резиновыми пробками. Если в течение ближайших 6-7 дней исследование не может быть произведено, соскобы кладут в 70%-ный спирт.
14.14 При подозрении на демодекоз (железничная чесотка) на месте нахождения бугорков выщипывают шерсть и острым скальпелем делают соскоб. Содержимое соскоба переносят на предметное стекло, покрывают другим предметным стеклом, завертывают в бумагу и перевязывают. На бумаге отмечают дату взятия соскоба, вид и номер животного.
14.15.1 Личинок, куколок и взрослых насекомых, не покрытых чешуйками или длинными волосками и неокрашенных в яркие цвета, помещают в 70%-ный спирт. Белых личинок, во избежание почернения, живыми бросают на несколько минут (2-3) в кипяток или на 30-50 секунд в раствор азотной кислоты, а затем помещают в спирт.
14.15.2 Мелких насекомых кладут в маленькие пробирки со спиртом, закрывают корковой пробкой. В пробирку вкладывают этикетку с указанием вида животного, даты и места сбора насекомых. В крайнем случае, вместо 70%-ного спирта берут 2%-ный раствор формалина (для этого обычный 40%-ный формалин разбавляют в 15-20 раз водой).
ПРАВИЛА ВЗЯТИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА, КРОВИ, КОРМОВ И ПЕРЕСЫЛКИ ИХ
ДЛЯ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ
от 9 сентября 1987 года (извлечения)
Взятие и пересылка материала для
исследования на болезни рыб.
1. Больных или подозрительных по заболеванию
инфекционными и инвазионными болезнями рыб доставляют в
лабораторию в живом виде. Для исследования отбирают 15-20
рыб с явно выраженными клиническими признаками болезни.
2. Рыб перевозят в чистых молочных бидонах, ваннах или
других емкостях, предназначенных для перевозки живой рыбы,
заполненных на 3/4 объема водой из того же водоема, откуда
взята рыба, или из артезианской скважины. Рыба, доставленная
в лабораторию в бумаге, марле и др. упаковочных материалах,
для исследования непригодна.
Летом при длительной транспортировке воду с рыбой
постепенно охлаждают до температуры 12-15°С, добавляя
кусочки льда. Чтобы не вызвать температурного шока и
простудных явлений, нельзя пересаживать рыбу в воду,
имеющую температуру ниже, чем в водоеме (на 7°С и более).
3. При отсутствии возможности доставить живую рыбу, у
крупных рыб берут кусочки пораженных органов и тканей,
помещают их в стерильную стеклянную посуду, заливают
стерильным 40%-ным водным раствором глицерина,
закрывают пробкой, заливают парафином и направляют с
нарочным в лабораторию. Жидкий патологический материал
(кровь, экссудат и др.) доставляют в лабораторию в запаянных
стерильных пастеровских пипетках. Летом патологический
материал пригоден для бактериологического исследования в
течение 2 часов после его взятия. Зимой патологический
материал можно посылать замороженным.
4. Для вирусологического исследования живых рыб
помещают в двойной полиэтиленовый пакет, заполненный
водой на 1/3 объема. В наружный пакет для охлаждения воды
кладут лед. Пакет помещают в ящик, отравляют с нарочным в
лабораторию. Мертвая рыба направляется только в том случае,
если она погибла после отлова перед отправкой в лабораторию.
Такую рыбу кладут в полиэтиленовый пакет, который
помещают в термос или пакет со льдом. При направлении
рыбы для исследования на вирусоносительство берут, с
соблюдением правил асептики, внутренние органы (можно
объединять органы от пяти рыб в одну пробу) и помещают в
стерильный флакон, который плотно закрывают резиновой
пробкой. Флакон помещают в термос или полиэтиленовый
пакет со льдом.
В тех случаях, когда невозможно направить материал
немедленно, его можно хранить в холодильнике при
температуре не выше +4°С не более суток. Патологический
материал от больных рыб или подозреваемых в заболевании
вирусной этиологии можно консервировать 50%-ным
фосфатно-буферным раствором глицерина рН 7,2-7,4.
4.1. Вирусная геморрагическая септицемия (ВГС). У
производителей и ремонтной форели отсасывают из брюшной
полости шприцем с иглой перитонеальную жидкость, сливают
ее в стерильную пробирку с резиновой пробкой и направляют в
ветеринарную лабораторию.
При подозрении на вирусную геморрагическую септицемию
патматериал 50%-ным фосфатно-буферным раствором не
консервируют, а отправляют в пакетах со льдом.
4.2. Инфекционный некроз гемопоэтической ткани (ИНГТ).
В лабораторию посылают от рыб маточного поголовья
внутренние органы, а в период нереста - овариальную
жидкость вместе с икрой, которые помещают в стерильные
флаконы или пробирки с резиновыми пробками и отправляют в
термосе или полиэтиленовом пакете со льдом.
4.3. Инфекционный некроз поджелудочной железы
(ИНПЖ). От производителей и ремонтной рыбы берут
перитонеальную жидкость, которую набирают из брюшной
полости шприцем с иглой, сливают ее в стерильную пробирку с
резиновой пробкой. Для исследования в период между
сезонами нереста от производителей берут фекалии, пробы
которых перевозят в термосе со льдом в стерильных пробирках
или флаконах, закрытых резиновыми пробками.
5. Материал для патологического исследования берут от
больных снулых рыб. Мелких рыб (мальки и сеголетки) после
вскрытия брюшной полости фиксируют целиком, а от крупных
берут органы или кусочки органов размером 2х3 см и
толщиной 0,5-1,0 см.
Кусочки из пораженных органон и тканей вырезают так,
чтобы были захвачены нормальные и пораженные участки.
Независимо от степени поражения берут кусочки из
различных органов: кожи с подлежащей мускулатурой, жабр,
печени, почек, селезенки, сердца, кишечника, плавательного
пузыря, головного мозга.
Кишечник перед фиксацией осторожно вскрывают или
делают на нем несколько надрезов, чтобы фиксирующая
жидкость проникла в его полость. Головной мозг осторожно
извлекают целиком после вскрытия черепной коробки.
Подлежащий исследованию материал помещают в
широкогорлую стеклянную банку и фиксируют обычным
способом.
Для гистохимических исследований патологический
материал фиксируют так: его тотчас помещают в
фиксирующую жидкость, объем которой должен в 10 раз
превышать объем взятого материала. В качестве фиксирующей
жидкости лучше всего использовать 10%-ный водный раствор
продажного формалина или 96%-ный этиловый спирт. При
применении спирта толщина кусочков ткани не должна
превышать 0,5 см.
Фиксирующую жидкость во всех случаях через сутки
необходимо заменить свежей.
Патологический материал фиксируют в стеклянной посуде.
Головной, спинной мозг фиксируют в 10%-ном
нейтральном формалине. Формалин нейтрализуют
прибавлением в продажный формалин сухого мела или
углекислого магния до 1/10-1/20 его объема. Для фиксации
кусочков мозга можно использовать также 96%-ный этиловый
спирт, жидкость Карнуа или смесь Буэна.
6. Кровь для исследования берут из хвостовой артерии или
из сердца. Чешую на месте взятия крови слущивают
скальпелем, кожу вытирают от слизи и дезинфицируют 70%-
ным спиртом. Кровь насасывают в пастеровскую пипетку,
затем переносят на часовое стекло и быстро отбирают
количество, необходимое для гематологических исследований
(подсчета количества форменных элементов, определения
гемоглобина, приготовления мазков и т.д.).
7. Для биохимических исследований цельную кровь
предохраняют от свертывания, добавляя к ней лимоннокислый
или щавелевокислый натрий (на 1 мл 2 мг), или 1-2%-ный
раствор гепарина (на 1 мл от 0,01 до 0,02 мл), и доставляют в
лабораторию в герметически закрытых стеклянных сосудах
(пробирках), снабженных этикеткой.
Сыворотку крови для биохимических исследований
получают так: взятую кровь выдерживают около часа при 20-
30°С для свертывания. Затем сгусток крови отделяют от стенок
пробирки стальной спицей (проволокой), которую
дезинфицируют раствором карболовой кислоты или обжигают
на пламени после каждой пробы, после чего пробирки
выдерживают при 4-10°С. Через 18-24 часа отстоявшуюся
сыворотку в количестве 2-3 мл сливают в сухие стерильные
пробирки (лучше пробирки Флоринского), которые маркируют
так же, как пробирки с кровью, и направляют в лабораторию в
свежем или консервированном виде.
Пробирки с сыворотками закрывают стерильными
резиновыми пробками и устанавливают для пересылки в
вертикальном положении (пробирки Флоринского - в
одноименных штативах).
8. При подозрении на инвазионные болезни у крупных рыб
извлекают пораженные паразитами органы и ткани (жабры,
кишечник, печет, и др.) и посылают для исследования
законсервированными в банках, мелких рыб - целиком.
Целых рыб или кусочки органов и тканей консервируют в
70%-ном этиловом спирте или 4%-ном растворе формалина.
9. Обнаруженных при клиническом осмотре и
паразитологическом вскрытии рыб паразитических организмов
помещают в пробирки или флаконы с консервирующей
жидкостью.
Паразитических простейших наносят на покровное или
предметное стекло и, не давая мазку подсохнуть, спускают в
жидкость Шаудина (50 мл насыщенного раствора сулемы и 25
мл абсолютного спирта) на 20 минут. Маленькие кусочки
пораженных паразитами тканей и органов фиксируют
указанной смесью и течение 30-120 минут. Затем стекло
промывают несколько раз водой и 70%-ным спиртом и
сохраняют в нем до исследования. Влажные мазки, кусочки
органов и тканей рыб с паразитами можно фиксировать также в
жидкости Буэна. Фиксация мазков 1-20 минут, кусочков 1-12
часов.
Гельминтов, прежде, чем консервировать, тщательно
промывают в воде или физиологическом растворе.
Моногенетических сосальщиков (дактилогирус,
гиродактилус и др.) консервируют в 4%-ном растворе
формалина.
Трематод и мелких цестод помещают на предметное стекло,
накрывают покровным стеклом или куском предметного стекла
(для нежного прессования), заливают 70%-ным спиртом н
оставляют на несколько часов. После этого гельминтов
перекладывают при помощи кисточки в пробирку (флакон) со
спиртом. Одновременно часть умерщвленных в
физиологическом растворе трематод (цестод), не подвергая
прессованию (для сохранения естественной формы), помещают
в пробирку с 70%-ным спиртом.
Нематод и личиночные стадии цестод консервируют в
жидкости Барбагалло.
Крупных ленточных гельминтов после умерщвления в
физиологическом растворе помещают в 70%-ный спирт.
При консервировании скребней в 70%-ном спирте
добиваются выдавливания хоботка из влагалища путем слабого
прессования передних концов с помощью покровных стекол.
Паразитических рачков консервируют в 3%-ном растворе
формалина и сразу же переносят для хранения в 70%-ный
спирт.
Пиявок фиксируют в 1 -2%-ном растворе формалина.
10. При подозрении на отравление рыб отбирают пробы
воды из водоема непосредственно на месте гибели рыбы,
сточные воды промышленных предприятий и
сельскохозяйственных объектов, находящихся вблизи
водосборной площади данного водоема.
10.1. Для гидрохимического и химико-токсикологического
исследований пробы воды из водоемов берут в количестве 2-3
л каждая, батометром из поверхностных (на глубине 30-50 см
от зеркала воды) и глубинных слоев (нe менее 10-15 см от дна),
не допуская взмучивания грунта, так, чтобы проба
соответствовала всей массе исследуемой воды. Из проруби
пробу воды берут на глубине 10-15 см от нижней поверхности
льда. При отборе проб необходимо исключить элементы
случайности (временная взмученность воды, поверхностный
слой воды со случайным загрязнением).
В проточном водоеме пробы берут на быстринах,
перепадах, водосборах и водоспусках. Из больших водоемов
пробы берут в нескольких местах с учетом
гидробиологических особенностей каждого участка (заросли,
заболоченные участки, плесы и т.д.), в однотипных по
гидробиологическим условиям водоемах - в одном-двух
местах, на расстоянии 3-4 м от берега.
10.2. Вблизи сельскохозяйственных объектов,
промышленных предприятий и мест сброса коммунально-
бытовых сточных вод, пробы воды берутся на условно чистом
участке выше источника загрязнения; в месте поступления
сточных вод и на различном расстоянии в нескольких точках
ниже места выпуска стоков.
На промышленном предприятии отбирают среднесуточные
пробы (2-3 л) воды общего выпуска.
10.3. Воду для анализа отбирают в чисто вымытые (без
мыла) склянки. Перед наполнением склянку промывают 2-3
раза исследуемой водой. При транспортировке проб зимой их
нужно утеплить. Если доставка в лабораторию в теплое время
займет свыше суток, взятые пробы консервируют. Для этого в
пробу, предназначенную для определения взвешенных
веществ, нитритов, нитратов, фосфатов на каждый литр воды
добавляют 2 мл хлороформа и хорошо взбалтывают. В порцию,
предназначенную для определения аммиака, окисляемости,
хлоридов на 1 л добавляют 2 мл 25%-ной серной кислоты.
Третью часть пробы для химического анализа на токсические
компоненты сточных вод не консервируют.
11. Для химико-токсикологических исследований в
лабораторию доставляют живых или недавно погибших рыб, не
менее 5 экземпляров каждого вида. Одновременно направляют
рыб того же вида из благополучного водоема для контрольных
исследований. Если доставить живых или свежеуснувших рыб
невозможно, а также в теплое время года, рыб охлаждают на
льду, промораживают или консервируют спиртом-
ректификатом. Другие вещества для консервирования
использовать нельзя. Вместе с пробами высылают 50-100 мл
консерванта.
12. Грунт для исследований берут в количестве 2 кг с
поверхности дна водоема дночерпателем Экмана или
Кирпичникова. Пробы отбирают выше предполагаемого
источника загрязнения, в месте поступления сточных вод и на
различном расстоянии в нескольких точках ниже места
выпуска стоков - на течении и в застойных зонах (ямах,
бочагах, низинах). Грунт высушивают на воздухе, растирают в
ступке, просеивают через мелкое сито и упаковывают в
щирокогорлые банки или полиэтиленовые мешочки по 50 г
каждый.
13. Планктон берут планктонной сеткой. Для этого 50-100 л
воды пропускают через сетку и собирают планктон.
14. Материал для исследования на отправление собирают
комиссионно с участием ветврача-ихтиопатолога, специалиста
органов рыбохраны водного хозяйства, санитарно-
эпидемиологической станции и представителя местной
администрации.
Весь материал (пробы воды, грунта, планктона и рыб)
упаковывают в водонепроницаемую тару, опечатывают и
вместе с актом комиссии направляют в лабораторию с
нарочным.
Читайте также:


